La intraoperative radiotherapy (IORT, «radioterapia intraoperatoria») en pacientes seleccionadas con cáncer de mama permite un tratamiento corto y preciso durante la cirugía conservadora sobre el lecho tumoral in situ. Presentamos nuestra experiencia inicial de IORT con dispositivo Intrabeam®.
Pacientes y métodosSe seleccionaron inicialmente 120 pacientes con cáncer de mama para IORT con Intrabeam® según protocolo TARGIT-A, desde enero de 2013 hasta febrero de 2015. Las indicaciones fueron: candidatas a cirugía conservadora, mayores de 45 años, diagnóstico histológico de carcinoma ductal infiltrante≤3cm hormonodependiente y axila clínica, ecográfica e histológicamente negativa.
ResultadosDe las pacientes seleccionadas, 34 (28%) no recibieron IORT debido al tamaño de la cavidad quirúrgica (28 casos) o problemas técnicos (6 casos). Finalmente, 86 pacientes (72%) recibieron IORT. La edad media fue de 64 años (DE±8,4). En 22 pacientes (26%) fue preciso administrar radioterapia externa a toda la mama. Trece pacientes (15%) tuvieron complicaciones: 3 casos de seroma que precisaron de más de 3 punciones para resolución (4%), 6 casos de absceso-mastitis (7%), 2 casos de hematoma (2%) y 2 casos de dehiscencia parcial de la herida quirúrgica (2%). No hubo toxicidad grave (grado iii-iv). El resultado estético fue bueno o muy bueno en el 87% de las pacientes (75).
ConclusiónLa IORT con Intrabeam® es una alternativa segura y bien tolerada frente a la radioterapia externa en pacientes seleccionadas, con un buen resultado estético a corto plazo.
Intraoperative radiotherapy (IORT) in selected patients with breast cancer allows a short and precise treatment on the tumor bed in situ during conservative surgery. We present our initial experience of IORT with the Intrabeam® device.
Patients and methodsFrom January 2013 to February 2015, 120 patients with breast cancer were pre-selected for IORT with Intrabeam® according to the TARGIT-A protocol. The indications were as follows: candidates for conservative surgery, age older than 45 years, a histological diagnosis of hormone-dependent infiltrating ductal carcinoma≤3cm and absence of axillary involvement on physical, ultrasound and histological examination.
ResultsAmong the selected patients, 34 (28%) did not receive IORT due to the size of the surgical cavity (28 patients) or technical problems (6 patients). Finally, 86 patients (72%) received IORT. The average age was 64 years (SD±8.4). In 22 patients (26%), it was necessary to administer external beam radiotherapy to the whole breast. Thirteen patients (15%) had complications: 3 cases of seroma requiring more than 3 attempts for resolution (4%), 6 cases of abscess-mastitis (7%), 2 cases of hematoma (2%) and 2 cases of partial dehiscence of the surgical wound (2%). There was no severe toxicity (grade iii-iv). The aesthetic result was good or very good in 87% of the patients (n=75).
ConclusionIORT with Intrabeam® is a safe and well tolerated alternative versus external radiotherapy in selected patients and provides a good short-term aesthetic result.
La radioterapia externa de toda la mama después de la cirugía conservadora es el estándar de tratamiento en el cáncer de mama en estadios precoces. Ha demostrado que reduce la recaída local y mejora la supervivencia1–4. Se administra en el centro de referencia y, a pesar de ser parte fundamental del tratamiento conservador de la mama, para muchas pacientes, y particularmente para las que se encuentran en la tercera edad, puede ser un inconveniente acudir a recibir el tratamiento por vivir lejos de su centro. En Estados Unidos, casi un tercio de las pacientes a las que se les realiza una cirugía conservadora no reciben radioterapia adyuvante por este motivo5–7. Algunas mujeres incluso llegan a preferir la mastectomía para evitar la radioterapia adyuvante8,9. Por otra parte, actualmente la cirugía oncoplástica supone un reto para la radioterapia adyuvante, sobre todo a la hora de administrar un boost al lecho tumoral.
Atendiendo a estas cuestiones, sería interesante desarrollar un esquema radioterápico en el que se consiguiera acortar el tiempo de tratamiento y que fuera además preciso sobre el área mamaria a tratar. Se ha observado que más del 90% de las recidivas locales tras cirugía conservadora se producen cerca o en el lecho quirúrgico4,10, lo que demuestra lo importante que es tratar el lecho tumoral. Existen numerosas técnicas de irradiación parcial, pero la técnica quizás más novedosa y cómoda sea la intraoperative radiotherapy (IORT, «radioterapia intraoperatoria»)11–14. La IORT permite a la paciente recibir todo el tratamiento radioterápico en una única fracción durante la cirugía directamente sobre el lecho tumoral, una vez se ha realizado la exéresis quirúrgica. Existen varias modalidades de IORT, siendo las más estudiadas y extendidas la terapia con electrones (intraoperative electrons radiotherapy o IOERT) y la terapia de rayos X de baja energía (targeted intraoperative radiotherapy o TARGIT). Esta última utiliza el dispositivo Intrabeam®. El objetivo de este estudio fue presentar nuestra experiencia inicial de IORT con Intrabeam® para el tratamiento del cáncer de mama.
Pacientes y métodosPacientesDesde enero de 2013 hasta febrero de 2015, se seleccionaron 120 pacientes candidatas a IORT con Intrabeam® siguiendo el protocolo del estudio TARGIT-A13,14. Las indicaciones fueron: candidatas a cirugía conservadora, mayores de 45 años, diagnóstico histológico de carcinoma ductal infiltrante≤3cm hormonodependiente y axila clínica, ecográfica e histológicamente negativa.
ProcedimientoSe siguió el siguiente protocolo de actuación y técnica quirúrgica para la administración de IORT con Intrabeam®:
- 1.
Anestesia general con intubación orotraqueal. En el antequirófano, el Servicio de Física Médica efectuaba las calibraciones necesarias en la consola.
- 2.
Realización de la biopsia selectiva del ganglio centinela.
- 3.
Tumorectomía, procurando ser precisos y extirpando solo el volumen mamario necesario para una cirugía oncológica correcta con márgenes libres. Se procuró que la forma de la cavidad residual se acercara a la esfericidad. Se consideró muy importante la comunicación con el radiólogo y el médico nuclear, quien, en su caso, colocó la guía metálica (arpón) o inyectó radiotrazador para la localización del tumor. Asimismo, realizó el marcaje sobre la piel de la mama con control ecográfico de la situación del tumor y, en su caso, de la punta del arpón.
- 4.
Comprobación radiológica y patológica de los márgenes de la pieza quirúrgica. Se ampliaban los márgenes si procedía. Hemostasia minuciosa.
- 5.
El radiooncólogo medía la cavidad residual de la cirugía (el lecho tumoral) con una regla y se decidía el diámetro del aplicador a utilizar.
- 6.
Se realizaba una sutura continua en bolsa de tabaco en el parénquima, superficial, para aproximar las paredes de la cavidad de tumorectomía al aplicador esférico. Mientras tanto, se había preparado el soporte quirúrgico de la fuente de rayos X con una funda estéril de cobertura y se ajustaba el aplicador estéril a la fuente que se encuentra en la terminal del soporte.
- 7.
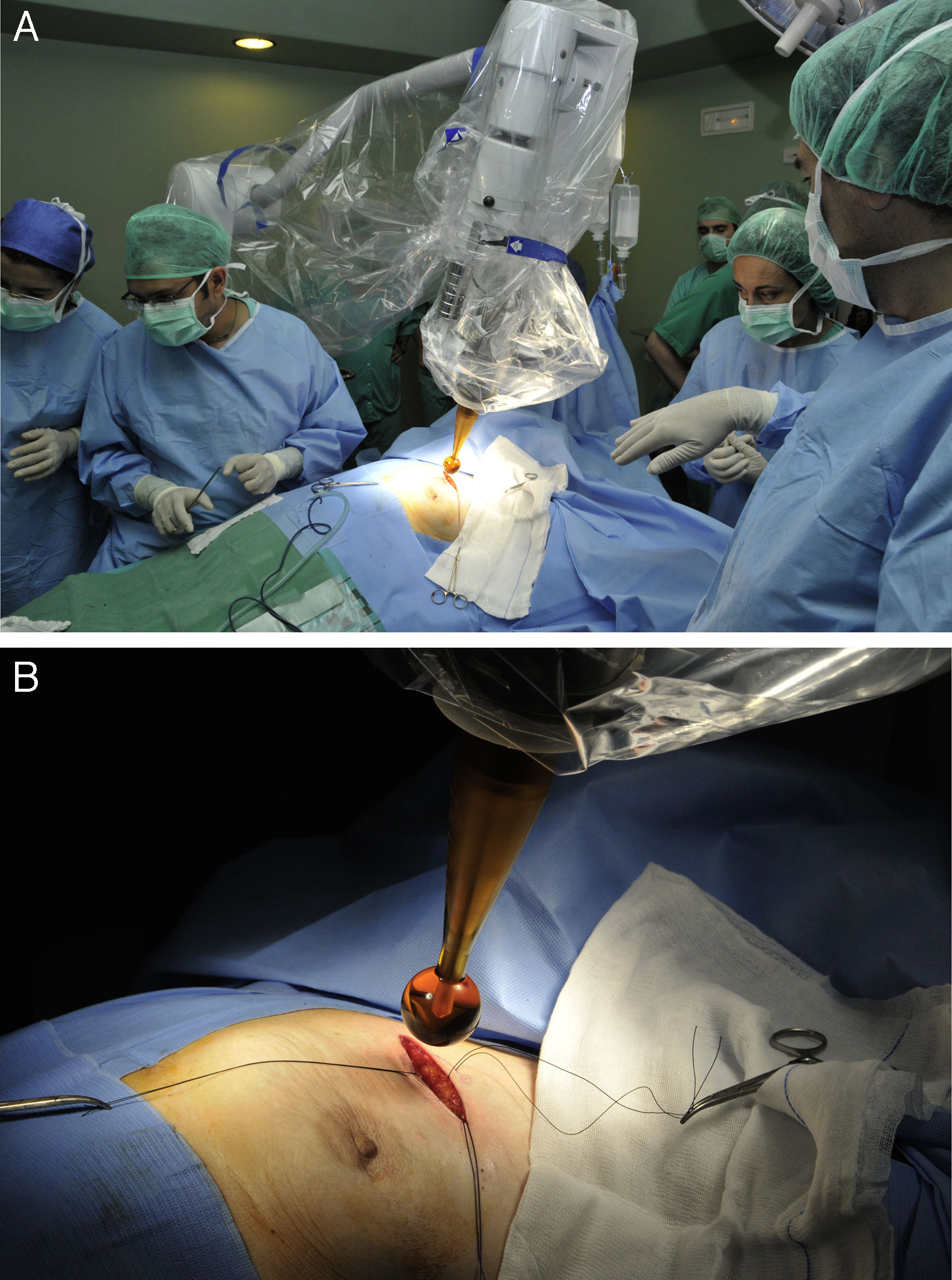
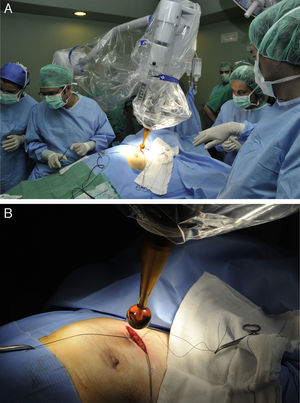
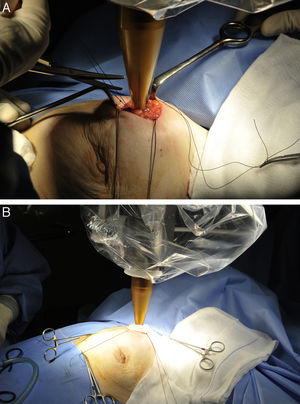
Movilización del soporte quirúrgico de la fuente de Rx hacia la mesa de quirófano (fig. 1A).
Figura 1.Protocolo de actuación y técnica quirúrgica para la administración de IORT con Intrabeam®. A) Movilización del soporte quirúrgico de la fuente de Rx hacia la mesa de quirófano. B) Colocación del aplicador esférico estéril de la fuente de rayos X intracavitaria. Se puede ajustar al lecho tumoral mediante el movimiento del brazo articulado del dispositivo.
- 8.
Colocación del aplicador intracavitario. Se podía movilizar el brazo articulado para ajustar el aplicador al lecho quirúrgico (fig. 1B).
- 9.
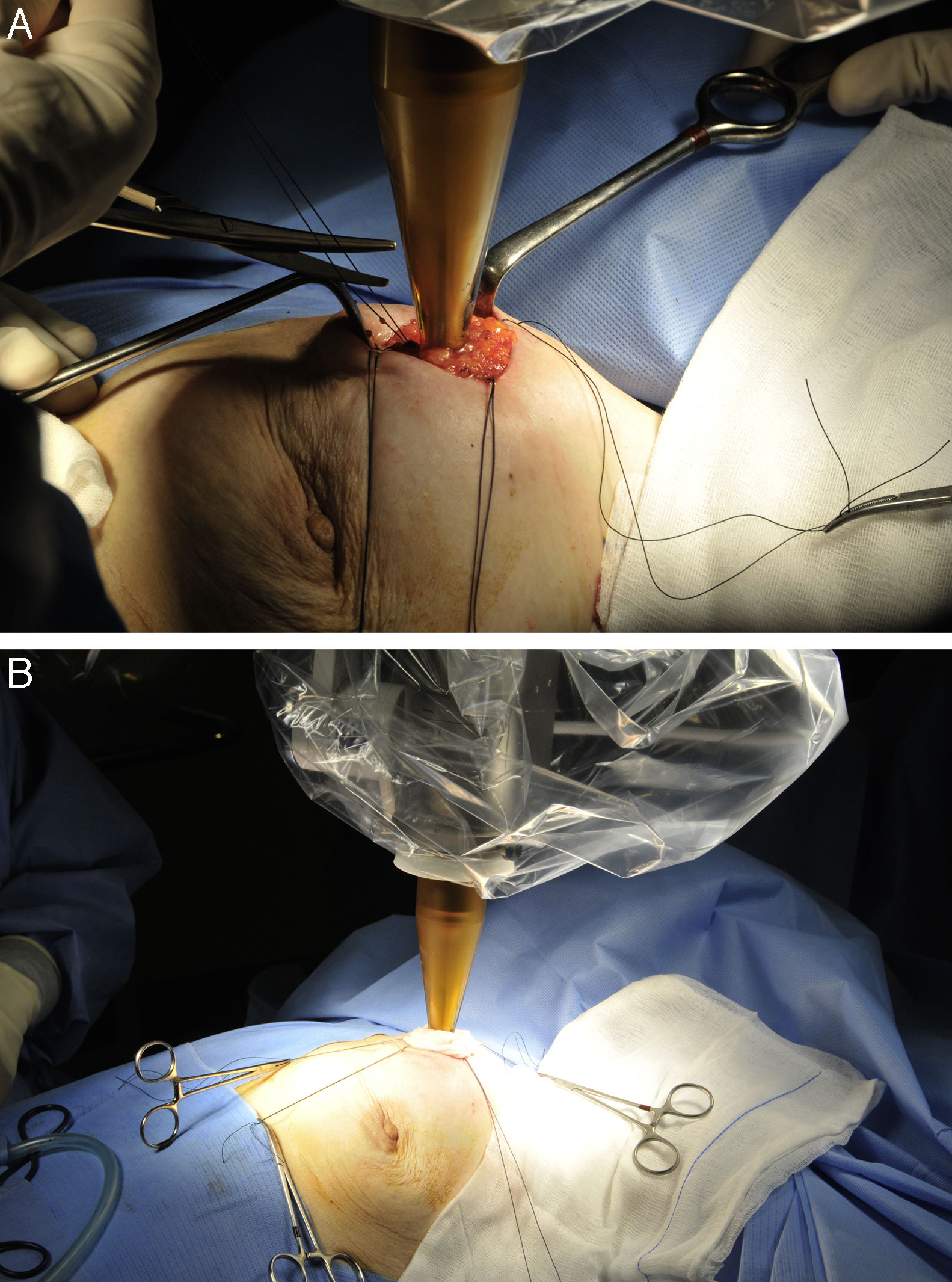
Ajuste de la bolsa de tabaco sobre el aplicador (fig. 2A).
Figura 2.Protocolo de actuación y técnica quirúrgica para la administración de IORT con Intrabeam®. A) Se ajusta la bolsa de tabaco parenquimatosa al aplicador esférico y se colocan en los bordes de la incisión cutánea los puntos tractores necesarios para alejar la piel del aplicador. B) Se coloca una gasa húmeda bajo la piel de todo el perímetro de la incisión para asegurar la preservación cutánea frente a la irradiación.
- 10.
Colocación en los bordes de la incisión cutánea de una serie de puntos tractores necesarios para alejar la piel del aplicador, al menos 10mm, fijándose los puntos a los paños de campo con pinzas de mosquito, etc. (fig. 2A).
- 11.
Colocación de una gasa húmeda bajo la piel de todo el perímetro de la incisión para alejarla del área de dosis elevada de irradiación y del aumento de temperatura que genera el equipo (fig. 2B).
- 12.
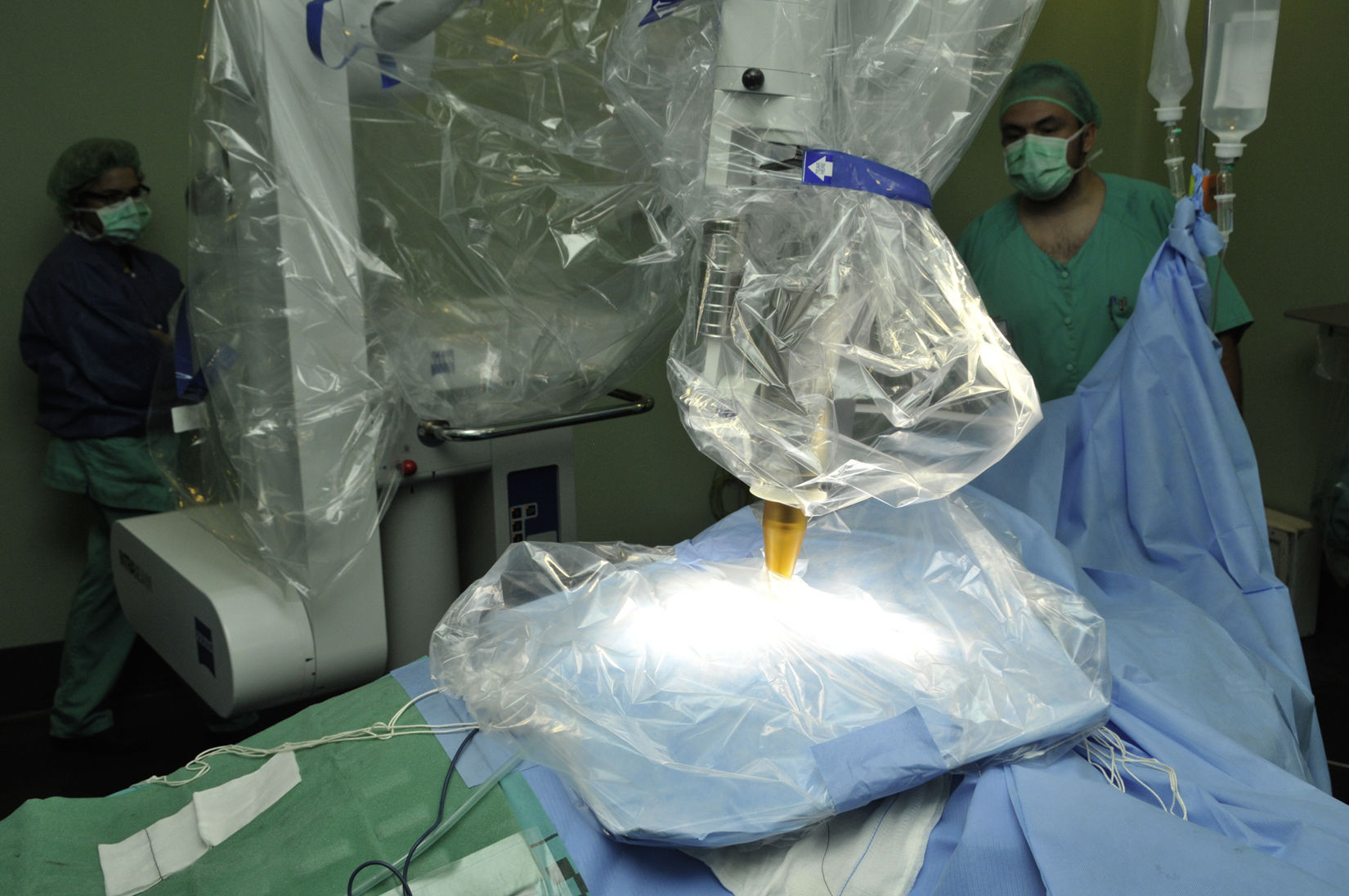
Colocación de las láminas de wolframio protectoras para sellar la herida quirúrgica antes del tratamiento y bloquear la radiación dispersa (fig. 3). Estas láminas bloquean el 95% de la radiación, permiten permanecer en quirófano durante el tratamiento con una pantalla blindada, pero en nuestro centro se optó por permanecer fuera con control de acceso al quirófano durante el tratamiento y control de parámetros anestésicos con monitor auxiliar. De esta forma, es posible utilizar para la administración de la IORT las salas operatorias existentes.
- 13.
Evacuación de todo el personal fuera del quirófano. El personal de Anestesiología y Radiofísica permanecía en un antequirófano contiguo, donde se encontraba la consola del dispositivo y los monitores de control de constantes del paciente.
- 14.
Comprobación de que la señalización de riesgo radiológico era la adecuada y de que las puertas de acceso al quirófano se encontraban bloqueadas.
- 15.
Inicio de la IORT. Se administró mediante el dispositivo Intrabeam® (Carl Zeiss Meditec, Oberkochen, Alemania), terapia utilizada en el ensayo clínico aleatorizado controlado multicéntrico TARGIT-A13,14, el único ensayo clínico multicéntrico sobre IORT, cuyos resultados a los 5 años de seguimiento se han publicado en febrero de 2014. El dispositivo Intrabeam® (fig. 1A y fig. 3) proporciona una fuente puntual de rayos X de baja energía (máximo 50kV) en la punta de un tubo con un diámetro de 3,2mm que se encuentra en el centro de un aplicador esférico adaptado al lecho tumoral (fig. 1B). Después de colocar quirúrgicamente el aplicador del tamaño adecuado en el lecho tumoral (de 2,5 a 5cm de diámetro), la radiación se administraba durante 17 a 47min para dirigirse a los tejidos con un mayor riesgo de recidiva local. La superficie del lecho del tumor recibe típicamente 20Gy, que se atenúan a 5-7Gy a 1cm de profundidad. En nuestras pacientes, se realizó, al igual que en el estudio TARGIT-A, un manejo «adaptado al riesgo», de manera que, si en el examen definitivo de Anatomía Patológica (AP) se objetivaban características adversas imprevistas preespecificadas (ganglio centinela afecto por metástasis de carcinoma, tipo histológico imprevisto definitivo de carcinoma lobulillar infiltrante, extensa invasión linfovascular, extenso componente in situ, margen libre próximo<5mm), se administraba radioterapia externa convencional a toda la mama (y cuando fue indicado también axilar), sirviendo la IORT como boost sobre el lecho tumoral. Finalización de la IORT.
- 16.
Liberación de la bolsa de tabaco para la extracción del aplicador y retirada del dispositivo, bajo la comprobación de Oncología Radioterápica y Física Médica.
- 17.
Revisión de hemostasia. Colocación de clips metálicos en el lecho de tumorectomía. Mamoplastia si es preciso, drenaje si el lecho quirúrgico es amplio y cierre de cavidad de tumorectomía. Conclusión de la cirugía.
Todas las pacientes firmaron el consentimiento informado para la realización de este tipo de tratamiento siguiendo las indicaciones del Comité de Ética y Ensayos Clínicos del Hospital.
Análisis de los datosSe analizaron la mortalidad y el número de complicaciones locales relacionadas con el procedimiento, la toxicidad según la última versión de la escala NCI CTCAE (v. 4.03), del Common Terminology Criteria for Adverse Events y The National Cancer Institute of the National Institutes of Health de los EE. UU.15, el índice de recidivas durante el seguimiento, el resultado estético valorado por la propia paciente (en una escala de valoración como malo, bueno, muy bueno), así como la necesidad de reintervención o de completar el tratamiento. Las frecuencias se expresaron como número y porcentaje.
ResultadosDurante el periodo a estudio, se intervino a 390 pacientes con cáncer de mama. De estas, 120 (31%) fueron inicialmente seleccionadas para IORT con Intrabeam®, según los criterios descritos. De las 120 pacientes, 34 (28%) no recibieron IORT debido al tamaño de la cavidad quirúrgica (28 casos) o problemas técnicos (6 casos). Finalmente, 86 pacientes (72%) recibieron IORT. Las características generales de la muestra se expresan en la tabla 1. El seguimiento medio de las pacientes fue de 12,5 meses.
Características de las pacientes y de los tumores
| Edad (años) | |
| <50 | 3 (4) |
| 50-59 | 19 (22) |
| 60-69 | 45 (52) |
| 70-79 | 14 (16) |
| ≥80 | 5 (6) |
| Tamaño tumoral clínico (cm) | |
| ≤2 | 84 (98) |
| >2 | 2 (2) |
| Tamaño tumoral histológico (cm) | |
| ≤2 | 76 (88) |
| >2 | 10 (12) |
| Grado tumoral | |
| 1 | 34 (39) |
| 2 | 42 (49) |
| 3 | 10 (12) |
| Diámetro aplicador (cm) | |
| 2,5 | 2 (2) |
| 3 | 4 (5) |
| 3,5 | 26 (30) |
| 4 | 35 (41) |
| 4,5 | 14 (16) |
| 5 | 5 (6) |
Datos expresados como n (%).
La edad media de las pacientes fue de 64 años (rango: 46-86 años). El diámetro medio del aplicador fue de 4cm (2,5-5cm). El tiempo quirúrgico medio por paciente fue de 150min. Todas las pacientes recibieron profilaxis antibiótica con amoxicilina-clavulánico iv o ciprofloxacino si eran alérgicas a penicilina. El tiempo empleado en la administración de la radioterapia dependió del diámetro del aplicador utilizado, variando de 17 a 47min. Con respecto al estadio clínico, 84 casos (96%) fueron clasificados como estadio IA y 2 casos (4%) como estadio IIA. Según el examen histológico definitivo de AP, se clasificaron 58 casos (67%) como estadio IA, 11 casos (13%) como estadio IB, 12 casos (14%) como estadio IIA y 5 casos (6%) como estadio IIB. El subtipo molecular fue luminal A en 49 pacientes (57%), luminal B HER 2+ en 6 pacientes (7%) y luminal sin determinar A o B en 31 pacientes (36%).
Se reintervino a 5 pacientes por márgenes afectos (6%), realizándose en un caso ampliación de márgenes y en 4, mastectomía por carcinoma in situ extenso o multifocalidad. Se realizó vaciamiento axilar en un caso (1%), en el que el examen histológico definitivo evidenció una macrometástasis y 2 micrometástasis en los ganglios centinela. En 22 pacientes (26%) fue preciso administrar radioterapia externa, en 21 de ellas (95%) por afectación axilar (14 casos con micrometástasis en los ganglios centinela [67%]) y en un caso tras ampliación de márgenes de tumorectomía y afectación axilar. Se administraron en estos casos 40,05Gy sobre la mama y áreas ganglionares. Una paciente (1%), tras mastectomía, recibió solo radioterapia axilar por afectación metastásica del ganglio centinela. En todas las pacientes se realizó ecografía axilar previa a la cirugía y se realizó PAAF si era preciso, siendo la axila ecográfica o citológicamente negativa en todos los casos. Todas las pacientes con afectación axilar recibieron quimioterapia adyuvante según el protocolo de nuestro hospital con FEC-taxol (±trastuzumab), iniciándose la radioterapia adyuvante tras la quimioterapia. Todas las pacientes, tras la finalización de la terapia adyuvante con quimio o radioterapia, iniciaron hormonoterapia (±trastuzumab).
No ha habido ninguna recidiva locorregional ni a distancia. Tampoco ha habido mortalidad relacionada con el cáncer de mama.
Trece pacientes (15%) tuvieron complicaciones clínicamente relevantes (tabla 2). Tres pacientes presentaron un seroma que requirió más de 3 aspiraciones para su resolución (4%). Seis pacientes (7%) tuvieron absceso-mastitis, siendo 3 casos en el postoperatorio tardío, tras la administración de la radioterapia externa (2 casos de mastitis y uno de absceso, que requirió drenaje por punción). Las otras 3 pacientes presentaron 2 casos de absceso (uno de ellos requirió drenaje quirúrgico con anestesia local y el otro caso, drenaje por punción) y un caso de mastitis, que se resolvió con antibioticoterapia oral. Ninguna paciente necesitó reintervención quirúrgica por hemorragia, aunque 2 presentaron hematoma en el lecho quirúrgico (2%), que requirió punción. Dos pacientes (2%) presentaron dehiscencia parcial de la herida quirúrgica, una de ellas tras un traumatismo casual en el domicilio, que evolucionó a fístula crónica, requiriendo una reintervención para fistulectomía.
No hubo toxicidad aguda grave (grado iii y iv). En 15 casos (17%) hubo toxicidad aguda moderada cutánea (grado ii). Entre las pacientes con un seguimiento mayor de 6 meses (65 pacientes, 76%) no hubo toxicidad crónica grave, presentando 21 casos (24%) induración crónica leve-moderada (grado i-ii).
El resultado estético fue considerado como bueno o muy bueno en 75 pacientes (87%).
DiscusiónLa IORT en estadios iniciales del cáncer de mama resulta actualmente una alternativa atractiva en pacientes seleccionadas. Se administra durante la cirugía y permite reducir a una única sesión el periodo de tratamiento radioterápico, evitándose los desplazamientos diarios durante semanas a los centros de referencia5–9. Por otra parte, descarga de trabajo y disminuye las listas de espera para tratamiento adyuvante radioterápico externo del cáncer de mama, que supone más del 30% de la actividad de los servicios de Oncología Radioterápica11.
Los estudios sobre IORT en el cáncer de mama con mayor evidencia científica son 2 ensayos clínicos: el estudio TARGIT-A13,14, que utiliza el dispositivo Intrabeam®, y el estudio ELIOT16, que usa radiación con electrones.
En nuestro hospital, se inició la IORT con dispositivo Intrabeam® para el cáncer de mama precoz considerándose candidatas a este tratamiento las pacientes que cumplían el protocolo del estudio TARGIT-A. De las 120 pacientes elegidas para IORT, finalmente se realizó en 86 (72%), lo cual indica que prácticamente a las dos terceras partes de este tipo de pacientes se les puede aplicar el tratamiento sin problemas. Algunas de las causas de la no realización de IORT fueron problemas técnicos que surgieron al comienzo de la aplicación de la técnica y que se han corregido con la curva de aprendizaje.
Las características generales y oncológicas de las pacientes de nuestra serie son muy similares a las del estudio TARGIT-A13,14, aunque existen algunas discrepancias con el estudio ELIOT16, que presenta más pacientes con factores de mal pronóstico (pacientes jóvenes, porcentaje de Ki67 elevado, subtipo triple negativo, etc.). En nuestro hospital, no es de rutina la determinación del Ki67, y la determinación de la sobreexpresión de HER 2 neu se realiza en la pieza de tumorectomía, no en la BAG al diagnóstico, lo que justifica que en algunas de nuestras pacientes el subtipo molecular sea luminal B HER 2+. Hay que destacar que el estudio ELIOT no tiene un diseño «adaptado al riesgo», es decir, aunque las pacientes presenten en el examen de AP definitivo factores que se consideran de mal pronóstico, no se realiza radioterapia externa de toda la mama. Esta es una importante diferencia con el estudio TARGIT-A y con nuestra serie. En el estudio TARGIT-A existen 2 cohortes, una en la que se administra la IORT durante el acto quirúrgico y, por tanto, sin los resultados definitivos de AP (cohorte pre-AP definitiva), más similar a la nuestra, y otra cohorte a la que se le administra IORT tras el examen definitivo de AP, con reapertura de la herida quirúrgica (cohorte post-AP). En el 15,2% de las pacientes hubo que administrar radioterapia externa, concretamente en el 21,6% de las pacientes de la cohorte pre-AP. En nuestra serie, el 26% de las pacientes recibieron radioterapia externa de la mama, porcentaje que se acerca al de la cohorte pre-AP del estudio TARGIT-A, y casi todas ellas debido a afectación metastásica de los ganglios centinela. De modo que 64 pacientes (74%) no requirieron radioterapia externa y se beneficiaron de un procedimiento que supone concluir el tratamiento conservador (cirugía y radioterapia) en un solo día.
Con respecto a la recaída locorregional y a distancia, en nuestras pacientes no ha habido ninguna recidiva local ni a distancia, ni mortalidad, si bien el seguimiento medio ha sido tan solo de 12,5 meses. En el estudio TARGIT-A13,14, que incluyó 3.451 pacientes con seguimiento medio de 29 meses, el 3,3% de las pacientes que recibieron IORT presentaron una recidiva frente al 1,3% de las que recibieron radioterapia externa. Se evidencia que las pacientes que reciben IORT tienen una mayor probabilidad de recidiva, aunque no repercute en la mortalidad relacionada con el cáncer de mama. Sin embargo, existían menos casos de muertes no relacionadas con el cáncer de mama, atribuibles a menos muertes por problemas cardiovasculares por toxicidad rádica y otros cánceres. La mortalidad global del grupo IORT fue del 3,9 vs. 5,3% en el grupo de radioterapia externa.
En cuanto a la necesidad de reexcisiones, en el estudio TARGIT-A no hubo diferencias entre el grupo que recibió IORT y el grupo que recibió radioterapia externa (7,1 vs. 9,2%)13,14. En nuestra serie, el porcentaje de reexcisiones fue incluso menor (6%), y se debieron fundamentalmente a carcinoma intraductal extenso peritumoral y multifocalidad. En nuestro centro, no se realiza de forma rutinaria RMN mamaria prequirúrgica a las pacientes candidatas a IORT. Los criterios para la realización de RMN mamaria en pacientes con cáncer de mama en nuestro hospital son carcinoma intraductal de dudosa extensión, mamas densas, pre y posquimioterapia neoadyuvante, portadoras de prótesis mamarias y no correlación clínico-radiológica tumoral.
La aparición de complicaciones en el grupo que recibió IORT en el estudio TARGIT-A fue de 11,5 frente al 10,6% en el grupo que recibió radioterapia externa de la mama, no existiendo diferencias significativas13. En nuestra serie, el porcentaje de pacientes que presentaron complicaciones clínicamente relevantes fue del 15%, algo más elevada y fundamentalmente a expensas de procesos infecciosos. Cabe decir de nuevo que a todas las pacientes se les realizó profilaxis antibiótica durante la inducción anestésica, algo que consideramos importante para la prevención de estas complicaciones. La aparición de seroma que precisara más de 3 aspiraciones para su resolución fue más frecuente en el grupo IORT en el estudio TARGIT-A13 (2,1 vs. 0,8%); sin embargo, la toxicidad grado iii y iv fue menor en el grupo que recibió IORT (0,5%) frente al grupo de radioterapia externa (2,1%). En el estudio ELIOT16, todos los tipos de toxicidad cutánea fueron menos frecuentes en el grupo que recibió IORT, excepto la necrosis grasa. Ninguna de nuestras pacientes tuvo toxicidad grave. Solo el 4% de las pacientes tuvieron seroma recidivante y únicamente el 2% presentaron dehiscencia parcial de la herida, datos que coinciden con los porcentajes descritos en la literatura para ambos grupos de tratamiento12–14.
La gran mayoría de nuestras pacientes se encontraron satisfechas con el resultado cosmético. Zhou et al.17 evaluaron el resultado estético al año de la cirugía en los 2 grupos de tratamiento (IORT vs. radioterapia externa convencional), encontrando que en el grupo de IORT los porcentajes de resultados excelentes y buenos eran mayores (90 vs. 75%).
Como conclusión, la IORT con Intrabeam® es una alternativa segura y bien tolerada frente a la radioterapia externa en pacientes seleccionadas, teniendo una baja morbilidad y permitiendo una mejoría en la calidad de vida de las pacientes, con un buen resultado estético a corto plazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesPedro Lara Jiménez es asesor médico de la empresa Carl Zeiss. El resto de autores declaran no tener ningún conflicto de intereses.