el tratamiento conservador de la mama junto con la radioterapia es de elección en las pacientes con cáncer de mama precoz. Gracias a un mayor conocimiento de la radiobiología tumoral, la tendencia actual consiste en utilizar técnicas de irradiación parcial acelerada, entre las que destaca la radioterapia intraoperatoria (RIO).
Métodosestudio prospectivo multicéntrico dividido en 2 grupos comparativos con casos consecutivos de las pacientes a que han recibido una cirugía conservadora por cáncer de mama asociada o no a RIO. Se valora la relación de esta terapia con los valores de las proteínas involucradas en la respuesta biológica (IL6, IL8, CXCL10, IL1β y TNF- α) en muestras de suero preoperatorio y a las 24 h desde la cirugía, y de drenaje quirúrgico a las 6 y 24 h desde la cirugía.
Resultadosse ha objetivado en las pacientes tratadas con RIO una disminución significativa de IL6 e IL8, así como un aumento de CXCL10 favorable para la lucha contra la progresión del tumor (p valor < 0,05). Las alteraciones del sistema inmunológico se manifiestan tanto en suero como en débito del drenaje quirúrgico a las 6 y 24 h desde la cirugía.
Conclusionesla RIO modifica la respuesta biológica en las pacientes con cáncer de mama. A pesar de que se deben desarrollar más líneas de investigación, la comprensión de los mecanismos de desarrollo del tumor, abre una nueva etapa en el desarrollo de tratamientos perioperatorios dirigidos a dianas concretas que compensen las consecuencias dañinas de la cirugía.
Breast conserving surgery with radiotherapy is the treatment of choice in patients with early breast cancer. Due to a better understanding of tumour radiobiology, the current trend is to use accelerated partial irradiation techniques, among which intraoperative radiotherapy (RIO) stands out.
MethodsProspective multicentre study divided into two comparative groups with consecutive cases of patients who have undergone conservative surgery for breast cancer associated or not with RIO. The relation of this therapy with the values of proteins involved in the biological response (IL6, IL8, CXCL10, IL1β y TNF- α) is assessed in serum samples preoperative and 24 hours after surgery, and surgical drainage samples at 6 and 24 hours after surgery.
ResultsA significant decrease in IL6 and IL8, as well as an increase in CXCL10 favourable for the fight against tumour progression (p-value < 0.05) was observed in patients treated with RIO. Immune system alterations are manifested in both serum and surgical drainage debit at 6 and 24 hours after surgery.
ConclusionsRIO modifies the biological response in breast cancer patients. Although more lines of research need to be developed, the understanding of the mechanisms of tumour development opens a new stage in the development of perioperative treatments directed at specific targets that compensate for the harmful consequences of surgery.
El tratamiento conservador de la mama junto con la radioterapia, es en la actualidad de elección para la mayoría de las pacientes con cáncer de mama precoz1.
La radioterapia externa constituye el tratamiento más ampliamente aceptado e impacta tanto en el control local como en la supervivencia. Sin embargo, gracias a un mayor conocimiento de la radiobiología tumoral, la tendencia actual consiste en utilizar técnicas de irradiación parcial acelerada, siguiendo una estricta selección de las pacientes de buen pronóstico según las recomendaciones de consenso de la American Society for Radiation Oncology (ASTRO) y de la European Society for Radiotherapy and Oncology (ESTRO). Entre ellas destaca la radioterapia intraoperatoria (RIO), que permite utilizar en una única dosis de radiación de forma directa en el lecho quirúrgico, dosis superiores, lo que disminuye la duración del tratamiento y mejora la calidad de vida de las pacientes1–7.
Estudios recientes sostienen que la RIO, además de esterilizar el lecho tumoral de las células cancerígenas, puede afectar a la cinética de crecimiento de dichas células modificando el microambiente tumoral, y compensar el efecto favorecedor del desarrollo del tumor que supone la propia cirugía, induciendo los mecanismos de respuesta del sistema inmunológico8–14.
La RIO podría mejorar los efectos biológicos de la radioterapia estándar, por aplicarse en el lecho quirúrgico sin intervalo libre de administración para la reparación de las células tumorales y su proliferación, lo que podría representar una medida más efectiva para reducir la recurrencia local9–11,14–17.
Belletti et al. objetivaron una menor migración, capacidad de invasión y proliferación de las células de cáncer de mama después de aplicar la RIO, así como una disminución en las citoquinas involucradas en el crecimiento tumoral, a través del análisis de mezclas de suero preoperatorio y drenaje quirúrgico a las 24 h desde la cirugía15,18.
Por su parte, otros autores han estudiado el efecto biológico de la RIO utilizando únicamente muestras de débito de drenaje quirúrgico a las 48 h desde la cirugía mediante diferentes metodologías de estudio.
Zaleska et al.9,10 observaron que se estimulaba en menor medida el desarrollo de las células CD44+/CD24low más agresivas.
Piotrowski et al.11 observaron que el daño producido en el ADN de las células de cáncer de mama era mediado por un efecto de vecindad que se objetivaba tras la administración de la RIO. Este efecto de vecindad hace referencia al hecho de que la radioterapia no solamente afecta a las células irradiadas, sino que también afecta a las células vecinas, a través de mecanismos mediados por señales del sistema inmunológico, principalmente citoquinas y quimiocinas19,20.
Además, en un reciente estudio publicado por Kulcenty et al.19,20 se ha determinado que el efecto que la cirugía tiene en la adquisición de un fenotipo más agresivo en las células tumorales del cáncer de mama relacionado con la transición epitelio-mesenquimal (EMT)21, se revierte tras la administración de la RIO mediado por el efecto de vecindad.
La RIO constituye la primera técnica que permite radiar el lecho tumoral en el mismo momento que la cirugía exerética del cáncer de mama y ofrece la posibilidad de estudiar el efecto de la radioterapia en el microambiente tumoral en humanos in vivo15.
Basándonos en estudios previos sobre el conocimiento de la rabiología tumoral, el objetivo de nuestro estudio, por tanto, es analizar el efecto que la RIO tiene sobre la respuesta biológica del cáncer de mama, ya que abriría una nueva etapa en el desarrollo de tratamientos perioperatorios dirigidos a dianas concretas que compensen las consecuencias dañinas de la cirugía y nos ayuden a comprender los mecanismos de desarrollo del tumor.
MétodosDiseño del estudioSe ha realizado un estudio prospectivo multicéntrico dividido en 2 grupos comparativos con casos consecutivos de las pacientes que han recibido una cirugía conservadora por cáncer de mama asociada o no a RIO.
Para evaluar la relación de la RIO con los valores de las proteínas involucradas en la respuesta biológica (IL6, IL8, CXCL10, IL1β y TNF- α) objetivados en las muestras de drenaje quirúrgico y suero de las pacientes se han recogido en todos los casos muestras de suero preoperatorio y a las 24 h desde la cirugía y muestras de drenaje quirúrgico a las 6 y 24 h desde la cirugía.
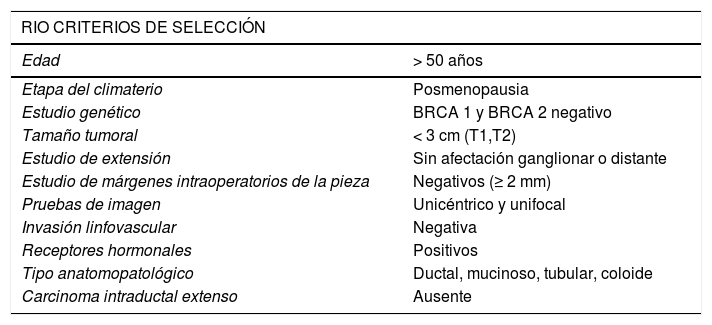
Criterios de inclusiónEl grupo correspondiente a las pacientes con cáncer de mama a las que se les ha administrado la RIO, grupo de casos, responden a los criterios de selección de la RIO en nuestro centro (tabla 1).
Criterios de selección RIO
| RIO CRITERIOS DE SELECCIÓN | |
|---|---|
| Edad | > 50 años |
| Etapa del climaterio | Posmenopausia |
| Estudio genético | BRCA 1 y BRCA 2 negativo |
| Tamaño tumoral | < 3 cm (T1,T2) |
| Estudio de extensión | Sin afectación ganglionar o distante |
| Estudio de márgenes intraoperatorios de la pieza | Negativos (≥ 2 mm) |
| Pruebas de imagen | Unicéntrico y unifocal |
| Invasión linfovascular | Negativa |
| Receptores hormonales | Positivos |
| Tipo anatomopatológico | Ductal, mucinoso, tubular, coloide |
| Carcinoma intraductal extenso | Ausente |
El grupo de control son las pacientes a las que se les ha realizado cirugía conservadora del cáncer de mama sin administración de la RIO pero que tienen las mismas características que el grupo de casos y no han recibido este tratamiento, bien por no disponer de la técnica en el centro donde fueron tratadas o por presentar una mama pequeña para la aplicación de la misma.
Todas las pacientes incluidas en el estudio han firmado el consentimiento informado específico requerido, siendo el estudio aprobado por el Comité de Ética de la Investigación de nuestra Comunidad.
ProcedimientosSe completó un formulario para cada paciente incluida en el estudio con los parámetros relativos a datos demográficos, clínicos, diagnósticos, quirúrgicos, anatomopatológicos, moleculares e inmunohistoquímicos.
En el grupo de pacientes en las que se administró la RIO, esta se aplicó mediante una fuente radiactiva Xoft AxxentTM x-Ray Source modelo S700 que imparte 20Gy en la superficie del aplicador tipo balón. El sistema de planificación utilizado es BrachyVisionTM de Varian.
Para la inmunodetección de proteínas, se ha realizado en cada una de las muestras recogidas de suero y drenaje quirúrgico el análisis de IL6, IL8, CXCL10, IL1β y TNF- α mediante kits de ELISA específicos para proteínas humanas (Invitrogen, Thermo Fisher Scientific). Se han realizado controles positivos y negativos, así como determinaciones por duplicado para considerarlas específicas.
Análisis estadísticoEl tamaño muestral se ha calculado asumiendo que la variable correspondiente a las proteínas analizadas sigue una distribución normal, basándose en el cálculo para comparación de medias de 2 grupos independientes y usando la prueba t de Student. A un nivel de confianza del 95% y una potencia mínima del 80%, se necesitan 25 pacientes por grupo. Teniendo en cuenta un 5% de posibles pérdidas, la muestra necesaria estimada es de 27 pacientes por grupo.
Se realizó en primer lugar un análisis descriptivo de las variables a estudio y, posteriormente, un análisis bivariante, mediante la prueba de Chi-Cuadrado o el test de Fisher para variables cualitativas, y el test de t de Student o la prueba de U de Mann-Whitney para variables cuantitativas paramétricas o no, respectivamente.
Por último, analizamos los valores obtenidos a través de los modelos ANOVA de medidas repetidas (nparLD: an R Software Package for the Nonparametric Analysis of Longitudinal Data in Factorial Experiments) en los que hemos tenido en cuenta si las pacientes han recibido o no la RIO (grupo de casos y de controles), así como el tipo de muestra (suero o débito del drenaje quirúrgico) y el tiempo transcurrido desde la cirugía (preoperatorio, a las 6 h y 24 h desde la cirugía).
Se utilizó el software estadístico R 3.5.1 y se estableció un nivel de significación estadística para un p valor menor de 0,05.
ResultadosSe reclutaron un total de 60 pacientes para el estudio, el 50% de las pacientes (n = 30) conformaron el grupo de casos, recibiendo la RIO tras la cirugía conservadora del cáncer de mama. El 50% restante (n = 30), formaron el grupo de controles realizándose cirugía conservadora del cáncer de mama asociada a la radioterapia convencional.
Todas las pacientes incluidas cumplían los criterios de inclusión sin observar diferencia estadística entre los grupos.
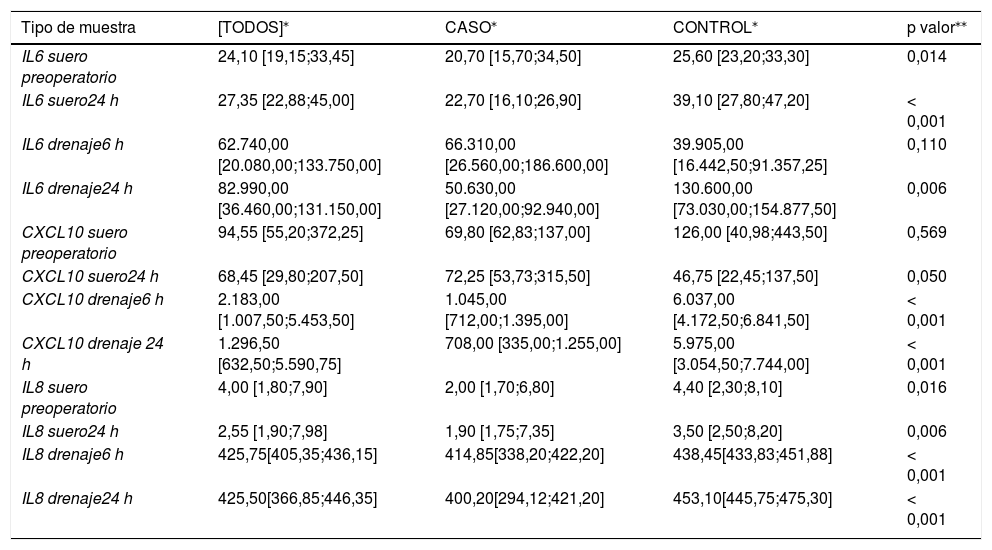
En primer lugar, se realizó un análisis bivariante comparando los valores de IL6, IL8, CXCL10, IL1β y TNF- α objetivados en los diferentes tipos de muestra entre las pacientes a las que se les ha realizado cirugía conservadora de cáncer de mama recibiendo posteriormente la RIO (casos) o no (controles).
Nuestros resultados muestran diferencias estadísticamente significativas entre las pacientes pertenecientes al grupo de casos y aquellas pertenecientes al grupo de controles en todos los casos salvo para los valores obtenidos en las muestras de suero preoperatorio y suero a las 24 h desde la cirugía de CXCL10, suero preoperatorio de TNF-α, drenaje a las 6 h desde la cirugía de IL6, IL1β, TNF-α y TGF-β, así como drenaje a las 24 h desde la cirugía de IL1β (tabla 2).
Análisis bivariante entre casos y controles
| Tipo de muestra | [TODOS]⁎ | CASO⁎ | CONTROL⁎ | p valor⁎⁎ |
|---|---|---|---|---|
| IL6 suero preoperatorio | 24,10 [19,15;33,45] | 20,70 [15,70;34,50] | 25,60 [23,20;33,30] | 0,014 |
| IL6 suero24 h | 27,35 [22,88;45,00] | 22,70 [16,10;26,90] | 39,10 [27,80;47,20] | < 0,001 |
| IL6 drenaje6 h | 62.740,00 [20.080,00;133.750,00] | 66.310,00 [26.560,00;186.600,00] | 39.905,00 [16.442,50;91.357,25] | 0,110 |
| IL6 drenaje24 h | 82.990,00 [36.460,00;131.150,00] | 50.630,00 [27.120,00;92.940,00] | 130.600,00 [73.030,00;154.877,50] | 0,006 |
| CXCL10 suero preoperatorio | 94,55 [55,20;372,25] | 69,80 [62,83;137,00] | 126,00 [40,98;443,50] | 0,569 |
| CXCL10 suero24 h | 68,45 [29,80;207,50] | 72,25 [53,73;315,50] | 46,75 [22,45;137,50] | 0,050 |
| CXCL10 drenaje6 h | 2.183,00 [1.007,50;5.453,50] | 1.045,00 [712,00;1.395,00] | 6.037,00 [4.172,50;6.841,50] | < 0,001 |
| CXCL10 drenaje 24 h | 1.296,50 [632,50;5.590,75] | 708,00 [335,00;1.255,00] | 5.975,00 [3.054,50;7.744,00] | < 0,001 |
| IL8 suero preoperatorio | 4,00 [1,80;7,90] | 2,00 [1,70;6,80] | 4,40 [2,30;8,10] | 0,016 |
| IL8 suero24 h | 2,55 [1,90;7,98] | 1,90 [1,75;7,35] | 3,50 [2,50;8,20] | 0,006 |
| IL8 drenaje6 h | 425,75[405,35;436,15] | 414,85[338,20;422,20] | 438,45[433,83;451,88] | < 0,001 |
| IL8 drenaje24 h | 425,50[366,85;446,35] | 400,20[294,12;421,20] | 453,10[445,75;475,30] | < 0,001 |
| Tipo de muestra | [TODOS]⁎ | CASO⁎ | CONTROL⁎ | p valor⁎⁎ |
|---|---|---|---|---|
| IL1β sueropreoperatorio | 1,90 [1,70;2,00] | 1,70 [1,50;1,83] | 2,00 [1,90;2,10] | < 0,001 |
| IL1β suero24 h | 1,90 [1,60;2,20] | 1,60 [1,50;1,70] | 2,10 [2,00;2,20] | < 0,001 |
| IL1β drenaje6 h | 30,90[12.10;56.10] | 37,20[14.10;69.20] | 19,55[6,28;41,45] | 0,073 |
| IL1β drenaje24 h | 52,85[25,45;95,43] | 40,70[23,30;71,40] | 56,70[30,80;119,25] | 0,307 |
| TNFα sueropreoperatorio | 3,60 [3,40;3,70] | 3,70 [3,45;3,75] | 3,55 [3,25;3,70] | 0,371 |
| TNFα suero24 h | 3,60 [3,15;3,75] | 3,70 [3,60;3,90] | 3,45 [3,10;3,70] | 0,019 |
| TNFα drenaje6 h | 40,40[19,15;101,80] | 39,90[20,10;100,52] | 40,40[15,80;101,80] | 0,823 |
| TNFα drenaje24 h | 19,10[3,90;108,50] | 71,95[16,68;121,52] | 3,90[3,60;28,70] | 0,003 |
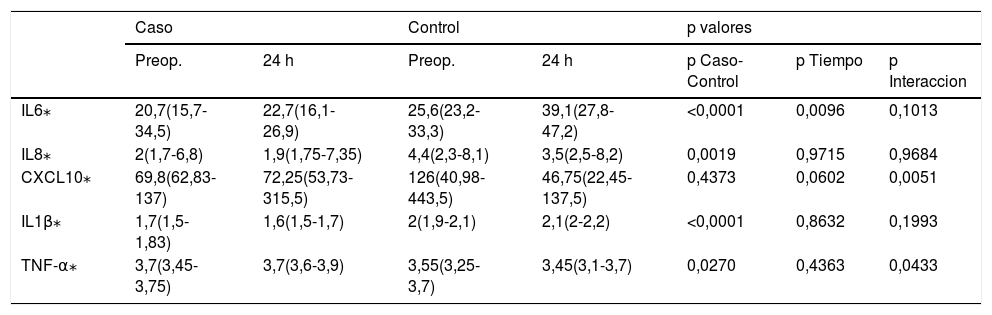
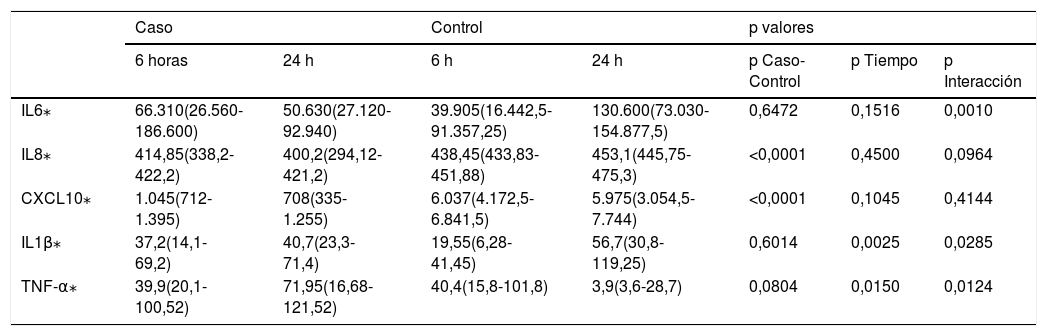
Posteriormente, realizamos un análisis multivariante a través de modelos ANOVA de medidas repetidas. En este caso, analizamos para cada una de las proteínas a estudio las diferencias en las muestras obtenidas en suero preoperatorio y a las 24 h desde la cirugía (tabla 3), así como las del drenaje quirúrgico a las 6 y a las 24 h desde la cirugía (tabla 4).
Modelo de medidas repetidas en suero preoperatorio y a las 24 h desde la cirugía
| Caso | Control | p valores | |||||
|---|---|---|---|---|---|---|---|
| Preop. | 24 h | Preop. | 24 h | p Caso-Control | p Tiempo | p Interaccion | |
| IL6⁎ | 20,7(15,7-34,5) | 22,7(16,1-26,9) | 25,6(23,2-33,3) | 39,1(27,8-47,2) | <0,0001 | 0,0096 | 0,1013 |
| IL8⁎ | 2(1,7-6,8) | 1,9(1,75-7,35) | 4,4(2,3-8,1) | 3,5(2,5-8,2) | 0,0019 | 0,9715 | 0,9684 |
| CXCL10⁎ | 69,8(62,83-137) | 72,25(53,73-315,5) | 126(40,98-443,5) | 46,75(22,45-137,5) | 0,4373 | 0,0602 | 0,0051 |
| IL1β⁎ | 1,7(1,5-1,83) | 1,6(1,5-1,7) | 2(1,9-2,1) | 2,1(2-2,2) | <0,0001 | 0,8632 | 0,1993 |
| TNF-α⁎ | 3,7(3,45-3,75) | 3,7(3,6-3,9) | 3,55(3,25-3,7) | 3,45(3,1-3,7) | 0,0270 | 0,4363 | 0,0433 |
Modelo de medidas repetidas en drenaje a las 6 y a las 24 h desde la cirugía
| Caso | Control | p valores | |||||
|---|---|---|---|---|---|---|---|
| 6 horas | 24 h | 6 h | 24 h | p Caso-Control | p Tiempo | p Interacción | |
| IL6⁎ | 66.310(26.560-186.600) | 50.630(27.120-92.940) | 39.905(16.442,5-91.357,25) | 130.600(73.030-154.877,5) | 0,6472 | 0,1516 | 0,0010 |
| IL8⁎ | 414,85(338,2-422,2) | 400,2(294,12-421,2) | 438,45(433,83-451,88) | 453,1(445,75-475,3) | <0,0001 | 0,4500 | 0,0964 |
| CXCL10⁎ | 1.045(712-1.395) | 708(335-1.255) | 6.037(4.172,5-6.841,5) | 5.975(3.054,5-7.744) | <0,0001 | 0,1045 | 0,4144 |
| IL1β⁎ | 37,2(14,1-69,2) | 40,7(23,3-71,4) | 19,55(6,28-41,45) | 56,7(30,8-119,25) | 0,6014 | 0,0025 | 0,0285 |
| TNF-α⁎ | 39,9(20,1-100,52) | 71,95(16,68-121,52) | 40,4(15,8-101,8) | 3,9(3,6-28,7) | 0,0804 | 0,0150 | 0,0124 |
Se observaron diferencias estadísticamente significativas entre las pacientes que habían recibido RIO y las que no habían recibido el tratamiento para cada una de las proteínas analizadas tanto en suero como en débito de drenaje quirúrgico, bien sea en lo relativo al grupo al que pertenecen, casos o controles, al tiempo transcurrido desde la cirugía o al comportamiento de casos y controles en función del paso del tiempo.
DiscusiónEl conocimiento que tenemos de los efectos biológicos que la RIO promueve en las células tumorales y el microambiente tumoral de las pacientes con cáncer de mama es todavía limitado.
La RIO parece contrarrestar los efectos negativos de la agresión quirúrgica a través de su interacción con el microambiente tumoral, postulándose que este efecto es mayor al aplicarse en el sitio quirúrgico en el momento de la intervención8–17.
Los estudios publicados previamente9–11,15,18–20 sobre los mecanismos que la RIO tiene para alterar el microambiente tumoral sugieren que estos están en relación con una alteración en la expresión de las proteínas a nivel local que difieren significativamente entre las pacientes a las que solo se les ha realizado cirugía conservadora del cáncer de mama y aquellas a las que se les ha asociado RIO, y que pueden manifestarse así mismo a nivel sistémico reflejadas en las muestras de suero.
Consideramos que los resultados obtenidos en la determinación de las proteínas analizadas en nuestro estudio, a diferencia de los previos, arrojan resultados más fiables al analizar diversas muestras de cada paciente de forma individual y poder comparar las muestras tanto de suero preoperatorio como a las 24 h desde la cirugía, así como las del drenaje quirúrgico a las 6 y 24 h desde la cirugía.
Según nuestro conocimiento de la bibliografía publicada, este es el primer estudio que compara los valores obtenidos de IL6, IL8, CXCL10, IL1β y TNF-α, como método para valorar la respuesta biológica que produce la RIO en las pacientes a las que se les ha realizado una cirugía conservadora del cáncer de mama aplicándoles RIO o no respectivamente, y utilizando muestras de suero de forma preoperatoria y a las 24 h desde la cirugía, y de débito del drenaje quirúrgico a las 6 y 24 h desde la cirugía.
IL6 e IL8Belletti et al.15 demostraron una disminución de la expresión de IL6 e IL8 en el drenaje quirúrgico tras la administración de RIO que se relaciona con una menor progresión del tumor, ya que estas citoquinas están involucradas en la adquisición de las células cancerígenas de mayor motilidad y capacidad migratoria, por la inducción de la EMT21. Por su parte, Zaleska et al.10 corroboraron que uno de los mecanismos por los que la RIO podía contrarrestar el efecto de la agresión quirúrgica era la vía IL6-STAT3.
En consonancia con sus resultados, nuestro estudio muestra una disminución estadísticamente significativa de IL6 en la muestra obtenida del drenaje quirúrgico a las 24 horas desde la cirugía (p valor 0,006) (tabla 2). Además, mediante el análisis multivariante se observa cómo en el grupo de las pacientes que no reciben la RIO los valores de IL6 se elevan de una forma estadísticamente significativa en la muestra de drenaje obtenida a las 24 h desde la cirugía respecto a la obtenida a las 6 h, cosa que no ocurre si se recibe la RIO (p valor 0,0010) (tabla 4).
Así mismo, para los valores obtenidos para IL8 se observa que se produce una disminución estadísticamente significativa si se recibe la RIO tanto a las 6 como a las 24 h desde la cirugía (p valor <0,001) (tabla 2). Además, se objetiva la misma tendencia comentada para IL6, aunque en este caso no se alcanza la significación estadística (p valor 0,0964) (tabla 4).
Sin embargo, los valores determinados tanto para IL6 como para IL8 deben analizarse con cautela, ya que se han observado diferencias estadísticamente significativas en los valores preoperatorios en suero (p valor 0,014 y 0,016, respectivamente) (tabla 2).
CXCL10Estudios previos han relacionado la expresión de proteínas como CXCL10 con un mejor pronóstico en las pacientes diagnosticadas con cáncer de mama, al promover la infiltración de linfocitos T CD8+ en el tumor12,13. Sin embargo, según nuestro conocimiento de la bibliografía publicada, no existe ningún estudio con un diseño que haga nuestros resultados comparables.
Nuestros resultados no alcanzan la significación estadística entre los casos y los controles en las muestras obtenidas de suero a las 24 h desde la cirugía (p valor 0,050) (tabla 2), sin embargo, muestran una tendencia al aumento de CXCL10 en suero que no se observa en el caso de no recibir la RIO que es estadísticamente significativa mediante el análisis multivariante (p valor 0,0051) (tabla 3).
Cabe destacar que los valores obtenidos en drenaje quirúrgico alcanzan significación estadística (p valor < 0,001), mostrando valores superiores en el grupo control a las 6 y 24 h desde la cirugía, y una disminución con el paso del tiempo en ambos casos que no alcanza la significación estadística y que no mostraría un beneficio en la lucha contra la progresión del tumor (tabla 4).
IL1β y TNF-αTanto IL1β como TNF-α se han relacionado previamente con un estado proinflamatorio que promueve la EMT y la mayor capacidad migratoria de las células tumorales, así como la progresión del tumor vía STAT3, que conlleva la inhibición de la apoptosis de dichas células21.
A pesar de ello, son fieles representantes de la creencia actual de que la inflamación y la respuesta inmunitaria son procesos conectados, desencadenando la inducción de la respuesta inmune en diferentes momentos del desarrollo del tumor22–24. Destaca su papel como mediadores en la respuesta por muerte celular inmunogénica provocada por la aplicación de la radioterapia que conlleva la activación de las células dendríticas y procesamiento de antígenos derivados del tumor, la disminución de citoquinas inmunosupresoras como IL10 y la secreción de quimiocinas como CXCL1012,13.
Los resultados obtenidos para IL1β en suero en el presente estudio se considera que no tienen significación clínica, ya que se partía de unos valores preoperatorios dispares (p valor < 0,001) (tabla 2).
Aunque en los valores obtenidos para IL1β en el drenaje quirúrgico no se observan diferencias estadísticamente significativas entre casos y controles a las 6 y 24 h desde la cirugía (p valores 0,073 y 0,307, respectivamente) (tabla 2), en el análisis multivariante se observa que, en el caso de las pacientes que reciben RIO, los valores se mantienen estables con el paso del tiempo, medianas de 37,2 pg/ml y 40,7 pg/ml a las 6 y 24 h desde la cirugía, respectivamente, mientras que en los controles se produce un aumento significativo de la mediana de 19,55 pg/ml a 56,7 pg/ml a las 6 y 24 h desde la cirugía, respectivamente, que alcanza la significación estadística (p valores 0,0025 y 0,0285) (tabla 4). Por lo tanto, al aplicarse la RIO, el ascenso en los valores de IL1β en el drenaje es menor.
Sin embargo, en el caso de TNF-α se objetiva un aumento significativo de los niveles en el drenaje a las 24 h desde la cirugía (p valor 0,003) (tabla 2), que se corroboran en el análisis multivariante, observando que mientras las pacientes que reciben la RIO experimentan un aumento significativo de TNF-α con el tiempo, en las pacientes que no la reciben, se produce una disminución (p valores 0,0150 y 0,0124, respectivamente) (tabla 4).
En el análisis de TNF- α en suero se observa que previamente a la aplicación de la RIO no había diferencias entre los grupos y posteriormente se establecen estas diferencias (p valor 0,371 y 0,019, respectivamente) (tabla 2). El grupo de pacientes a las que se aplica la RIO mantiene valores estables, mientras que el que no la recibe expresa una disminución de la mediana y un aumento de la variabilidad de los datos (p valor 0,0433) (tabla 3).
Nuestros resultados objetivan que la RIO modifica la respuesta biológica en las pacientes con cáncer de mama. Las alteraciones del sistema inmunológico se manifiestan tanto en suero como en débito del drenaje quirúrgico a las 6 y 24 h desde la cirugía. A pesar de que se deben desarrollar más líneas de investigación, se ha objetivado en las pacientes tratadas con esta terapia una disminución significativa de IL6 e IL8, así como un aumento de CXCL10 favorable para la lucha contra la progresión del tumor.
El conocimiento de los mecanismos de respuesta del sistema inmunológico a la aplicación de la RIO en las pacientes con cáncer de mama puede suponer el desarrollo de nuevas terapias perioperatorias. Algunas de las proteínas analizadas en el presente trabajo se han evaluado como diana terapéutica para control del cáncer. Es el caso de TNF-α coincidiendo con la comercialización de fármacos anti-TNF indicados en enfermedades inflamatorias, con resultados prometedores como la disminución de IL625–27.
Consideraciones éticasTodas las pacientes incluidas en el estudio han firmado el consentimiento informado específico requerido. El estudio ha sido aprobado por el Comité de Ética de Investigación de la Comunidad Autónoma de Aragón.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.