la radioterapia adyuvante en el cáncer de mama se ha administrado durante décadas en fracciones diarias de 1,8 a 2 Gy. Los esquemas hipofraccionados han demostrado ser tan efectivos y seguros como los convencionales. El objetivo es confirmar que los fraccionamientos basados en 5 sesiones durante 5 semanas (sesión semanal) son tan seguros como aquellos de 15 sesiones durante 3 semanas (sesión diaria) en nuestra población.
Material y métodosestudio observacional, retrospectivo, de un solo centro, en el que participaron 100 mujeres con cáncer de mama, radiadas con fraccionamiento de 40 Gy/15 fracciones en 3 semanas o 28,5 Gy/5 fracciones en 5 semanas (1:1). Los test estadísticos empleados fueron U de Mann–Whitney y chi-cuadrado. La toxicidad fue recogida de la historia clínica de las pacientes y evaluada por médicos y enfermeras mediante RTOG/CTCAE Score al final del tratamiento, un mes y 6 meses después.
Resultadosseguimiento medio: 16,6 meses. Edad media: 59 años. En la comparación entre los grupos de 15 y 5 sesiones, respectivamente, se observaron los siguientes resultados: tumorectomía 62% vs. 92%; mastectomía 38% vs. 14%; linfadenectomía 36% vs. 14%; boost 24% vs. 2%; RT sobre FSC + nivel III 54% vs. 8%; toxicidad cutánea aguda 70% vs. 60%; odinofagia aguda 16% vs. 2%; toxicidad tardía (induración, edema, deformidad-distorsión, telangiectasias, hiperpigmentación) 30% vs. 52%.
ConclusionesOdinofagia: más frecuente en tratamientos semanales. Se observó un modesto incremento de induración mamaria G1 en el esquema de 5 fracciones. Por tanto, no se ha detectado ninguna desventaja clínicamente significativa entre ambos esquemas en lo referente a tolerancia y toxicidad.
Adjuvant radiotherapy (RT) for breast cancer has been given in 1.8–2 Gy daily fractions for decades. Protracted schemes have proven as effective and safe as conventional. Schemes involving 5 fractions once a week are as safe as those involving one daily fraction for three weeks. We compared acute and late toxicity of two hypofractionated regimes.
Material and methodsRetrospective single-center observational study involving 100 unselected patients, treated with adjuvant radiotherapy for breast cancer with either 40 Gy/15 fr/3 weeks or 28,5 Gy/5 fr/5 weeks (1:1 ratio). Statistical tests used: Mann–Whitney U and Chi-square (χ2). Toxicity (assessed by physicians/nurses using RTOG/CTCAE Score at end of treatment, one month and six months later) was retrieved from patients notes.
ResultsMedian follow-up: 16.6 months. Average age: 59 years. The comparison between the 15-session and 5-session groups revealed the following results: boost: 24% vs. 2%; lumpectomy: 62% vs. 92%; mastectomy 38% vs. 14%; lymphadenectomy 36% vs. 14%; RT to SCF + level III: 54% vs. 8%; acute skin toxicity 70% vs. 60%; acute odynophagia: 16% vs. 2%; late toxicity (induration, edema, deformity-distortion, telangiectasias, hyperpigmentation) 30% vs. 52%.
ConclusionOdynophagia was more frequent in weekly treatments. Prophylactic nodal irradiation rates could be a confounding factor. A modest excess of G1 breast induration in 5 fractions schemes was detected. To summarize, both schemes are similar concerning acute and late toxicity.
En España, en 2022, el cáncer colorrectal fue el más común en ambos sexos, seguido por el cáncer de mama, próstata y pulmón. Con respecto a la mortalidad, el cáncer de mama representó la cuarta causa de muerte, detrás del cáncer de pulmón, colorrectal y páncreas1.
La mayoría de los cánceres de mama se diagnostican en mujeres después de la menopausia (un 10% ocurre en menores de 40 años), encontrándose, en el momento del diagnóstico, limitado a la mama y a las áreas ganglionares locorregionales en más del 90% de los casos2.
La radioterapia adyuvante en el cáncer de mama reduce significativamente la probabilidad de recaída local del cáncer en la mama tratada, la pared torácica o los ganglios linfáticos regionales, lo que contribuye a una mejora en la supervivencia libre de progresión y, en algunos casos, en la supervivencia global. Esto permite que muchas mujeres puedan optar por una cirugía conservadora de la mama en lugar de una mastectomía, lo que además conlleva una mejora en la calidad de vida y en la imagen corporal de las pacientes.
Dentro de un servicio de oncología radioterápica, el cáncer de mama representa entre el 25 y el 30% de la carga de trabajo anual, ya que aproximadamente 8 de cada 10 pacientes reciben tratamiento radioterápico (RT). Las indicaciones del tratamiento radioterápico adyuvante no varían en función del esquema de fraccionamiento empleado. Estas indicaciones son3:
- •
Tras una cirugía conservadora, se debe irradiar la mama. En nuestro centro, además, realizamos una sobreimpresión del lecho tumoral (boost) en aquellas pacientes menores de 50 años. Se ha demostrado una reducción del riesgo de recurrencia a la mitad y de mortalidad en una sexta parte, evitando así una posterior mastectomía.
- •
Tradicionalmente, las candidatas a mastectomía tenían tumores T3–T4 o N+. El estándar inicial es la RT de pared + RT a las áreas ganglionares. La recomendación es mayor para los T4 que para los T3 y también para los N2 comparados con los N1. Algunas recomendaciónes sugieren que se podría omitir RT en algún T3 (básicamente T3N0) y en alguna paciente con N1 (1–3 ganglios positivos). Las indicaciones de irradiación ganglionar tras una cirugía conservadora no cambian (siempre que existieran ganglios positivos en la cirugía).
A lo largo del tiempo, el tratamiento del cáncer de mama ha sufrido una importante evolución. Inicialmente, durante años, el fraccionamiento convencional consistió en 25 sesiones (START A, 50/2 Gy)4 y gracias a las nuevas técnicas se ha podido establecer como estándar un hipofraccionamiento moderado (START B, 40/2,67 Gy) de 15 sesiones (15 s) sin aumentar la toxicidad (la toxicidad tardía fue igual o menor en comparación con el esquema convencional de 25 sesiones), con la misma eficacia (con un menor impacto en la calidad de vida, ya que la tolerancia fue mejor en comparación) y seguridad (no se ha descrito un aumento en la tasa de recaída local en las pacientes tratadas con este esquema hipofraccionado)5.
En la actualidad, se ha propuesto un nuevo fraccionamiento en 5 sesiones (5 s), con los estudios FAST6 y FAST-FORWARD7. El primero compara 50/2 Gy en 25 sesiones (1 sesión diaria durante 5 semanas) vs. 30/6 Gy en 5 sesiones vs. 28,5/5,7 Gy en 5 sesiones (estos 2 últimos esquemas administrados durante 5 semanas, con una sesión semanal). Los resultados obtenidos no describieron diferencias significativas en la tasa de recurrencia, aunque sí se reportaron menos efectos adversos tardíos en el esquema 28,5/5,7 Gy (siendo, además, este el esquema mejor tolerado) y una mayor fibrosis y cambios en la piel con el fraccionamiento 30/6 Gy. Estos resultados han justificado la continuación de estudios posteriores (FAST-FORWARD). Este analiza 40/2,67 Gy (una sesión diaria durante 3 semanas) vs. 27/5,4 Gy vs. 26/5,2 Gy (los 2 últimos esquemas durante 5 días, una sesión diaria). Aquí los resultados que se obtuvieron pusieron de manifiesto que los esquemas de una semana no eran inferiores al estándar en relación a la tasa de recurrencia local y con respecto a los efectos secundarios la toxicidad es mayor en el esquema de 27 Gy, pero similar en el caso de 26 Gy respecto al estándar de 40 Gy.
Gracias a los resultados de este último estudio, actualmente en nuestro centro estamos llevando a cabo regímenes de tratamiento de 5 fracciones (28,5/5,7 Gy o 26/5,2 Gy).
MetodologíaSe ha llevado a cabo un estudio observacional retrospectivo, de un solo centro, en el que han participado 100 mujeres con cáncer de mama localizado, intervenidas mediante cirugía conservadora o mastectomía, con margen negativo, RT adyuvante en todos los casos sobre la mama o la pared, según tipo de cirugía, sobreimpresión del lecho tumoral (boost) e irradiación de FSC y nivel III ganglionar en las que tuvieron ganglios positivos.
Los regímenes de fraccionamiento han sido de 40 Gy/15 fracciones/3 semanas o 28,5 Gy/5 fracciones/5 semanas (relación 1:1). En el 95% de las pacientes, la técnica de RT empleada ha sido 3D (mientras se cumplieran los «constraints»). En las pacientes en las que no se cumplían (5%), se empleó IMRT.
En cuanto a los test estadísticos empleados, en primer lugar, se ha llevado a cabo un análisis descriptivo univariante, tanto de las variables sociodemográficas como clínicas, para la descripción de estas variables en la muestra. Posteriormente, se ha evaluado la normalidad de las variables cuantitativas con la prueba de Kolmogorov–Smirnov, con el fin de determinar el uso de estadísticos paramétricos o no paramétricos. Una vez categorizadas las variables necesarias, se ha recurrido a un análisis multivariado para establecer las posibles diferencias entre los grupos de análisis de «tratamiento RT». La diferencia de seguimiento en días en los 2 grupos de «tratamiento RT» se ha evaluado a través de la prueba U de Mann–Whitney. Además, se ha recurrido a una prueba de contraste de proporciones basada en el test chi-cuadrado (χ2) para comparar las variables cualitativas. En todos los casos, se ha exigido una significación estadística del 5% (p < 0,05). Los análisis estadísticos se han realizado mediante el programa estadístico SPSS, versión 24.0.
La toxicidad ha sido evaluada por médicos y enfermeras, utilizando la escala RTOG/EORTC8 y CTCAE versión 59 al final del tratamiento, al mes y a los 6 meses.
ResultadosEntre febrero de 2019 y junio de 2020, se han recogido los datos de un total de 100 pacientes, con una media de edad de 59 años (para el grupo de 15 s la media ha sido de 54 años, y para el de 5 s, 64 años). La mediana de seguimiento ha sido de 16,6 meses (6,5–27 meses). Es importante puntualizar que todas las mujeres finalizaron el tratamiento de manera continua, sin interrupciones.
En lo referente a la cirugía, finalmente todas han tenido márgenes negativos (tanto en el grupo de 15 s como en el de 5 s) aunque en algunos casos se haya precisado una ampliación. Con respecto a la técnica, en el grupo de 15 s se ha realizado tumorectomía en el 62% de los casos (el 38% restante ha precisado mastectomía), mientras que en el grupo de 5 s, el porcentaje de cirugía conservadora ha sido del 92% (8% mastectomía). Por último, si se habla de linfadenectomía, dentro del fraccionamiento de 15 s se ha realizado en el 36% de las pacientes, mientras que en el grupo de 5 s ha sido en un 14% (tablas 1 y 2).
Características de la población a estudio
| Clasificación TNM clínica y patológica | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| cT | pT | cN | pN | ||||||||
| 15 sesionesn (%) | 5 sesionesn (%) | 15 sesionesn (%) | 5 sesionesn (%) | 15 sesionesn (%) | 5 sesionesn (%) | 15 sesionesn (%) | 5 sesionesn (%) | ||||
| cTx | 0 (0) | 3 (6) | pTx | 1 (2) | 0 (0) | cNx | 0 (0) | 2 (4) | pNx | 1 (2) | 1 (2) |
| pT0 | 5 (10) | 0 (0) | cN0 | 35 (70) | 44 (88) | pN0 | 25 (50) | 38 (76) | |||
| pTis | 6 (12) | 2 (4) | |||||||||
| cT1 | 25 (50) | 30 (60) | pT1mi | 3 (6) | 1 (2) | cN1 | 11 (22) | 2 (4) | pN1 | 21 (42) | 11 (22) |
| pT1a | 1 (2) | 1 (2) | |||||||||
| pT1b | 5 (10) | 6 (12) | |||||||||
| pT1c | 16 (32) | 28 (56) | |||||||||
| cT2 | 10 (20) | 15 (30) | pT2 | 10 (20) | 12 (24) | cN2 | 4 (8) | 2 (4) | pN2 | 3 (6) | 0 (0) |
| cT3 | 11 (22) | 1 (2) | pT3 | 1 (2) | 0 (0) | ||||||
| cT4 | 4 (8) | 1 (2) | pT4a | 1 (2) | 0 (0) | ||||||
| pT4b | 1 (2) | 0 (0) | |||||||||
| p | 0,006 | p | 0,104 | p | 0,019 | p | 0,104 | ||||
| Tipo de cirugía | |||||||||||
| 15 sesionesn (%) | 5 sesionesn (%) | ||||||||||
| Tumorectomía | 31 (62) | 46 (92) | |||||||||
| Mastectomía | 19 (38) | 4 (8) | |||||||||
| p | <0,001 | ||||||||||
| Linfadenectomía | |||||||||||
| 15 sesionesn (%) | 5 sesionesn (%) | ||||||||||
| No | 32 (64) | 43 (86) | |||||||||
| Sí | 18 (36) | 7 (14) | |||||||||
| p | 0,011 | ||||||||||
TNM: Tumor, ganglio linfático, metástasis.
En cuanto a la toxicidad, se puede diferenciar entre toxicidad aguda y tardía. Con respecto a la primera, a su vez se divide en toxicidad al fin del tratamiento radioterápico y al mes. Atendiendo a la primera, al final de la RT un 62% de las pacientes del fraccionamiento de 15 s han presentado radiodermitis (correspondiendo el 46% a un grado 1, el 14% a un grado 2 y el 2% a un grado 3) y un 16% odinofagia (leve), mientras que pasado un mes las cifras decayeron al 24% (18% de grado 1 y 6% de grado 2) y 2% (leve), respectivamente. En el grupo de 5 s, un 54% ha presentado radiodermitis (correspondiendo el 38% a un grado 1 y el 16% a un grado 2) y un 2% odinofagia (leve) al fin de la RT, mientras que un mes más tarde la primera se redujo al 26% (22% de grado 1 y 4% de grado 2) y no se han registrado pacientes con odinofagia (tablas 3 y 4).
Clasificación de la toxicidad aguda al finalizar el tratamiento radioterápico
| Toxicidad aguda a la finalización de la RT | |||
|---|---|---|---|
| 15 sesionesn (%) | 5 sesionesn (%) | ||
| Radiodermitis | Ninguna | 19 (38) | 23 (46) |
| Grado 1 | 23 (46) | 19 (38) | |
| Grado 2 | 7 (14) | 8 (16) | |
| Grado 3 | 1 (2) | 0 (0) | |
| Grado 4 | 0 (0) | 0 (0) | |
| p | 0,609 | ||
| Odinofagia | Nada | 42 (84) | 49 (98) |
| Leve | 8 (16) | 1 (2) | |
| Moderada | 0 (0) | 0 (0) | |
| Grave | 0 (0) | 0 (0) | |
| p | 0,014 | ||
RT: radioterapia.
Clasificación de la toxicidad aguda al mes de la finalización del tratamiento radioterápico
| Toxicidad aguda un mes tras finalizar la RT | |||
|---|---|---|---|
| 15 sesionesn (%) | 5 sesionesn (%) | ||
| Radiodermitis | Ninguna | 38 (76) | 37 (74) |
| Grado 1 | 9 (18) | 11 (22) | |
| Grado 2 | 3 (6) | 2 (4) | |
| Grado 3 | 0 (0) | 0 (0) | |
| Grado 4 | 0 (0) | 0 (0) | |
| p | 0,813 | ||
| Odinofagia | Nada | 49 (98) | 50 (100) |
| Leve | 1 (2) | 0 (0) | |
| Moderada | 0 (0) | 0 (0) | |
| Grave | 0 (0) | 0 (0) | |
| p | 0,315 | ||
RT: radioterapia.
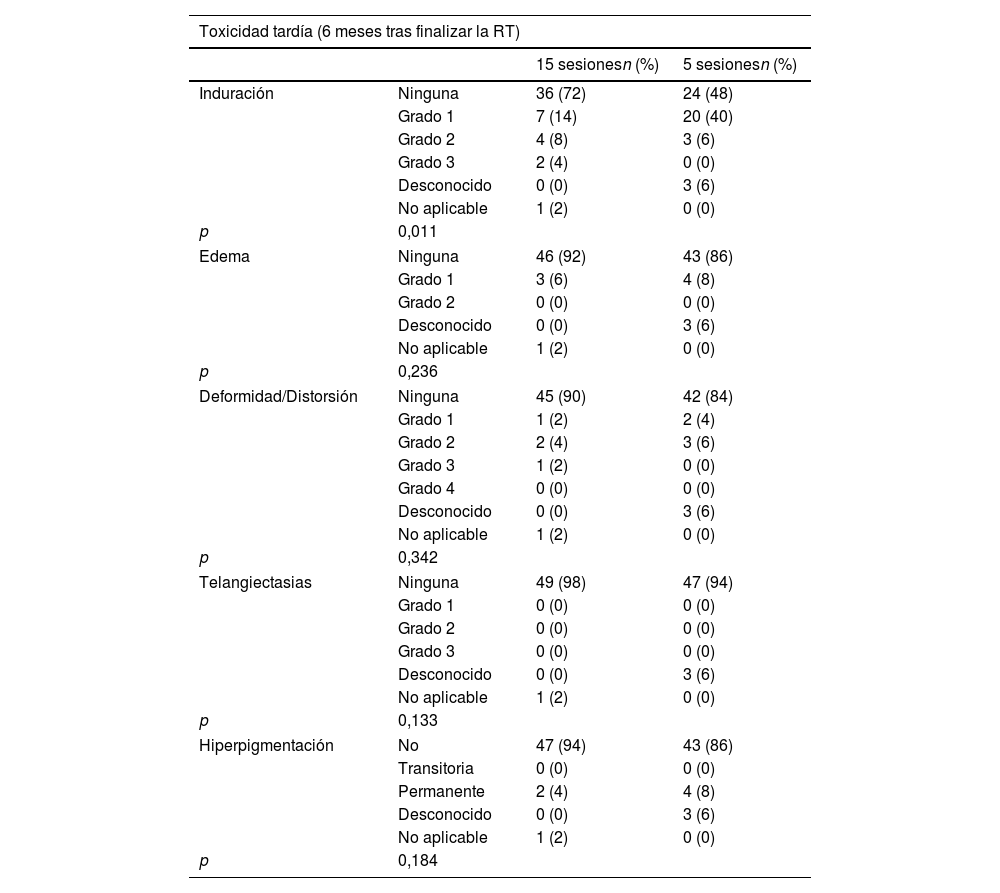
Por último, con respecto a la toxicidad a los 6 meses tras haber finalizado la RT, en el grupo de 15 s se obtuvieron los siguientes resultados: 26% de induración (correspondiendo el 14% a un grado 1, el 8% a un grado 2 y el 4% a un grado 3), 6% de edema (grado 1), 8% de deformidad-distorsión (2% de grado 1, 4% de grado 2 y 2% de grado 3) y 4% de hiperpigmentación (permanente). No se han registrado pacientes que hayan presentado telangiectasias. Cabe mencionar que a un 2% de las pacientes no se pudo valorar la toxicidad a los 6 meses por fallecimiento. En el otro fraccionamiento, un 46% ha presentado induración (correspondiendo el 40% a un grado 1 y el 6% a un grado 2), un 8% edema (grado 1), un 10% deformidad-distorsión (4% de grado 1 y 6% de grado 2) y un 8% hiperpigmentación (permanente). No se han registrado pacientes que hayan presentado telangiectasias. A un 6% de las pacientes no se les ha podido evaluar la toxicidad tardía por falta de exploración (tabla 5).
Clasificación de la toxicidad tardía a los 6 meses del fin del tratamiento radioterápico
| Toxicidad tardía (6 meses tras finalizar la RT) | |||
|---|---|---|---|
| 15 sesionesn (%) | 5 sesionesn (%) | ||
| Induración | Ninguna | 36 (72) | 24 (48) |
| Grado 1 | 7 (14) | 20 (40) | |
| Grado 2 | 4 (8) | 3 (6) | |
| Grado 3 | 2 (4) | 0 (0) | |
| Desconocido | 0 (0) | 3 (6) | |
| No aplicable | 1 (2) | 0 (0) | |
| p | 0,011 | ||
| Edema | Ninguna | 46 (92) | 43 (86) |
| Grado 1 | 3 (6) | 4 (8) | |
| Grado 2 | 0 (0) | 0 (0) | |
| Desconocido | 0 (0) | 3 (6) | |
| No aplicable | 1 (2) | 0 (0) | |
| p | 0,236 | ||
| Deformidad/Distorsión | Ninguna | 45 (90) | 42 (84) |
| Grado 1 | 1 (2) | 2 (4) | |
| Grado 2 | 2 (4) | 3 (6) | |
| Grado 3 | 1 (2) | 0 (0) | |
| Grado 4 | 0 (0) | 0 (0) | |
| Desconocido | 0 (0) | 3 (6) | |
| No aplicable | 1 (2) | 0 (0) | |
| p | 0,342 | ||
| Telangiectasias | Ninguna | 49 (98) | 47 (94) |
| Grado 1 | 0 (0) | 0 (0) | |
| Grado 2 | 0 (0) | 0 (0) | |
| Grado 3 | 0 (0) | 0 (0) | |
| Desconocido | 0 (0) | 3 (6) | |
| No aplicable | 1 (2) | 0 (0) | |
| p | 0,133 | ||
| Hiperpigmentación | No | 47 (94) | 43 (86) |
| Transitoria | 0 (0) | 0 (0) | |
| Permanente | 2 (4) | 4 (8) | |
| Desconocido | 0 (0) | 3 (6) | |
| No aplicable | 1 (2) | 0 (0) | |
| p | 0,184 | ||
RT: radioterapia.
Radioterapia adyuvante en el cáncer de mama: análisis comparativo de la toxicidad de 2 esquemas de hipofraccionamiento.
Para comprobar la hipótesis de nuestro estudio, se han categorizado 16 variables para establecer las posibles diferencias entre los grupos de análisis, en función del fraccionamiento empleado.
Se ha estudiado la diferencia en el perfil tóxico entre 2 esquemas de radioterapia externa para la irradiación adyuvante del cáncer de mama.
Las pacientes tratadas con el esquema START B han presentado tumores más avanzados (cT3–cT4) que las pacientes tratadas con el esquema FAST, tanto en la extensión del tumor primario como del estadio ganglionar tras la estadificación clínica. Esas diferencias se han mantenido tras la estadificación patológica en lo referente a la clasificación ganglionar (pN). Las diferencias se deben a los distintos criterios de selección de las pacientes para cada esquema terapéutico en nuestro departamento. El estudio FAST no incluía pacientes con ganglios positivos; por tanto, inicialmente, las mujeres que presentaban indicación de radioterapia a nivel ganglionar no han sido tratadas con fraccionamiento semanal en nuestro centro. Posteriormente, sí se decidió incluirlas (por ello el menor número de pacientes en este grupo).
El hecho de que las pacientes tratadas con el esquema diario presentasen tumores más avanzados justifica las diferencias en las características del tratamiento quirúrgico. De esta manera, el número de pacientes que recibieron mastectomía y linfadenectomía axilar ha sido mayor en las pacientes que han recibido 40 Gy. Por el mismo motivo, estas pacientes también han presentado mayores volúmenes de irradiación (mayores tasas de irradiación de áreas de drenaje ganglionar). La dosis sobre la mama también ha sido mayor en las pacientes tratadas según el esquema START B ya que casi todas las pacientes han recibido sobreimpresión (boost) sobre el lecho tumoral. Esto se debe a que el boost no se contempló en el ensayo FAST y, por ese motivo, todas las pacientes que han precisado boost se han tratado con el esquema de irradiación diario, lo cual explica que las pacientes tratadas de acuerdo con este esquema sean más jóvenes (la indicación de sobreimpresión del lecho quirúrgico en nuestro centro se restringe a pacientes de 50 años o menos).
Resumiendo, hay una diferencia importante en el estadio y en las modalidades de tratamiento (quirúrgico y radioterápico) entre ambas cohortes, que sesga de manera importante los resultados de forma que no se va a poder atribuir las diferencias observadas en toxicidad al esquema de radioterapia usada.
De acuerdo con todo lo anterior, el exceso de toxicidad esofágica, medida tras la finalización del tratamiento radiante, asociada al tratamiento diario, puede atribuirse a la mayor cantidad de pacientes que recibieron irradiación electiva ganglionar en esta cohorte. La desaparición de ese exceso en momentos posteriores del seguimiento se corresponde con la evolución temporal habitual de la faringitis-esofagitis rádica.
En nuestra serie no se han observado diferencias estadísticamente significativas entre las 2 cohortes, ni en la frecuencia ni en la severidad de radiodermitis, lo cual se correlaciona con los resultados publicados en ambos estudios.
En lo referente a la toxicidad medida a los 6 meses («induración», «edema», «deformidad/distorsión», «telangiectasias» e «hiperpigmentación»), solo se ha demostrado diferencia estadísticamente significativa para la primera, a favor del fraccionamiento de 5 fracciones. No obstante, esta diferencia se restringe a un mayor índice de toxicidad grado 1, a la que no atribuimos significación clínica ni impacto en la calidad de vida. El hallazgo podría explicarse por el mayor número de tumorectomías entre las pacientes tratadas con el esquema de 5 s.
ConclusiónNuestro estudio tiene muchas limitaciones: escaso número de pacientes, naturaleza retrospectiva, ausencia de datos generados por la paciente y de datos referentes a la calidad de vida. La valoración de la toxicidad no ha sido, lógicamente, ni centralizada ni enmascarada. Si a ello se añade el sesgo de selección, que se refleja en el hecho de que se detectan claras diferencias en las variables basales entre ambas cohortes, los resultados pueden verse afectados.
A pesar de ello, y de acuerdo con la literatura disponible, no se ha detectado ninguna desventaja clínicamente significativa entre ambos esquemas en lo referente a tolerancia y toxicidad. Las ventajas para las pacientes y para la organización, derivadas del menor número de asistencias de las mujeres a nuestras instalaciones, han animado a la organización a persistir en la estrategia del hipofraccionamiento, de modo que el tratamiento en 5 días consecutivos ha sido incluido recientemente dentro de nuestra práctica clínica. Por tanto, haría falta continuar con el estudio, ampliando nuestra serie e intentando evitar los sesgos, para observar si existen cambios en la significación estadística de los resultados obtenidos.
Responsabilidades éticasEste estudio se llevó a cabo respetando los principios éticos establecidos en la investigación científica. El comité ético que aprobó la investigación fue CEI Provincial de Huelva. Código de la comunicación/solicitud: SICEIA-2024-001070.
Consentimiento informadoLos autores declaran que cuentan con el consentimiento de los pacientes para su publicación.
FinanciaciónLos autores declaran que la presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Contribuciones de los autoresLaura Vaya González: Desarrollo del manuscrito. Análisis de datos e interpretación de los mismos. Clara Iglesias Melero: Revisión del manuscrito para aprobación definitiva. María Soledad Quesada Muñoz: Recogida de base datos. Análisis estadísticos. María Domínguez Rodríguez: Diseño del estudio. Interpretación resultados. José Manuel Rico Pérez: Diseño del estudio e interpretación de los resultados. Nuria Azahara Linares Mesa: Recogida de base de datos. Interpretación de resultados. Revisión del manuscrito para aprobación definitiva.
Conflicto de interesesTodos los autores declaran que no existen conflictos de intereses en relación con este trabajo.
AgradecimientosDeseo expresar mi más sincero agradecimiento a todos aquellos que han contribuido a la realización de este estudio. En primer lugar, agradecer a las pacientes que participaron en el estudio, cuya colaboración fue fundamental para llevar a cabo esta investigación.
Agradezco también al equipo de radioterapia y al personal médico del Hospital Juan Ramón Jiménez por su inestimable apoyo y dedicación en la atención a las pacientes y en la recopilación de los datos.
Finalmente, extiendo mi agradecimiento a Nuria Azahara Linares Mesa, María Domínguez Rodríguez, José Manuel Rico Pérez, María Soledad Quesada Muñoz y Clara Iglesias Melero, por su implicación, asesoramiento y apoyo técnico a lo largo de todo el proceso.