Evaluar la relación del resultado del test Oncotype DX en tumores luminales con el valor del coeficiente de difusión aparente (CDA) en la secuencia de difusión en resonancia magnética (RM) mamaria y con otros parámetros radiológicos y anatomopatológicos.
Pacientes y métodoSe revisaron retrospectivamente las RM mamarias de estadificación de las pacientes con cáncer de mama (CM) con receptores de estrógenos (RE) positivos y HER2 negativo a las que se les había solicitado el test Oncotype DX en los últimos cuatro años. Se recogieron los antecedentes familiares y personales, el tamaño y tipo de realce de la lesión, el CDA, el porcentaje de restricción a la difusión y la anatomía patológica. Todo ello se relacionó con el riesgo de recidiva (bajo: < 18, intermedio: 18-30 y alto: > 30) estimado en el test Oncotype DX.
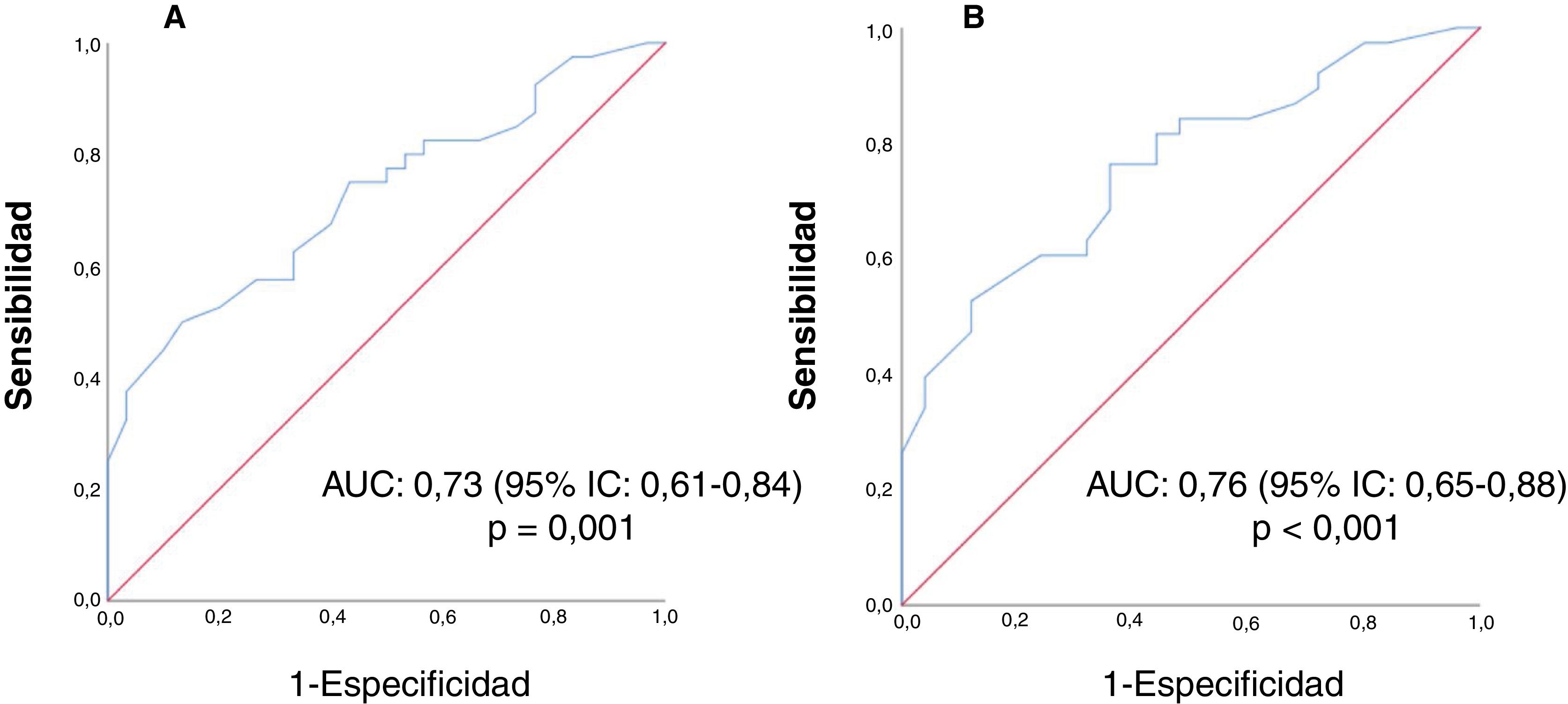
ResultadosSe incluyeron 70 pacientes. Las lesiones categorizadas como bajo riesgo de recidiva asociaron valores de CDA significativamente más altos que el resto de grupos (p = 0,04) y las clasificadas como alto riesgo menor expresión de receptores de progesterona (RP) (p = 0,038). El valor de CDA clasificó como riesgo bajo o intermedio-alto según Oncotype DX con un área bajo la curva (AUC) de 0,73 (p = 0,001) para todos los tumores y de 0,76 (p < 0,001) en lesiones con RP positivos.
ConclusionesSe encontraron valores más altos del CDA en el grupo clasificado como riesgo bajo de recidiva y menor expresión de RP en el grupo de riesgo alto. El CDA podría ser útil en el pronóstico del CM, aunque son necesarios más estudios.
To assess the relationship of the Oncotype DX test result with the apparent diffusion coefficient (ADC) value in the diffusion sequence in breast magnetic resonance imaging (MRI) and with other radiological and anatomical-pathological parameters.
Patients and methodsWe reviewed the pre-surgical staging breast MRIs of breast cancer (BC) patients with positive oestrogen receptors (ER) and negative HER2, for which the Oncotype DX test had been requested over the last four years. The ADC and the diffusion restriction percentage were obtained. Personal and family background were collected, along with pathological anatomy findings. We determined the association between all these factors and the risk of recurrence (low: < 18, intermediate: 18-30 and high: > 30) estimated by the Oncotype DX test.
ResultsA total of 70 patients were included. Lesions categorized as being at low risk of recurrence according to the Oncotype DX test were associated with significantly higher ADC values than the rest of the groups (p = 0.04), and those classified as high risk were associated with lower progesterone receptor (PR) expression (p = 0.038). The ADC value classified the risk as low or intermediate-high according to the Oncotype DX test with an area under the curve (AUC) of 0.73 (p = 0.001) for all tumours and 0.76 (p < 0.001) in lesions with positive PR.
ConclusionsHigher ADC values were found in the group classified as being at low risk of tumour recurrence according to Oncotype DX. Lesions with high risk scores expressed lower PR. The ADC value may be useful in the prognosis of breast cancer, although further studies are required.
El cáncer de mama (CM) es el tumor maligno más frecuente en el sexo femenino, se estima que una de cada ocho mujeres lo presentarán1. Sin embargo, no todos los tumores poseen las mismas características y pronóstico, por lo que en la actualidad se tiende a un abordaje individualizado2.
El uso de quimioterapia adyuvante ha contribuido a la reducción de la mortalidad y del riesgo de recidiva, aunque no todas las pacientes se benefician de igual manera. La última actualización de la guía de la Sociedad Americana de Oncología Clínica (ASCO)3 recomienda la realización del test Oncotype DX (Genomic Health Inc., Redwood City, CA, EE. UU.) en tumores con estadio precoz (T1-T2, N0 y M0) clasificados como luminales sin sobreexpresión de HER2, para determinar los casos que no se beneficiarían de un tratamiento quimioterápico neoadyuvante y así evitar sus efectos adversos y citotoxidad. La Sociedad Europea de Oncología Médica (ESMO)4 publica su guía en la misma línea.
Oncotype DX es un test que permite analizar la expresión de 21 genes pronósticos y predictivos del CM a partir de una muestra de tejido obtenida mediante biopsia del tumor, realizando la técnica de transcripción inversa de la cadena de polimerasa en tiempo real (RT-PCR). Con el resultado, se establece el riesgo asignando una puntuación que va de 0 a 100, donde un valor menor a 18 indica un riesgo bajo de recurrencia, entre 18 y 30 (incluidos) engloba un grupo de riesgo intermedio con incertidumbre acerca de la eficacia de la quimioterapia neoadyuvante, y mayor a 30 incluye un grupo en el cual el riesgo de recidiva a 10 años es alto y los beneficios de la terapia neoadyuvante son claramente mayores al riesgo5.
Dado el alto coste del test Oncotype DX y su invasividad, se buscan nuevas estrategias para predecir el riesgo de recidiva en estos tumores y la necesidad de indicar quimioterapia6. La radiogenómica es un nuevo campo de estudio basado en el análisis cualitativo de las características radiológicas de las lesiones para su comparación génica. La secuencia de difusión (DWI) en resonancia magnética (RM) nos aporta datos cualitativos y cuantitativos, a través del cálculo del coeficiente de difusión aparente (CDA), sobre el movimiento de las partículas de agua y la celularidad de una lesión. La proliferación celular tumoral provoca barreras que restringen la difusión del agua extracelular obteniendo valores de CDA bajos, que se relacionan con la agresividad o la malignidad del tumor7.
Múltiples autores han estudiado la relación del CDA y otras variables radiológicas con el riesgo estimado por el test con resultados discordantes8-20. El objetivo de este estudio es evaluar la relación del CDA y otras características radiológicas y anatomopatológicas de los tumores luminales en RM mamaria de 1.5T con el resultado del test Oncotype DX.
MétodosEl estudio fue aprobado por el Comité de Ética e Investigación Clínica de la Comunidad Autónoma de Aragón (CEICA) y todas las pacientes firmaron el consentimiento informado para la realización de la RM mamaria.
Selección de pacientesEstudio retrospectivo en el que se incluyeron consecutivamente todas las pacientes con CM a las que se les había realizado una RM de estadificación y el panel genético Oncotype DX entre enero de 2015 y diciembre de 2018. Se dividió a las pacientes en tres grupos según el resultado del test: < 18 (riesgo bajo), 18-30 (riesgo intermedio) y > 31 (riesgo alto).
Los criterios de inclusión fueron los siguientes: a) edad mayor de 18 años, b) pacientes con diagnóstico histológico de CM luminal, es decir, con respuesta endocrina y sin sobreexpresión o amplificación de HER2 y c) RM mamaria de estadificación preoperatoria con secuencia DWI y estudio dinámico T1w. Los criterios de exclusión fueron: a) embarazo o puerperio, b) género masculino, c) multifocalidad o multicentricidad, d) afectación ganglionar clínica, radiológica o patológica, c) lesiones a distancia, d) otra neoplasia conocida, e) estudio de RM afectado significativamente por artefactos o baja calidad de la técnica y f) RM realizada en otro centro.
Se revisaron 113 RM mamarias, de las cuales 43 fueron excluidas. Los motivos de exclusión del estudio fueron: baja calidad diagnóstica debido a artefactos por movimiento (1), imposibilidad de valoración del CDA (21) y realización en otro centro o equipo (21).
Adquisión y lectura de RMTodos los estudios de RM fueron realizados en el equipo Signa HD de 1.5T (GE Healthcare, Milwaukee, EE. UU.). El protocolo utilizado incluyó las secuencias: T2 FSE axial (TR: 4,64; TE: 90,9; ET: 13; grosor de corte: 2 mm; FOV: 32 × 32; matriz: 320 × 224), secuencia potenciada en difusión SE-EPI DWI axial (valores de b: 0, 600 mm2/s; TR: 8.000; TE: 61,3; grosor de corte: 5 mm; FOV: 34 × 34; matriz: 64 × 128), y estudio dinámico FSPGR T1 3D (TR: 5; TE: 2,4; grosor de corte: 2 mm; FOV: 34 × 34; matriz: 320 × 224), antes y después de la administración intravenosa de contraste paramagnético, 0,15 mmol/kg de Gd-DTPA a 3 ml/s seguido de un bolo de suero salino de 20 mL.
Dos radiólogos con dedicación exclusiva a la mama y entre 6 y 12 años de experiencia realizaron las lecturas de las RM mamarias. Se recogieron datos del tamaño de la lesión, el tipo de realce en la secuencia dinámica, el valor del CDA medido con un ROI colocado manualmente en el área de máxima intensidad en la secuencia dinámica y copiado al mapa de CDA y el porcentaje de restricción a la difusión en dicha localización.
Evaluación patológicaSe consultó la anatomía patológica de las biopsias diagnósticas previas a la RM, se recogió el tiempo entre biopsia y RM, el tipo de tumor, el grado tumoral según la Clasificación de Nottingham (grado I: 3-5, grado II: 6-7 y grado III: 8-9)21, la expresión de receptores de estrógenos (RE), su intensidad y porcentaje, de receptores de progesterona (RP), el valor de Ki67 estableciendo como 14% el límite entre baja y alta expresión según lo publicado por Cheang et al.22 o la positividad de la proteína p53.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS (versión 22; IBM Corporation, Somers, NY, EE. UU.). Para la descripción de las características de los grupos se utilizaron porcentajes, valor mínimo y máximo, media y desviación estándar (DE). Para el análisis de variables cualitativas se construyeron tablas de contingencia y se usó el estadístico χ2. Para las variables cualitativas y cuantitativas se utilizó la t de Student y ANOVA. Se construyó un modelo predictivo estableciendo dos niveles de riesgo, bajo e intermedio-alto, según el resultado de Oncotype DX y curvas de características operativas del receptor (ROC) con el cálculo de las áreas bajo la curva (AUC). Se consideró estadísticamente significativo un valor de p < 0,05.
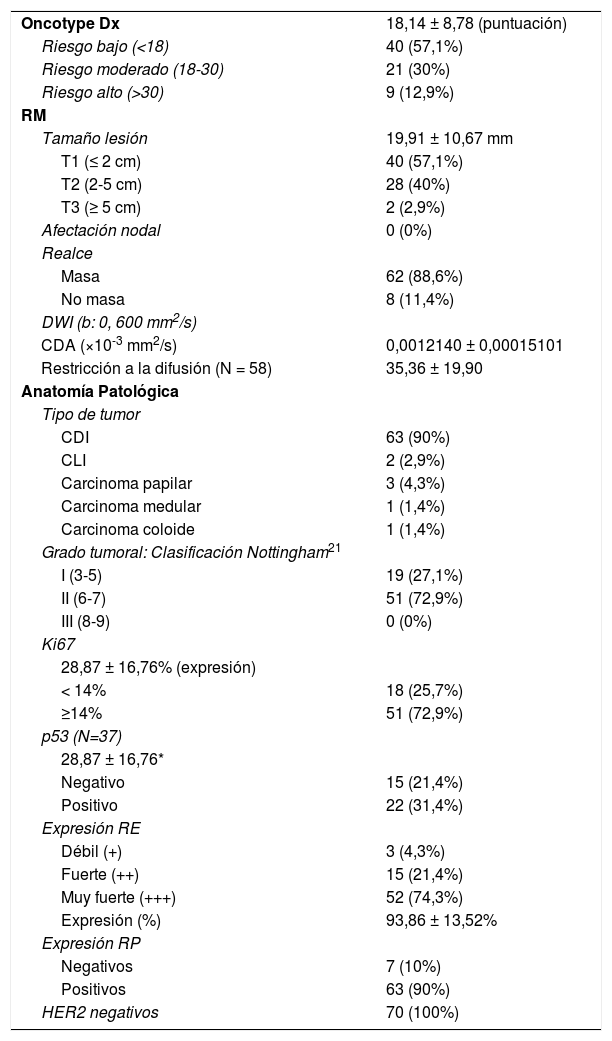
ResultadosPacientesSe incluyeron 70 pacientes con una edad media de 50,78 ± 9,75 años. 17 mujeres (24,3%) tenían antecedentes familiares de CM y 2 (2,9%) antecedentes personales. En 1 caso (1,4%) se hallaron antecedentes familiares de cáncer de ovario. Ninguna de las pacientes cumplía criterios de alto riesgo de CM. Los valores descriptivos pueden consultarse en la tabla 1.
Descripción del resultado: test Oncotype, RM mamaria y biopsia diagnóstica
| Oncotype Dx | 18,14 ± 8,78 (puntuación) |
| Riesgo bajo (<18) | 40 (57,1%) |
| Riesgo moderado (18-30) | 21 (30%) |
| Riesgo alto (>30) | 9 (12,9%) |
| RM | |
| Tamaño lesión | 19,91 ± 10,67 mm |
| T1 (≤ 2 cm) | 40 (57,1%) |
| T2 (2-5 cm) | 28 (40%) |
| T3 (≥ 5 cm) | 2 (2,9%) |
| Afectación nodal | 0 (0%) |
| Realce | |
| Masa | 62 (88,6%) |
| No masa | 8 (11,4%) |
| DWI (b: 0, 600 mm2/s) | |
| CDA (×10-3 mm2/s) | 0,0012140 ± 0,00015101 |
| Restricción a la difusión (N = 58) | 35,36 ± 19,90 |
| Anatomía Patológica | |
| Tipo de tumor | |
| CDI | 63 (90%) |
| CLI | 2 (2,9%) |
| Carcinoma papilar | 3 (4,3%) |
| Carcinoma medular | 1 (1,4%) |
| Carcinoma coloide | 1 (1,4%) |
| Grado tumoral: Clasificación Nottingham21 | |
| I (3-5) | 19 (27,1%) |
| II (6-7) | 51 (72,9%) |
| III (8-9) | 0 (0%) |
| Ki67 | |
| 28,87 ± 16,76% (expresión) | |
| < 14% | 18 (25,7%) |
| ≥14% | 51 (72,9%) |
| p53 (N=37) | |
| 28,87 ± 16,76* | |
| Negativo | 15 (21,4%) |
| Positivo | 22 (31,4%) |
| Expresión RE | |
| Débil (+) | 3 (4,3%) |
| Fuerte (++) | 15 (21,4%) |
| Muy fuerte (+++) | 52 (74,3%) |
| Expresión (%) | 93,86 ± 13,52% |
| Expresión RP | |
| Negativos | 7 (10%) |
| Positivos | 63 (90%) |
| HER2 negativos | 70 (100%) |
CDA, coeficiente de difusión aparente; CDI, carcinoma ductal infiltrante; CLI, carcinoma lobulillar infiltrante; RE, receptores de estrógenos; RP, receptores de progesterona.
Variables radiológicas
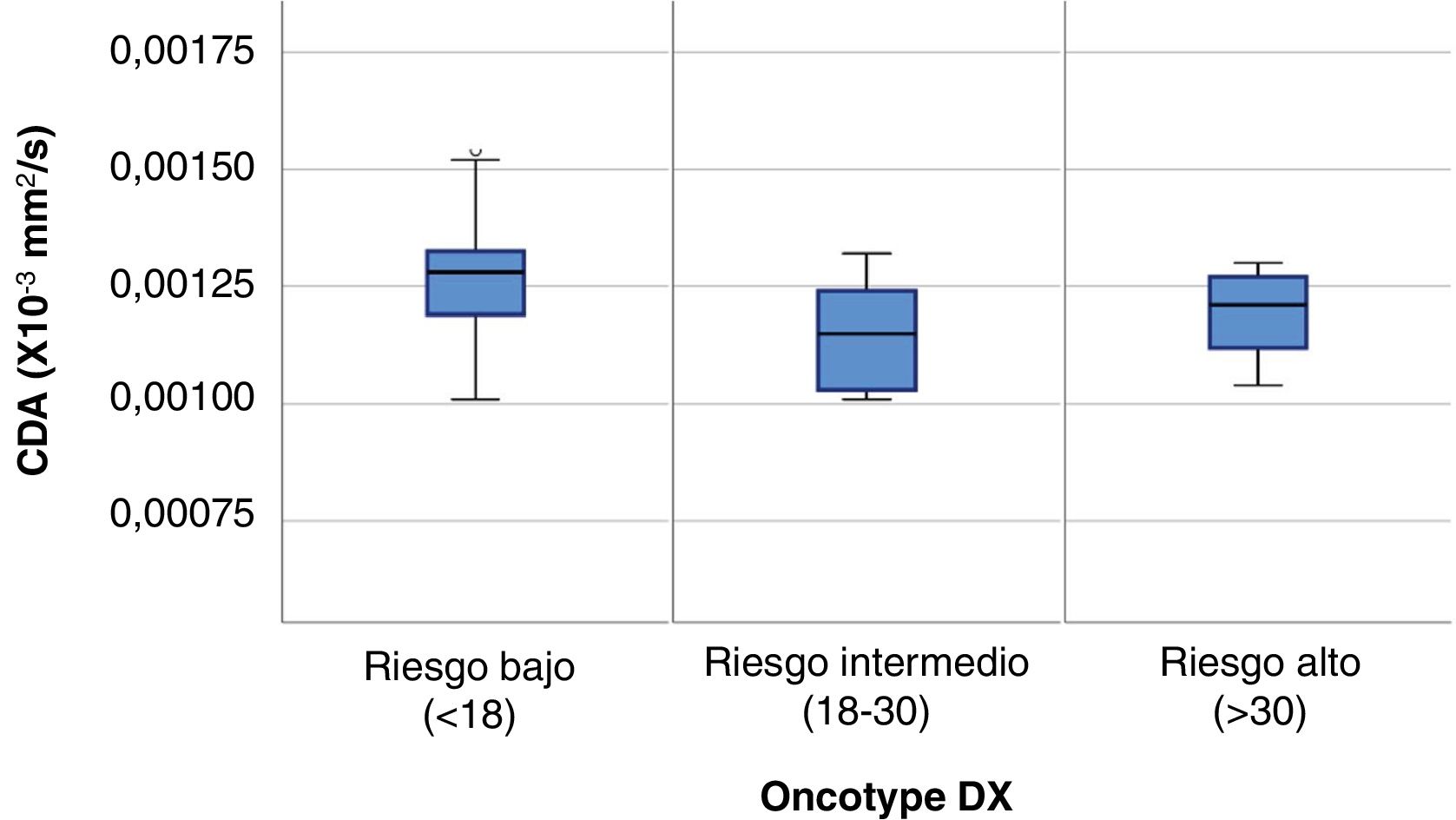
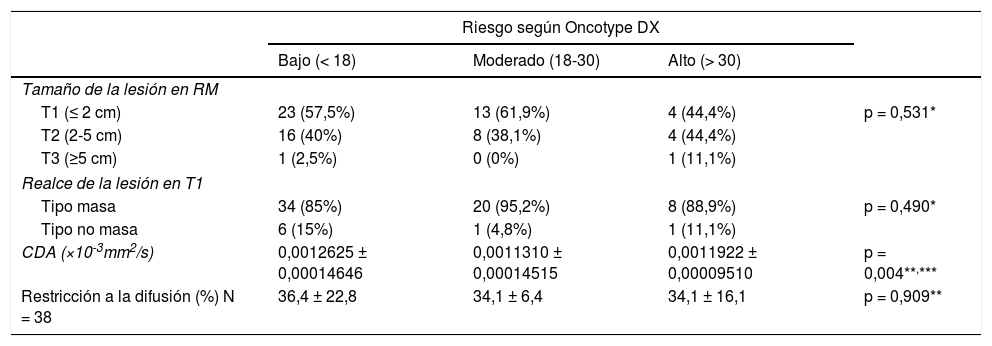
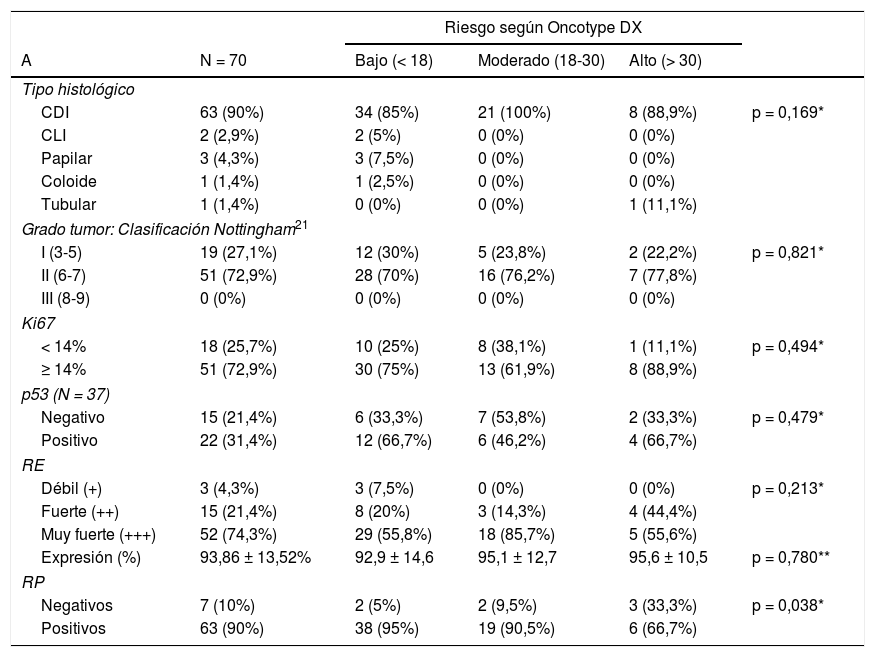
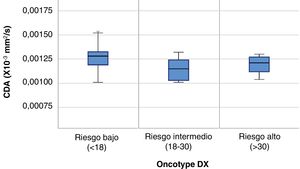
El resultado medio del test genético Oncotype DX fue 18,14 ± 8,78. El porcentaje de pacientes pertenecientes a cada grupo de riesgo según el test y los valores de CDA (×10-3 mm2/s) con sus respectivos intervalos de confianza al 95% (IC 95%) obtenidos en RM puede consultarse en la tabla 2 y figura 1. Se encontraron diferencias significativas en el valor de CDA entre grupos (p = 0,04), especialmente entre las pacientes con bajo y moderado riesgo en el análisis post-hoc (p = 0,01). No se observaron diferencias en el porcentaje de restricción a la difusión, que sólo pudo ser calculado en 38 de los 70 casos, tampoco en el tamaño de las lesiones, cuyo tamaño medio medido en RM fue de 19,91 ± 10,67 mm. El realce de la lesión tras la administración de contraste, que fue mayoritariamente de tipo masa (85% de los casos), tampoco mostró diferencias.
Relación de las características radiológicas de los tumores en RM 1.5T con el resultado del test Oncotype
| Riesgo según Oncotype DX | ||||
|---|---|---|---|---|
| Bajo (< 18) | Moderado (18-30) | Alto (> 30) | ||
| Tamaño de la lesión en RM | ||||
| T1 (≤ 2 cm) | 23 (57,5%) | 13 (61,9%) | 4 (44,4%) | p = 0,531* |
| T2 (2-5 cm) | 16 (40%) | 8 (38,1%) | 4 (44,4%) | |
| T3 (≥5 cm) | 1 (2,5%) | 0 (0%) | 1 (11,1%) | |
| Realce de la lesión en T1 | ||||
| Tipo masa | 34 (85%) | 20 (95,2%) | 8 (88,9%) | p = 0,490* |
| Tipo no masa | 6 (15%) | 1 (4,8%) | 1 (11,1%) | |
| CDA (×10-3mm2/s) | 0,0012625 ± 0,00014646 | 0,0011310 ± 0,00014515 | 0,0011922 ± 0,00009510 | p = 0,004**,*** |
| Restricción a la difusión (%) N = 38 | 36,4 ± 22,8 | 34,1 ± 6,4 | 34,1 ± 16,1 | p = 0,909** |
CDA, coeficiente de difusión aparente.
El tiempo medio transcurrido entre la biopsia diagnóstica y la RM fue de 19 ± 15 días. Los datos correspondientes a la anatomía patológica de los tumores se reflejan en la tabla 3. No se encontraron diferencias en el tipo de tumor, grado histológico ni en la expresión de Ki67, p53 o RE. Un 90% de los tumores expresaron RP, siendo el porcentaje de expresión inferior en el grupo clasificado como riesgo alto (66,7%) que en los grupos con riesgo moderado (90,5%) o bajo (95%), observando diferencias (p = 0,038).
Relación de las características patológicas de los tumores con el resultado del test Oncotype
| Riesgo según Oncotype DX | |||||
|---|---|---|---|---|---|
| A | N = 70 | Bajo (< 18) | Moderado (18-30) | Alto (> 30) | |
| Tipo histológico | |||||
| CDI | 63 (90%) | 34 (85%) | 21 (100%) | 8 (88,9%) | p = 0,169* |
| CLI | 2 (2,9%) | 2 (5%) | 0 (0%) | 0 (0%) | |
| Papilar | 3 (4,3%) | 3 (7,5%) | 0 (0%) | 0 (0%) | |
| Coloide | 1 (1,4%) | 1 (2,5%) | 0 (0%) | 0 (0%) | |
| Tubular | 1 (1,4%) | 0 (0%) | 0 (0%) | 1 (11,1%) | |
| Grado tumor: Clasificación Nottingham21 | |||||
| I (3-5) | 19 (27,1%) | 12 (30%) | 5 (23,8%) | 2 (22,2%) | p = 0,821* |
| II (6-7) | 51 (72,9%) | 28 (70%) | 16 (76,2%) | 7 (77,8%) | |
| III (8-9) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | |
| Ki67 | |||||
| < 14% | 18 (25,7%) | 10 (25%) | 8 (38,1%) | 1 (11,1%) | p = 0,494* |
| ≥ 14% | 51 (72,9%) | 30 (75%) | 13 (61,9%) | 8 (88,9%) | |
| p53 (N = 37) | |||||
| Negativo | 15 (21,4%) | 6 (33,3%) | 7 (53,8%) | 2 (33,3%) | p = 0,479* |
| Positivo | 22 (31,4%) | 12 (66,7%) | 6 (46,2%) | 4 (66,7%) | |
| RE | |||||
| Débil (+) | 3 (4,3%) | 3 (7,5%) | 0 (0%) | 0 (0%) | p = 0,213* |
| Fuerte (++) | 15 (21,4%) | 8 (20%) | 3 (14,3%) | 4 (44,4%) | |
| Muy fuerte (+++) | 52 (74,3%) | 29 (55,8%) | 18 (85,7%) | 5 (55,6%) | |
| Expresión (%) | 93,86 ± 13,52% | 92,9 ± 14,6 | 95,1 ± 12,7 | 95,6 ± 10,5 | p = 0,780** |
| RP | |||||
| Negativos | 7 (10%) | 2 (5%) | 2 (9,5%) | 3 (33,3%) | p = 0,038* |
| Positivos | 63 (90%) | 38 (95%) | 19 (90,5%) | 6 (66,7%) | |
RE, receptores de estrógenos; RP, receptores de progesterona.
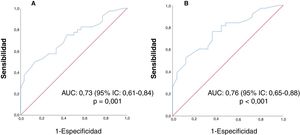
El valor de CDA clasificó como riesgo bajo o intermedio-alto según Oncotype DX con un AUC de 0,73 (IC 95% 0,61-0,84) (p = 0,001) para cualquier expresión de los RP y de 0,76 (IC 95% 0,65-0,88) (p < 0,001) en lesiones con RP positivos. Las curvas ROC se muestran en la figura 2. Estableciendo el punto de corte del valor del CDA en 0,0013°×10-3 mm2/s, las lesiones con valores superiores obtendrían un resultado de bajo riesgo de recidiva del test Oncotype DX en el 86% de los casos (sensibilidad (S): 34%, especificidad (E) 96%, valor predictivo positivo (VPP): 86% y valor predictivo negativo (VPN): 55%).
DiscusiónEn el presente estudio, se encontraron diferencias en los valores del CDA en RM mamaria entre los diferentes grupos de riesgo de recidiva estimados por el test génico Oncotype DX. Los tumores clasificados como bajo riesgo, es decir, que no se beneficiarían de quimioterapia, mostraron un CDA medio más alto que los de riesgo intermedio. Las lesiones clasificadas como alto riesgo registraron una menor expresión de RP.
La 8a edición del sistema de clasificación TNM de la Comisión Conjunta Americana de Cáncer (AJCC)23 incluye la clásica estadificación anatómica y nuevos biomarcadores pronósticos como los RE, RP, HER2 o el grado histológico del tumor. En la actualidad, se están estudiando fenotipos radiológicos que puedan complementar la información pronóstica.
Existen estudios que analizan las características radiológicas de los tumores luminales en pruebas convencionales14,19 y en RM según el resultado de Oncotype DX. Roknsharifi et al.8 clasificaron las lesiones en dos grupos según riesgo de recidiva, bajo e intermedio-alto, y encontraron valores inferiores del CDA en el grupo de riesgo intermedio-alto. Amornsiripanitch et al.11 también obtuvieron resultados en la misma línea, así como valores de CDA más bajos en lesiones con mayor grado tumoral. Thakur et al.10 no sólo hallaron esta relación entre el CDA y el riesgo estimado por Oncotype DX, sino que comprobaron que el resultado era independiente del valor de b utilizado en la secuencia DWI, con un coeficiente de correlación de R2 = 0,8171. Esto ya había sido demostrado por Pereira et al.24 y Chen et al.25.
Kim et al.12 fueron los primeros en manejar histogramas en la valoración del CDA y encontraron diferencias en el valor diferencial del CDA, para cuyo cálculo utilizaron los percentiles 5 y 95 del histograma, siendo al contrario que en los autores antes citados, bajo en el grupo de bajo riesgo de recidiva. También se ha recomendado la realización de una RM previa al test Oncotype DX, debido al alto porcentaje de pacientes con lesiones multifocales, multicéntricas o en la mama contralateral (13,5% de las pacientes).15
En la actualidad, la inteligencia artificial y la radiómica están tomando más importancia en la valoración de las lesiones. En 2014, Ashraf et al.20 crearon un modelo predictivo basado en características morfológicas, cinéticas y en la heterogeneidad de las lesiones en RM para estimar el resultado de Oncotype DX. En 2015, Sutton et al.9 también construyeron otro modelo ateniéndose a la morfología, el histograma y la textura antes y después de la administración de contraste. En 2016, Li et al.13 trabajaron con fenotipos extraídos por ordenador y ampliaron el estudio a diversas plataformas multigénicas (Oncoype DX, MammaPrint y Pam50), con las que encontraron diferencias entre grupos de riesgo con el máximo realce de la lesión, la textura del realce y el diámetro de las lesiones. En 2018, Saha et al.18 utilizaron el «machine-learning» para desarrollar dos modelos predictivos con 539 características radiológicas. Por último, en 2019, Nam et al.16 basándose en la radiómica y en modelos clínico-patológicos, crearon un score predictivo con un AUC = 0,759. Ha et al.17 también desarrollaron una red neuronal segmentando las lesiones y aplicando fenotipos multiparamétricos con una AUC = 0,92.
Este estudio se ha centrado en el panel Oncotype DX, sin embargo, existen otros test genéticos como MammaPrint (Agendia, Amsterdam, the Netherlands), EndoPredict (EP; Myriad Genetics, Salt Late City, UT, EE. UU.), Breast Cancer Index (BCI; Biotheranos tics, San Diego, CA, EE. UU.) o Predictor Analysis of Microarray 50 (PAM50; NanoString Technologies, Seattle, WA, EE. UU.); así como calculadoras del riesgo (Adjuvant! Online and PREDICT) que se utilizan para estimar el beneficio potencial de la quimioterapia26.
Este estudio presenta diversas limitaciones. En primer lugar, se trata de un diseño retrospectivo, unicéntrico, en el que se analizan las imágenes de un sólo equipo de RM. Por otro lado, se comparan valores de CDA según el riesgo de recidiva estimado por la plataforma génica Oncotype DX. Lo más adecuado sería realizar un seguimiento de las pacientes para valorar la recidiva real. La valoración de la expresión de la proteína p53 sólo estuvo disponible en 37 casos debido a que fue excluida del protocolo diagnóstico durante el tiempo establecido para la selección de pacientes. En 12 casos no se pudo calcular el porcentaje de restricción a la difusión por dificultades en el postprocesado y 21 casos fueron excluidos por no poder valorar correctamente el CDA. Una posible causa es el menor tamaño de estas lesiones (13,22 ± 6,02 mm), que dificultaría la valoración del mapa de CDA. Ninguno de los tumores incluidos en la muestra era grado III. Por último, el intervalo de tiempo entre la realización de la biopsia y el estudio de RM preoperatorio fue amplio (19 ± 15 días), aunque este hecho podría haber minimizado los cambios que el procedimiento invasivo causara en la secuencia DWI.
La última actualización de la guía de la ASCO en 2019 establece diferentes scores de recurrencia según la edad de la paciente27. Un resultado del test Oncotype DX menor de 26 en pacientes mayores de 50 años o menor de 16 en mujeres de 50 o más años, establece que la quimioterapia adyuvante es innecesaria, pudiendo administrar hormonoterapia. En este estudio no se ha realizado esta diferenciación, ya que se incluyeron pacientes de 2015 a 2018.
En la muestra de pacientes estudiada, un valor de CDA > 0,0013 ×10-3 mm2/s clasificaría correctamente a las pacientes como bajo riesgo de recidiva según el test Oncotype DX en el 86% de los casos. Sin embargo, solo uno de cada cuatro pacientes del grupo de bajo riesgo presentó estos valores del CDA, por lo que no se puede evitar la realización del test.
Múltiples estudios han evaluado el valor de CDA como posible factor pronóstico, aunque todavía necesita ser validado. Son necesarios estudios prospectivos, con amplias muestras de pacientes y sistemas de inteligencia artificial para evaluar si los diferentes fenotipos radiológicos de los tumores luminales pueden predecir el riesgo de recurrencia tumoral o la necesidad de utilizar quimioterapia neoadyuvante, para que, de este modo, sea posible crear modelos predictivos de riesgo fiables que permitan un tratamiento personalizado del CM.
En conclusión, los tumores clasificados como bajo riesgo según Oncotype DX mostraron en este estudio un CDA medio más alto que los agrupados como riesgo intermedio. El análisis de la secuencia DWI dentro de la radiogenómica es un campo prometedor que necesita más estudio.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Consideraciones éticasEl estudio fue aprobado por el Comité de Ética e Investigación Clínica de Aragón, con número PI20/028 (acta N° 05/2020).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.