el cáncer de mama es la neoplasia más frecuente en mujeres españolas. Los continuos avances en su tratamiento han contribuido a mejorar de forma progresiva la supervivencia en estadios precoces. Entre los avances durante los últimos años, hay que destacar el tratamiento neoadyuvante.
Material y métodoshemos valorado la evolución temporal de las indicaciones y los resultados del tratamiento neoadyuvante del cáncer de mama durante un periodo de 10 años. Para ello, se han analizado las características clínicas, la respuesta completa patológica (RCp), la supervivencia global (SG) y libre de progresión (SLP) de todos los pacientes con cáncer de mama tratados con neoadyuvancia entre el 1 de enero de 2007 y el 31 de diciembre de 2016.
Resultadosse han tratado 212 pacientes con cáncer de mama. A lo largo de los 10 años hemos observado un progresivo aumento en el número de pacientes tratadas con neoadyuvancia, en la edad de los pacientes incluidos (p < 0,001), en los casos de menopausia (p = 0,029), de casos triple negativo y HER2 positivo. También, hemos observado un aumento en el número de casos en los que se ha realizado cirugía conservadora y biopsia selectiva del ganglio centinela.
Conclusionesel tratamiento neoadyuvante se utiliza cada vez más en las pacientes con cáncer de mama, sobre todo en los subtipos de mal pronóstico (triple negativo y HER2). La incorporación de nuevos fármacos y el tratamiento de estadios más precoces está contribuyendo a la mejora de las tasas de RCp y las cirugías conservadoras.
Breast cancer is the most frequent tumor in Spanish women. Continuous advances in the treatment of this neoplasm, have contributed to progressively improve survival in early stages. In the last years, neoadjuvant treatment has evolved and changes have occurred in the treatment indication and in the results.
Material and methodsWe have assessed the temporal evolution of indications and results of neoadjuvant therapy in breast cancer over a 10-year period. We have analyzed the clinical characteristics, the complete pathological response (CRp), overall survival (OS) and progression-free survival (PFS) of all patients with breast cancer treated with neoadjuvant therapy between January 1st 2007 and December 31st 2016.
ResultsDuring the study period, 212 patients were treated. Throughout the 10-year period, we observed that increasingly older patients had been treated (p < 0.001), a greater number of menopausal patients (p = 0.029), a greater number of triple negative and HER2 positive cases. In addition, a larger number of conservative surgeries and sentinel lymph node biopsies had been performed.
ConclusionsNeoadjuvant therapy is increasing in patients with breast cancer, especially in subtypes with poor prognosis (triple negative and HER2). The emerging new drugs and treatment in earlier stages has increased the rate of pCR and breast conserving surgery.
El cáncer de mama es el tumor más frecuente en las mujeres en España y constituye la primera causa de muerte por cáncer entre las mujeres en nuestro país con 6.606 fallecimientos cada año, el 5,8% de todas las muertes por cáncer1.
El tratamiento quimioterápico ha demostrado en el cáncer de mama precoz un claro beneficio en términos de supervivencia global (SG), tanto si es administrado antes como después de la cirugía del tumor primario2. Las guías más relevantes para el tratamiento del carcinoma de mama localizado, NCCN (National Comprehensive Cancer Network)3, ESMO (European Society for Medical Oncology)4 y SEOM (Sociedad Española de Oncología Médica)5, recomiendan el uso del tratamiento neoadyuvante teniendo en cuenta aspectos como el tamaño tumoral, el subtipo histológico, la afectación ganglionar, el estado general (Performance Status, [PS]) y las comorbilidades de las pacientes.
El tratamiento neoadyuvante presenta algunas particularidades con respecto al tratamiento adyuvante: puede reducir el tamaño tumoral, lo que puede facilitar la resecabilidad, aumentando las tasas de cirugía conservadora6. También puede eliminar las metástasis axilares, pudiéndose realizar la biopsia selectiva del ganglio centinela (BSGC)7. Permite asimismo una evaluación objetiva de la eficacia del tratamiento, siendo útil para testar in vivo la sensibilidad de las células tumorales. Proporciona información sobre la biología tumoral y la obtención de muestras de sangre y tumor antes, durante y después del tratamiento; además, puede revelar biomarcadores cruciales para la investigación.
El tratamiento neoadyuvante ha evolucionado de forma importante en las últimas décadas, convirtiéndose en uno de los pilares en el manejo del cáncer de mama en estadios localizados. Los avances en este contexto se han hecho patentes en las indicaciones (desde tumores inflamatorios o inoperables de inicio a tumores localizados), en los objetivos (desde evitar mastectomías a disminuir la morbilidad de las pacientes y aumentar la tasa de respuestas completas patológicas [RCp]), en los fármacos utilizados (nuevas terapias antiHER2, incorporación de los platinos en triple negativo), implementación de técnicas como la BSGC en el algoritmo terapéutico, etc. Los subtipos de cáncer de mama que más se benefician del tratamiento neoadyuvante son los que muestran mayor tasa de respuestas: los subtipos triples negativos y HER2 positivos8.
El objetivo de este estudio es valorar la evolución temporal del tratamiento neoadyuvante del cáncer de mama durante un periodo de 10 años, en un único hospital terciario y analizar los cambios que se han producido en la práctica clínica.
Material y métodosSe trata de un estudio observacional de cohortes retrospectivo que analiza a todas las pacientes con carcinoma de mama tratadas con neoadyuvancia en el Servicio de Oncología Médica del Hospital Universitario de La Princesa de Madrid, desde el 1 de enero de 2007 hasta el 31 de diciembre de 2016.
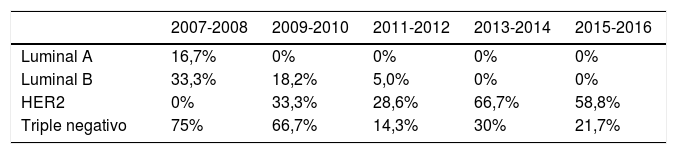
Todas las pacientes con diagnóstico de cáncer de mama tienen una evaluación del tumor primario mediante mamografía, ecografía y/o resonancia magnética, con una clasificación del estadio inicial según la 7ª Edición (Manual de estadificación de la AJCC, 7ª Edición)9, vigente durante el periodo estudiado (la 8ª Edición se publicó en 2017). Previo al tratamiento neoadyuvante, se realiza una valoración histológica en la que se analiza el estatus de los receptores hormonales (receptores de estrógenos [RE], receptores de progesterona [RP]), estatus de HER2 (medido por inmunohistoquímica, por CISH [hibridación cromogénica in situ] o por ambos), el grado de diferenciación y el Ki67 (en %). Se clasifica según el fenotipo en Luminal A, Luminal B, HER2 y triple negativo (Luminal A: RE y/o RP positivo [≥ 1%], HER2 negativo y Ki67 < 14%, Luminal B: HER2 negativo: RE y/o RP positivo y Ki67 ≥ 14%, HER2 positivo: HER2 positivo, RE y RP negativos o positivos y triple negativo: RE, RP y HER2 negativos).
Se recogen los datos del tratamiento neoadyuvante realizado (quimioterapia, hormonoterapia o tratamiento anti-HER2), los fármacos empleados y su duración. Son 2 los centros en los que se intervienen las pacientes dependiendo de dónde se realizó el diagnóstico: en nuestro propio centro (Servicio de Cirugía General) y en el Hospital de Santa Cristina (Servicio de Ginecología): mastectomía vs. cirugía conservadora, linfadenectomía axilar vs biopsia selectiva del ganglio centinela (BSGC). En nuestros centros, se comenzó a realizar la BSGC preneoadyuvancia en 2014, no habiéndose iniciado en el periodo recogido la realización de la BSGC posneoadyuvancia.
Se estudia la respuesta al tratamiento neoadyuvante, definiéndose como respuesta completa patológica (RCp) en los casos en los que se objetiva desaparición completa del carcinoma infiltrante en la mama y en la axila10.
En el análisis estadístico, se han utilizado los programas SPSS 22 y STATA 14.
Para analizar la evolución temporal y debido a la escasa n de algunos años, se dividieron los 10 años estudiados en 5 periodos de 2 años. Se realiza un análisis univariante, comparando las características de las pacientes por periodo. Se calcula el test chi-cuadrado o el test exacto de Fisher para las variables cualitativas y el test F del ANOVA de un factor para las variables cuantitativas. Se estima la SG y la supervivencia libre de progresión (SLP) mediante Kaplan–Meier y se comparan las funciones por grupos con el test log-rank. Las pacientes se siguen desde la fecha del diagnóstico hasta la fecha de la muerte por cualquier causa y son censuradas en la fecha de última consulta o en diciembre de 2020.
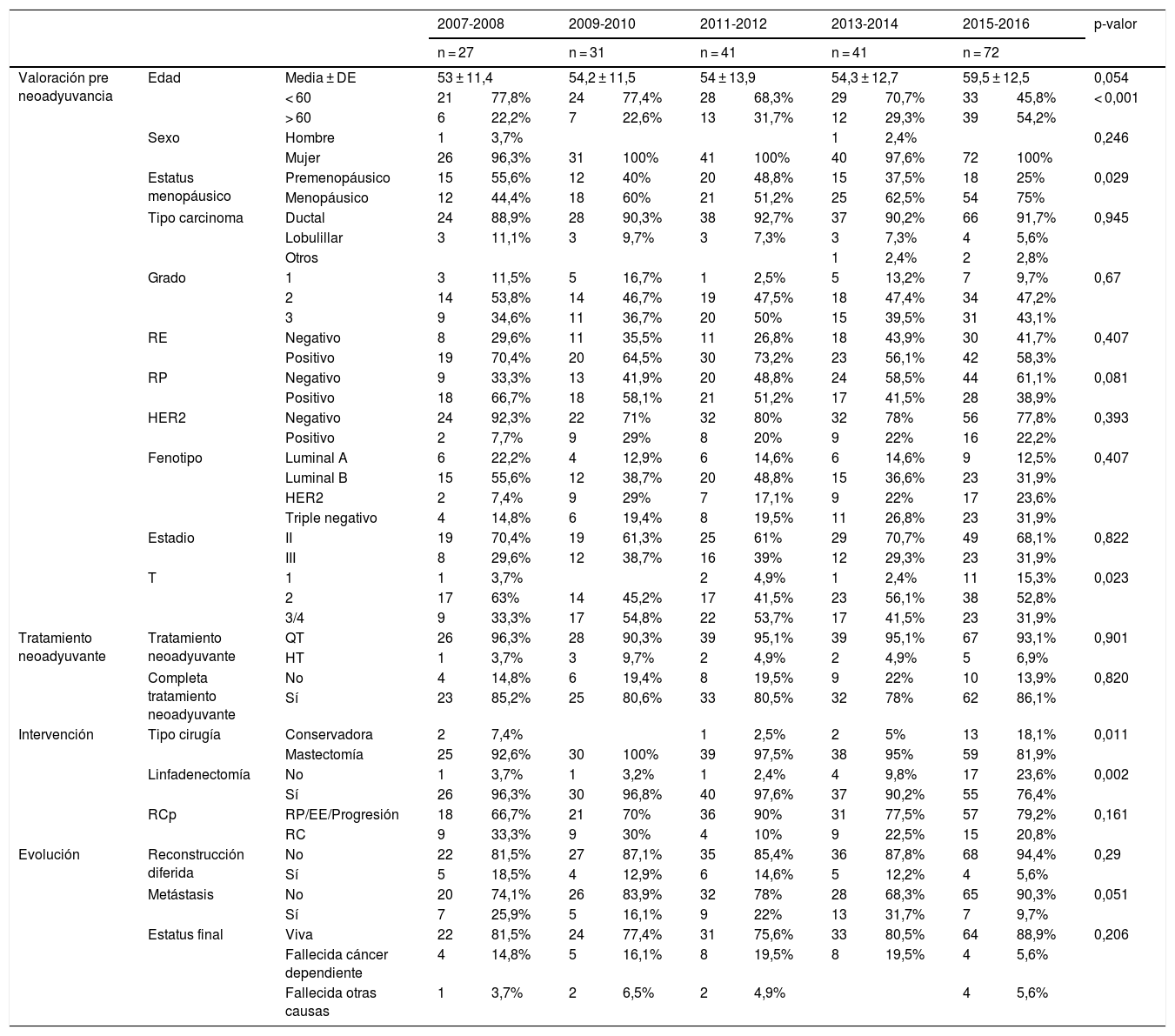
ResultadosEn el periodo de estudio, se han tratado con neoadyuvancia por carcinoma de mama 212 casos (115 casos en el Hospital de Santa Cristina [54,2%] y 97 en el Hospital de La Princesa [45,8%]). La edad media fue de 56 años (DE 13), siendo un 36,3% mayores de 60 años. En 210 casos fueron mujeres y en 2 casos varones. El 38,1% de las mujeres que diagnosticaron con cáncer de mama siendo premenopáusicas.
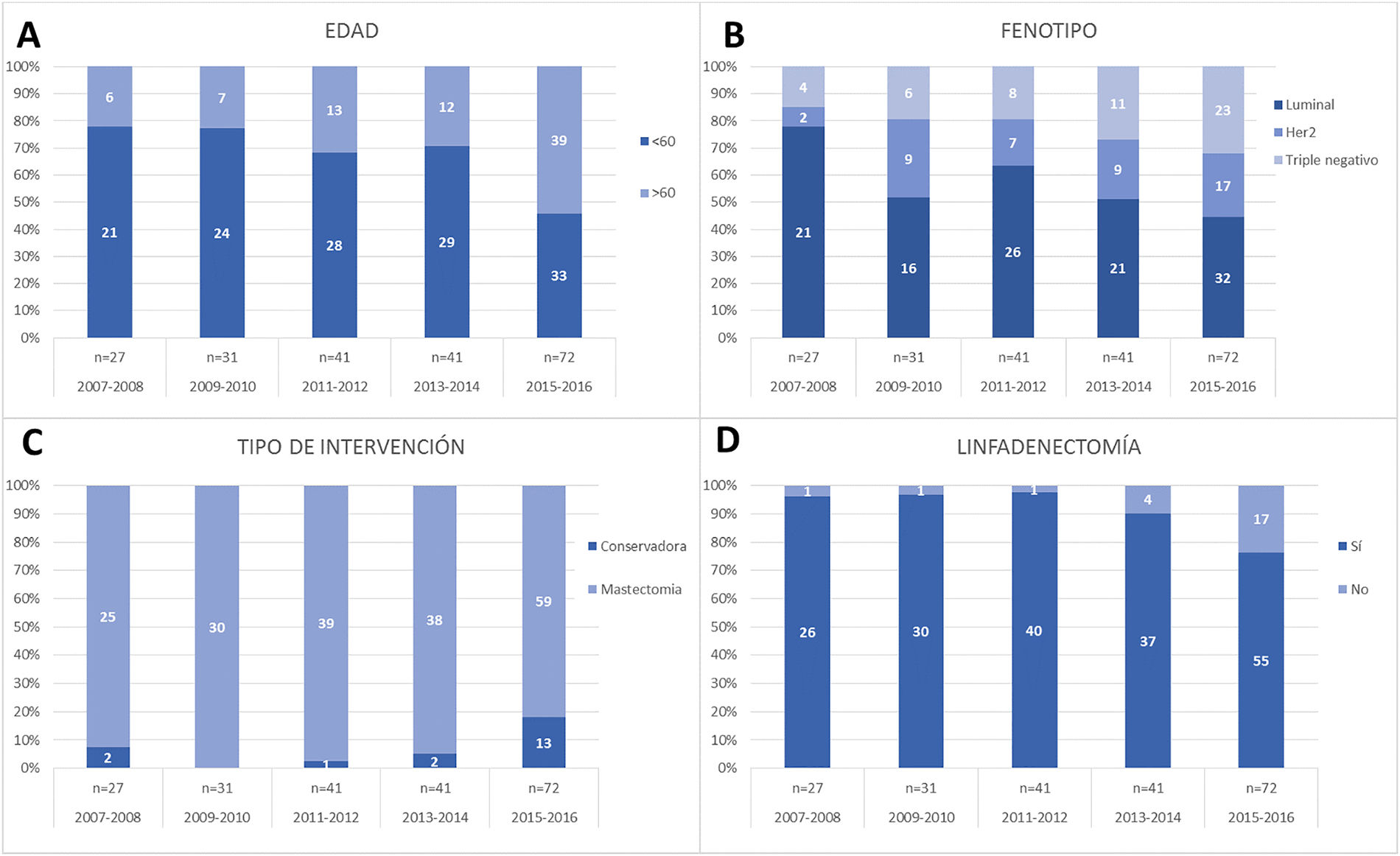
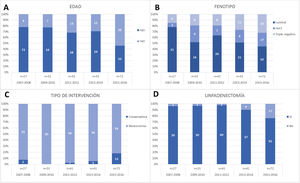
Se observa un aumento de pacientes de mayor edad tratadas en los últimos periodos (> 60 años, pasaron del 6% hasta el 39% en el primer y último periodo respectivamente, p = 0,09), congruente con el aumento progresivo de pacientes menopáusicas en los 2 últimos periodos (fig. 1A).
Respecto al fenotipo, en nuestra serie hemos encontrado 31 pacientes (14,6%) con tumores Luminales A, 85 (40,1%) Luminales B, 44 (20,8%) HER2, y 52 (24,5%) triple negativo. Observamos cómo han aumentado los triples negativos, desde el 14,8% en el primer periodo hasta el 31,9% en el último y los HER2, de 7,4% a 23,6% (fig. 1B). Sin embargo, no se observan diferencias estadísticamente significativas.
El tipo de tratamiento más utilizado es el tratamiento secuencial con antraciclinas y taxanos en 128 casos (64,3%). En un 20% de los casos, en todos aquellos clasificados como subtipo HER-2, se incluyó un anticuerpo monoclonal anti-HER2, en el 95% de los casos trastuzumab y en el 5% pertuzumab. El pertuzumab comenzó a utilizarse en 2015 y es en este el único periodo en el que se trataron 10 pacientes. A partir de 2013, comenzamos a utilizar un esquema con carboplatino para el cáncer de mama triple negativo.
De los 212 pacientes, se intervinieron 209 (191 mastectomías y 18 cirugías conservadoras), las 3 pacientes restantes rechazaron cirugía. En último periodo (2015-2016) se objetivó de forma estadísticamente significativa un aumento en el número de cirugías conservadoras (18,1%) (fig. 1C). Se realizó linfadenectomía en 188 pacientes (88,7%), con una disminución en el último periodo (fig. 1D). En 17 casos se ha realizado la BSCG (2 en el periodo 2013-2014 y 15 en el último periodo) (tabla 1).
Descripción y diferencias por periodos según las características clínicas al diagnóstico, de tratamiento, intervención y evolución
| 2007-2008 | 2009-2010 | 2011-2012 | 2013-2014 | 2015-2016 | p-valor | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n = 27 | n = 31 | n = 41 | n = 41 | n = 72 | |||||||||
| Valoración pre neoadyuvancia | Edad | Media ± DE | 53 ± 11,4 | 54,2 ± 11,5 | 54 ± 13,9 | 54,3 ± 12,7 | 59,5 ± 12,5 | 0,054 | |||||
| < 60 | 21 | 77,8% | 24 | 77,4% | 28 | 68,3% | 29 | 70,7% | 33 | 45,8% | < 0,001 | ||
| > 60 | 6 | 22,2% | 7 | 22,6% | 13 | 31,7% | 12 | 29,3% | 39 | 54,2% | |||
| Sexo | Hombre | 1 | 3,7% | 1 | 2,4% | 0,246 | |||||||
| Mujer | 26 | 96,3% | 31 | 100% | 41 | 100% | 40 | 97,6% | 72 | 100% | |||
| Estatus menopáusico | Premenopáusico | 15 | 55,6% | 12 | 40% | 20 | 48,8% | 15 | 37,5% | 18 | 25% | 0,029 | |
| Menopáusico | 12 | 44,4% | 18 | 60% | 21 | 51,2% | 25 | 62,5% | 54 | 75% | |||
| Tipo carcinoma | Ductal | 24 | 88,9% | 28 | 90,3% | 38 | 92,7% | 37 | 90,2% | 66 | 91,7% | 0,945 | |
| Lobulillar | 3 | 11,1% | 3 | 9,7% | 3 | 7,3% | 3 | 7,3% | 4 | 5,6% | |||
| Otros | 1 | 2,4% | 2 | 2,8% | |||||||||
| Grado | 1 | 3 | 11,5% | 5 | 16,7% | 1 | 2,5% | 5 | 13,2% | 7 | 9,7% | 0,67 | |
| 2 | 14 | 53,8% | 14 | 46,7% | 19 | 47,5% | 18 | 47,4% | 34 | 47,2% | |||
| 3 | 9 | 34,6% | 11 | 36,7% | 20 | 50% | 15 | 39,5% | 31 | 43,1% | |||
| RE | Negativo | 8 | 29,6% | 11 | 35,5% | 11 | 26,8% | 18 | 43,9% | 30 | 41,7% | 0,407 | |
| Positivo | 19 | 70,4% | 20 | 64,5% | 30 | 73,2% | 23 | 56,1% | 42 | 58,3% | |||
| RP | Negativo | 9 | 33,3% | 13 | 41,9% | 20 | 48,8% | 24 | 58,5% | 44 | 61,1% | 0,081 | |
| Positivo | 18 | 66,7% | 18 | 58,1% | 21 | 51,2% | 17 | 41,5% | 28 | 38,9% | |||
| HER2 | Negativo | 24 | 92,3% | 22 | 71% | 32 | 80% | 32 | 78% | 56 | 77,8% | 0,393 | |
| Positivo | 2 | 7,7% | 9 | 29% | 8 | 20% | 9 | 22% | 16 | 22,2% | |||
| Fenotipo | Luminal A | 6 | 22,2% | 4 | 12,9% | 6 | 14,6% | 6 | 14,6% | 9 | 12,5% | 0,407 | |
| Luminal B | 15 | 55,6% | 12 | 38,7% | 20 | 48,8% | 15 | 36,6% | 23 | 31,9% | |||
| HER2 | 2 | 7,4% | 9 | 29% | 7 | 17,1% | 9 | 22% | 17 | 23,6% | |||
| Triple negativo | 4 | 14,8% | 6 | 19,4% | 8 | 19,5% | 11 | 26,8% | 23 | 31,9% | |||
| Estadio | II | 19 | 70,4% | 19 | 61,3% | 25 | 61% | 29 | 70,7% | 49 | 68,1% | 0,822 | |
| III | 8 | 29,6% | 12 | 38,7% | 16 | 39% | 12 | 29,3% | 23 | 31,9% | |||
| T | 1 | 1 | 3,7% | 2 | 4,9% | 1 | 2,4% | 11 | 15,3% | 0,023 | |||
| 2 | 17 | 63% | 14 | 45,2% | 17 | 41,5% | 23 | 56,1% | 38 | 52,8% | |||
| 3/4 | 9 | 33,3% | 17 | 54,8% | 22 | 53,7% | 17 | 41,5% | 23 | 31,9% | |||
| Tratamiento neoadyuvante | Tratamiento neoadyuvante | QT | 26 | 96,3% | 28 | 90,3% | 39 | 95,1% | 39 | 95,1% | 67 | 93,1% | 0,901 |
| HT | 1 | 3,7% | 3 | 9,7% | 2 | 4,9% | 2 | 4,9% | 5 | 6,9% | |||
| Completa tratamiento neoadyuvante | No | 4 | 14,8% | 6 | 19,4% | 8 | 19,5% | 9 | 22% | 10 | 13,9% | 0,820 | |
| Sí | 23 | 85,2% | 25 | 80,6% | 33 | 80,5% | 32 | 78% | 62 | 86,1% | |||
| Intervención | Tipo cirugía | Conservadora | 2 | 7,4% | 1 | 2,5% | 2 | 5% | 13 | 18,1% | 0,011 | ||
| Mastectomía | 25 | 92,6% | 30 | 100% | 39 | 97,5% | 38 | 95% | 59 | 81,9% | |||
| Linfadenectomía | No | 1 | 3,7% | 1 | 3,2% | 1 | 2,4% | 4 | 9,8% | 17 | 23,6% | 0,002 | |
| Sí | 26 | 96,3% | 30 | 96,8% | 40 | 97,6% | 37 | 90,2% | 55 | 76,4% | |||
| RCp | RP/EE/Progresión | 18 | 66,7% | 21 | 70% | 36 | 90% | 31 | 77,5% | 57 | 79,2% | 0,161 | |
| RC | 9 | 33,3% | 9 | 30% | 4 | 10% | 9 | 22,5% | 15 | 20,8% | |||
| Evolución | Reconstrucción diferida | No | 22 | 81,5% | 27 | 87,1% | 35 | 85,4% | 36 | 87,8% | 68 | 94,4% | 0,29 |
| Sí | 5 | 18,5% | 4 | 12,9% | 6 | 14,6% | 5 | 12,2% | 4 | 5,6% | |||
| Metástasis | No | 20 | 74,1% | 26 | 83,9% | 32 | 78% | 28 | 68,3% | 65 | 90,3% | 0,051 | |
| Sí | 7 | 25,9% | 5 | 16,1% | 9 | 22% | 13 | 31,7% | 7 | 9,7% | |||
| Estatus final | Viva | 22 | 81,5% | 24 | 77,4% | 31 | 75,6% | 33 | 80,5% | 64 | 88,9% | 0,206 | |
| Fallecida cáncer dependiente | 4 | 14,8% | 5 | 16,1% | 8 | 19,5% | 8 | 19,5% | 4 | 5,6% | |||
| Fallecida otras causas | 1 | 3,7% | 2 | 6,5% | 2 | 4,9% | 4 | 5,6% | |||||
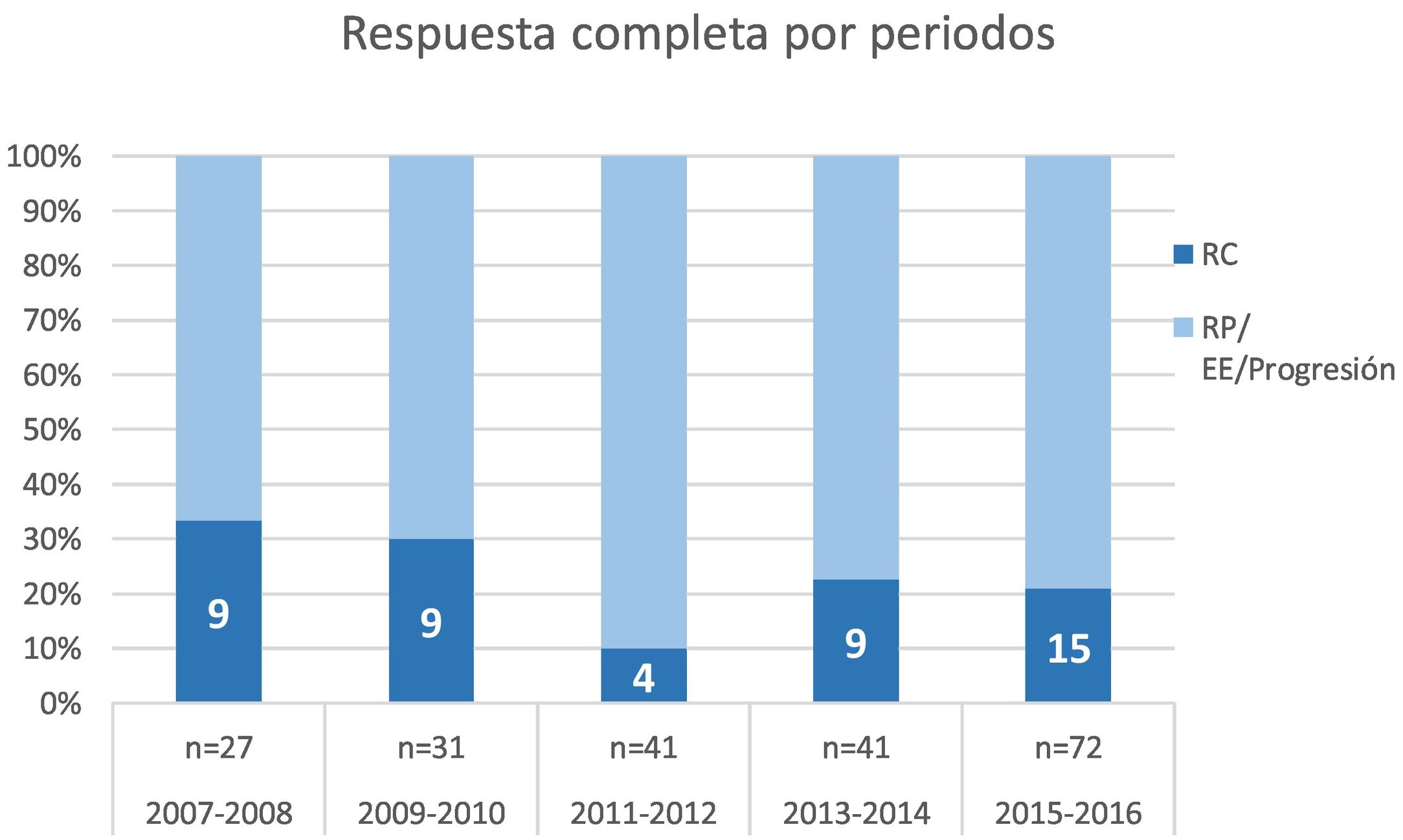
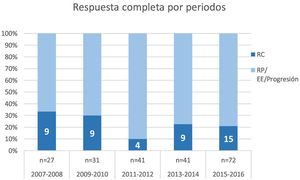
La tasa de RCp en todos los pacientes fue del 22% (IC 95%: 17-28%). Globalmente, no se observó variación a lo largo de los 5 periodos evaluados (p = 0,161) (fig. 2). Al hacer un análisis de los subgrupos moleculares en el análisis univariante, se observan diferencias en la tasa de RC en los subtipos HER2 y triple negativo (p < 0,001). No hallamos diferencias en los 5 periodos estudiados, debido al bajo número de pacientes. Sin embargo, hemos observado un aumento progresivo de las RCp en el subtipo HER2 positivo (sobre todo en los 2 últimos periodos) y triple negativo. Es destacable que la tasa de RCp en los casos luminales en los 2 últimos periodos es de 0 (tabla 2).
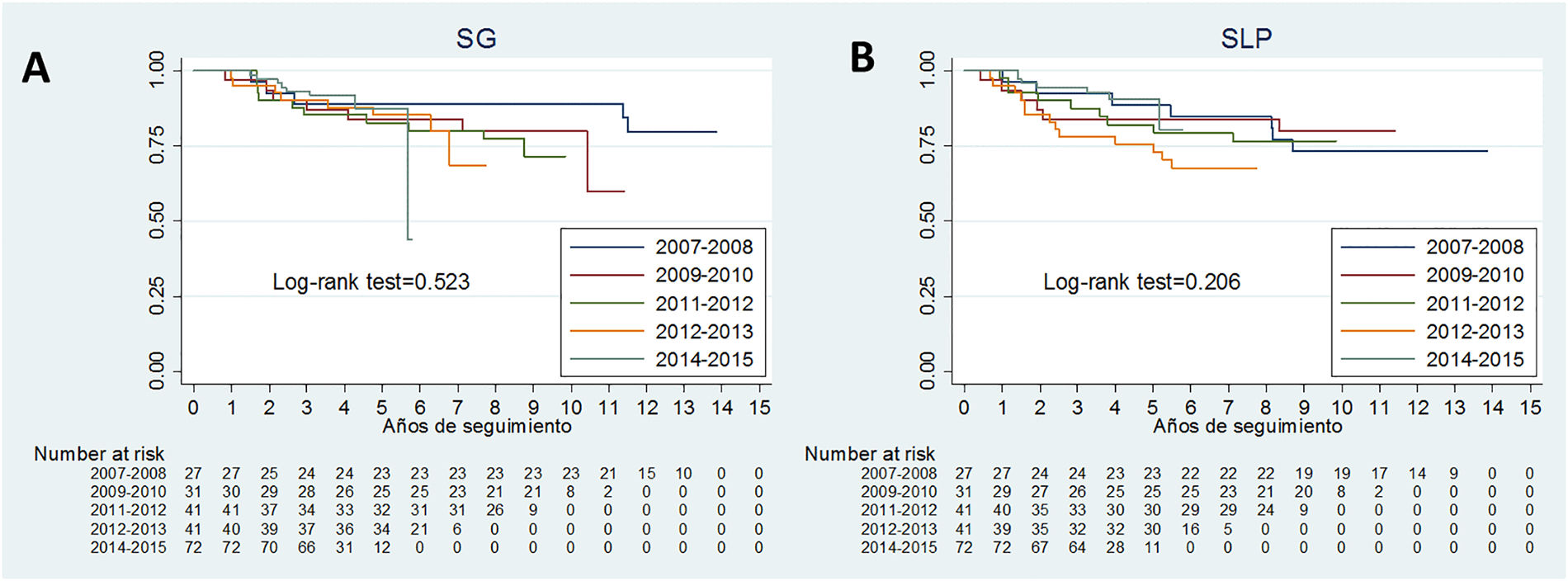
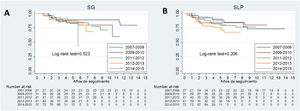
La mediana de seguimiento fue de 5,8 años (RIQ: 3,8-9). De las 212 pacientes, en 2 se diagnosticó una recaída local y en 41 metástasis a distancia. Así en diciembre de 2020, 162 pacientes (76,4%) estaban vivas libres de enfermedad, 12 (5,7%) vivas con enfermedad, 29 (13,7%) habían fallecido por el cáncer de mama y 9 (4,2%) fallecieron por otras causas. En 2 pacientes se diagnosticó un segundo primario de mama. La SG a los 3 y 5 años fue del 90,1% (IC 95%: 85,2 a 93,4%) y del 86,1% (IC 95%: 80,4 a 90,2%) respectivamente (fig. 3A). En cuanto a la SLP, a los 3 años fue del 88,1% (IC 95%: 82,9 a 91,8%) y del 84,7% (78,9 a 89%) a los 5 años. La SG y la SLP se mantuvieron estables en el periodo estudiado, no observándose diferencias por periodos en ningún caso (p = 0,523 y p = 0,206) (fig. 3B).
DiscusiónLos beneficios clínicos del tratamiento neoadyuvante en el cáncer de mama precoz se centran en conseguir la desaparición completa de todo el tejido maligno (respuesta completa patológica, RCp) y en incrementar la conservación de la glándula mamaria, entre otros6.
A lo largo de los 10 años evaluados, hemos observado que el número de pacientes tratadas con neoadyuvancia ha crecido progresivamente, pasando de un 7,45% de las pacientes diagnosticadas en el periodo 2007-2008, hasta un 18% en el último periodo. Ello se ha debido a que han aumentado el número de casos con estadios más precoces y también han crecido los casos HER2 y triple negativo.
Durante el periodo de estudio han variado los esquemas de tratamiento. Esto refleja las incorporaciones de nuevos fármacos en el arsenal terapéutico: incorporación de trastuzumab11–13 y pertuzumab14 en los tumores HER2 y la incorporación de platinos15 en el triple negativo.
En el año 2014, Cortázar et al., publicaron un metaanálisis sobre neoadyuvancia, en el que se incluyeron datos de 12.000 pacientes, que estableció que conseguir una RCp se asocia a un mejor pronóstico en los distintos subtipos de cáncer de mama16,17. Los subtipos de cáncer de mama que más se benefician del tratamiento neoadyuvante son los que muestran mayor tasa de respuestas: los subtipos triple negativo y HER2 positivo7. La tasa de RCp global en nuestro estudio fue del 22% (IC 95%: 17-28%), sin variación a lo largo de los 5 periodos evaluados.
Si comparamos las tasas de RCp de los HER2 en los distintos periodos podemos observar cómo van aumentando desde 0 en el primer periodo hasta el 67 y 59% en los 2 últimos, probablemente debido a la incorporación de pertuzumab en el último periodo, habiéndose tratado exclusivamente 10 pacientes. Unas cifras en línea con el 60% reportado en la mayor parte de ensayos clínicos que han usado trastuzumab, pertuzumab y quimioterapia en neoadyuvancia18–21.
En lo que respecta a los tumores luminales, la quimioterapia neoadyuvante consigue unas tasas de RCp menores en comparación con otros subtipos, entre el 10 y el 24%. En nuestro estudio la tasa de RCp en este subgrupo es globalmente de 7,8%, sin cambios a lo largo de los 5 periodos.
En el caso de los tumores triple negativo más del 45% obtienen una RCp tras la neoadyuvancia. Esto es importante porque las pacientes que no consiguen una RCp tienen una alta probabilidad de recaída22.
Respecto a la cirugía, se realizó mastectomía en el 91% de los pacientes y solamente en el último periodo (2015-2016) se objetivó de forma estadísticamente significativa un aumento en el número de cirugías conservadoras (18,1%). Se realizó linfadenectomía en la mayoría de las pacientes (88,7%), realizándose BSGC preneoadyuvancia exclusivamente 17 casos. Estos porcentajes están lejos de los recomendados en 2006, que consideraba una tasa aceptable de cirugías conservadoras en cáncer de mama precoz entre el 50 y el 80% y de BSGC del 100%23. También, se alejan de un metaanálisis publicado en 2018 de 10 ensayos clínicos con tratamiento antes de 2005, que mostró un aumento en el número de cirugías conservadoras (65% en el grupo de pacientes tratadas con neoadyuvancia frente al 49% de los realizados con adyuvancia)24.
Observamos a lo largo de los 10 años cómo se ha ido incorporando la quimioterapia postoperatoria en el arsenal terapéutico del cáncer de mama. En nuestro estudio, se debe fundamentalmente a la incorporación en el cáncer de mama triple negativo de un esquema sin antraciclinas, de forma que las pacientes que no alcanzaron RCp las recibían de forma adyuvante y a la adición de capecitabina en las pacientes que habían realizado tratamiento con antraciclinas y taxanos19.
En los últimos años son muchos los estudios que se realizan en vida real (RWD: Real Word Data), que resultan muy útiles para conocer la implementación progresiva de los diferentes tratamientos25.
ConclusionesEn nuestra serie hemos tratado cada vez más casos con neoadyuvancia, siendo estos cada vez de mayor edad y hemos obtenido unas tasas de RCp en el subtipo HER2 progresivamente mejores.
Sin embargo, el número de cirugías conservadoras y de BSGC a pesar de ser progresivamente mayor a lo largo de los 10 años estudiados, resulta inferior a lo recomendado por las principales guías clínicas.
FinanciaciónNo ha sido necesaria financiación.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes. Se ha obtenido la aprobación del Comité Ético de Investigación clínica (CEIC) del Hospital Universitario de La Princesa.
Consentimiento del pacienteLos autores declaran que han obtenido el consentimiento del paciente para la publicación de este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.