Establecer el estado actual del empleo de hormonoterapia en neoadyuvancia (HTNA) en las distintas unidades de patología mamaria del territorio nacional.
Material y métodosSe confeccionó una encuesta electrónica de 14 preguntas que se envió a los socios de la Sociedad Española de Senología y Patología Mamaria (SESPM) así como a miembros de otros centros del ámbito público y privado.
ResultadosSe obtuvieron 79 respuestas. El 74,7% correspondían a centros del ámbito público. El 77,2% afirman emplear HTNA, si bien la mayoría (44,3%) solo en caso de mujeres ancianas pluripatológicas. El seguimiento de las pacientes corre a cargo del oncólogo médico en el 62,0% de los casos, siendo la exploración (64,7%), la resonancia (55,9%) y la ecografía los métodos más empleados en el seguimiento. El fármaco más utilizado es el letrozol (45,5%) y la duración habitual del tratamiento es de 3-6meses en casi de la mitad de los casos (43,0%). El 82,2% de los encuestados afirman realizar HTNA en caso de axila positiva, si bien casi la mitad (47,6%) la restringen al caso de mujer anciana con comorbilidad. La alternativa en caso de no respuesta es la cirugía en el 78,5% de los casos. El 72,2% de los encuestados creen que la posibilidad de realizar una plataforma genómica en la biopsia inicial les animaría a emplear más la HTNA.
ConclusionesLa HTNA es un método empleado por las unidades de mama de forma habitual, si bien su uso queda relegado por lo general a mujeres ancianas con comorbilidades.
To establish the current state of the use of neoadjuvant endocrine treatment (NET) for breast cancer in breast cancer units (BCU) in Spain.
Material and methodsA 14-question electronic survey was designed and sent on-line to members of the Spanish Society of Senology and Breast Disease (SESPM) as well as to other breast cancer units in public and private healthcare centres in Spain.
ResultsA total of 79 surveys were completed. Nearly three quarters (74.7%) of respondents worked in public centres, and 77.2% used NET, although most (44.3%) only used it in elderly or frail women. Follow-up was carried out by a medical oncologist in 62.0% of the cases. The preferred follow-up methods were clinical examination (64.7%), MRI (55.9%) and ultrasound (48.5%). Letrozole was the chosen drug in 45.5%, and 43.0% maintained treatment for 3-6months. Most (82.2%) respondents used NET when there were axillary-positive nodes but, of these, 47.6% restricted it to frail elderly women. Surgery was the alternative treatment in 78.5% of non-responders. In all, 72.2% of the respondents believed that the possibility of performing a genomic profile in the core biopsy would increase the chances of NET use.
ConclusionsNET is a frequently employed method in BCUs in Spain, although its use is usually relegated to elderly or frail women.
En los últimos años hemos asistido a un importante incremento del enfoque sistémico primario, o neoadyuvante, como tratamiento del cáncer de mama, pues aporta algunas ventajas adicionales al abordaje tradicional. De este modo, la intensidad de la respuesta in vivo del tumor al tratamiento nos permite conocer mejor el pronóstico de la paciente y, por otro lado, aumentar las posibilidades de reducir la extensión de la cirugía.
Pero mientras la quimioterapia neoadyuvante (QTNA) se ha convertido en una estrategia habitual, la hormonoterapia neoadyuvante (HTNA) permanece como una herramienta infrautilizada y relegada habitualmente a pacientes muy ancianas, frágiles o con importantes comorbilidades que dificultan la cirugía1,2. Y ello a pesar de que la mayoría de los cánceres de mama son estrógeno-dependientes y de que existe evidencia sólida que avala su empleo, pues al menos tres ensayos clínicos aleatorizados han demostrado que constituye una alternativa segura frente a la QTNA3-5, con una toxicidad significativamente menor. Son también numerosos los trabajos que demuestran que la HTNA incrementa de forma notable las posibilidades de cirugía conservadora, permitiendo alcanzar cifras de hasta el 80%6-8.
Existen dos modos fundamentales de reducir la estimulación estrogénica. El primero de ellos es mediante la inhibición de la producción de estrógenos, o de su forma activa, de manera que ningún ligando pueda activar el receptor del mismo. Este es el mecanismo empleado por los fármacos inhibidores de la aromatasa (IA) o los agonistas de LHRH. El segundo consiste en el bloqueo o modulación del propio receptor estrogénico (RE), como ocurre al emplear tamoxifeno o fulvestrant9. En el ámbito de la adyuvancia en la enfermedad localizada disponemos de abundante literatura que demuestra la eficacia de estos tratamientos en la reducción de la recurrencia y en la mejora de la supervivencia10,11.
Las tasas de respuesta patológica completa (RPC) en los tumores luminales son infrecuentes tras el tratamiento sistémico primario, ya sea QTNA u HTNA, y en general se considera que el impacto pronóstico de esta baja tasa de RPC es menor que en el caso de tumores no luminales12. No obstante, sí se ha logrado, a partir de los resultados del estudio P024, elaborar un modelo predictivo y pronóstico en función del grado de respuesta a la HTNA. Este modelo, conocido como Preoperative Endocrine Prognostic Index score, o PEPI score, incorpora variables patológicas comunes (tamaño del tumor, estado ganglionar) y biomarcadores de respuesta al tratamiento (Ki67, RE), y establece tres grupos de riesgo. Así, las pacientes con un PEPI score bajo presentan un bajo riesgo de recaída y no obtienen ningún beneficio con la administración de quimioterapia en adyuvancia13.
Por tanto, uno de los retos principales de la HTNA lo constituye la identificación de los tumores más sensibles a ella, pues la positividad del RE no siempre garantiza buenos resultados tras el tratamiento hormonal. Es bien conocido que neoplasias con una expresión de RE elevada (Allred score 7-8) habitualmente responden mejor al tratamiento endocrino. Pero existen otros parámetros, como el receptor de progesterona o los cambios producidos en el antígeno nuclear Ki67, que también parecen jugar un papel importante en la predicción de respuesta14-17. Así, la realización de biopsias algunas semanas tras la instauración del tratamiento puede aportar información útil sobre posibles resistencias cuando el Ki67 no se reduce16,18-20. La HTNA se presenta entonces como una oportunidad única en la investigación de biomarcadores que permitan predecir la respuesta al tratamiento y la aparición de eventuales resistencias21.
Por último, el desarrollo de nuevos tratamientos en combinación con la terapia endocrina tradicional también amplía las posibilidades de la HTNA. Tratamientos diana, como los inhibidores de CDK4/6, y fármacos que actúan a través de la vía PI3K han demostrado su eficacia en el escenario del cáncer de mama metastásico o localmente avanzado, y más recientemente en el ámbito de la neoadyuvancia22-24. El tiempo y nuevos ensayos arrojarán más pruebas acerca del beneficio de las combinaciones de fármacos en la HTNA.
El objetivo de este estudio es tener un conocimiento real de la situación de la HTNA en España, en lo que se refiere a sus indicaciones y a su manejo en la práctica clínica.
Material y métodosTras una búsqueda bibliográfica y a partir de la experiencia de nuestro grupo en el manejo de la HTNA, se elaboró una encuesta formada por 14 preguntas que se envió, a través de la Sociedad Española de Senología y Patología Mamaria (SESPM), a las unidades españolas de patología mamaria para su cumplimentación de forma electrónica. Se lanzó el 24 de octubre de 2018 y la recogida de resultados se cerró el 13 de enero de 2019.
Los datos solicitados eran las características del centro de trabajo y el empleo de tratamientos neoadyuvantes en general y de la HTNA en particular. Así mismo, quién toma las decisiones en cada caso acerca del tratamiento, el fármaco empleado y cómo se realiza el seguimiento de estas pacientes.
Por considerarse un dato relevante y con posibilidad de impacto en el empleo de la HTNA, también se cuestionó sobre el empleo de plataformas genómicas y la posibilidad de que su utilización pueda influir en la decisión sobre el tratamiento neoadyuvante.
El estudio que se ha realizado es de tipo descriptivo observacional a partir de los datos recogidos. Los resultados se han expresado en número de respuestas y en porcentaje respecto al total.
ResultadosSe recibieron 79 encuestas completadas. Las preguntas no respondidas se incluyeron bajo el formato No sabe/No contesta (NS/NC). Las 14 preguntas formuladas y sus respuestas se resumen en la tabla 1.
Respuestas a la encuesta de HTNA
| Número de respuestas/total | % | |
|---|---|---|
| Su centro está en el ámbito | ||
| Público | 59/79 | 74,7 |
| Privado | 20/79 | 25,3 |
| Aproximadamente, ¿qué número de casos nuevos de cáncer se atienden en su centro? | ||
| < 100 | 17/79 | 21,5 |
| 101-150 | 14/79 | 17,7 |
| 151-200 | 14/79 | 17,7 |
| 201-250 | 8/79 | 10,1 |
| 251-300 | 15/79 | 19 |
| > 300 | 11/79 | 13,9 |
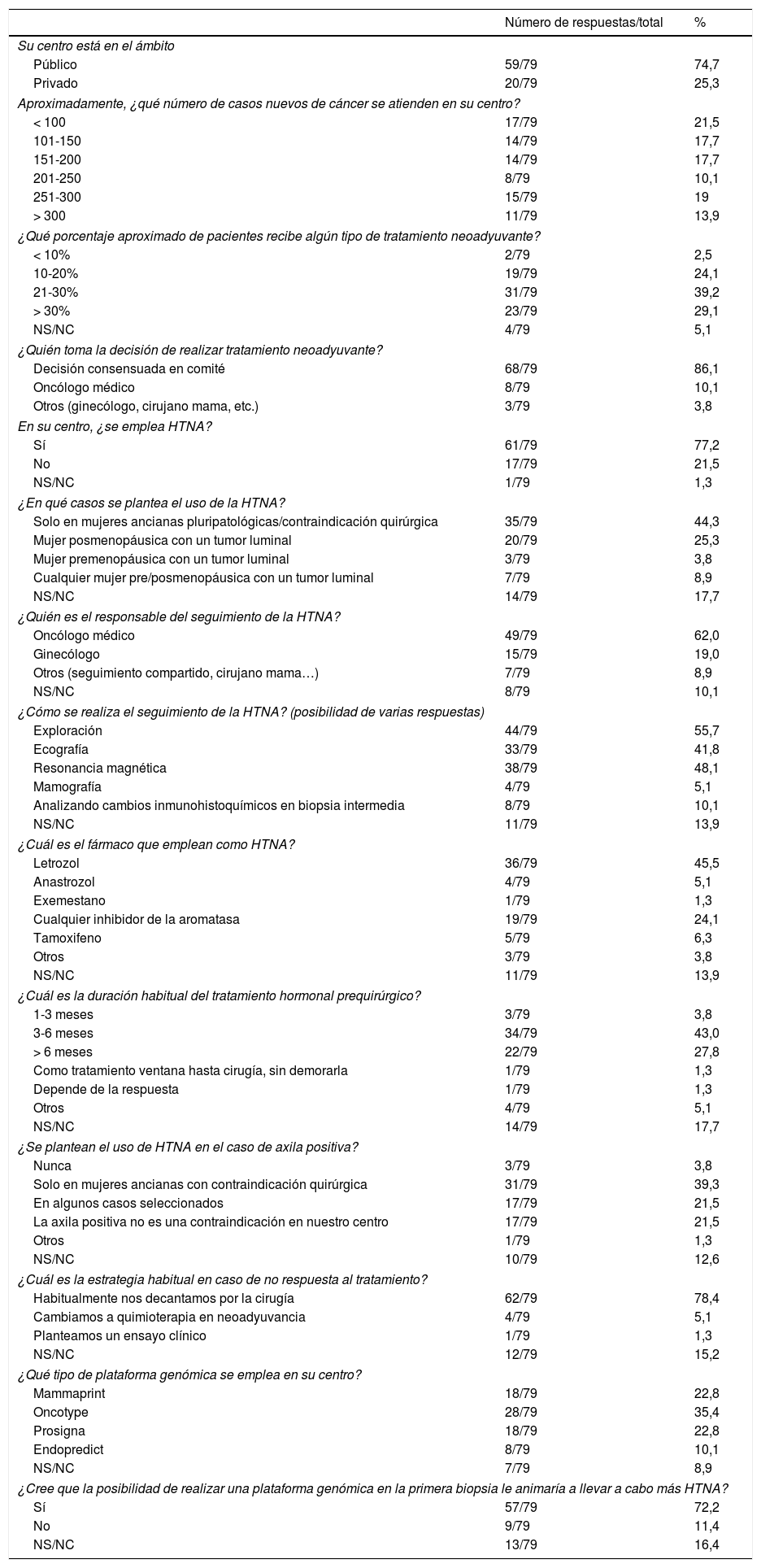
| ¿Qué porcentaje aproximado de pacientes recibe algún tipo de tratamiento neoadyuvante? | ||
| < 10% | 2/79 | 2,5 |
| 10-20% | 19/79 | 24,1 |
| 21-30% | 31/79 | 39,2 |
| > 30% | 23/79 | 29,1 |
| NS/NC | 4/79 | 5,1 |
| ¿Quién toma la decisión de realizar tratamiento neoadyuvante? | ||
| Decisión consensuada en comité | 68/79 | 86,1 |
| Oncólogo médico | 8/79 | 10,1 |
| Otros (ginecólogo, cirujano mama, etc.) | 3/79 | 3,8 |
| En su centro, ¿se emplea HTNA? | ||
| Sí | 61/79 | 77,2 |
| No | 17/79 | 21,5 |
| NS/NC | 1/79 | 1,3 |
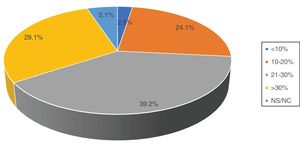
| ¿En qué casos se plantea el uso de la HTNA? | ||
| Solo en mujeres ancianas pluripatológicas/contraindicación quirúrgica | 35/79 | 44,3 |
| Mujer posmenopáusica con un tumor luminal | 20/79 | 25,3 |
| Mujer premenopáusica con un tumor luminal | 3/79 | 3,8 |
| Cualquier mujer pre/posmenopáusica con un tumor luminal | 7/79 | 8,9 |
| NS/NC | 14/79 | 17,7 |
| ¿Quién es el responsable del seguimiento de la HTNA? | ||
| Oncólogo médico | 49/79 | 62,0 |
| Ginecólogo | 15/79 | 19,0 |
| Otros (seguimiento compartido, cirujano mama…) | 7/79 | 8,9 |
| NS/NC | 8/79 | 10,1 |
| ¿Cómo se realiza el seguimiento de la HTNA? (posibilidad de varias respuestas) | ||
| Exploración | 44/79 | 55,7 |
| Ecografía | 33/79 | 41,8 |
| Resonancia magnética | 38/79 | 48,1 |
| Mamografía | 4/79 | 5,1 |
| Analizando cambios inmunohistoquímicos en biopsia intermedia | 8/79 | 10,1 |
| NS/NC | 11/79 | 13,9 |
| ¿Cuál es el fármaco que emplean como HTNA? | ||
| Letrozol | 36/79 | 45,5 |
| Anastrozol | 4/79 | 5,1 |
| Exemestano | 1/79 | 1,3 |
| Cualquier inhibidor de la aromatasa | 19/79 | 24,1 |
| Tamoxifeno | 5/79 | 6,3 |
| Otros | 3/79 | 3,8 |
| NS/NC | 11/79 | 13,9 |
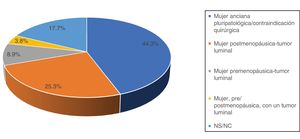
| ¿Cuál es la duración habitual del tratamiento hormonal prequirúrgico? | ||
| 1-3 meses | 3/79 | 3,8 |
| 3-6 meses | 34/79 | 43,0 |
| > 6 meses | 22/79 | 27,8 |
| Como tratamiento ventana hasta cirugía, sin demorarla | 1/79 | 1,3 |
| Depende de la respuesta | 1/79 | 1,3 |
| Otros | 4/79 | 5,1 |
| NS/NC | 14/79 | 17,7 |
| ¿Se plantean el uso de HTNA en el caso de axila positiva? | ||
| Nunca | 3/79 | 3,8 |
| Solo en mujeres ancianas con contraindicación quirúrgica | 31/79 | 39,3 |
| En algunos casos seleccionados | 17/79 | 21,5 |
| La axila positiva no es una contraindicación en nuestro centro | 17/79 | 21,5 |
| Otros | 1/79 | 1,3 |
| NS/NC | 10/79 | 12,6 |
| ¿Cuál es la estrategia habitual en caso de no respuesta al tratamiento? | ||
| Habitualmente nos decantamos por la cirugía | 62/79 | 78,4 |
| Cambiamos a quimioterapia en neoadyuvancia | 4/79 | 5,1 |
| Planteamos un ensayo clínico | 1/79 | 1,3 |
| NS/NC | 12/79 | 15,2 |
| ¿Qué tipo de plataforma genómica se emplea en su centro? | ||
| Mammaprint | 18/79 | 22,8 |
| Oncotype | 28/79 | 35,4 |
| Prosigna | 18/79 | 22,8 |
| Endopredict | 8/79 | 10,1 |
| NS/NC | 7/79 | 8,9 |
| ¿Cree que la posibilidad de realizar una plataforma genómica en la primera biopsia le animaría a llevar a cabo más HTNA? | ||
| Sí | 57/79 | 72,2 |
| No | 9/79 | 11,4 |
| NS/NC | 13/79 | 16,4 |
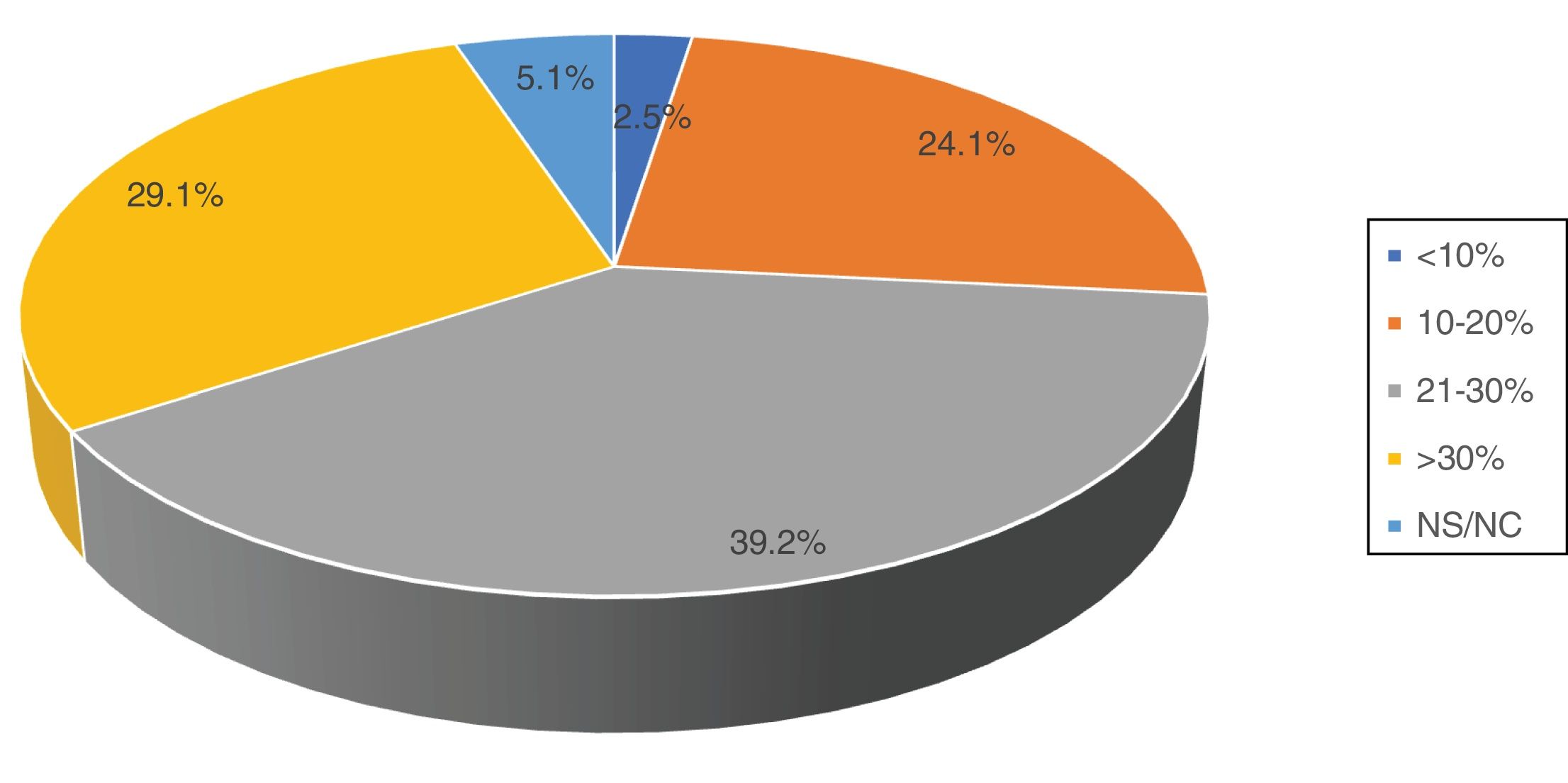
De las 79 encuestas contestadas, 59 (74,7%) pertenecieron a centros públicos. El 29,1% de los centros atienden entre 200 y 300 casos nuevos de cáncer de mama al año, y el 13,9%, más de 300 casos. Respecto al empleo de tratamiento neoadyuvante, 19 encuestados (24,1%) contestaron emplearlo en el 10-20% de los casos, 31 (39,2%) en el 21-30% de los casos y 23 (29,1%) en más del 30% (fig. 1). El 86,1% de los encuestados afirmaron que la decisión de administrar un tratamiento neoadyuvante deriva de un consenso en un comité multidisciplinar, si bien el 10% contestaron que se trataba de una decisión unilateral tomada por el oncólogo médico.
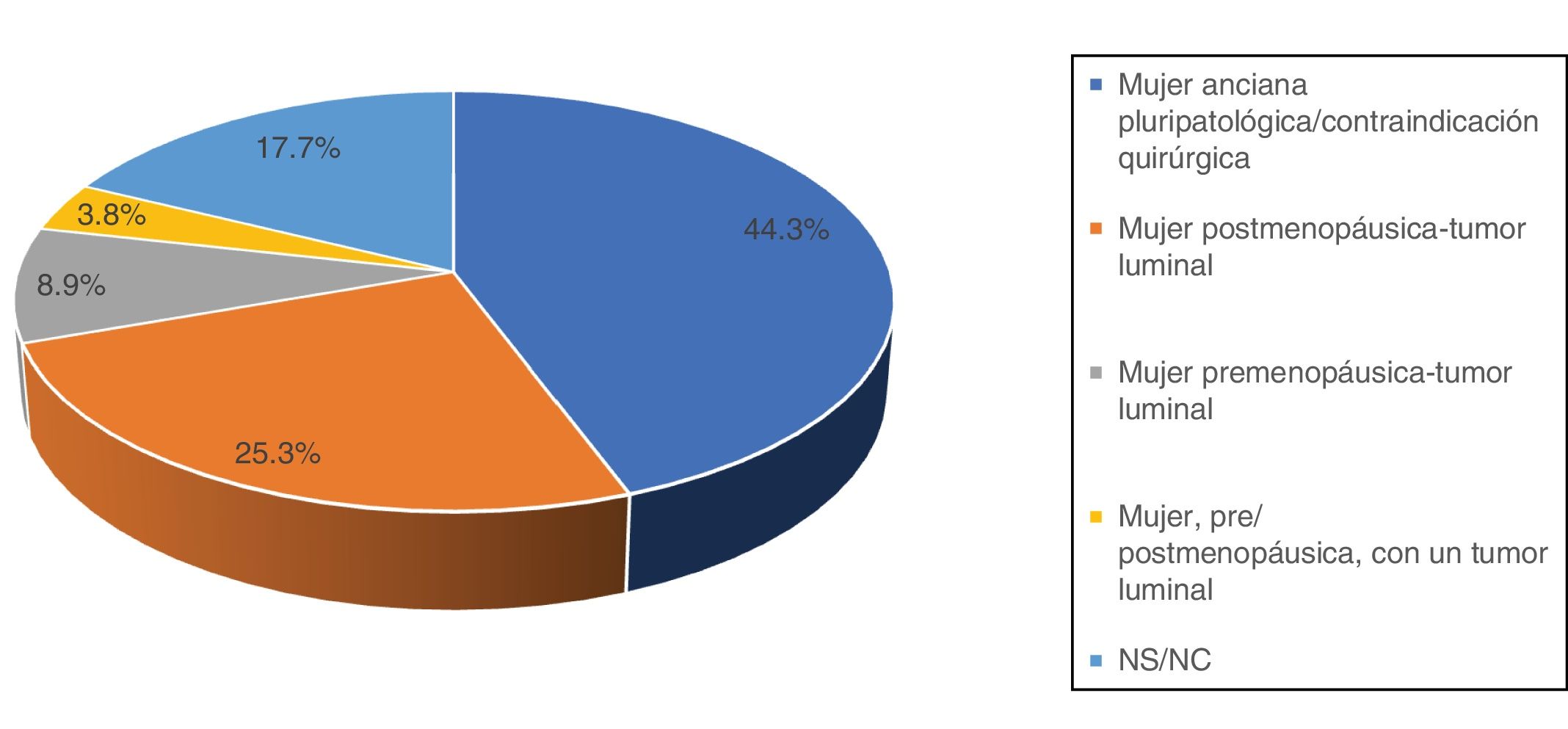
Acerca del empleo de la HTNA, solo 18 encuestados (32,8%) negaron utilizarla. Respecto a las indicaciones de la HTNA, 35 (44,3%) respondieron que su uso queda relegado a mujeres ancianas pluripatológicas o con contraindicación quirúrgica; 20 (25,3%) se plantearían su utilización en cualquier mujer postmenopáusica con un tumor luminal, y 10 (12,7%) lo usarían también en pacientes premenopáusicas (fig. 2).
Sobre el seguimiento de la HTNA, 49 encuestados (62,0%) contestaron que el seguimiento lo lleva a cabo el oncólogo médico y 14 (17,7%), el ginecólogo, tratándose en el resto de los casos de seguimientos combinados. Los tres métodos preferidos para el seguimiento, a menudo empleando más de uno de ellos, son: la exploración, por 44 de los encuestados (64,7%); la resonancia magnética (RM) de mama, por 38 (55,9%), y la ecografía mamaria, por 33 (48,5%).
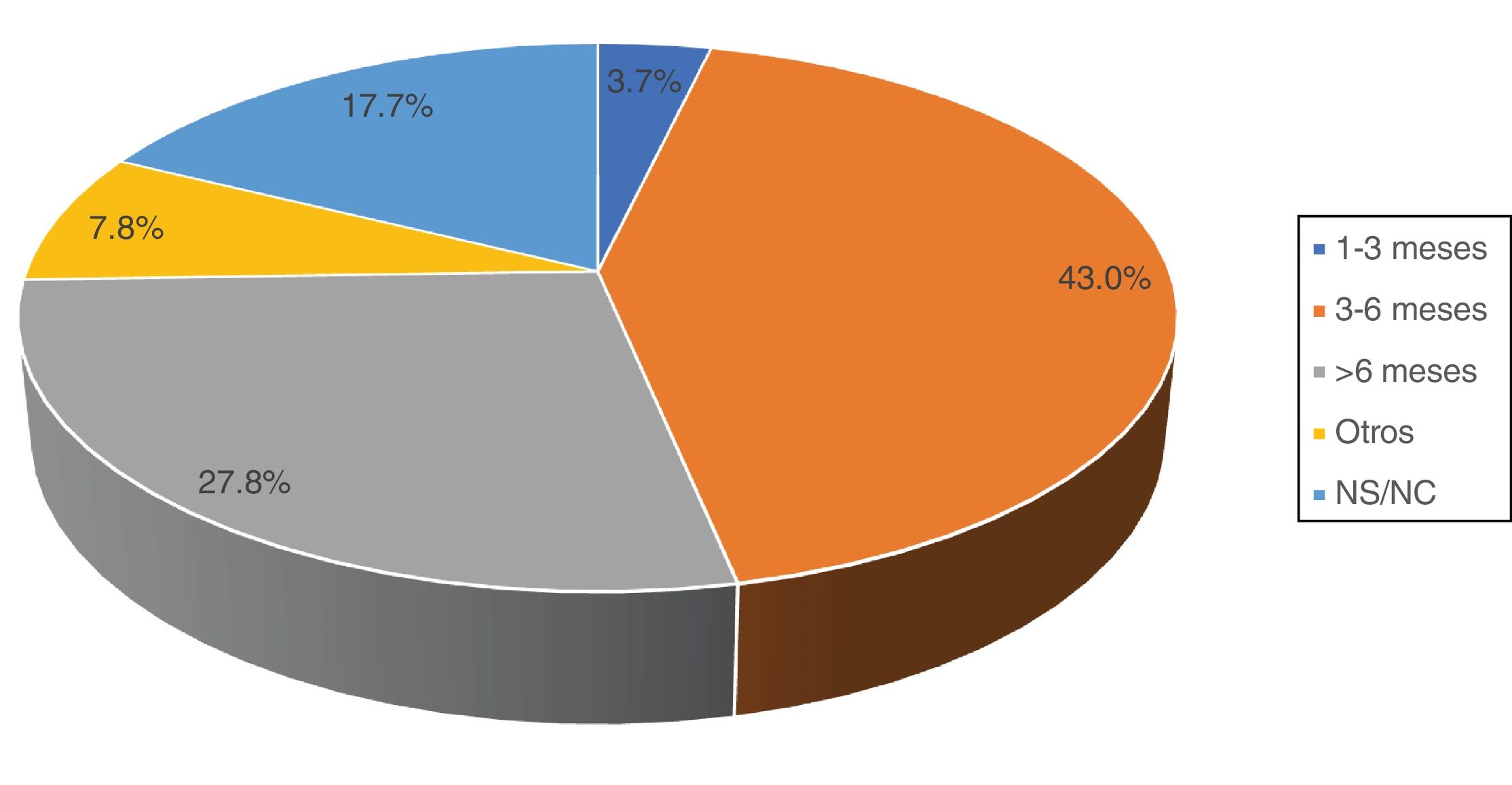
El letrozol fue el fármaco habitualmente elegido por 36 de los encuestados (45,5%), mientras que 19 (27,9%) afirmaron emplear cualquier IA. Cinco encuestados (7,4%) refirieron utilizar tamoxifeno como primera alternativa. Acerca de la duración del tratamiento, 34 (43,0%) se decantaron por un régimen de 3-6meses y 22 (27,8%) más de 6meses. El resto de las alternativas fueron minoritarias (fig. 3).
En lo referente al uso de la HTNA en casos de axila positiva, 31 (39,2%) de los encuestados afirmaron utilizarlo en la paciente muy anciana o con contraindicación quirúrgica, 17 (21,5%) lo considerarían en casos seleccionados, y otros 17 (21,5%) respondieron que la axila positiva no es un obstáculo para la HTNA. Hubo consenso casi absoluto acerca de la actitud ante una mala respuesta a la HTNA, pues 62 especialistas (78,5%) se decantaron por el tratamiento quirúrgico. Tan solo 4 (5,1%) optarían por cambiar a QTNA. Solo un especialista se planteó un ensayo clínico en caso de no respuesta.
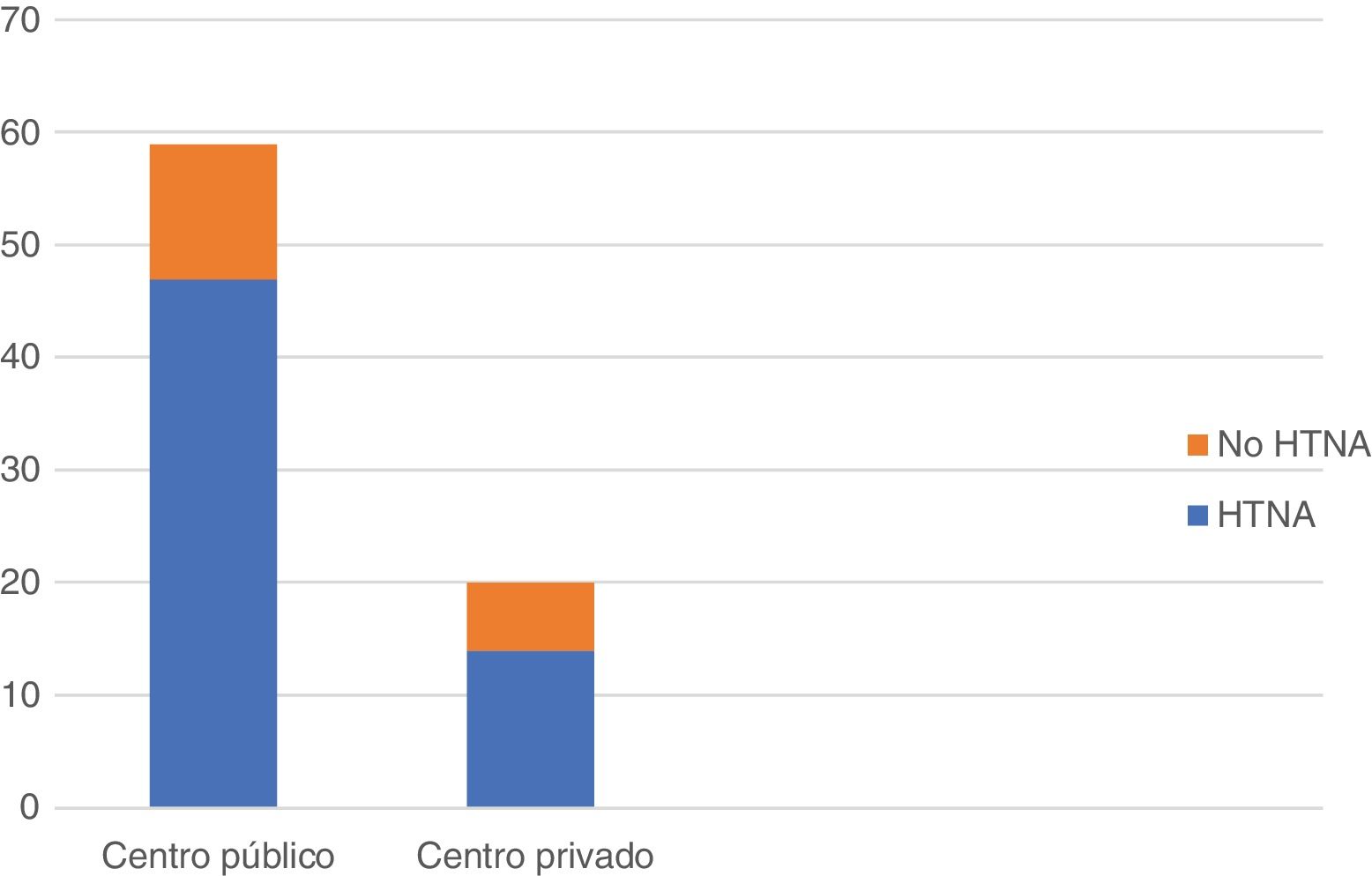
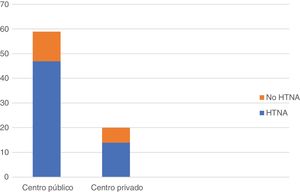
En cuanto a la plataforma genómica más empleada, 28 de los encuestados (35,4%) refirieron la utilización de OncotypeDx; 18 (22,7%), Mammaprint o Prosigna, y 8 (10,1%), Endopredict. La posibilidad de realizar una plataforma genómica en la biopsia diagnóstica animaría a 57 (72,2%) de los encuestados a llevar a cabo más HTNA. Cabe destacar, por último, que el empleo de la HTNA fue superior en los centros de ámbito público 47/59 (79,6%) que en los de ámbito privado 14/20 (70%), si bien estos últimos fueron menos numerosos en la muestra (fig. 4).
DiscusiónEl tratamiento neoadyuvante en cáncer de mama ha adquirido un papel protagonista en los últimos años. Las ventajas son numerosas25,26 y, como vemos en la encuesta, puede suponer la alternativa de tratamiento inicial entre el 20 y el 30% de los casos.
La publicación en la literatura de trabajos que contemplan la utilización de la HTNA es cada vez más frecuente: estudios comparativos frente a la QTNA3-5, estudios de supervivencia13,20,27,28, de evaluación de tratamientos combinados de HTNA con otras moléculas22-24, o de investigación básica de biomarcadores16,21,25,29,30. A pesar de toda la evidencia, la utilización de la HTNA todavía está muy por debajo de lo esperable, quedando relegada generalmente a las mujeres muy ancianas y frágiles en las que probablemente no se realice cirugía posterior.
En nuestro medio encontramos que el empleo de la HTNA es frecuente, pues más de tres cuartas partes de los encuestados se plantean su uso. Sin embargo, y coincidiendo con lo observado por otros autores1,31, la mayoría de los especialistas encuestados la reservan para casos de mujer anciana con comorbilidad, siendo apenas un tercio de ellos los que se lo plantean en la mujer posmenopáusica con un tumor luminal. Es difícil comparar estos resultados con los de países de nuestro entorno, pues no hemos encontrado trabajos similares al nuestro en la literatura que informen de la situación real de la HTNA en otras zonas.
Aunque la decisión del tratamiento neoadyuvante suele tomarse en el seno de un comité multidisciplinar, esta encuesta confirma que en la mayoría de los centros el seguimiento clínico de la HTNA se produce por parte del oncólogo médico. En la literatura no existe apenas información al respecto, lo que queda también de manifiesto en la heterogeneidad de las respuestas en este punto. Aunque la mayor parte de los especialistas se apoyan en la exploración para realizar el seguimiento, esto casi siempre va asociado al empleo de una técnica de imagen complementaria. Con el fin de estandarizar la evaluación es recomendable llevar a cabo el seguimiento según los criterios de la guía del Response Evalution Criteria In Solid Tumours (RECIST)32. Algo más de la mitad se decantan, al igual que ocurre con el uso de QTNA, por la RM como prueba de imagen. El grupo japonés liderado por Takeda encuentra la misma precisión de la RM en la HTNA que en la QTNA33, y recientemente se ha publicado un artículo en el que la RM podría tener un valor predictivo de respuesta a la HTNA34. Un porcentaje muy similar emplean la ecografía en el seguimiento, técnica más accesible y de menor coste que la RM y con buena precisión en la detección de cambios en el tamaño, permitiendo además de forma cómoda la realización de biopsias intermedias que arrojen información sobre la respuesta al tratamiento, como es el caso de nuestro centro. La técnica de PET-TAC utilizando como trazador el 18-fluoroestradiol puede resultar prometedora en la predicción de respuesta al tratamiento de tumores luminales35.
Los fármacos más empleados por los encuestados son los IA, que han demostrado mayor eficacia en neoadyuvancia que el tamoxifeno13,36-39. Aunque, como demostró el ensayo ACOSOG Z103140, no existen diferencias entre los tres IA comercializados, más de la mitad de los encuestados eligen inicialmente el letrozol. Respecto a la duración del tratamiento, no existe consenso en la literatura. La mayor parte de los ensayos realizados mantienen el tratamiento 3-4meses, aunque se han publicado buenos resultados con duraciones entre los 6-12meses y, en general, se recomienda la individualización o mantenerlo hasta obtener la máxima respuesta o exista posibilidad de cirugía conservadora41. Tampoco entre los especialistas encuestados existe una pauta concreta, si bien la mayor parte lo mantuvieron más allá de 3meses.
Otro de los escenarios polémicos que se plantea con la HTNA es la posibilidad de su empleo en el caso de afectación axilar. La mayor parte de los ensayos no consideran la axila positiva como una contraindicación para el tratamiento endocrino primario, si bien la respuesta ganglionar suele ser pobre tanto con HTNA como con QTNA en el caso de los tumores luminales. Las plataformas genómicas pueden tener un papel importante a este nivel. Recientemente se ha publicado un estudio del grupo de Mamounas en el que en pacientes con afectación limitada de la axila y con un recurrence score (RS) bajo tras la realización de la plataforma Oncotype es factible evitar la quimioterapia42. Entre los especialistas que respondieron que sí tratarían con HTNA un tumor luminal N+ son minoría los que se lo plantean fuera del contexto de la mujer anciana con comorbilidades.
La ausencia o la mala respuesta a la HTNA es otra de las preocupaciones que plantea la terapia endocrina, pues puede traslucir la existencia de resistencia hormonal. Aunque la no respuesta clínica puede ser un parámetro indicador de mejor o peor resultado, los cambios en la expresión de Ki67 tras 2semanas de tratamiento parecen correlacionarse de forma más precisa con la predicción de respuesta19,43. Sin embargo, tan solo un pequeño porcentaje de los encuestados contestaron que realizan una biopsia intermedia para valorar la respuesta al tratamiento. Otro de los interrogantes que surge en este contexto es el de la actitud cuando dicha respuesta no es buena. En muchos de los ensayos realizados, cuando la respuesta objetivada (medida por reducción del Ki67 o de respuesta clínico-radiológica) no es favorable, suele derivarse a la paciente a quimioterapia, si bien se ha observado que la eficacia del tratamiento en estas pacientes está también por debajo de lo esperado18. Es decir, las pacientes malas respondedoras a la HTNA tampoco presentan buenas tasas de respuesta a la quimioterapia, lo cual orienta a que la terapia óptima de estas pacientes todavía no está bien definida. Entre nuestros encuestados, la práctica unanimidad se decantaron por la cirugía en el caso de no respuesta. Solo un mínimo porcentaje se plantean el cambio a quimioterapia, o a un ensayo clínico. Probablemente las terapias combinadas de IA con tratamientos dirigidos (inhibidores de ciclinas, PI3K, etc.) lleguen a constituir una alternativa en estos casos, si bien aún están pendientes los resultados de los ensayos en marcha.
La realización de plataformas genómicas generalmente está enfocada a detectar qué casos pueden beneficiarse o no de la quimioterapia, en función del riesgo de recaída que presenta un tumor luminal. Pero a pesar de que los perfiles genómicos de los que se dispone se han demostrado muy útiles en la determinación del pronóstico en términos de recaída y estratificación del riesgo, su capacidad de predecir la eficacia del tratamiento endocrino aún no ha sido validada21. La combinación de parámetros dinámicos como el Ki67, los arrays y otros valores con una plataforma genómica es planteada por algunos autores como una alternativa para implementar este enfoque21,44. Si bien las plataformas de las que disponemos (Prosigna, Mammaprint, Oncotype y Endopredict) no están validadas en este contexto, su realización en la biopsia con aguja gruesa del diagnóstico nos puede orientar acerca de las opciones que tiene una paciente de evolucionar de forma valorable con tratamiento endocrino exclusivo, sobre todo en los casos de tumores con fenotipo luminalB o con afectación axilar limitada. La mayoría de los especialistas encuestados confirman que un resultado «favorable» en una plataforma genómica les animaría a decantarse por la HTNA. Aunque esto puede constituir una alternativa relativamente sencilla y asequible, la investigación traslacional, con el estudio de muestras pareadas y los cambios que en ellas se producen, probablemente suponga la oportunidad de encontrar los biomarcadores que predigan probabilidad de respuesta y de aparición de resistencias25.
Por lo tanto, la evidencia, aunque no así los datos de esta encuesta, confirma la HTNA como una alternativa terapéutica a considerar cuando nos enfrentamos a un tumor luminal. Aunque todavía carecemos de un biomarcador predictor de respuesta, los cambios producidos en el Ki67 o los resultados del PEPI score aportan una valiosa información pronóstica. La investigación traslacional y los resultados de ensayos clínicos en marcha y futuros probablemente despejen esta y otras dudas aún presentes.
ConclusionesLa HTNA es una opción terapéutica empleada en nuestro medio, pero en la mayoría de los casos queda relegada al tratamiento de la mujer anciana o con comorbilidades, a pesar de que existe evidencia sólida que respalda su uso en otros escenarios. Un mejor conocimiento de la biología tumoral, como el que pueden proporcionar las plataformas genómicas, podría contribuir a extender el uso de estos tratamientos. Finalmente, los resultados de las investigaciones actuales muy posiblemente consolidarán la HTNA en nuestro entorno como una alternativa sólida de tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.