La asociación de enfermedades cardiovasculares, tromboembolismo y aterosclerosis se asocia significativamente con disfunción endotelial. La posibilidad de asociación de esta última con enfermedades psiquiátricas como el trastorno por estrés postraumático (TEPT) constituiría un factor de riesgo para el desarrollo de fenómenos de aterosclerosis.
ObjetivoDetectar una asociación significativa entre el TEPT y mayores valores de moléculas de disfunción endotelial como e-Selectina, s-ICAM-1 y v-CAM-1, en comparación con sujetos sanos sin TEPT.
MétodosSe seleccionaron 24 pacientes con TEPT y 24 sujetos sanos control sin TEPT y se midieron e-Selectina, v-CAM-1 e ICAM-1 soluble en plasma en ambos grupos. Además se les administró la escala de gravedad de síntomas del trastorno por estrés postraumático y el Trauma Symptom Checklist para evaluación del TEPT.
ResultadosSe comprobó una asociación significativa y robusta entre e-Selectina, s-ICAM-1 y v-CAM-1 y la gravedad del TEPT.
ConclusionesHay una relación continua entre la severidad de los síntomas de TEPT y los niveles plasmáticos de marcadores de disfunción endotelial. Este vínculo puede explicar la asociación entre la probabilidad de desarrollar enfermedades cardiovasculares y aterogénesis y los eventos traumáticos conducentes a desarrollar TEPT en el nivel de la respuesta vascular inflamatoria común.
There is a strong association between cardiovascular diseases, thromboembolism, and atherosclerosis with endothelial dysfunction. The relationship of the latter with neuropsychiatric diseases such as the post traumatic stress disorder (PTSD) stands as a risk factor for the development of atherosclerotic phenomena.
ObjectiveTo disclose a meaningful association between PTSD and higher values of endothelial dysfunction molecules like e-Selectin, s-ICAM-1 and v-CAM-1, in comparison with healthy subjects without PTSD.
Methods24 patients with PTSD and 24 healthy subjects were selected e-Selectin, v-CAM-1 e soluble ICAM-1 levels were measured in plasma. The PTSD severity symptoms scale and the Trauma Symptom Checklist were administered to both samples.
ResultsA meaningful and robust correlation between endothelial dysfunction markers e-Selectin, s-ICAM-1 y v-CAM-1 plasma levels and the severity of the PTSD was disclosed.
ConclusionThere is a continual relationship between PTSD symptoms severity and plasmatic levels of endothelial dysfunction markers. This relationship can explain the probability of developing cardiovascular diseases and atherogenesis and traumatic life events which ends up as PTSD at common grounds with inflammatory vascular response.
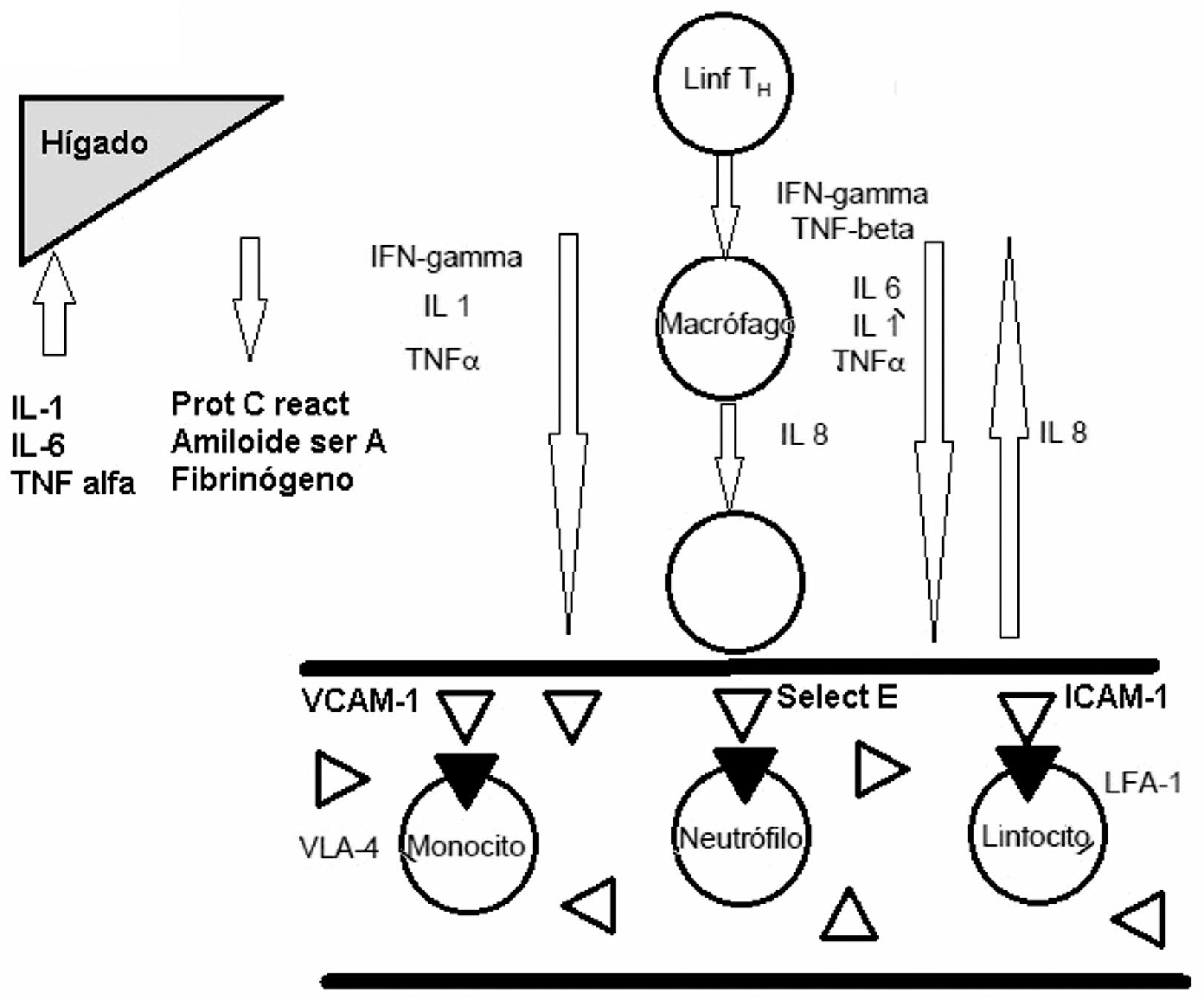
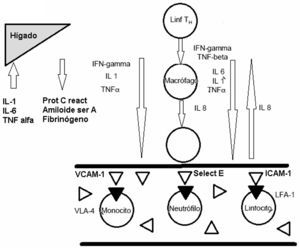
El cuadro de trastorno por estrés postraumático (TEPT) se caracteriza por 3 tipos de síntomas diferentes (DSM IV) a saber, experiencia recidivante del evento traumático, evitación de señales o pistas relacionadas con el mismo e hiperactivación (American Psychiatric Association, 1994). La prevalencia del TEPT es del 7,8% en la población adulta general, siendo las mujeres el doble (10,4%) de los hombres (5%). Los traumas más frecuentemente experimentados son haber sido testigo de una persona gravemente lesionada o muerta, estar involucrado en tiroteos, inundaciones o desastres naturales, haber participado en accidentes que pusieron en peligro la vida. La mayoría experimentan más de un tipo de traumas, e incluso 10% de los hombres y 6% de las mujeres refieren 4 o más durante sus vidas1. La incidencia del trastorno se duplica en pacientes que han sufrido infarto agudo de miocardio (IAM)2. Además los pacientes con TEPT tienen riesgo aumentado de enfermedades tromboembólicas3,4 y de mortalidad cardiovascular5–8. Pacientes con IAM y TEPT como comorbilidad tienen mayor tasa de recaídas. TEPT y depresión pueden asociarse con enfermedad aterosclerótica a través de un estado proinflamatorio y disfunción endotelial9,10. La disfunción endotelial se puede valorar cuantificando proteínas circulantes derivadas del endotelio. Numerosas investigaciones indican varias sustancias tales como: citoquinas IL-1, IL-6 y TNF-alfa; e-Selectina (e-S), endotelina-1 (E-1); molécula de adhesión intercelular-1, 2 y 3 (ICAM-1, ICAM-2, ICAM-3), molécula de adhesión vascular (v-CAM-1), antígeno del factor von Willebrand (agFvW), inhibidor de la activación del plasminógeno tipo 1 y 2 (PAI-1 y PAI-2), trombomodulina soluble, factor tisular soluble (sTF), molécula de adhesión intercelular soluble-1 (s-ICAM-1)11–24; factor inhibidor de la activación tisular (TAIF)25,26, proteína C reactiva (PCR), dimetil-arginina asimétrica (ADMA)27,28. El mecanismo propuesto es que en el lugar de la inflamación e injuria las células endoteliales expresan sTF, s-ICAM-1 y v-CAM en la superficie de la célula (fig. 1).
Aunque no se conoce con precisión el papel exacto de cada uno de los factores mencionados, todos participan en las respuestas inflamatorias y de coagulación que preceden los fenómenos aterogénicos29. En respuesta a estímulos proinflamatorios ICAM-1 media adhesión endotelial y migración leucocitaria, recluta macrófagos sobre la placa coronaria e induce fibrosis e inestabilidad de la placa. ICAM-1, v-CAM-1, PCR tienen mayor concentración en sujetos sanos que van a tener infarto agudo de miocardio (IAM), anticipan el desarrollo de aterosclerosis carotídea junto con e-S, son mayores en pacientes que sufrieron IAM, se asocian con factores de riesgo cardiovascular, ansiedad, menores hábitos de salud y depresión, que a su vez aumentan la disfunción endotelial30,31. Esta última es el resultado de varias etapas, incluyendo aumento de IL-1, IL-6, FNTα, interferón; adhesión leucocitaria a células endoteliales por ICAM-1, v-CAM-1 y e-S; migración transendotelial, aumento del agFvW, activación de la cascada trombótica y formación ateromatosa32. La expresión de las ICAM, v-CAM-1 y e-S está aumentada en placas ateroscleróticas33 en tanto que sus formas solubles están aumentadas en suero en condiciones que cursan con un componente inflamatorio como enfermedad arterial coronaria, esclerosis carotídea, enfermedad vascular periférica, síndrome metabólico, diabetes, hipertensión y dislipidemia34–37. La molécula de adhesión celular vascular-1 pertenece a la sub-familia β1 de integrinas y media la adhesión de linfocitos, monocitos, eosinófilos y basófilos al endotelio vascular, interviene en la transducción de señales y en el desarrollo de aterosclerosis y artritis reumatoide. El factor de necrosis tumoral alfa (TNF-α) y las interleuquinas 1 y 4 (IL-1, IL-4) la regulan en alza38. La molécula de adhesión intracelular-1 o CD54 (ICAM-1) es una proteína transmembranal de la superfamilia de Ig, fuertemente glicosilada y asociada a endotelio y leucocitos que interviene en la estabilización de interacciones intercelulares y la trans-migración endotelial, la transducción de señales inmunológicas, la producción de efectos proinflamatorios y reclutamiento de quinasas como p 56 lyn39. La e-Selectina (e-S) pertenece a una familia de moléculas de adhesión celular del tipo de glicoproteínas transmembranales, que se expresa en células endoteliales en respuesta a citoquinas inflamatorias como la interleuquina-1beta (IL-1β), y/o el factor de necrosis tumoral alfa (TNF-α). Se ha sugerido que niveles aumentados de la forma soluble de e-S (e-S-s) podrían ser marcadores específicos y precoces de endotelio vascular dañado40.
ObjetivosDetectar una asociación significativa entre el TEPT y mayores valores de moléculas de disfunción endotelial como e-Selectina, s-ICAM-1 y v-CAM-1, en comparación con sujetos sanos sin TEPT de control. Para ello se valoró un conjunto de posibles correlaciones entre función endotelial y TEPT mediante diversas pruebas estadísticas.
MétodosAl ingreso al estudio, se extrajo a cada sujeto una muestra de 10cc de sangre venosa antecubital en ayunas, entre las 8 y las 9 de la mañana y con un periodo previo de ayuno de 12h. Las muestras fueron colocadas en tubos conteniendo citrato de sodio al 3,8% y luego centrifugadas a 2.000×g durante 20min a 4°C. Posteriormente se separaron en plasma, suero y buffy coat, y almacenadas a −80°C. Posteriormente una alícuota fue procesada para determinación de glicemia y perfil lipídico mediante método enzimático colorimétrico (BTS-330® BioSystems; Barcelona, España). Las concentraciones de s-ICAM-1 (molécula de adhesión intercelular soluble-1) se determinaron mediante enzimoinmunoanálisis (enzime-linked immunosorbent assay-ELISA, Parameter Human s-ICAM-1 Immunoassay; R&D Systems, Minneapolis, Estados Unidos). La sensibilidad del ensayo fue de 0,35ng/ml, con un rango de valores de 2,73–49,55ng/ml y las variabilidades intra-analítica e inter-analítica fueron del 4,8 y del 10,1%. El s-v-CAM-1 (molécula de adhesión vascular soluble 1) se midió por ELISA usando un anticuerpo monoclonal específico para s-VCAM-1 (Quantikine Human s-VCAM-1 Immunoassay; R&D Systems, Minneapolis, MN EE. UU.). El límite inferior de detección fue de 0,17–1,26ng/ml con un rango de 0–200ng/ml. Los coeficientes de variación intra-ensayo oscilaron entre 2,3–3,6% y los coeficientes de variación interensayo fueron de 5,5–7,8%. e-Selectina soluble se midió usando un panel enzimático cuantitativo de alta sensibilidad (Parameter Human sE-Selectin Immunoassay; R&D Systems, Minneapolis, MN EE.UU). El nivel mínimo detectable de e-Selectina fue <0,1ng/ml y el rango del ensayo fue de 0,47–10,52mg/ml. Los coeficientes de variación intra e inter ensayos oscilaron entre 4,7–5,0% y 5,7–8,8%, respectivamente. Las muestras de pacientes y controles se distribuyeron aleatoriamente en diferentes frascos y ensayos para prevenir errores sistemáticos de medición. Para la evaluación del TEPT se utilizó la escala de gravedad de síntomas del trastorno por estrés postraumático41. Esta escala consta de 17 ítems basados en los criterios diagnósticos del DSM IV y sirve para evaluar los síntomas de este cuadro clínico en victimas de sucesos traumáticos. Los ítems se agrupan en tres dominios: reexperimentación (cluster A del DSM IV), evitación (cluster B) e hiperactivación (cluster C). Los síntomas se valoran en una escala tipo Likert de 0 a 3, según frecuencia e intensidad de los síntomas. Reexperimentación consta de 5 ítems, evitación tiene 7, e hiperactivación tiene 5. Cuenta además con una subescala complementaria de manifestaciones somáticas de la ansiedad con la misma estructura que se compone de 13 ítems (rango: 0 a 39) y puede ayudar a diferenciar entre distintos tipos de victimas y a orientar en la elección de estrategias terapéuticas. El coeficiente de fiabilidad test-retest es de 0,89 y el coeficiente alfa de 0,90. Se requiere la presencia de al menos 1 síntoma de reexperimentación, 3 de evitación y 2 de hiperactivación para cumplir los criterios de TEPT. Por otra parte, estos síntomas deben prolongarse más de 1 mes y provocar malestar clínico significativo o un deterioro social laboral o de otras áreas importantes de la vida cotidiana de la persona. La validez de contenido de esta escala, que abarca el 100% de los criterios diagnósticos del DSM IV, puede considerarse totalmente satisfactoria. La Trauma Symptom Checklist42 se usó para valorar la ansiedad y la depresión, ya que con frecuencia se encuentra esta última como comorbilidad en personas con TEPT. Las propiedades psicométricas son satisfactorias con un índice α de Cronbach de 0,86 para escalas de ansiedad y depresión. Ambas escalas contienen 9 ítems respectivamente cuya respuesta se valora en una escala Likert de 4 puntos desde 0 (nunca) hasta 3 (muy a menudo) arrojando un resultado global de 0 a 27.
SujetosSe seleccionaron 24 pacientes de un servicio de consulta externa de psiquiatría y taller de día, con diagnóstico de TEPT que cumplían con los criterios del DSM-IV para el diagnóstico, y un grupo de control de 24 sujetos apareados por edad y sexo y sin patología psiquiátrica, reclutados a partir de la consulta espontánea de un servicio de kinesiología y rehabilitación del mismo centro sanitario. El tamaño muestral se calculó para un coeficiente de correlación de Pearson entre muestras de 0,8 con un poder (1 –β) de 99%, una probabilidad de error tipo i α de dos lados=0,01 y un tamaño de efecto de 0,7 para un valor de f de 0,3543. Dentro de los eventos traumáticos desencadenantes de TEPT el más frecuente fue haber sufrido un accidente. También se encontraron referencias a accidentes entre los controles pero en estos, los mismos no conducían al desarrollo de la enfermedad. Tanto los pacientes como los controles no evidenciaron problemas de salud importantes como para ser excluídos del estudio, para lo cual se los sometió a una evaluación clínica completa por dos clínicos ajenos al estudio. Los criterios de exclusión fueron historia de enfermedades cardíacas, hepáticas, renales o sistémicas, accidentes o cirugías mayores en el mes anterior al estudio, infecciones respiratorias, urinarias o gastrointestinales, así como fiebre en la semana anterior; tromboembolismo pulmonar o uso de anticoagulantes orales dentro de los últimos 3 meses; consumo de aspirinas en los últimos 10 días, embarazo o terapia hormonal. Dado que los antidepresivos pueden modificar los niveles de marcadores endoteliales, a los pacientes medicados con estos últimos se los sometió a un período de lavado (wash-out) de 1 mes44. Para la exclusión de trastornos psiquiátricos en controles se utilizó en M.I.N.I 5.045. Todos los participantes dieron su consentimiento informado. Se evaluaron factores de riesgo cardiovascular y de estilo de vida como correlatos potenciales de marcadores endoteliales. Para la evaluación se les requirió a los sujetos información sobre tabaquismo, hipertensión arterial, diabetes, niveles de glicemia o historia de diabetes, dislipidemia. Se calculó el índice de masa corporal como la razón entre peso en kg y altura en metros cuadrados. Se consideró la hipertensión con valores de presión sistólica (PS) >140mmhg, y/o presión diastólica (PD) >90mmhg calculada como el promedio de 3 mediciones con esfiigmomanómetro con el sujeto en posición sedente. También se requirió información sobre hábitos de ejercicio, consumo de alcohol o café.
Análisis estadísticosSe usó el paquete estadístico SPSS 14.0 (Chicago, IL EE·UU) para los análisis. El nivel de significación se fijó en p≤0,05, y todos los tests fueron de dos colas. Para evitar sesgos por distribución no normal, se normalizaron los valores por transformación z antes de someterlos a análisis estadístico. Mediante este procedimiento se reemplazó cada valor original por su valor de rango z y se ajustaron las distancias escalares entre rangos para una distribución normal. Los pacientes y controles se compararon usando un diseño de caso-control apareados mediante t-tests de dos colas para variables continuas y Wilcoxon signed rank tests para variables categoriales. La asociación entre variables se estimó mediante análisis de correlación de Pearson. Se utilizó un análisis de regresión logística para determinar si la relación entre estado de enfermedad TEPT (1=TEPT, 0=control) y niveles plasmáticos de marcadores endoteliales serían afectada por ajuste de covariantes que se asocian significativamente con marcadores endoteliales en análisis de correlación. Para identificar clústers de síntomas de TEPT asociados significativamente con marcadores endoteliales con y sin ajuste para covariantes de marcadores endoteliales se usó análisis de regresión linear jerárquica para muestra de pacientes y controles por separado y en forma conjunta. También se determinó la significación de la diferencia para pacientes y controles en los coeficientes de correlación entre escala de TEPT y marcadores endoteliales, con y sin ajuste para covariantes.
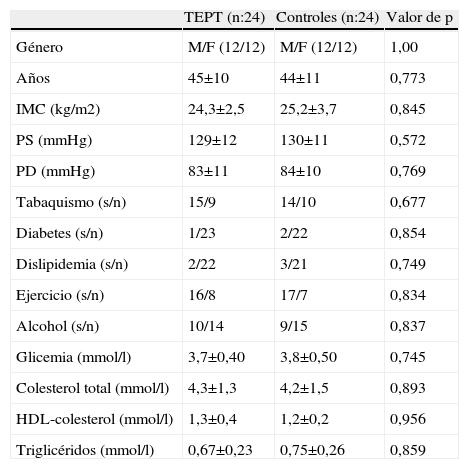
ResultadosNo hubo diferencias significativas en los datos demográficos y clínicos entre pacientes y controles (tabla 1). No hubo historia significativa de enfermedades sistémicas, renales, hepáticas o cardíacas. El tiempo promedio entre el evento traumático y el desarrollo del TEPT fue de 18±15 (rango de 9–37) meses.
Datos demográficos y médicos de TEPT y controles (media±DE)
| TEPT (n:24) | Controles (n:24) | Valor de p | |
| Género | M/F (12/12) | M/F (12/12) | 1,00 |
| Años | 45±10 | 44±11 | 0,773 |
| IMC (kg/m2) | 24,3±2,5 | 25,2±3,7 | 0,845 |
| PS (mmHg) | 129±12 | 130±11 | 0,572 |
| PD (mmHg) | 83±11 | 84±10 | 0,769 |
| Tabaquismo (s/n) | 15/9 | 14/10 | 0,677 |
| Diabetes (s/n) | 1/23 | 2/22 | 0,854 |
| Dislipidemia (s/n) | 2/22 | 3/21 | 0,749 |
| Ejercicio (s/n) | 16/8 | 17/7 | 0,834 |
| Alcohol (s/n) | 10/14 | 9/15 | 0,837 |
| Glicemia (mmol/l) | 3,7±0,40 | 3,8±0,50 | 0,745 |
| Colesterol total (mmol/l) | 4,3±1,3 | 4,2±1,5 | 0,893 |
| HDL-colesterol (mmol/l) | 1,3±0,4 | 1,2±0,2 | 0,956 |
| Triglicéridos (mmol/l) | 0,67±0,23 | 0,75±0,26 | 0,859 |
Se usó t-test para muestras apareadas o Wilcoxon signed ranks test para control de casos.
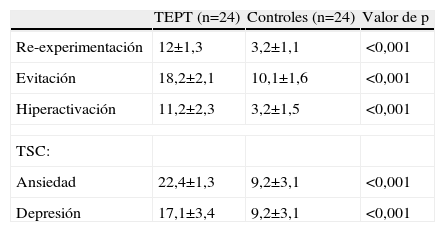
Los pacientes con TEPT tuvieron mayores niveles de síntomas, además de ansiedad y depresión que los controles (tabla 2).
Datos psicométricos de TEPT y controles (medias y DE)
| TEPT (n=24) | Controles (n=24) | Valor de p | |
| Re-experimentación | 12±1,3 | 3,2±1,1 | <0,001 |
| Evitación | 18,2±2,1 | 10,1±1,6 | <0,001 |
| Hiperactivación | 11,2±2,3 | 3,2±1,5 | <0,001 |
| TSC: | |||
| Ansiedad | 22,4±1,3 | 9,2±3,1 | <0,001 |
| Depresión | 17,1±3,4 | 9,2±3,1 | <0,001 |
Los análisis usaron t-test de doble cola para caso-control apareados.
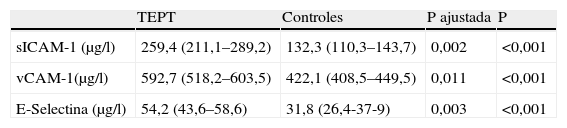
En todos los sujetos s-ICAM, v-ICAM y e-Selectina correlacionaron con síntomas de ansiedad (r=0,56; p=0,014) y depresión (0,58; p=0,006). Escalas de ansiedad y depresión estuvieron altamente correlacionadas entre sí (r=0,75, p<0,001). El tiempo entre el momento del evento traumático y el inicio de los síntomas no se asoció significativamente con los marcadores endoteliales en los pacientes (p=0,47). Los marcadores de disfunción endotelial alcanzaron valores más altos en TEPT con un efecto de tamaño importante (d de Cohen =0,81); los valores más altos de s-ICAM en pacientes vs controles mostraron un efecto de tamaño moderado (d=0,65) igual que e-Selectina (d=0,54). El ajuste para s-ICAM, v-ICAM y e-Selectina por edad y ejercicios no mostró diferencias significativas entre grupos (tabla 3).
Marcadores de disfunción endotelial en TEPT y controles
| TEPT | Controles | P ajustada | P | |
| sICAM-1 (μg/l) | 259,4 (211,1–289,2) | 132,3 (110,3–143,7) | 0,002 | <0,001 |
| vCAM-1(μg/l) | 592,7 (518,2–603,5) | 422,1 (408,5–449,5) | 0,011 | <0,001 |
| E-Selectina (μg/l) | 54,2 (43,6–58,6) | 31,8 (26,4-37-9) | 0,003 | <0,001 |
Los valores se expresan como medias y rangos intercuartilos. Se aplicó t-test para muestras pareadas y regresión logística en parejas de caso-control para comparación ajustada para covariantes (edad y ejercicio).
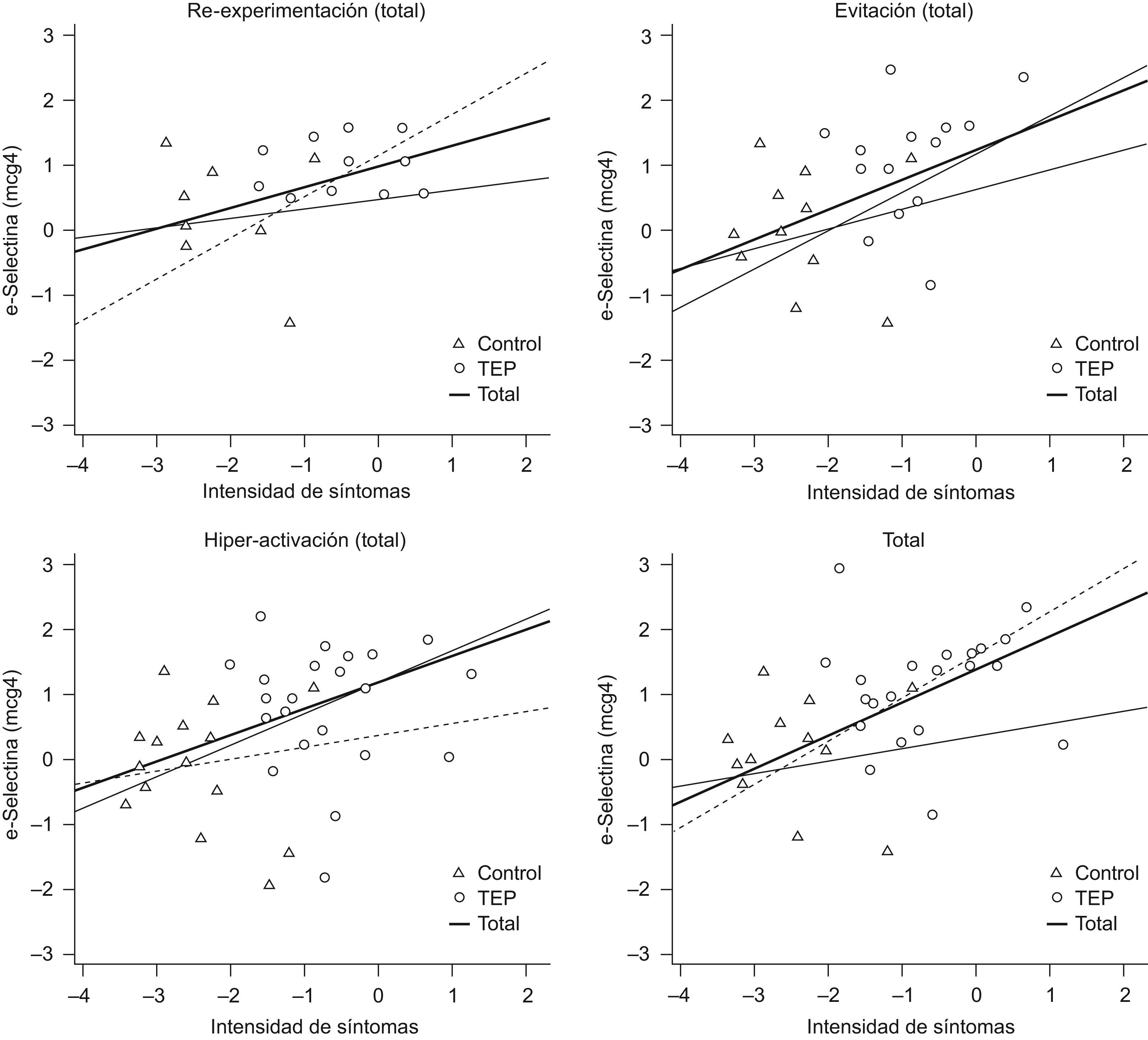
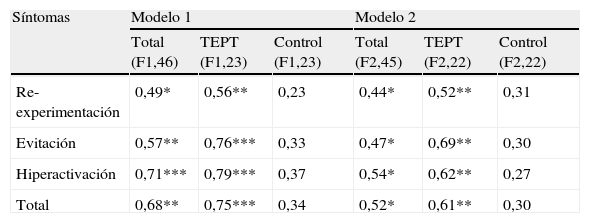
Todos los síntomas de TEPT se asocian con e-Selectina en los pacientes con TEPT (tabla 4), especialmente hiperactivación y evitación, pero no en los controles (modelo 1). Sin embargo, aunque se mantienen las pendientes, estadísticamente la significación de la asociación disminuye cuando se corrigen los datos para covariantes como edad y actividad física.
Modelo de regresión para e-selectina
| Síntomas | Modelo 1 | Modelo 2 | ||||
| Total (F1,46) | TEPT (F1,23) | Control (F1,23) | Total (F2,45) | TEPT (F2,22) | Control (F2,22) | |
| Re-experimentación | 0,49* | 0,56** | 0,23 | 0,44* | 0,52** | 0,31 |
| Evitación | 0,57** | 0,76*** | 0,33 | 0,47* | 0,69** | 0,30 |
| Hiperactivación | 0,71*** | 0,79*** | 0,37 | 0,54* | 0,62** | 0,27 |
| Total | 0,68** | 0,75*** | 0,34 | 0,52* | 0,61** | 0,30 |
Modelo 1: sin ajuste para covariantes; Modelo 2: ajustado para edad y actividad física. Los niveles de significación son: *p<0,10, **p<0,05, ***p<0,001. Los valores indican coeficientes β (pendiente). Las columnas indican sujetos y df.
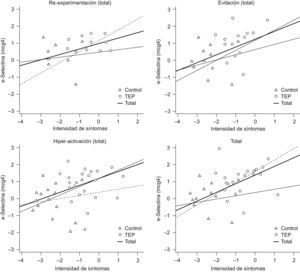
La relación entre e-Selectina y los síntomas de TEPT reexperimentación, evitación e hiperactivación, así como los totales en controles y pacientes graficados como datos transformados (z) permiten observar la asociación significativa entre la intensidad de síntomas en TEPT y las concentraciones de e-Selectina (fig. 2).
DiscusiónA partir de los resultados obtenidos se puede asumir la existencia de una asociación significativa entre disfunción endotelial y el TEPT, en comparación con sujetos control sin TEPT. Los pacientes tuvieron niveles más altos de e-Selectina, s-ICAM-1 y v-CAM-1, aún controlando covariables como actividad física y edad, que podrían modificar los valores de endotelinas. También se observó una asociación significativa entre los resultados de depresión y ansiedad y los valores de marcadores endoteliales, lo cual no es sorprendente dada la prevalencia de estos síntomas en el TEPT. No obstante, los síntomas de TEPT hicieron una contribución mayor a los aumentos de marcadores endoteliales que depresión y ansiedad por separado. Los síntomas de evitación e hiperactivación se relacionaron de manera robusta con endotelinas especialmente e-Selectina en comparación con los controles. Estos hallazgos están en concordancia con otros estudios que han encontrado una asociación entre TEPT y signos de IAM, aún después de ajuste para depresión y ansiedad46. La relación positiva entre TEPT y niveles de s-ICAM-1 son robustas independientemente de corregir para edad, lo que sugiere una relación continua entre estas variables aún con síntomas moderados de TEPT, es decir que existe una asociación directa entre intensidad y severidad de síntomas de TEPT y los niveles de marcadores de disfunción endotelial, incluso en el rango de menores niveles de gravedad de síntomas. Parece surgir evidencia a favor de una respuesta aterogénica inflamatoria endotelial continua asociada a niveles crecientes de intensidad de respuestas estresoras en TEPT47. Los marcadores e-Selectina, s-ICAM-1 y v-CAM-1 estuvieron elevados independientemente del tiempo de desarrollo de síntomas, sugiriendo una base común para los efectos aterogénicos y cardiovasculares entre TEPT agudo y crónico, si bien no se puede deducir del estudio una cadena causal. El objetivo primario del estudio fue investigar la relación entre los marcadores de disfunción endotelial y TEPT, generando una base hipotética para relacionar este trastorno con enfermedades cardiovasculares. Si bien este es un estudio transversal y no puede expresar una hipótesis longitudinal sobre los cambios a largo plazo de marcadores endoteliales, son conocidos algunos factores que influyen en su expresión a partir de estados mentales y emocionales propios del TEPT48 que modifican a su vez el eje hipotálamo-hipofiso-suprarrenal (HHS) y el sistema nervioso simpático (SS)49. Los pacientes con TEPT tienen menores niveles de cortisol plasmático, aumento de catecolaminas en plama y orina de 24h50, activación de células endoteliales51, hiperactividad de citoquinas52, IL-6, selectinas y factores de adhesión53. El TNF-α (factor de necrosis tumoral α) activa los factores de transcripción nuclear AP-1, COUP-TF1, NFκB, STAT, los que estimulan la producción de IL-6 y factores de adhesión54, en tanto que los glucocorticoides ejercen sus efectos por dos mecanismos, genómicos y no genómicos. Entre los primeros se cuentan las retroalimentaciones negativas sobre el TNF-α, aumentado en TEPT55 y sobre factores de activación y transcripción. Los mecanismos no genómicos generan insensibilidad a los inhibidores de transcripción genómica, modificando canales iónicos y proteínas asociadas de membrana, e inhiben la señalización intracelular de ICAM-1 y vCAM1 y la reorganización citoesquelética necesaria para la adhesividad y movilización celular56. El SS, a partir de la noradrenalina producida en los centros A1/A2 del locus ceruleus y en el sistema nervioso autónomo central, estimula receptores endoteliales noradrenérgicos β257 que en TEPT aumentan niveles de MCP-1, MIP-1α, M-CSF, TNF-α, IL-1, IL-1ra, IFN-γ e IL-6 y disminuyen niveles de IL-4 e IL-10; incrementando la expresión de neutrófilos, monocitos, CD8+, CD2+, DC26+,CD2+, células T HLA-DR+ y células B CD19+, eSelectina, ICAM-1 y vCAM158. Además inducen un cambio de respuesta immune de TH1 (celular) a TH2 (humoral)59. Se ha observado un aumento en valores de ICAM-1 y v-CAM-1 en adultos con eventos cardiovasculares seguidos durante períodos prolongados60, en tanto que los niveles aumentados de e-Selectina, pero no ICAM-1 o v-CAM-1, se asocian de manera independiente y robusta con factores de riesgo cardiovascular y ateroesclerosis aórtica61. Esto indica que e-Selectina se relaciona con la fase inicial, e ICAM-1 y v-CAM-1 con la fase final de aterosclerosis, reemplazando la cascada de eventos desencadenados por e-Selectina y v-CAM-1por un paso único a cargo de ICAM-162. La e-Selectina parece ser predominante en situaciones de estrés crónico, en tanto que se suma a ICAM-1 y vCAM1 en situaciones de estrés agudo sugiriendo diferentes modelos temporales de regulación. Los eventos iniciales en ateroesclerosis se asocian con la expresión de moléculas de adhesión en la superficie de células endoteliales, que a su vez son inhibidas por activación de receptores de proliferación de peroxisomas, limitado la inflamación crónica mediada por vCAM1 e ICAM-1, sin afectar los fenómenos de inflamación agudos mediados por e-Selectina y la aglutinación de leucocitos63. El mismo fenómeno de altos niveles de e-Selectina se asocia con situaciones de estrés crónico64. Dado que estas modificaciones pueden responden a múltiples desencadenantes, como factores de riesgo cardiovascular, artritis reumatoidea, trastornos endocrinos y metabólicos65, incluso hábitos de salud como tabaquismo, sedentarismo, consumo de alcohol y obesidad, además de edad y género66 se tuvo en cuenta aparear la muestra clínica por edad y género con controles sanos. Las limitaciones del estudio surgen de la muestra relativamente pequeña, la falta de valoración de la función endotelial por medios más precisos67, la falta de seguimiento longitudinal, y omisión de posibles factores de confusión derivados de comportamientos de riesgo no evaluados en el estudio (ej.: número de cigarrillos consumidos o ingesta de comidas con alto tenor de lípidos y sal), pero que podrían estar asociados con el comienzo de los síntomas de TEPT.
ConclusionesSe puede concluir del presente estudio que hay una relación continua entre la severidad de los síntomas de TEPT y los niveles plasmáticos de marcadores de disfunción endotelial. Este vínculo puede explicar la asociación entre la probabilidad de desarrollar enfermedades cardiovasculares y aterogénesis y los eventos traumáticos conducentes a desarrollar TEPT en el nivel de la respuesta vascular inflamatoria común. Son necesarios más estudios de tipo longitudinal para valorar el posible rol antecedente del evento traumático o TEPT en el desarrollo de patología cardiovascular, así como investigar la relación de los cambios neuro-hormonales como hiperactividad simpática adrenal, disfunción del eje hipotálamo-hipófiso-suprarrenal e hiper-cortisolemia en la disfunción endotelial de pacientes con TEPT, ya que estos factores neuroendocrinos podrían afectar la función endotelial de manera directa o indirecta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.