Determinar a ocorrência de sinais clínicos de disfagia em lactentes com bronquiolite viral aguda e comparar os parâmetros respiratórios entre as fases da deglutição, assim como realizar a concordância intra e interexaminadores da avaliação clínica da deglutição.
MétodosEstudo transversal, com 42 lactentes, entre zero e 12 meses. A avaliação clínica da deglutição foi acompanhada das medidas da frequência respiratória e oximetria de pulso. Foi elaborado um escore de alterações de deglutição para estabelecer associações com demais variáveis do estudo e, para a avaliação clínica, realizada a concordância intra e interexaminadores. Os cuidadores responderam a um questionário sobre dificuldades de alimentação. O nível de significância utilizado foi p<0,05.
ResultadosForam encontradas alterações na fase oral (pausas prolongadas) e faríngea (respiração ruidosa, tosse e engasgos) da deglutição. Houve aumento significativo da frequência respiratória entre o momento pré e pós-alimentação, e quase metade dos lactentes apresentou taquipneia. Observou-se associação entre o escore de alterações de deglutição e a queda de saturação de oxigênio. Os lactentes cujos cuidadores relataram dificuldades de alimentação durante a internação tiveram um número maior de alterações de deglutição na avaliação. A concordância intraexaminador foi considerada muito boa.
ConclusõesLactentes com bronquiolite viral aguda apresentaram alterações de deglutição, acrescidas de mudanças na frequência respiratória e nas medidas das taxas de saturação de oxigênio. Sugere-se, assim, risco para a disfagia.
To determine the occurrence of clinical signs of dysphagia in infants with acute viral bronchiolitis, to compare the respiratory parameters during deglutition, and to ensure the intra- and inter- examiners agreement, as well as to accomplish intra and interexaminators concordance of the clinical evaluation of the deglutition.
MethodsThis was a cross-sectional study of 42 infants aged 0-12 months. The clinical evaluation was accompanied by measurements of respiratory rate and pulse oximetry. A score of swallowing disorders was designed to establish associations with other studied variables and to ensure the intra- and interrater agreement of clinical feeding assessments. Caregivers also completed a questionnaire about feeding difficulties. Significance was set at p<0.05.
ResultsChanges in the oral phase (prolonged pauses) and pharyngeal phase (wheezing, coughing and gagging) of swallowing were found. A significant increase in respiratory rate between pre- and post-feeding times was found, and it was determined that almost half of the infants had tachypnea. An association was observed between the swallowing disorder scores and a decrease in oxygen saturation. Infants whose caregivers reported feeding difficulties during hospitalization stated a significantly greater number of changes in the swallowing evaluation. The intra-rater agreement was considered to be very good.
ConclusionsInfants with acute viral bronchiolitis displayed swallowing disorders in addition to changes in respiratory rate and measures of oxygen saturation. It is suggested, therefore, that infants displaying these risk factors have a higher probability of dysphagia.
A bronquiolite viral aguda (BVA) é uma doença infecciosa comum das vias aéreas inferiores que afeta principalmente lactentes com menos de um ano. A doença é caracterizada por uma inflamação difusa bronquiolar induzida pelo vírus sincicial respiratório (VSR), em 60–70% dos casos.1 Lactentes com BVA mostram uma grande variabilidade na gravidade da doença. Embora a prematuridade, as doenças cardíacas congênitas, a doença pulmonar crônica e as imunodeficiências sejam fatores de risco conhecidos,2 metade dos lactentes que necessita de internação em unidades de cuidados intensivos nasceu a termo e foi previamente saudável.3
O diagnóstico de BVA em geral é clínico, caracteriza-se por um primeiro episódio de sibilância em lactente, acompanhado de coriza, tosse e febre.2,4,5 À medida que a doença progride, podem aparecer taquipneia e sibilância, juntamente com dificuldade respiratória crescente e retração dos músculos respiratórios durante a inspiração.4,5 Na fase aguda, a bronquiolite é frequentemente associada com obstrução nasal, irritabilidade e problemas alimentares.6
Os distúrbios de deglutição em doenças respiratórias são uma complicação mais comum do que previamente reconhecido, sobretudo se associados à BVA.6–8 O risco de aspiração em lactentes com BVA tem sido relatado,6–8 mostrando a possível interferência do quadro respiratório no processo de deglutição. Um estudo pioneiro6 nesta temática, bastante citado na literatura, aponta a presença de penetração laríngea e aspiração traqueal em lactentes previamente hígidos e clinicamente estáveis, que apresentavam dificuldades de alimentação durante a internação. Em outro estudo,8 verificou-se a associação entre a aspiração traqueal e piora respiratória de lactentes com BVA.
A disfagia, ou distúrbio de deglutição, ocorre quando há problema em uma ou mais fases da deglutição, no transporte do bolo alimentar, e a falta de sincronia ou coordenação dessas fases pode levar à aspiração.9 A necessidade de coordenar a dificuldade respiratória com a deglutição demanda à criança uma adaptação ao complexo processo de deglutição.10 A hipótese é a de que os lactentes com BVA sofram uma deterioração, advinda de um comprometimento do quadro respiratório. Em consequência, podem apresentar risco para disfagia e aspirar, agravando a condição clínica.
O objetivo primário deste estudo foi determinar a ocorrência de sinais clínicos de disfagia em lactentes com BVA. Como objetivos secundários, comparar os parâmetros respiratórios entre as fases pré-alimentação, alimentação e pós-alimentação, assim como realizar a concordância intra e interexaminadores na avaliação da deglutição.
MétodoEntre julho e setembro de 2012, foram selecionados 42 lactentes com diagnóstico de BVA, menores do que 12 meses, internados no Hospital da Criança Santo Antônio. Foram prospectivamente incluídos lactentes que tivessem nascido a termo ou com idade gestacional igual ou superior a 34 semanas, previamente hígidos do ponto de vista respiratório e que estivessem recebendo dieta por via oral. Os critérios de exclusão foram diagnóstico ou investigação de problemas neurológicos, cardíacos e genéticos, presença de malformações craniofaciais, uso de procinéticos e antiácidos ou diagnóstico de refluxo gastroesofágico realizado por phmetria esofágica, necessidade de ventilação mecânica invasiva durante a internação, uso de sonda para alimentação e oxigenioterapia acima de um litro. Também foram excluídas as crianças com sinais de sedação ou em sono profundo no momento da avaliação fonoaudiológica, ou nas quais não foi possível a realização de todas as etapas da pesquisa.
A avaliação dos lactentes, respeitando os critérios acima estabelecidos, foi realizada em até 48 horas após a internação hospitalar. Inicialmente foram selecionados os lactentes com o diagnóstico clínico de BVA realizado pelo pediatra, considerando como marcadores o nível de saturação, a frequência e o esforço respiratórios.11 O diagnóstico de BVA foi confirmado pela técnica da imunofluorescência direta em secreção nasofaríngea e, quando necessário, pela realização da reação em cadeia de polimerase (polymerase chain reaction – PCR).
Os responsáveis pelos lactentes responderam a um questionário composto por perguntas fechadas, com informações sobre o histórico de saúde, comportamento alimentar prévio e atual, e a existência de suspeitas clínicas relacionadas aos critérios de exclusão. Na sequência, foi preenchido o protocolo de caracterização clínica, adaptado de um formulário comumente utilizado na área da disfagia,12 quando foram coletados dados sobre suporte ventilatório, saturação periférica de oxigênio (SpO2) e frequência respiratória (FR). A medida da SpO2 foi identificada numericamente nos períodos pré, peri e pós-alimentação por meio do oxímetro digital MiniScope II (Instramed, Porto Alegre, RS, Brasil). Considerou-se queda de saturação a redução maior do que 4% da linha de base após a oferta de via oral.13,14 A FR foi aferida nos momentos pré e pós-alimentação. Considerou-se aumento os valores ≥10%. Por fim, os valores também foram comparados aos indicados na literatura como taquipneia,15 considerando-se 60 mpm para lactentes de 0–60 dias e 50 mpm para os com ≥60 dias.
Antes da realização da avaliação clínica da deglutição (ACD), foi realizada a avaliação estrutural, no que se refere à morfologia das estruturas orais. Na ACD, o responsável foi orientado a alimentar a criança, por aleitamento materno ou alimentação artificial oferecida na mamadeira, na posição habitual. Quando necessário, a fórmula era preparada de acordo com a prescrição médica, na consistência líquida fina. As avaliações sempre foram realizadas nos horários habituais, com o intervalo entre as dietas de três horas. Nos casos de aleitamento materno, era solicitado o intervalo mínimo de duas horas após a última mamada.
Na fase oral da deglutição, foram identificados os parâmetros de manutenção do vedamento labial, a movimentação da língua e a perda de líquidos pelas comissuras labiais. O padrão de sucção foi analisado pelas categorias de presença, ritmo, ocorrência e extensão de pausas. O ritmo de sucção baseou-se na contagem de sucções e pausas, identificando a regularidade das pausas entre os blocos de sucção. Para a extensão de pausa, foi cronometrado o intervalo entre os blocos de sucções, sendo estipulado, para este estudo, o tempo ≥5 segundos como pausa longa. A coordenação sucção-deglutição-respiração (CSDR) ficou definida com base no equilíbrio entre a eficiência alimentar e as funções de sucção, deglutição e respiração, sem a presença de sinais de estresse. Na fase faríngea da deglutição, foram avaliados os parâmetros de presença de respiração ruidosa, engasgos, tosse, voz molhada e deglutições múltiplas durante a alimentação. Também foram identificadas as variações de coloração da pele e a ocorrência de batimento de asa de nariz, lacrimejamento e agitação. As deglutições múltiplas foram definidas como a presença de duas ou mais deglutições que ocorriam sem um período de respiração.
Ao fim da coleta, atribuiu-se um escore relacionando o número (%) de alterações de deglutição encontradas na ACD, variando de zero a seis sinais clínicos alterados. Baseando-se nos dados de literatura, foram selecionadas as seguintes alterações: ruído respiratório, tosse, engasgos, pausa alterada — seja como presença, seja como ausência, bem como sua extensão —, ritmo de sucção e CSDR. Os parâmetros tosse, engasgos e ruído respiratório são citados frequentemente como indicadores de risco de aspiração.16,17 Já os demais parâmetros caracterizam mais especificamente a relação respiração e deglutição no processo de alimentação. Com base nesse escore, foram determinadas as associações com as variáveis: idade, dias de internação, dificuldades de alimentação, uso de sonda e de oxigênio, tipo de alimento, taxa SpO2 e FR.
Também foi realizada a avaliação da concordância intra e interexaminadores. Para tanto, foi reduzido o protocolo inicial de avaliação clínica da deglutição, tendo como critério os itens passíveis de reprodução ao vídeo, como padrão de sucção nutritiva, movimentação da língua e dos lábios durante alimentação, avaliação da fase oral e faríngea da deglutição. Para avaliar a concordância intraexaminador, a pesquisadora preencheu o protocolo reduzido 30 dias após a coleta, a partir do vídeo realizado. Para a concordância interexaminadores, foi convidada uma fonoaudióloga experiente na área de disfagia infantil para realizar uma avaliação baseada apenas nos vídeos. A concordância foi analisada pelo coeficiente kappa, sendo a classificação da concordância descrita a seguir: <0,2 pobre, 0,21–0,40 fraca, 0,41–0,60 moderada, 0,61–0,80 boa e ≥0,81 muito boa.18
O estudo foi aprovado pelo Comitê de Ética e Pesquisa do Complexo Hospitalar Santa Casa, conforme o Parecer Consubstanciado n° 39.058, e todos os participantes tiveram o termo de consentimento livre e esclarecido assinado por seus responsáveis legais antes da avaliação.
O cálculo amostral foi realizado em relação ao número de alterações na deglutição, pois não foram encontradas referências que apresentassem a prevalência de sinais clínicos de disfagia nessa população, e sim aspiração e penetração, que não eram propriamente o desfecho avaliado. O cálculo amostral, considerando-se um nível de confiança de 95%, com correlação moderada entre as variáveis (≥0,5), indicou que seriam necessários pelo menos 38 crianças para alcançar um poder estatístico de 90%.19
Para a análise estatística dos dados obtidos, foi utilizado o software Statistical Package for Social Science (SPSS) v. 18.0 for Windows (PASW Statistics for Windows, Chicago, EUA). As variáveis quantitativas foram descritas por média e desvio padrão ou mediana e amplitude interquartílica, e as variáveis qualitativas foram descritas por frequências absolutas e relativas. Para comparar os valores da saturação, foi aplicada a Análise de Variância (ANOVA) para medidas repetidas com post-hoc de Bonferroni. Para os valores de FR, avaliada em dois momentos, usou-se o teste t-student para amostras pareadas. Para avaliar a associação entre as variáveis qualitativas, o teste qui-quadrado de Pearson. E, para comparar o número de alterações de deglutição entre grupos, o teste de Mann-Whitney. Nas análises de associação entre as variáveis contínuas e ordinais, aplicou-se o teste da correlação de Spearman. A concordância intra e interexaminadores foi avaliada pelo coeficiente kappa, e as diferenças entre os examinadores foram verificadas pelo teste qui-quadrado de McNemar. O nível de significância adotado foi 5% (p≤0,05).
ResultadosA amostra total consistiu de 174 lactentes, mas 132 preencheram os critérios de exclusão adotados neste estudo, totalizando uma amostra final de 42 lactentes. A mediana de idade dos lactentes foi 82 (p25=32; p75=156) dias; a do tempo de internação, 4 (p25=4; p75=5). Do total, 57,1% eram do gênero masculino. A pesquisa viral identificou, por meio da imunofluorescência direta, que 71,4% dos lactentes estavam infectados pelo VSR, e 7,15% pelos vírus parainfluenza 1, parainfluenza 2, parainfluenza 3 e adenovírus. O PCR não foi realizado em nenhum lactente.
Com base na entrevista com os cuidadores, foi identificado que 37 (88,1%) dos pacientes não tinham queixa de dificuldades prévias de alimentação. No entanto, em 36 (85,7%), os cuidadores relataram dificuldades de alimentação no período da internação hospitalar. Entre as principais dificuldades citadas, 24 (64,9%) referiram fadiga; 19 (45,2%), tosse; e 17, (40,5%) engasgos. Para o estudo, 27 (64,3%) pacientes foram alimentados em seio materno, e 15 (35,7%) receberam a dieta por mamadeira.
Os sinais clínicos identificados na ACD, relacionados à fase oral e faríngea da deglutição, estão apresentados na tabela 1. No momento da avaliação, 26 (60,5%) lactentes estavam com suporte ventilatório de até um litro de oxigênio. Houve diferença na taxa de SpO2 entre o momento pré e pós-alimentação, com queda da saturação no momento da alimentação. A FR aumentou significativamente o número de incursões respiratórias entre o momento pré e pós-alimentação, conforme a tabela 2. Também se percebe que quase metade dos lactentes estava com taquipneia nos momentos pré e pós-alimentação.
Avaliação da deglutição em 42 lactentes com bronquiolite viral aguda
| Variável | n(%) |
|---|---|
| Fase oral | |
| Sucção | |
| Adequada | 41 (97,6) |
| Alterada | 1 (2,4) |
| Ritmo | |
| Normal | 19 (45,2) |
| Alterado | 23 (54,8) |
| Coordenação sucção × respiração × deglutição | |
| Sim | 26 (61,9) |
| Não | 16 (38,1) |
| Escape de líquido | |
| Não | 33 (78,6) |
| Sim | 9 (21,4) |
| Presença de pausa respiratória | |
| Sim | 36 (85,7) |
| Não | 6 (14,3) |
| Extensão de pausa respiratória* | |
| Curta | 19 (52,8) |
| Longa | 17 (47,2) |
| Manutenção do vedamento labial | |
| Sim | 33 (78,6) |
| Não | 9 (21,4) |
| Movimento língua | |
| Adequado | 41 (97,6) |
| Alterado | 1 (2,4) |
| Fase faríngea | |
| Presença de ruído respiratório | |
| Não | 29 (69,0) |
| Sim | 13 (31,0) |
| Tosse | |
| Não | 29 (69,0) |
| Sim | 13 (31,0) |
| Voz molhada | |
| Não | 42 (100) |
| Sim | 0 (0,0) |
| Engasgo | |
| Não | 36 (85,7) |
| Sim | 6 (14,3) |
| Deglutições múltiplas | |
| Não | 42 (100) |
| Sim | 0(0,0) |
Sinais clínicos observados na avaliação fonoaudiólogica
| Saturaçãoa [média +DP] | |
| Pré-alimentação SpO2 | 95,9±3,0b |
| Alimentação SpO2 | 94,1±4,0a |
| Pós-alimentação SpO2 | 95,8±2,9b |
| Queda de saturação ≥4% [n(%)] | |
| Pré-alimentação × alimentação | 9 (21,4) |
| Alimentação × pós-alimentação | 2 (4,8) |
| Pré-alimentação × pós-alimentação | 2 (4,8) |
| FRd [média ± DP] | |
| Pré-alimentação | 52,2±9,4 |
| Pós-alimentação | 54,8±8,6 |
| Aumento da FR ≥10% [n(%)] | |
| Sim | 12 (28,6) |
| Não | 30 (71,4) |
| FR pré-alimentação [n(%)] | |
| Alteradoe | 20 (47,6) |
| Normal | 22 (52,4) |
| FR pós-alimentação [n(%)] | |
| Alteradoe | 19 (45,2) |
| Normal | 23 (54,8) |
SpO2, saturação periférica de oxigênio; SD, desvio padrão; RR, frequência respiratória
Com o escore proposto, verificou-se que 9 (21,4%) pacientes não apresentaram alterações na deglutição, e 33 (78,5%) tinham alterações que se distribuíram da seguinte forma: 7 (16,7%) com uma alteração, 8 (19%) com duas alterações, 6 (14,3%) com três alterações, 7 (16,7%) com quatro alterações e 5 (11,9%) com cinco alterações.
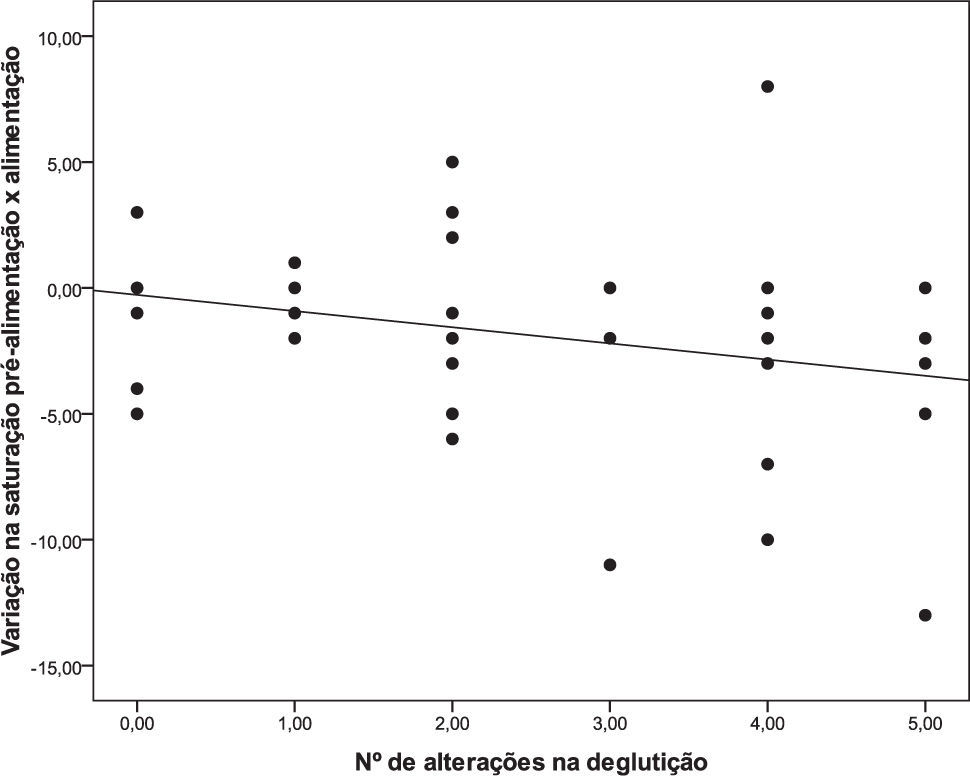
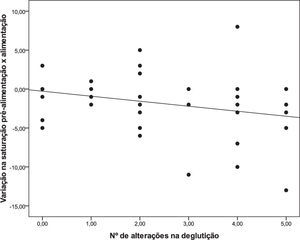
As associações entre o escore de alterações proposto no estudo com as variáveis analisadas estão apresentadas na tabela 3. Se observada a queda de SpO2 pelos valores numéricos, há associação significativa (rs=-0,305; p=0,050), ou seja, quanto maior o número de alterações de deglutição, maior a queda da saturação durante a alimentação (Figura 1). A associação do número de alterações de deglutição com o aumento da FR não foi significativa (rs=0,215; p=0,172).
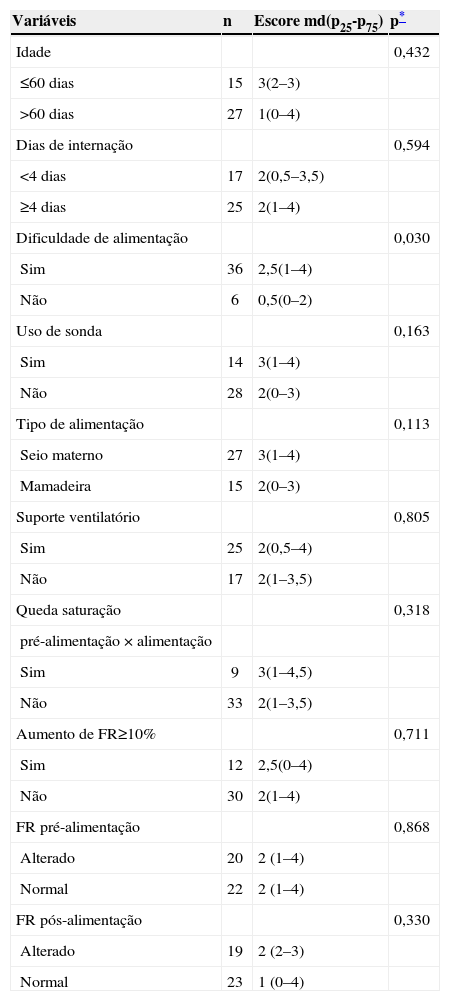
Associação das variáveis em estudo com o número de alterações de deglutição
| Variáveis | n | Escore md(p25-p75) | p* |
|---|---|---|---|
| Idade | 0,432 | ||
| ≤60 dias | 15 | 3(2–3) | |
| >60 dias | 27 | 1(0–4) | |
| Dias de internação | 0,594 | ||
| <4 dias | 17 | 2(0,5–3,5) | |
| ≥4 dias | 25 | 2(1–4) | |
| Dificuldade de alimentação | 0,030 | ||
| Sim | 36 | 2,5(1–4) | |
| Não | 6 | 0,5(0–2) | |
| Uso de sonda | 0,163 | ||
| Sim | 14 | 3(1–4) | |
| Não | 28 | 2(0–3) | |
| Tipo de alimentação | 0,113 | ||
| Seio materno | 27 | 3(1–4) | |
| Mamadeira | 15 | 2(0–3) | |
| Suporte ventilatório | 0,805 | ||
| Sim | 25 | 2(0,5–4) | |
| Não | 17 | 2(1–3,5) | |
| Queda saturação | 0,318 | ||
| pré-alimentação × alimentação | |||
| Sim | 9 | 3(1–4,5) | |
| Não | 33 | 2(1–3,5) | |
| Aumento de FR≥10% | 0,711 | ||
| Sim | 12 | 2,5(0–4) | |
| Não | 30 | 2(1–4) | |
| FR pré-alimentação | 0,868 | ||
| Alterado | 20 | 2 (1–4) | |
| Normal | 22 | 2 (1–4) | |
| FR pós-alimentação | 0,330 | ||
| Alterado | 19 | 2 (2–3) | |
| Normal | 23 | 1 (0–4) |
FR, frequência respiratória; md, mediana; p25-p75, percentil;
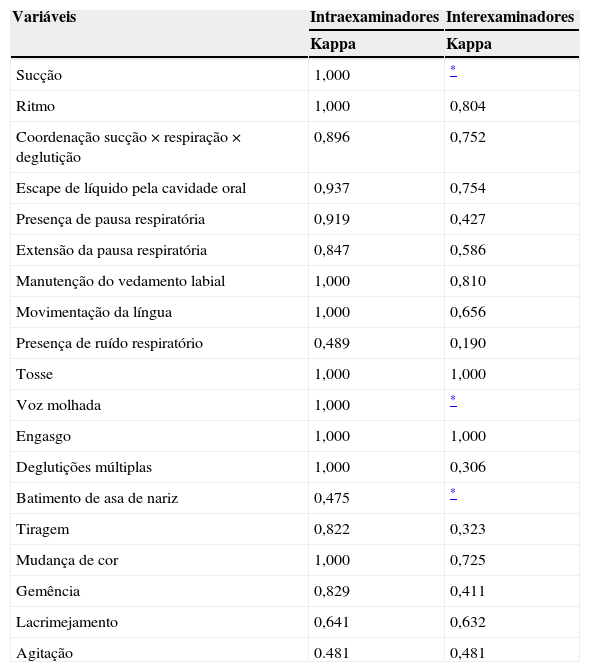
Especificamente em relação à concordância (tabela 4), não houve diferença significativa entre as duas avaliações do mesmo observador (p>0,05), sendo a concordância intraexaminador muito boa em 15 (78,9%) itens. Quanto à concordância interexaminadores, houve diferença significativa entre os dois avaliadores quanto a cinco itens, conforme se visualiza na tabela 4.
Concordância intra e interexaminadores
| Variáveis | Intraexaminadores | Interexaminadores |
|---|---|---|
| Kappa | Kappa | |
| Sucção | 1,000 | * |
| Ritmo | 1,000 | 0,804 |
| Coordenação sucção × respiração × deglutição | 0,896 | 0,752 |
| Escape de líquido pela cavidade oral | 0,937 | 0,754 |
| Presença de pausa respiratória | 0,919 | 0,427 |
| Extensão da pausa respiratória | 0,847 | 0,586 |
| Manutenção do vedamento labial | 1,000 | 0,810 |
| Movimentação da língua | 1,000 | 0,656 |
| Presença de ruído respiratório | 0,489 | 0,190 |
| Tosse | 1,000 | 1,000 |
| Voz molhada | 1,000 | * |
| Engasgo | 1,000 | 1,000 |
| Deglutições múltiplas | 1,000 | 0,306 |
| Batimento de asa de nariz | 0,475 | * |
| Tiragem | 0,822 | 0,323 |
| Mudança de cor | 1,000 | 0,725 |
| Gemência | 0,829 | 0,411 |
| Lacrimejamento | 0,641 | 0,632 |
| Agitação | 0.481 | 0,481 |
Os dados deste estudo contribuem para o conhecimento atual, na medida em que se demonstrou que alterações de deglutição, nas diversas fases, estão presentes nos lactentes com BVA, associando os dados de alimentação aos aspectos respiratórios. Além disso, deve-se ressaltar que, se há risco para disfagia nesses pacientes, consequentemente pode haver aspiração, o que comprometeria o aspecto pulmonar.
A partir da ACD, observou-se que os lactentes com BVA apresentaram alterações nas fases oral e faríngea da deglutição durante o período da internação hospitalar. O aumento da FR, a necessidade de oxigenioterapia e a fadiga na alimentação interferiram na deglutição. Apesar dos estudos que abordam o risco de aspiração em lactentes com BVA6–8 terem utilizado formas de investigação para a aspiração diferentes das da ACD, os resultados vão de encontro aos achados desta pesquisa.
Neste trabalho, apesar de determinados aspectos da avaliação da fase oral da deglutição estarem preservados, como o padrão de sucção e a movimentação de língua, foram encontradas dificuldades de deglutição, em especial, na relação com a respiração. As variáveis de ritmo e CSDR apresentaram alterações na avaliação de alguns lactentes. Entretanto, no item extensão das pausas durante as sucções, observaram-se pausas prolongadas em quase metade da amostra. Esses achados são corroborados por outra pesquisa10 que compara a alimentação de lactentes com BVA a um grupo controle de lactentes saudáveis e não encontrou diferenças significativas em relação ao número de sucções por grupo, mas percebeu maior período de descanso entre as sucções. Os dados sugerem que, à medida que o esforço respiratório aumenta, modifica-se a sequência de deglutição seguida por inspiração ou apneia, aumentando o risco de aspiração. O evento apneia nos lactentes infectados pelo VSR muitas vezes dura mais do que 30 segundos — quando, além da apneia central, típica do momento da deglutição, ocorre uma apneia obstrutiva, gerando uma série de deglutições ou ocasionalmente tosse. Outro aspecto a ser destacado é que o padrão de pausas longas, intercaladas por poucas sucções, pode supor imaturidade ou fadiga, decorrente de condições clínicas específicas.12 A fadiga foi relatada pelos cuidadores como o sintoma mais percebido de disfagia e pode gerar risco de aspiração na fase de deglutição durante a alimentação.20
Quanto aos resultados referentes à fase faríngea da deglutição, observou-se a ocorrência de respiração ruidosa, tosse e engasgos em parte da amostra, que são referenciados pela literatura como sinais de risco de aspiração.16,20–22
Outro estudo examinou a ocorrência de marcadores clínicos sugestivos de distúrbios de deglutição em lactentes, comparando aos achados visualisados na videofluoroscopia da deglutição. Tosse, voz molhada e respiração ruidosa obtiveram associação significativa com aspiração em líquidos finos, sendo considerados bons marcadores clínicos para aspiração em lactentes. Além deles, a dessaturação foi identificada como marcador, em especial em menores de 12 meses, tendo em vista que os lactentes estão mais propensos à aspiração silenciosa. Dessa forma, a tosse é um indicador menos confiável de aspiração em lactentes jovens.23
Considerando que a ACD e a utilização dos sinais clínicos são conhecidas por terem baixa confiabilidade na detecção de aspiração21 comparadas à avaliação objetiva da deglutição, enfatiza-se que este ainda é o método mais acessível ao cotidiano do ambiente hospitalar. Após a ocorrência de determinados sinais e sintomas no momento da alimentação, o fonoaudiólogo é capaz de fazer inferências sobre o risco de aspiração. Baseando-se no exposto acima e com o intuito de tornar a ACD mais mensurável, o fonoaudiólogo tem se munido da observação de sinais vitais, como a frequência respiratória e medidas da taxa de saturação de oxigênio. O uso da oximetria de pulso como recurso para avaliação da disfagia tem sido amplamente debatido. Estudo recente24 apresenta resultados preliminares sugestivos de que a média de dessaturações pode discriminar moderadamente lactentes com e sem disfagia, exercendo papel complementar na ACD. No presente trabalho, houve significativa queda de saturação durante alimentação e recuperação após a interrupção da via oral. Já na associação com o escore de alterações, verificou-se que os lactentes com dessaturação no momento da alimentação apresentaram mais alterações de deglutição. A FR, por sua vez, não tem sido citada regularmente nos protocolos de avaliação da deglutição por fonoaudiólogos. Na literatura,25 quando a FR excede 60–70 mpm nos casos de BVA, a segurança alimentar pode estar comprometida, e, por isso, recomenda-se a oferta de fluidos intravenosos. O aumento da FR, a modificação nos tempos de inspiração e expiração e a diminuição do tempo de apneia para a deglutição elevam consideravelmente a possibilidade de aspiração.13,26
Os lactentes cujos cuidadores relataram dificuldades de alimentação durante a internação tiveram um número maior de alterações de deglutição na avaliação. O primeiro passo da avaliação fonoaudiológica é a realização de uma anamnese sobre as questões de alimentação.12 Assim, reforça-se a necessidade de as equipes de saúde prestarem atenção especial ao realizar os questionamentos sobre alimentação para os cuidadores de lactentes internados com BVA. O relato das mães pode sinalizar a possibilidade de risco para aspiração e a necessidade da avaliação específica de deglutição.
A ACD é perceptual e, portanto, envolve observação de sinais clínicos e parâmetros fisiológicos.13 Alguns desses sinais são passíveis de reprodutibilidade, enquanto outros sofrem interferências de fatores externos e do próprio sujeito a ser avaliado — neste caso, lactentes. Diante do exposto, os achados da concordância intraobservador foram muito bons; entretanto, a concordância interobservador demonstrou as limitações da reprodução em vídeo de alguns sinais clínicos, como deglutição múltipla, tiragem e ruído respiratório.
Algumas limitações podem ser observadas neste estudo. As ACD tendem a ser influenciadas pela subjetividade do examinador e foram controladas parcialmente com a definição de variáveis e escore de alterações, assim como com a concordância. Ressalte-se que os achados deste estudo abrangem uma pequena parcela dos casos com BVA mais graves, atendidos num hospital terciário. Foi necessário estabelecer um número expressivo de critérios de exclusão, o que limitou o tamanho da amostra.
Face aos resultados apresentados e discutidos, conclui-se ser importante a atenção à alimentação na avaliação clínica da equipe médica e sugere-se a solicitação de avaliação específica de deglutição, realizada pelo fonoaudiólogo, nos casos em que se observam maiores chances de aspiração. A criação de protocolos para o manejo da alimentação durante a BVA merece discussão cuidadosa. Com base na avaliação clínica fonoaudiológica foram encontradas alterações na fase oral (pausas prolongadas) e faríngea (respiração ruidosa, tosse e engasgos) da deglutição. Houve aumento significativo da frequência respiratória entre o momento pré e pós-alimentação, e quase metade dos lactentes apresentou taquipneia. Observou-se associação entre o escore de alterações de deglutição e a queda de saturação de oxigênio. Os lactentes cujos cuidadores relataram dificuldades de alimentação durante a internação tiverasm um número significativamente maior de alterações de deglutição na avaliação. Houve uma concordância muito boa intraexaminadores na maioria dos itens.
Os autores declaram não haver conflitos de interesse.
Estudo conduzido no Programa de Pós-Graduação em Ciências Pneumológicas, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.