Objetivo: Analizar la concentración de la molécula de fosfato ν1 en el esmalte dental por medio de espectroscopia Raman luego de la aplicación de blanqueamiento dental a diferentes concentraciones. Metodología: Se seleccionaron 30 piezas dentales, libres de caries y pigmentaciones recién extraídas en seres humanos. Se obtuvieron espectros Raman de cada pieza dental previo a la aplicación de agentes blanqueadores. Los especímenes se separaron en tres grupos experimentales según la concentración del blanqueamiento de activación química a utilizar (Day White®, Discus Dental). Grupo y grupo 3: 38% peróxido de carbamida. Se midió la concentración dea molécula de fosfato ν1 en el esmalte dental previo a la aplicación y a la segunda y cuarta semana de blanqueamiento por medio de espectroscopia Raman. Se realizó el análisis de varianza ANOVA para mediciones repetitivas (p ≤ 0.05). Resultados: Se observó una reducción en la concentración de la molécula de fosfato ν1 durante y al finalizar el proceso de blanqueamiento en los grupos experimentales 2 y 3 (p ≤ 0.05). El grupo 1 no mostró una reducción estadísticamente significativa. Conclusiones: Dentro de las limitaciones de este estudio es posible concluir que el agente blanqueador causó una pérdida de concentración de la molécula fosfato ν1. Dicha pérdida fue mayor en los blanqueamientos de mayor concentración.
Objective: To analyze concentration of phosphate ν1 molecule in dental enamel by means of Raman spectroscopy after applying dental bleaching materials at different concentrations. Methodology: 30 recently extracted human teeth were selected. Teeth were free of caries and pigmentations. Raman specters were obtained from each tooth before application of bleaching agents. Specimens were divided into three experimental groups according to the chemical activation of the used bleaching material concentration (Day White®, Discus Dental). Group 1: 9.5% hydrogen peroxide, group 2: 14% hydrogen peroxide, and group 3: 38%hydrogen peroxide. With a Raman spectroscope ν1 phosphate molecule concentration was measured in the dental enamel before application as well as at second and fourth week of bleaching procedure. For repetitive measurements (p ≤ 0.05) ANOVA variance analysis was conducted. Results: In experimental groups 2 and 3 (p ≤ 0.05), a decrease in concentration of phosphate ν1 molecule was observed during treatment execution and at treatment completion group 1 did not reveal statistically significant reduction. Conclusions: Within the limitations inherent to the present study, it was possible to conclude that the bleaching agent caused loss of concentration of the phosphate ν1 molecule. This loss was greater in higher concentration bleaching procedures.
En la actualidad se utilizan diferentes tratamientos de superficie para modificar y mejorar las propiedades ópticas y microestructurales de las piezas dentales, tales como los blanqueamientos dentales, tratamientos remineralizantes y ácidos para mejorar la adhesión. En la literatura se pueden encontrar publicaciones donde se describen los efectos de estos tratamientos sobre la dureza superficial, cambios estructurales, coloración y adhesión a materiales restauradores.1–6 Sin embargo, no se encuentran muchos estudios acerca de los efectos a nivel molecular, aspecto que permitiría un conocimiento más profundo y una descripción más completa del comportamiento clínico de estos materiales.
Un método no destructivo para analizar la composición molecular es la espectroscopia Raman. Este método es ideal para analizar el tejido superficial inorgánico (por ejemplo, la concentración de moléculas de fosfato y carbonato) ya que es posible obtener información de los minerales presentes por medio de la observación de sus energías características de sus modos vibracionales.7,8 Como es bien conocido, es posible excitar moléculas (e. g. usando radiación electromagnética de un láser), las cuales absorben y emiten parte de esta energía, la cual es fácilmente medible con fotodetectores comerciales. Una descripción simple para entender la espectroscopia Raman se puede hacer al observar los distintos tipos de dispersión que ocurren cuando la radiación electromagnética interactúa con las moléculas. Una opción es que la energía que transporta la radiación electromagnética, o la energía del fotón, sea igual antes y después de la colisión con la molécula, este caso se conoce como dispersión elástica o Rayleigh. El caso cuando se observa una variación entre la energía inicial y final del fotón después de la interacción con la molécula es llamado dispersión inelástica o Raman. A nivel atómico, la probabilidad de que suceda la dispersión Raman es mucho menor que la dispersión de tipo Rayleigh, aproximadamente 109 veces menor. Este valor es equivalente a la diferencia que hay si se compara la altura promedio de un ser humano con respecto al radio del sol. La dispersión Raman o emisión de radiación energética de estas moléculas, se lleva a cabo en la región del espectro electromagnético conocido como espectro infrarrojo cercano. Así mismo, las moléculas superficiales presentes en estructuras dentales pueden ser caracterizadas a partir de su espectro de emisión en la región del infrarrojo cercano, conocido como espectros vibracionales. La espectroscopia Raman presenta ventajas tales como: 1) preparación sencilla de la muestra; 2) análisis simple de banda y espectral, 3) respuesta lineal a concentraciones minerales y químicas, 4) análisis de muestras sin ningún daño, 5) alta sensibilidad a cambios pequeños de estructura y 6) es posible escoger qué tanta cantidad de la muestra se está analizando. Además, al ser un método no des-tructivo (pues el espécimen no se debe modifi car cada vez que va a ser analizado), las muestras pueden ser analizadas antes y después de un tratamiento, con lo cual cada espécimen puede funcionar como su propio control.8,9
Debido a las características mencionadas anterior-mente, la espectroscopia Raman es entonces una técnica idónea para investigar el efecto de los blanqueamientos dentales a base de peróxido de hidrógeno. El blanqueamiento dental, tanto casero como de oficina, se promueve como un tratamiento conservador y de pocos efectos secundarios.10 No obstante, pocas investigaciones han analizado los cambios en el esmalte a nivel molecular y los que lo han hecho presentan resultados muy antagónicos. Algunos de los investigadores indican que la concentración de la molécula de fosfato disminuye luego de la aplicación del blanqueamiento,11–13 otros estudios sugieren que la concentración molecular permanece inalterada.1,14–17 Sin embargo, como se mencionó antes, la literatura sobre el tema es escasa y las investigaciones presentan irregularidades en el método espectroscópico aplicado tales como el uso del silicio como patrón de referencia,18 el cual se encuentra lejano en el ámbito de energía de trabajo en comparación con la molécula observada. Además, hay estudios que estiman la concentración de la molécula de fosfato en la pieza dental como la altura máxima de la curva observada en el espectro (intensidad del pico) en la espectroscopia Raman,1,12 siendo la forma correcta de estimar una concentración de las moléculas presentes como el área debajo de la curva medida con el espectrómetro.
Constantemente se anuncian nuevos productos comerciales en el mercado, con una promesa de disminuir la sensibilidad dental, acelerar el proceso de blanqueamiento con diferentes concentraciones y menores tiempos de aplicación. Por otro lado, si se considera la decoloración dental, existe una creciente demanda de los tratamientos para mejorar el color de los mismos. La Academia Americana de Odontología Cosmética (American Academy of Cosmetic Dentistry) ha reportado que los procedimientos de blanqueamiento dental han incrementado en un poco más del 300% entre el 2002 y el 2007 y que los números siguen creciendo alrededor de un 25% anual.19 Por lo anterior, el blanqueamiento es un procedimiento común muy solicitado por los pacientes. Es así que el análisis molecular del esmalte dental luego de estos tratamientos es un terreno fértil para la investigación en la odontología. El objetivo de nuestra investigación es analizar los cambios en la concentración de la molécula de fosfato ν1 luego del proceso de blanqueamiento con tres agentes blanqueadores de diferente concentración, de una misma casa comercial, por medio de la espectroscopia Raman.
MATERIAL Y MÉTODOSSelección y preparación de la muestraSe utilizaron 30 piezas dentales extraídas, libres de pigmentaciones y caries. De ser necesario se eliminó todo el cálculo presente por medio de un tratamiento de las piezas con el baño ultrasónico. Todos los especímenes fueron sometidos a una profilaxis con piedra pómez para eliminar impurezas.
Los dientes fueron divididos aleatoriamente en tres grupos de 10 piezas cada uno. El área de trabajo en cada espécimen fue la porción más convexa en el tercio medio vestibular. Esta área se marcó con dos líneas con el fin de aplicar el gel blanqueador siempre en la misma parte y para facilitar la ubicación del área con el láser utilizado en el espectrómetro Raman al momento de las mediciones (Figura 1). Una vez seleccionadas y marcadas las piezas dentales se almacenaron en agua destilada a una temperatura de aproximadamente 32°C.
Proceso de blanqueamientoEl blanqueamiento se realizó utilizando el gel blanqueador de la marca Day White® a tres diferentes concentraciones. En el cuadro I se muestran los materiales utilizados y sus diferentes características para los grupos experimentales investigados.
Características de los grupos de blanqueamientos utilizados
| Grupo | Producto | Composición | Lote número |
|---|---|---|---|
| 1 | Day White® | Peróxido de hidrógeno 9.5% | 14150012 |
| 2 | Day White® | Peróxido de hidrógeno 14% | 14043020 |
| 3 | Day White® | Peróxido de carbamida 38% (correspondiente a 13.3% de peróxido de hidrógeno) | 14150024 |
Las muestras se blanquearon dos veces al día siguiendo las instrucciones del fabricante, siendo cada aplicación de 30 minutos. La primera aplicación se realizó a las 07:00 horas y la segunda aplicación a las 16:00 horas. Se continuó con este procedimiento durante 28 días consecutivos. Rutinariamente, antes de cada aplicación del gel, se retiraron manualmente los excesos de las jeringas blanqueadoras, con el fin de eliminar el producto químico inactivo.
El gel blanqueador se aplicó en la superficie previamente marcada y se dejó actuar en ella por 30 minutos. Luego, las muestras se lavaron con abundante agua destilada y se almacenaron en agua destilada a 32 oC en tres cajas debidamente rotuladas.
Obtención de la espectroscopia RamanPara la medición de los espectros Raman, se utilizó un espectrómetro comercial tipo Raman con focal (marca: WiTec, modelo: Alpha 300 R) equipado con un láser cuya longitud de onda es de 785nm. La potencia utilizada para la obtención de espectros fue de aproximadamente 100 mW. El diámetro del láser utilizado fue de aproximadamente 50μm. Estos valores fueron verificados periódicamente para corregir las variaciones debidas a las fluctuaciones de la fuente láser y de la fibra óptica para no irradiar el espécimen con mayor intensidad, i. e., potencia por unidad de área. Antes de realizar la medición con el espectrómetro se secaron los especímenes para evitar la fluorescencia que las moléculas de agua pudieran generar al interactuar con la radiación del láser. Luego cada pieza se colocó en un portamuestras y se adosó al mismo por medio de pasta moldeable de arcilla plástica (Figura 2).
A cada muestra se le realizaron mediciones con el espectrómetro Raman antes de la aplicación del gel blanqueador. Esta medición se denominó medida control para que cada muestra sea por sí misma su propia referencia. Luego, las mediciones con el espectrómetro se llevaron a cabo en la segunda y cuarta semana de blanqueamiento continuo. El espectro Raman del espécimen fue adquirido mediante la irradiación con láser de la superficie coronal del diente previamente marcada. Típicamente en el espectro se observa un pico cercano a 0cm-1, el cual corresponde a la energía dispersada de forma elástica, i. e. Rayleigh. Además, otro pico que es intenso en el espectro obtenido es el correspondiente a la molécula de fosfato ν1. Además, se observan otros picos con menor intensidad característicos de la molécula de fosfato ν2, ν3 y ν4, en conjunto con el carbonato. En esta investigación se analizó únicamente el pico proveniente de la molécula de fosfato ν1, para así determinar su concentración a lo largo de las cuatro semanas de blanqueamiento continuo. Para cada espectro que se obtuvo de un espécimen se llevaron a cabo 100 mediciones (un total de 100 acumulaciones) en el mismo punto con un tiempo de integración de 0.5 s cada acumulación. Lo anterior con el fin de aumentar la señal Raman obtenida de la molécula de fosfato y disminuir el ruido derivado de fluctuaciones del láser y el detector. También, después de obtener el espectro Raman de cada pieza, se llevó a cabo otra medición con la misma cantidad de acumulaciones y tiempo de integración pero sin radiación láser. Esto con el fin de substraer matemáticamente estos dos espectros y obtener la señal producida únicamente de la interacción del láser con la molécula a investigar.
Cada espectro obtenido de una muestra fue importado al software PeakFit® (Systat Software Inc.), el cual permite graficar el espectro Raman de cada muestra y además permite obtener, con mucha precisión, los valores de energía (eje «x») e intensidad (eje «y») para cada pico espectral por medio de ajustes (línea base, tipo de picos: gaussianos o lorentzianos, suavizado, eliminación de puntos solos, etc.) a los espectros. Los datos obtenidos con el software PeakFit® (energía, intensidad, área bajo la curva) para cada muestra fueron almacenados semanalmente al igual que el gráfico del espectro Raman correspondiente a cada muestra. Cabe recalcar que para cada pico se calculó, además, el área bajo la curva, lo cual refleja de una manera objetiva la intensidad de la señal de la molécula analizada.
Análisis estadísticoPrevio a la realización del análisis estadístico se aplicó una normalización con el pico tipo Rayleigh obtenido de los valores medidos del espectro Raman para cada molécula de cada espécimen. Esto se hizo con el fin de neutralizar la posible variabilidad del equipo de medición a lo largo del tiempo y posibles fl uctuaciones de potencia de la fuente láser.
Con ayuda del programa SPSS® v19 (IBM Software) se llevó a cabo la estadística descriptiva para la muestra, así como un análisis de varianza para mediciones repetitivas. Este análisis de varianza se realizó para detectar cualquier tipo de diferencia estadísticamente significativa entre los grupos experimentales (grupo 1, grupo 2 y grupo 3) y entre las diferentes semanas del blanqueamiento aplicado según cada grupo experimental. Previo a los análisis de varianza se realizó el test Mauchly de esfericidad con el fin de corroborar si los datos recolectados a través del análisis con el software PeakFit® de los espectros Raman cumplían con las condiciones necesarias para poder llevar a cabo el análisis estadístico ANOVA.
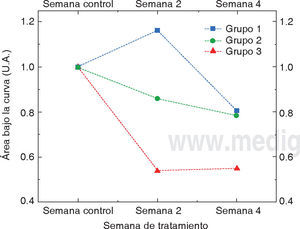
RESULTADOSLa figura 3 nos muestra el comportamiento de la concentración de la molécula de fosfato ν1 previo (semana control) y a lo largo de las semanas de blanqueamiento (semana 2 y semana 4). Para una mejor visualización de los resultados, los datos fueron normalizados con respecto a su concentración inicial de la semana control. Cada punto del gráfi co corresponde al promedio de los diez especímenes de cada grupo experimental.
Se puede observar a partir del gráfico anterior que tanto el segundo como el tercer grupo experimental presentan una disminución de la molécula estudiada a lo largo de todas las semanas de tratamiento. Cabe destacar que el tercer grupo experimental tiene el descenso más pronunciado entre la segunda semana de tratamiento y que esta disminución se estabiliza para la semana cuatro del tratamiento. En comparación con el grupo 3, el grupo 2 tiene un descenso en la concentración de la molécula de fosfato con una pendiente menos pronunciada. A diferencia de lo anterior, el grupo 1 es el único que presenta un aumento de la molécula de fosfato a la mitad del tiempo de tratamiento investigado. Nótese a su vez que los grupos 1 y 2 llegan a una pérdida de la molécula de fosfato similar a la semana cuatro del tratamiento. Entonces, a partir del gráfico anterior, se puede inferir que los grupos experimentales 1 y 2 pierden aproximadamente 20% de la molécula de fosfato y el grupo 3 pierde aproximadamente 50%.
El cuadro II presenta el análisis de varianza general para los valores de concentración de la molécula de fosfato ν1.
En la fila «prepost» del cuadro II se analiza si hay una diferencia estadísticamente significativa (a un nivel de significancia del 95%) en la concentración de la molécula de fosfato ν1 antes y durante el blanqueamiento. El nivel de significancia nos indica que sí hay una diferencia significativa entre las tres semanas de medición.
En la fila «prepost grupo» se analiza si hay una interacción entre el grupo experimental y la semana de tratamiento, es decir, si la concentración de la molécula fosfato ν1 cambia de forma diferente depende de si pertenece al grupo experimental 1, 2 o 3. El resultado indica que sí hay una interacción, es decir, que según el grupo experimental al que se pertenezca, así va a disminuir la concentración de la molécula.
Se procedió a realizar una prueba post hoc de Bonferroni (Cuadro III) según cada grupo experimental para observar entre cuáles semanas de medición hubo una diferencia estadísticamente significativa. En esta tabla se puede observar que en el grupo 1 no hay una variación significativa de la concentración de la molécula ν1 de fosfato a lo largo de las cuatro semanas de tratamiento. En el grupo 2 se observa una diferencia entre la semana control y la última semana de tratamiento, no así con la segunda semana de tratamiento. El grupo experimental 3 refleja una diferencia significativa entre la semana control respecto a la segunda y cuarta semana de tratamiento, pero no entre la segunda semana y la cuarta.
Prueba post hoc: comparaciones pareadas de semanas de tratamiento según el grupo experimental
| Grupo | (I) Prepost | (J) Prepost | Diferencia de medias (I-J) | Sig.aa | 95% Intervalo de confianza | |
|---|---|---|---|---|---|---|
| Límite inferior | Límite superior | |||||
| 1 | Control | Sem. 2 | -57,782 | 1,000 | -335,367 | 219,804 |
| Sem. 4 | 69,067 | 0,959 | -123,314 | 261,448 | ||
| Semana 2 | Sem. 4 | 126,848 | 0,266 | -68,023 | 321,720 | |
| 2 | Control | Sem. 2 | 76,286 | 0,265 | -40,855 | 193,427 |
| Sem. 4 | 117,563* | 0,047 | 1,489 | 233,637 | ||
| Semana 2 | Sem. 4 | 41,277 | 1,000 | -86,691 | 169,244 | |
| 3 | Control | Sem. 2 | 288,324* | 0,005 | 98,003 | 478,646 |
| Sem. 4 | 281,252* | 0,019 | 48,639 | 513,866 | ||
| Semana 2 | Sem. 4 | -7,072 | 1,000 | -210,809 | 196,665 | |
a Ajuste para comparaciones múltiples de Bonferroni.
* p ≤ 0.05
El principal componente mineral del esmalte es la hidroxiapatita, cuya fórmula básica es Ca10(PO4)6(OH)2 algunos otros iones como fluoruro usualmente están incorporados en el cristal. La disolución del esmalte en ácido ocurre como resultado de la interacción de los iones de hidrógeno y la hidroxiapatita como se muestra a continuación en la ecuación balanceada:
Por lo anterior, la cuantificación de la concentración del grupo fosfato en la hidroxiapatita por medio de espectroscopia Raman es un buen indicador del grado de mineralización del esmalte dental.11,13
Estudios previos han utilizado la intensidad del pico máximo dada en unidades arbitrarias y el valor del ancho a la mitad del pico máximo para la comparación de las mediciones. Sin embargo, en el presente estudio se utilizó el área total bajo la curva para realizar los análisis cuantitativos del fosfato dental ya que según Gilchrist20éste es el método de comparación más exacto porque excluye el fondo del espectro producido por la luz incidente y la oscuridad proveniente del detector CCD y, por lo tanto, se mide sólo la señal producida por la excitación de la molécula de fosfato ν1 que es directamente proporcional a la concentración del grupo total de fosfato dentro de la molécula de hidroxiapatita y por lo tanto puede ser utilizada para analizar los cambios en la concentración de este mineral cuando el esmalte dental es sometido a agentes blanqueadores en diferentes concentraciones.11
Los resultados de nuestro estudio demostraron que en el grupo de dientes blanqueados con peróxido de hidrógeno al 9.5% (grupo experimental 1) no hubo diferencia estadísticamente significativa entre la banda de fosfato ν1 evaluada previo a la aplicación del gel de blanqueamiento, y la banda de fosfato ν1 obtenida después de cuatro semanas de tratamiento. Sin embargo, parece importante resaltar que aunque estadísticamente no es significativo, la concentración del grupo fosfato tuvo una variación en las primeras dos semanas de blanqueamiento en las cuales se notó un leve aumento (aproximadamente 20%) en la medición de la molécula en estudio. Este aumento se puede atribuir a la composición química del gel blanqueador Day White® ACP(amorphous calcium phosphate, fosfato de calcio amorfo), ya que algunas investigaciones21 han demostrado que el uso de ACP tiene el potencial para rellenar defectos superficiales del esmalte dental con iones minerales similares a los que están presentes en esta estructura del diente, tales como calcio y fosfato. Es posible que después de las semanas iniciales de blanqueamiento el fosfato brindado por el ACP no sea suficiente para restablecer la concentración de la molécula perdida, evidenciándose en una disminución en la banda de fosfato ν1 para el grupo experimental 1. Para los grupos experimentales 2 y 3, en los cuales la pérdida de la molécula de fosfato ν1 fue estadísticamente significativa, este aumento inicial de fosfato no se obtuvo, probablemente porque desde el inicio del blanqueamiento a una mayor concentración de peróxido de hidrógeno fue mayor la cantidad de fosfato perdida que la brindada por el ACP de los geles blanqueadores.
La pérdida de concentración de la molécula fosfato ν1 en el grupo experimental 2, en el cual se utilizó peróxido de hidrógeno al 14%, fue estadísticamente significativa y se puede decir que mostró un patrón de disminución uniforme o constante a lo largo de las cuatro semanas de blanqueamiento; sin embargo, el grupo experimental 3, sometido a peróxido de carbamida al 38%, el cual según el fabricante es equivalente a 14% de peróxido de hidrogeno, mostró de la misma manera una disminución significativa (aproximadamente 50%) del fosfato al fi nal del tratamiento.
Es importante notar que la disminución en el grupo experimental 3 en las primeras dos semanas fue más drástica que la obtenida para este mismo tiempo en el grupo experimental 2, esto podría justificarse con lo mencionado en otra investigación22 donde se indica que aunque el resultado final es equivalente, los especímenes sometidos a peróxido de carbamida presentan un efecto más acelerado en comparación a los tratados con peróxido de hidrógeno. Lo anterior fue observado, también por otras investigaciones,6,23,24 en donde se menciona que en el mecanismo de blanqueamiento dental del peróxido de carbamida se divide el compuesto en dos componentes: urea y peróxido de hidrógeno. La urea tiene la habilidad de desnaturalizar las proteínas presentes en la porción orgánica de la estructura dental con el potencial de penetrar y afectar no solamente el esmalte dental superficial sino que también la porción prismática. Por lo tanto, la penetración de la urea podría contribuir a una permeabilidad incrementada en el esmalte y en consecuencia cambios microestructurales más acelerados (como el observado en la figura 3 para el grupo experimental 3. Además de la urea, se ha reportado que el oxígeno liberado del peróxido de carbamida también es capaz de incrementar la porosidad del esmalte dental.24 En los estudios anteriores no se concluye que el efecto del peróxido de carbamida sea mejor que el causado por el peróxido de hidrógeno, por el contrario indican que el efecto final es comparable entre los dos compuestos, pero si se indica un cambio más acelerado en las primeras semanas de uso del peróxido de carbamida. Esto fue igualmente comprobado en esta investigación y además se obtuvo una disminución total mayor para el grupo experimental 3 de aproximadamente 1.5 veces más que el grupo experimental 2.
Luego de discutir el comportamiento de la concentración de la molécula de fosfato ν1 (o del compuesto total de fosfato) a lo largo de las semanas de blanqueamiento, cabe resaltar la significancia clínica de la pérdida de éste. El fosfato ejerce una acción cariostática, es decir, reduce la solubilidad del esmalte y actúa como un búfer en la neutralización de los valores de pH de la saliva, la placa bacteriana y los alimentos. También, interfi ere con los procesos enzimáticos en la superfi cie del esmalte para aumentar la resistencia del huésped, disminuir la adhesión bacteriana e interferir en la síntesis de formación de polisacáridos extracelulares.12 La disminución estructural de la microdureza del diente puede ser atribuida a la degradación de la superficie como resultado del proceso oxidativo de los radicales libres. La microdureza está directamente relacionada con el contenido de minerales del esmalte por tanto una pérdida del grupo de fosfato puede alterar esta propiedad en el esmalte.16
Una de las limitaciones del presente estudio fue no haber almacenado los especímenes en saliva artificial a 37 oC a lo largo de la investigación. La saliva artificial contiene fosfato, el cual tendría el efecto potencial de revertir el efecto causado por los agentes blanqueadores y actuar como agente alcalinizante. Sin embargo, la composición de la saliva artificial rara vez es conocida en su totalidad y esto podría introducir una variable adicional a la investigación.17 Por otro lado, como es bien conocido, el medio oral provee condiciones para la remineralización del esmalte. Cuando el agente blanqueador causa desmineralización en el mismo, se inducen cambios iónicos que incrementan la captación de minerales. Por lo tanto se reemplaza así la pérdida que se dio por el agente blanqueador.25,26 No obstante, en el presente estudio, la variable saliva fue eliminada para concentrarse en el efecto puro de los geles de blanqueamiento sobre la concentración del grupo fosfato del esmalte dental en función del tiempo y porcentaje de concentración del peróxido de hidrógeno.
Otra de las limitaciones de este estudio es el hecho de haber utilizado piezas dentales extraídas de diferentes individuos, esto implica que la concentración de fosfato inicial difiera entre los especímenes y por ende la pérdida de concentración de éste a lo largo del tratamiento con el gel blanqueador. Además, el hecho de ser diferentes tipos de piezas dentales dificultó las mediciones, pues las piezas muy bulbosas se volvían difíciles de colocar en el espectrómetro Raman, y la presencia de fluorescencia, cuando se realizaron las mediciones, obligó a mover las muestras para obtener mejores resultados, no garantizando así que todas las mediciones fueran realizadas exactamente en el mismo sitio.
CONCLUSIONESDentro de las limitaciones del presente estudio se puede concluir que los especímenes tratados con peróxido de hidrógeno al 9.5% presentan una mínima pérdida de fosfato dental, no significativa estadísticamente, cuando se compara con los especímenes tratados con peróxido de hidrógeno al 14% y peróxido de carbamida al 38%.
El blanqueamiento dental con peróxido de hidrógeno al 14% produjo una pérdida de fosfato dental continua a lo largo de las cuatro semanas de tratamiento y representó una pérdida mineral de aproximadamente 22%.
Los especímenes blanqueados con peróxido de carbamida al 38% presentaron la mayor pérdida de fosfato del esmalte dental, equivalente a una disminución de aproximadamente el 45% la cual ocurrió principalmente en las primeras dos semanas del estudio, dado que en las semanas 3 y 4 la concentración se mantuvo constante.
AgradecimientosEste proyecto es financiado por el Fondo Especial de Estímulo a la Investigación de la Universidad de Costa Rica.
Los autores agradecen la colaboración de todo el personal del Laboratorio de Infraestructura Vial del Laboratorio Nacional de Materiales y Modelos Estructurales (LANAMME), Víctor Rodríguez del Laboratorio Mecánico de Precisión de la Escuela de Física, Universidad de Costa Rica, así como a las estudiantes Calendy Soto, Sofía Obando y Amaya Vásquez de la Facultad de Odontología, Universidad de Costa Rica.
Universidad de Costa Rica.