Objetivo: Analizar el impacto de las comorbilidades (diabetes mellitus DM, hipertensión arterial HAS, obesidad OB y dislipidemia DL) en la supervivencia global (SG) y libre de recurrencia (SLR) del cáncer urotelial vesical (CUV) superficial.
Material y métodos: Estudio retrospectivo de 152 pacientes con diagnóstico de CUV, se registró el historial clínico en una base de datos, identificando a las comorbilidades antes mencionadas, y se analizó la SG y SLR de pacientes con tumores superficiales (pTa).
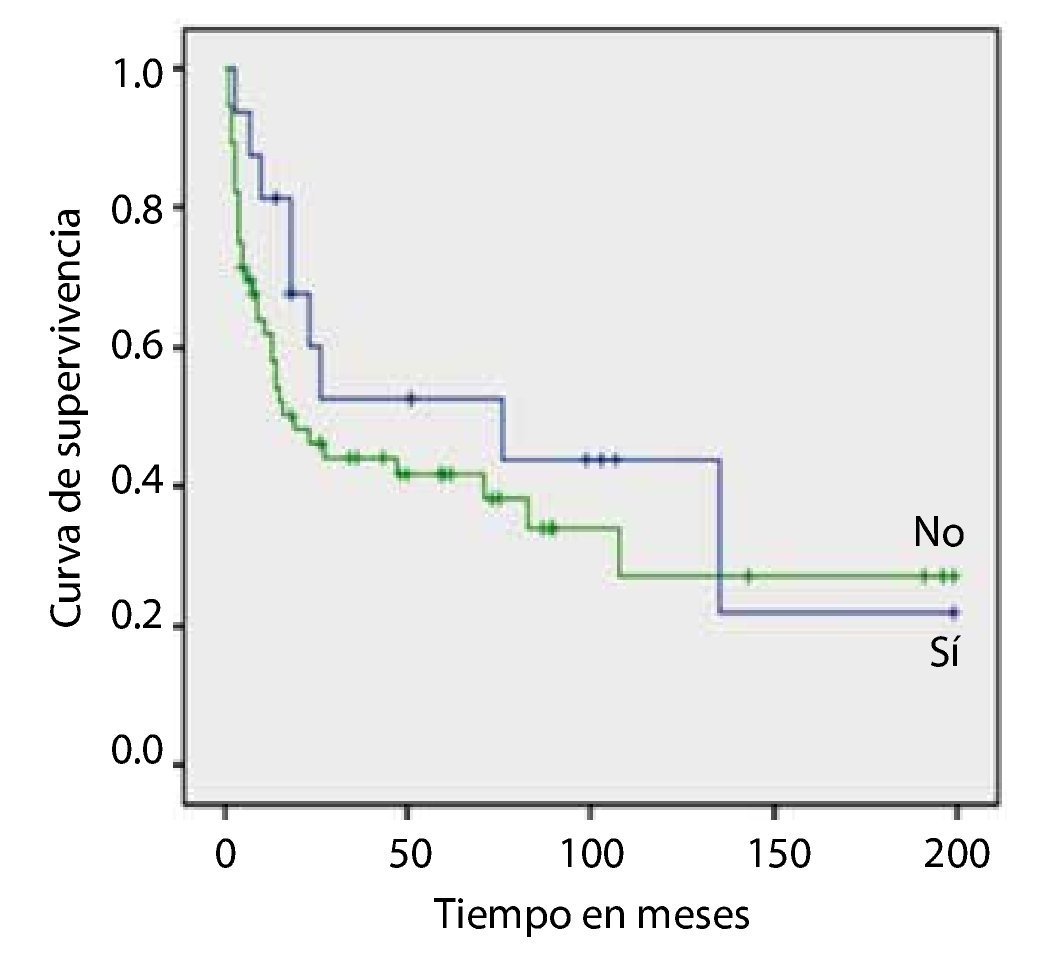
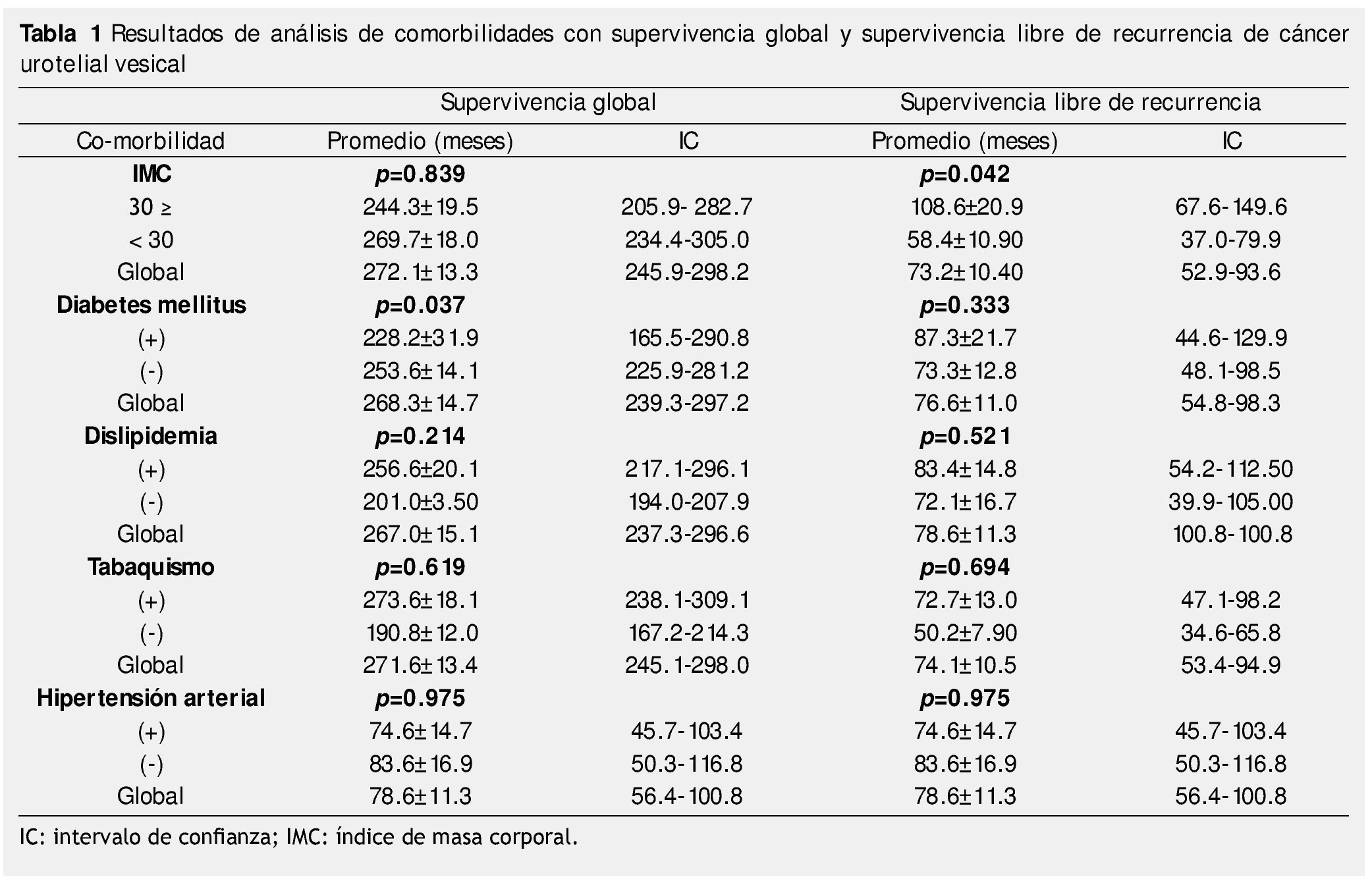
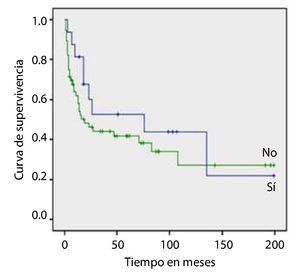
Resultados: Se seleccionaron 91 pacientes en estadio Ta. La SG media de los pacientes con CUV pTa con DM fue de 228.2 ± 31.9 meses vs. 253.6 ± 14.1 en no diabéticos, siendo estadísticamente significativo (p=0.037).
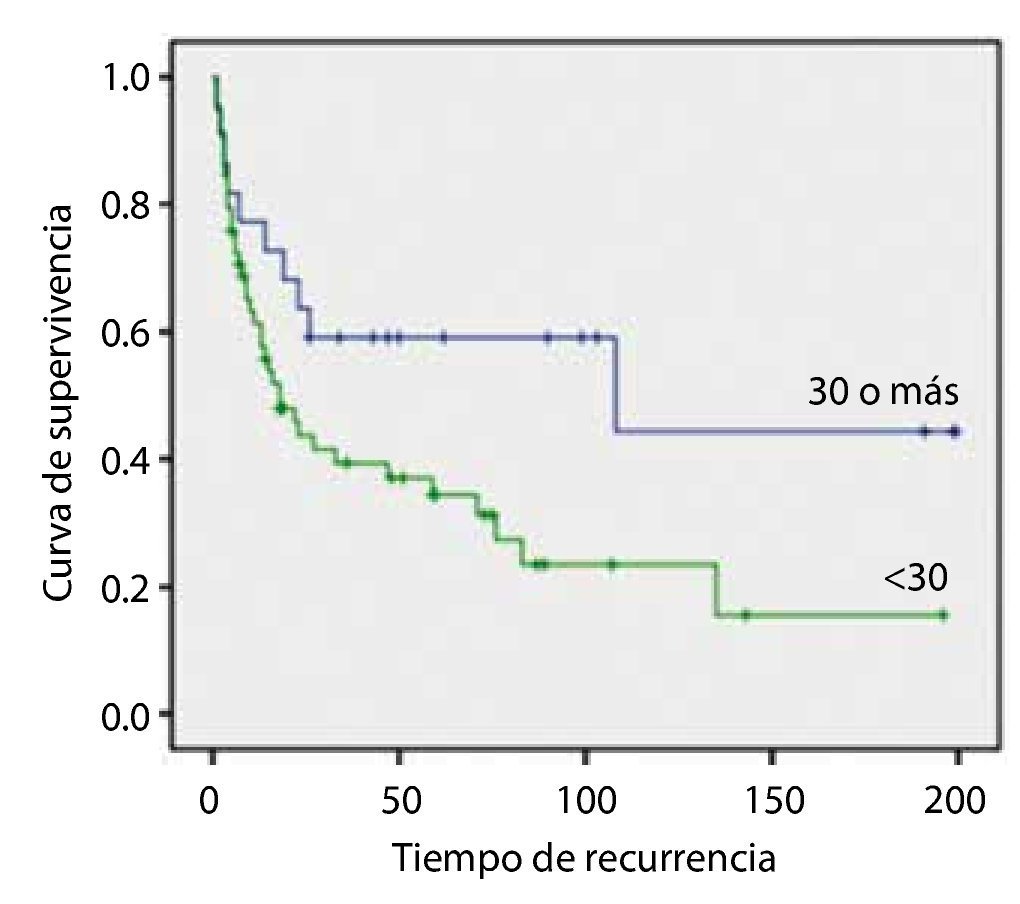
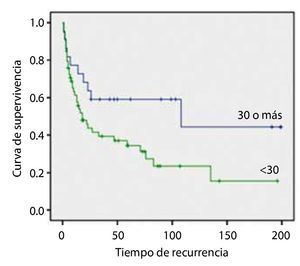
La SLR en los pacientes con CUV pTa con índice de masa corporal (IMC) ≥ 30 Kg/m2 fue de 244.3 ± 19.5 meses, y la de los pacientes con IMC < 30 Kg/m2 fue de 269.7 ± 18.0, con diferencia estadística significativa (p=0.042). El análisis de supervivencia con hipertensión arterial y dislipidemia no mostró impacto significativo.
Conclusión: La DM disminuye la SG en este grupo de pacientes con tumores vesicales superficiales, y la obesidad (IMC > 30 Kg/m2) disminuye la SLR.
Aims: To analyze the impact of comorbidities (diabetes mellitus DM, high blood pressure HBP, obesity OB, and dyslipidemia DL) on the overall survival (OS) and recurrence-free survival (RFS) rates of superficial urothelial carcinoma of the bladder (UCB).
Methods: A retrospective study of 152 patients diagnosed with UCB was carried out. The clinical history of the patients was registered in a database, identifying the abovementioned comorbidities, and the OS and RFS of the patients with superficial tumors (pTa) were analyzed.
Results: Ninety-one patients with stage Ta disease were selected; the mean OS of the patients with pTa UCB with DM was 228.2 ± 31.9 months vs. 253.6 ± 14.1 in the non-diabetic patients, resulting in statistical significance (p=0.037). The RFS in patients with stage pTa UCB with a body mass index (BMI) ≥ 30 Kg/m2 was 244.3 ± 19.5 months and in patients with a BMI < 30 Kg/m2, it was 269.7 ± 18.0, with a statistically significant difference of p=0.042. The survival analysis in patients with high blood pressure and dyslipidemia did not show significant impact.
Conclusions: DM reduced the OS in this group of patients with superficial bladder tumors, and obesity (BMI > 30 Kg/m2) reduced the RFS.
Introducción
El cáncer vesical representa el 4° y 9° tumor maligno más frecuente en hombres y mujeres, respectivamente. La edad media de diagnóstico para ambos sexos es de 73 años1.
El factor de riesgo más importante para cáncer urotelial de vejiga (CUV) es el tabaquismo, implicado en el 50% de los casos en hombres y 30% en mujeres. Existen otras comorbilidades como diabetes mellitus (DM), obesidad (OB), hipertensión arterial sistémica (HAS) y dislipidemia (DL) que no han mostrado una asociación consistente como factores de riesgo para CUV1.
Sin embargo, la DM ha sido implicada como factor de riesgo para ciertas neoplasias, incluyendo cáncer hepático, colon y páncreas.
El CUV es una enfermedad heterogénea que representa el 5% de todos los cánceres diagnosticados1. El 85% de los CUV son enfermedad confinada a la mucosa (estadio Ta y Tis) o submucosa (estadio T1)1. El pronóstico de la enfermedad no músculo invasora es excelente, la supervivencia estimada a 5 años es reportada en algunas series hasta en un 94%2.
El objetivo de este estudio es analizar el impacto de las comorbilidades antes descritas en la supervivencia global (SG) y libre de recurrencia (SLR) del CUV superficial (pTa).
Material y métodos
Diseñamos una cohorte histórica de 152 pacientes diagnosticados con CUV en el Departamento de Urología, en el Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán". La selección de los pacientes se realizó por el diagnóstico histopatológico de tejido obtenido por resección transureteral de vejiga (RTUV). Se escogieron aquellos con diagnóstico de tumor superficial (pTa). Los pacientes fueron clasificados por grado nuclear y estadio patológico. Se analizó la SG y SLR, con las siguientes comorbilidades: tabaquismo (TB), OB, índice de masa corporal (IMC > 30 Kg/m2), DL (colesterol mayor a 200 mg/dL y triglicéridos mayor a 150 mg/dL), HAS y DM, previamente diagnosticados. Los datos de comorbilidades fueron tomados del expediente clínico (TB, OB, HAS y DM), se utilizaron los resultados de laboratorios previos inmediatos (colesterol total y triglicéridos) a la RTUV para diagnosticar DL.
El análisis de supervivencia fue realizado utilizando curvas de supervivencia de Kaplan-Meier en el programa de análisis estadístico SPSS® versión 17.0 (SPSS Inc., Chicago IL, USA). Se utilizó la prueba estadística de Log-rank para identificar diferencias. Todos los valores significativos fueron considerados con valor de p≤0.05.
Resultados
La base incluyó 152 pacientes, de los cuales se seleccionaron 91 con estadio Ta, con un rango de edades de 31 a 108 años, con una media de 70.59 ± 9.2 años, de los cuales 64 (70.3%) fueron hombres y 27 (29.7%) mujeres. El 56.7% tenían historia de TB, el 21.7% de DM, el 58% DL, el 50.6% HAS y el 27.5% OB. Se clasificaron según grado nuclear a 39 como pTaG1, 24 pTaG2 y 28 pTaG3. La SG después de RTUV fue de 272 ± 13 meses y la SLR fue de 73.29 ± 10.43 meses. En la tabla 1 se muestra el análisis de SG y SLR.
La SG media de los pacientes con CUV pTa con DM, fue de 228.2 ± 31.9 meses 253.6 ± 14.1 en no diabéticos, siendo estadísticamente significativo (=0.037) (fig. 1).
Figura 1. Diabetes mellitus.
La SLR en los pacientes con CUV pTa con IMC ≥ 30 Kg/m2 fue de 244.3 ± 19.5 meses y la de los pacientes con IMC < 30 Kg/m2 fue de 269.7 ± 18.0, con diferencia estadística significativa (=0.042) (fig. 2).
Figura 2. Índice de masa corporal.
Discusión
Se ha descrito en múltiples estudios a la edad y algunas comorbilidades como la OB2-8, DM, HAS9,10 y DL11,12, como factores que impactan directamente en la SG y SLR en pacientes con CUV13-20.
Diversos estudios han observado que la alta mortalidad por CUV en pacientes mayores de 60 años es debida a las comorbilidades antes descritas, destacando la DM como mayor predictor de mortalidad global14,15.
Algunos estudios, incluyendo un meta-análisis14, han investigado la asociación entre DM y el aumento de la mortalidad por CUV13,15-17.
El uso de insulina en pacientes con DM tipo 2 ha sido propuesto como un promotor de crecimiento para neoplasias malignas, explicando así el incremento del riesgo de cáncer en adultos con DM. La DM se caracteriza por un largo periodo subclínico de hiperinsulinemia, en respuesta a la resistencia de insulina, lo cual explica el incremento del riesgo de padecer neoplasias malignas4,21-27. En el análisis de supervivencia que realizamos, encontramos a la DM como la comorbilidad de mayor impacto significativo en la SG (=0.037), coincidiendo con lo antes descrito.
Otras de las comorbilidades que se ha relacionado como predictor de riesgo y mortalidad para CUV es la HAS10,12,28. Algunos estudios han postulado la HAS como fuerte predictor de mortalidad12,24. Sin embargo, un estudio prospectivo reciente no reportó asociación entre HAS y mortalidad cáncer-específica10. Aún es muy limitada la evidencia científica que sustenta los posibles efectos de la HAS y el cáncer. Distintos autores han propuesto que la HAS propicia un estado inflamatorio en el endotelio vascular, con proliferación del músculo liso vascular, lo cual podría contribuir al desarrollo de tumores28. En este trabajo no encontramos un impacto significativo de la HAS en SG y SLR del CUV.
El síndrome metabólico (SM) representa una de las comorbilidades con mayor impacto en la calidad de vida y en mortalidad en pacientes con cáncer. El SM es un importante problema de salud pública, que ha sido sujeto de múltiples estudios, destacando el impacto en la mortalidad del CUV. Un estudio prospectivo18 y cohortes más pequeñas han estudiado al SM y a los componentes por separado de este, no encontrando aumento en la mortalidad por CUV11,16,19,20.
Uno de los componentes del SM es la obesidad, en la cual, uno de los parámetros más importantes de referencia es el IMC. Al analizar en nuestro grupo de pacientes el efecto del IMC en la supervivencia, encontramos que los pacientes con IMC < 30 Kg/m2 tenían mayor SLR, a lo cual inferimos que la diferencia en SLR en pacientes con IMC ≥ 30 Kg/m2 puede estar relacionada a la influencia de factores inflamatorios sobre la diferenciación nuclear de la neoplasia o reflejar un mejor estado general nutricional y funcional, especialmente en este grupo etario25. Se ha estudiado el papel de la obesidad en la carcinogénesis, en donde se ha comprobado un estado proinflamatorio, con proliferación celular y alteraciones del DNA celular. Algunos estudios no han reportado asociación significativa entre el IMC y CUV7-9,21. Un estudio reportó disminución del riesgo22. Sin embargo, una cohorte reciente de 20,000 casos de CUV, reportó un modesto incremento en el riesgo en obesos blancos, no así con los obesos negros23.
Actualmente, el papel del IMC como factor de impacto en el desarrollo y supervivencia de cáncer se ha estudiado. Un estudio prospectivo demostró que pacientes adultos mayores de 60 años de edad con IMC > 25 Kg/m2, pero < 30 Kg/m2 tenían aumento en la SG. Este beneficio se ha sugerido como un reflejo de un buen estado nutricio. Sin embargo, esta asociación debe ser estudiada, en otros estudios prospectivos. Además, se ha comprobado que el IMC en adultos mayores de 65 años, no puede ser considerado como parámetro diagnóstico del estado nutricio, debido a los cambios morfológicos en la estatura propios de la edad, que traduce una sobrevaloración del IMC25,29-31.
El alto índice de recurrencia y progresión del CUV, implica un importante impacto en la calidad de vida y la supervivencia.
Este trabajo es un estudio preliminar, de trabajos futuros. La principal limitante de este estudio es el diseño retrospectivo, el limitado tamaño de muestra, lo cual no permitió obtener resultados concluyentes en el análisis de todas las variables.
Conclusión
La DM disminuye la SG en pacientes con CVU superficial. La obesidad (IMC > 30 Kg/m2) disminuye la SLR.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
No se recibió patrocinio para llevar a cabo este artículo.
* Autor para correspondencia:
Instituto Nacional de Ciencias Médicas y Nutrición "Salvador Zubirán".
Vasco de Quiroga N° 15, Delegación Tlalpan, C.P. 14000, México D.F., México.
Teléfono: 5487 0900, ext. 2145.
Correo electrónico: rcastillejos@hotmail.com (R. A. Castillejos-Molina).