In recent years, as a result of a greater offer of ‘fast food’ (FF), an increase has been induced in the quantity and caloric content of the foods consumed. The aim of this work was to carry out a review of the investigations related to the effect of fatty acids (FA) on the hunger-satiety cycle. Long-chain saturated FA predominate in FF, which tend to increase appetite. However, the N-acylethanolamines that are synthesized minutes after food intake can modulate appetite or satiety levels. This is due to the ability to induce different hormones secretion involved in orexigenic or anorexigenic signals activation. In contrast, unsaturated FA can secrete anorexigenic hormones that induce satiety, such as omegas 3 and 9, so it would be advisable to increase their proportion in the FF production process. Therefore, it is concluded that the type of effect that FA have on hunger-satiety cycle depends, on the one hand, on the length of their chain and, on the other hand, on the number of unsaturations contained in them.
En los últimos años, como resultado de una mayor oferta de «comida rápida» (CR), se ha inducido un incremento en la cantidad y el contenido calórico de los alimentos consumidos. El objetivo de este trabajo fue realizar una revisión de las investigaciones relativas al efecto de los ácidos grasos (AG) sobre el ciclo hambre-saciedad. En la CR predominan los AG saturados de cadena larga, los cuales tienden a incrementar el apetito. No obstante, las N-aciletanolaminas que se sintetizan minutos después de la ingesta de alimento pueden modular los niveles de apetito o de saciedad. Esto gracias a la capacidad de inducir la secreción de diferentes hormonas involucradas en la activación de las señales orexigénicas o anorexigénicas. Por el contrario, los AG insaturados pueden secretar hormonas anorexigénicas que inducen saciedad; tal es el caso de los omegas 3 y 9, por lo que sería recomendable incrementar su proporción en el proceso de elaboración de la CR. Por tanto, se concluye que el tipo de efecto que los AG tengan en el ciclo hambre-saciedad depende, por un lado, de la longitud de su cadena y, por otro, del número de insaturaciones que contengan.
La alimentación tradicional se ha visto desplazada por varios factores, como son la globalización, la urbanización y la industrialización, entre otros. Las personas han adoptado una dinámica que requiere invertir una importante cantidad de tiempo no solo en el desempeño de su jornada laboral o académica, sino también en los traslados de su hogar al trabajo o la escuela. Por tanto, las personas cuentan con poco tiempo que puedan destinar a la preparación e ingesta de sus alimentos. Aunado a esto, en la actualidad existe un creciente, competitivo y muy diverso mercado de alimentos procesados, conocidos como «comida rápida» (CR; para un listado de las principales abreviaturas utilizadas en el presente trabajo, ver Anexo). Genéricamente estos alimentos se caracterizan por tener un alto contenido calórico, condición que, aunada al excesivo tamaño de las porciones y la alta frecuencia de consumo, son factores que favorecen la etiología de la obesidad (Loría y Salas, 2014; Secretaría de Salud, 2013).
En México existen estudios que relacionan el incremento en la prevalencia de obesidad con el consumo de alimentos de alto valor energético, lo que —a su vez— está fuertemente asociado con la ingesta de CR (Ramos-Morales, Marín-Flores, Rivera-Maldonado y Silva-Ramales, 2006), en la que prevalecen los ácidos grasos (AG) saturados (30-50%), con escasos AG omega 3 (Barrado, Mayo, Tesedo, Romero y de la Rosa, 2008; Barrado, Prieto, Sanz, Tesedo y Romero, 2007). Reséndiz, Hernández, Sierra y Torres (2014) estudiaron los hábitos de alimentación de pacientes mexicanos con obesidad severa, y encontraron que a mayor índice de masa corporal fue también mayor la tendencia a comer alimentos altos en grasa y a ingerir alimento en ausencia de la sensación de hambre.
De manera general, en la población existe una preferencia por el consumo de alimentos con alto contenido de grasa. Por un lado, se ha demostrado que algunos AG de cadena larga (18 a 22 carbonos) y con instauración en alguno de los carbonos (1, 2, 3, 5 y 6) —como oleico 18:1 (OA), linoleico 18:2 (LA), α linolénico 18:3 (ALA), eicosapentaenoico 20:5 (EPA) o docosahexaenoil 22:6 (DHA)— son agonistas de los receptores acoplados a proteína G 120 (GPR-120), presentes en las papilas gustativas, por lo que su estimulación provoca secreción de dopamina en el núcleo accumbens (Adachi et al., 2014). Así, la estimulación de los receptores a dopamina D1, presentes en la corteza prefrontal, produce un mayor deseo de ingerir alimento (Land et al., 2014). Por tanto, aunque en el consumo excesivo de alimento influyen diversos factores, el tipo de AG que se ingiere es uno de ellos (Palou, Bonet, Picó y Rodríguez, 2004).
Los alimentos con alto contenido de lípidos (o grasas) se diferencian, unos de otros, dependiendo del tipo y de las proporciones de cada AG que contienen (tabla 1). Los AG saturados, que —como ya se dijo— predominan en la CR, activan a los receptores Toll tipo 4 (TLR-4) (Calegari et al., 2011; Gupta, Knight, Gupta, Keller y Bruce-Keller, 2012; Wang et al., 2016) y al receptor cannabinoide tipo1 (CB1R) (Lim, Lim, Han y Park, 2010), induciendo incremento en la ingesta de alimento (Jamshidi y Taylor, 2001; Wang et al., 2016). Por el contrario, los AG del tipo omega 3 (e.g., EPA, DHA), por su origen son difíciles de encontrar en la CR (Barrado et al., 2007, 2008; Rubio, 2002), estando más presentes en esta los tipos omega6 (e.g., LA), desbalance que se ha visto asociado al aumento en la prevalencia de sobrepeso y obesidad (Simopoulos, 2016). Condiciones además estrechamente asociadas al desarrollo de enfermedades crónico-degenerativas y, con ello, al incremento —a mediano y largo plazo— del gasto en salud pública. Por esta razón, el gobierno mexicano ha implementado medidas de prevención y control, enfocándose en desarrollar campañas masivas de prevención y exigir que en las etiquetas de los alimentos procesados aparezcan las cantidades de energía que proporcionan (Secretaría de Salud, 2013).
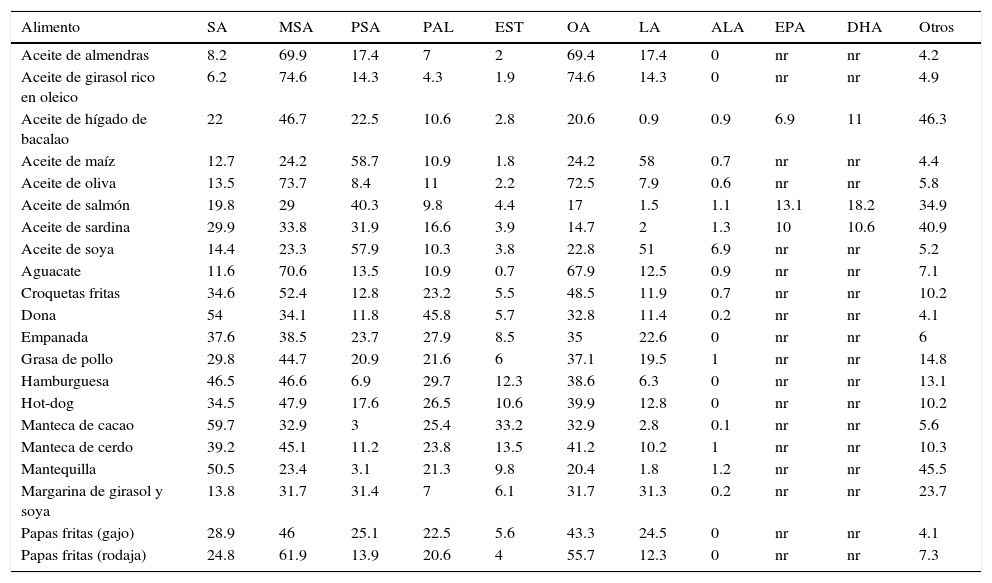
Porcentaje relativo de los principales ácidos grasos presentes en diferentes alimentos
| Alimento | SA | MSA | PSA | PAL | EST | OA | LA | ALA | EPA | DHA | Otros |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Aceite de almendras | 8.2 | 69.9 | 17.4 | 7 | 2 | 69.4 | 17.4 | 0 | nr | nr | 4.2 |
| Aceite de girasol rico en oleico | 6.2 | 74.6 | 14.3 | 4.3 | 1.9 | 74.6 | 14.3 | 0 | nr | nr | 4.9 |
| Aceite de hígado de bacalao | 22 | 46.7 | 22.5 | 10.6 | 2.8 | 20.6 | 0.9 | 0.9 | 6.9 | 11 | 46.3 |
| Aceite de maíz | 12.7 | 24.2 | 58.7 | 10.9 | 1.8 | 24.2 | 58 | 0.7 | nr | nr | 4.4 |
| Aceite de oliva | 13.5 | 73.7 | 8.4 | 11 | 2.2 | 72.5 | 7.9 | 0.6 | nr | nr | 5.8 |
| Aceite de salmón | 19.8 | 29 | 40.3 | 9.8 | 4.4 | 17 | 1.5 | 1.1 | 13.1 | 18.2 | 34.9 |
| Aceite de sardina | 29.9 | 33.8 | 31.9 | 16.6 | 3.9 | 14.7 | 2 | 1.3 | 10 | 10.6 | 40.9 |
| Aceite de soya | 14.4 | 23.3 | 57.9 | 10.3 | 3.8 | 22.8 | 51 | 6.9 | nr | nr | 5.2 |
| Aguacate | 11.6 | 70.6 | 13.5 | 10.9 | 0.7 | 67.9 | 12.5 | 0.9 | nr | nr | 7.1 |
| Croquetas fritas | 34.6 | 52.4 | 12.8 | 23.2 | 5.5 | 48.5 | 11.9 | 0.7 | nr | nr | 10.2 |
| Dona | 54 | 34.1 | 11.8 | 45.8 | 5.7 | 32.8 | 11.4 | 0.2 | nr | nr | 4.1 |
| Empanada | 37.6 | 38.5 | 23.7 | 27.9 | 8.5 | 35 | 22.6 | 0 | nr | nr | 6 |
| Grasa de pollo | 29.8 | 44.7 | 20.9 | 21.6 | 6 | 37.1 | 19.5 | 1 | nr | nr | 14.8 |
| Hamburguesa | 46.5 | 46.6 | 6.9 | 29.7 | 12.3 | 38.6 | 6.3 | 0 | nr | nr | 13.1 |
| Hot-dog | 34.5 | 47.9 | 17.6 | 26.5 | 10.6 | 39.9 | 12.8 | 0 | nr | nr | 10.2 |
| Manteca de cacao | 59.7 | 32.9 | 3 | 25.4 | 33.2 | 32.9 | 2.8 | 0.1 | nr | nr | 5.6 |
| Manteca de cerdo | 39.2 | 45.1 | 11.2 | 23.8 | 13.5 | 41.2 | 10.2 | 1 | nr | nr | 10.3 |
| Mantequilla | 50.5 | 23.4 | 3.1 | 21.3 | 9.8 | 20.4 | 1.8 | 1.2 | nr | nr | 45.5 |
| Margarina de girasol y soya | 13.8 | 31.7 | 31.4 | 7 | 6.1 | 31.7 | 31.3 | 0.2 | nr | nr | 23.7 |
| Papas fritas (gajo) | 28.9 | 46 | 25.1 | 22.5 | 5.6 | 43.3 | 24.5 | 0 | nr | nr | 4.1 |
| Papas fritas (rodaja) | 24.8 | 61.9 | 13.9 | 20.6 | 4 | 55.7 | 12.3 | 0 | nr | nr | 7.3 |
ALA: α linolénico; DHA: docosahexaenoico; EPA: eicosapentaenoico; EST: esteárico; LA: linoleico; MSA: ácidos grasos monoinsaturados; nr: no reportado; OA: oleico; PAL: palmítico; PSA: ácidos grasos poliinsaturados; SA: ácidos grasos saturados.
Fuentes: Barrado et al. (2007, 2008) y Rubio (2002).
Sin embargo, aún es necesario profundizar en la comprensión de los mecanismos a través de los cuales actúan los AG para incrementar o disminuir la ingesta de alimento, identificar los receptores que estimulan y el efecto que producen. Por tanto, el objetivo de este trabajo fue realizar una revisión de aquellos estudios que en los últimos 15años han caracterizado los AG presentes en los alimentos y su efecto sobre la ingesta de alimento. Para ello se exponen los principales receptores que se activan y las hormonas que se secretan involucradas en el ciclo de hambre-saciedad, tanto por los AG consumidos como por las N-aciletanolaminas (NAE) sintetizadas a partir de estos.
Ácidos grasos y apetitoLa longitud de la cadena y el número de insaturaciones de los AG determinan el tipo de efecto que estos tendrán en el ciclo hambre-saciedad. En general, son más saciantes los de cadena corta; en cambio, los de cadena larga tienden a incrementar el consumo de alimento. No obstante, los AG insaturados de cadena larga tienen un efecto opuesto, ya que entre mayor número de insaturaciones tengan, provocarán un mayor efecto saciante (Palou et al., 2004), resultado de la estimulación hormonal y de la hidrólisis de triacilglicéridos provenientes de la ingesta de AG libres (Gentilcore et al., 2006). Al respecto, Feinle et al. (2003) utilizaron tetrahidrolipstatina (THL), que es un inhibidor de las lipasas gástricas e intestinales, y encontraron que al no haber lipólisis de triacilglicéridos que den origen a AG libres, no se estimula la secreción de hormonas anorexigénicas.
Ácidos grasos que inducen apetitoEl consumo crónico de AG de cadena larga y saturados tiende a aumentar la ingesta de alimento, de modo que predispone a la hiperfagia y, por ende, a la obesidad (Palou et al., 2004). Tal es el caso del ácido esteárico 18:0 (EST), que por sí solo tiene un efecto orexigénico. Wang et al. (2016), al utilizar un modelo de células inmortales de hipotálamo (CIH) provenientes de ratones N38, a las que pusieron en contacto con EST, observaron aumento en la concentración de la proteína relacionada con Agouti (AgRP). Estos autores concluyeron que ello está relacionado con procesos inflamatorios de los que se responsabiliza a TLR-4, comúnmente presente en monocitos, macrófagos y células del epitelio gástrico (Schmauber et al., 2004) y del intestino (Dapito et al., 2012). Además, se ha reportado que ratones carentes de dicho receptor tienden a consumir menor cantidad de alimento (Okun et al., 2014). Por otra parte, la activación de TLR-4 en células del páncreas de ratas (Mateu, Ramudo, Manso y de Dios, 2015), dada la presencia de AG saturados (e.g., EST), aumenta la concentración de citocinas proinflamatorias, lo que a su vez provoca disminución en la secreción de insulina (Holland et al., 2011). Calegari et al. (2011), al suministrar EST intracerebroventricularmente (ICV) a ratas, observaron incremento en la concentración de interleucina6 (IL-6) y factor de necrosis tumoral-alfa (TNF-α), con disminución en la secreción de insulina e incremento en marcadores de apoptosis en células del islote de Langerhans.
En cuanto al ácido palmítico 16:0 (PAL), otro AG saturado, Schwinkendorf, Tsatsos, Gosnell y Mashek (2011) reportaron en ratas, con base a la administración ICV de PAL, incremento en el consumo de alimento. Esto como resultado del aumento en los niveles de neuropéptidoY (NPY) y disminución de proopiomelanocortina (POMC), efecto que es contrario al de la administración de OA. Cheng et al. (2015) investigaron los efectos de la administración de PAL en CIH de ratón N38, y encontraron que dicho AG causa resistencia a la leptina, disminuyendo el efecto supresor del apetito asociado a esta adipocitocina; además, PAL promueve una respuesta proinflamatoria, por lo que estos autores concluyen que puede estar participando en la inducción de obesidad. Esto último concuerda con lo encontrado por Dinh, Szabo, Wang, Yu y Huang (2013), al administrar PAL —vía ICV— a ratas, quienes observaron incremento tanto de la cantidad de alimento ingerido como de la temperatura corporal. Estos autores proponen que el efecto de PAL está mediado por el sistema nervioso central, y podría estar regulado por CB1R, mismo que se encuentra distribuido en este sistema, en varios tejidos periféricos y en el tracto digestivo (Malik, Baik y Schey, 2015). Por tanto, PAL tiene la capacidad de activar dicho receptor a nivel periférico (Lim et al., 2010), aunado a la activación de TLR-4 (Gupta et al., 2012).
Ácidos grasos que inducen saciedadComo ya se mencionó, el efecto saciante de los lípidos puede ser debido tanto a la longitud del AG como al número de insaturaciones. En un experimento con 18 personas a las que, después de ayuno de 12h, se les dio una emulsión de AG, y 20min después desayunaron, Harden et al. (2012) observaron que DHA indujo el consumo de menos calorías, como resultado de la secreción de colecistoquinina (CCK). Además, las células SCT-1 expuestas a AG de cadena larga inducen una mayor excreción de CCK, siendo DHA y EPA los que más CCK secretaron, seguidos de LA y OA. Efecto saciante que se induce en el yeyuno y que depende de la vía vagal. Ogawa et al. (2012) demostraron esto al implantar una cánula en el yeyuno de ratas y suministrarles una infusión de 50, 100, 150 o 200μl/h de LA, ALA o ácido caprílico (8:0), e identificar que tanto LA como ALA provocaban disminución de la ingesta; más específicamente, LA incrementó los niveles de glucagón tipo1 (GLP-1), péptido tirosina-tirosina (PYY) y CCK, esto a manera de dosis-respuesta, a partir de 1h de la infusión. Posteriormente Ogawa et al. realizaron en las ratas una cirugía para eliminar la comunicación vagal, y encontraron que aumentaba el consumo de alimento. No obstante, este efecto también puede inducirse a través del íleon (Maljaars, Romeyn, Haddeman, Peters y Masclee, 2009). Con humanos, estos autores hicieron un experimento con 15 varones saludables a los que les fue implantado un catéter naso-íleon, y antes del consumo de alimentos recibieron una emulsión de aceite de kárite, aceite de cánola o aceite de girasol, en los que predominan EST, OA y LA, respectivamente. Después, con alimentos ad libitum, se observó que los participantes que consumieron EST secretaron menor CCK y mostraron más hambre frente a los participantes que ingirieron OA o LA; en cambio, estos últimos se sintieron más satisfechos, siendo LA el que indujo mayor secreción de CCK. Por tanto, se confirma que a mayor número de insaturaciones es también mayor el poder saciante; sin embargo, es importante mencionar que el efecto de EST y de LA solo se manifestó en los primeros 20min, tendiendo a revertirse posteriormente.
El aumento en la secreción de hormonas anorexigénicas puede deberse a la activación del receptor acoplado a proteína G-40 (GPR-40), que se encuentra en el tracto digestivo, desde el estómago hasta el duodeno, yeyuno e íleon, y tiene la capacidad de estimular la secreción de péptido inhibidor gástrico y de GLP-1 de las células K o L, respectivamente. Mecanismo que también pueden activar algunos AG libres (Edfalk, Steneberg y Edlund, 2008), como DHA y ALA (Hauge et al., 2015), o bien OA y LA en células del páncreas, lo que incrementa la movilización del calcio intracelular y provoca la secreción de insulina (Kim et al., 2013).
Omega 3En la actualidad se ha popularizado el consumo de AG provenientes de mamíferos marinos y peces azules, como una manera segura de mantener una «buena dieta» (Román, Ojeda-Granados y Panduro, 2013), ya que se ha reportado que estos AG de cadena larga (e.g., EPA, DHA) pueden modular el apetito. Parra et al. (2008) proporcionaron a humanos dos tipos de alimento, y aunque ambos aportaban la misma cantidad de calorías, variaban en la de AG poliinsaturados omega 3. Se encontró que las personas que consumían alimentos con alto contenido de estos AG expresaban menos apetito y, al terminar de comer, mayor saciedad; efecto que se extendía hasta 2h después de la ingesta. En animales se ha visto que reduce la grasa corporal, lo que ha llevado a sugerir que algo similar puede pasar en humanos, por lo que se ha propuesto que su consumo puede servir al tratamiento de la obesidad (Buckley y Howe, 2009). En ratas se ha observado que estos AG reducen la expresión de la enzima estearoil-CoA desaturasa-1 (SCD-1), que interviene en la síntesis de novo de AG, por lo que al inhibirla no solo disminuye su síntesis, sino que también aumenta la sensibilidad a la insulina (Borengasser et al., 2012). Kim, Carlson, Kuchel, Newman y Watkins (2016) estudiaron el consumo crónico de DHA en ratones, y encontraron que a partir de los 62días de tratamiento aumentaba la expresión del mRNA de receptores a insulina (IR) en el músculo, de los transportadores de glucosa1 (GLUT-1) y de los de glucosa4 (GLUT-4), así como de los receptores CB1R y CB2R. Mecanismo que podría explicar el efecto anti-obesidad de los omega 3.
Omega 6Algunos AG tienen la capacidad de secretar PYY. Hand et al. (2013) utilizaron células STC-1 en ratas y obtuvieron que la secreción aguda de PYY se ve incrementada con la administracion de LA frente a otros AG (con EST y OA dicha secreción disminuyó 40% y 50%, respectivamente). También se ha observado que el omega 6 tiene la capacidad de aumentar la secreción aguda de CCK (Maljaars et al., 2009) y de GLP-1 (Ogawa et al., 2012).
Omega 9El aceite de oliva es una grasa vegetal que se diferencia de otras por su alto contenido de AG monoinsaturados, predominando OA (70%) (Lozano, Segura y Fernández, 2009; Rubio, 2002). El efecto benéfico del consumo de este aceite se ha identificado en el metabolismo de glúcidos, tanto en sujetos normales como en aquellos con diabetes mellitus tipo2 (Marí-Sanchis et al., 2011). Gentilcore et al. (2006) dieron a pacientes con este padecimiento una dosis de aceite de oliva 30min antes de la ingesta de alimento, y observaron que se amplió el tiempo requerido para alcanzar los niveles más altos en la curva de tolerancia a la glucosa. Esto debido a que el omega9 provoca disminución en la velocidad del vaciado gástrico, con incremento en la secreción de GLP-1. También se ha observado que OA tiene efectos anorexigénicos, como lo demostraron Schwinkendorf et al. (2011) en ratas, a quienes suministraron ICV diferentes AG, y encontraron que OA y DHA redujeron la cantidad de alimento ingerido, ya que estimulan la concentración de POMC; adicionalmente, las ratas tratadas con OA presentaron valores de NPY inferiores a los registrados con otros AG.
N-aciletanolaminas posprandiales y apetitoLas NAE son un conjunto de amidas de AG formadas por uno o varios grupos acilos, unidos a un átomo de nitrógeno, proveniente de una etanolamina. Las fuentes naturales de AG son la dieta o la síntesis de novo. Las NAE más representativas son: 2-araquidonilglicerol (2-AG), palmitoiletanolamida (PEA), anandamida (AEA) y estearoil etanolamida (SEA). En ratas sometidas a ayuno de 24h, Petersen et al. (2006) observaron que existían niveles más bajos de PEA, SEA y oleoiletanolamida (OEA), los cuales se relacionan con efectos anorexigénicos (Oiso et al., 2015; Raso et al., 2014; Terrazzino et al., 2004), mientras que los niveles de AEA incrementaron, lo que se relaciona con el «comer por placer» (Rigamonti et al., 2015). No obstante, 1h después de haber ingerido alimento, dichas ratas mostraron niveles más altos de PEA, SEA y OEA, contrastando con concentraciones más bajas de AEA. En humanos, Schrieks, Ripken, Stafleu, Witkamp y Hendriks (2015) identificaron que 30min después de la ingesta de alimento variaban los niveles de NAE. Específicamente, cuando las personas comían en un ambiente confortable y agradable (e.g., con música o luces suaves), 2-AG y AEA tendieron a incrementar, pero PEA y SEA a disminuir; en contraste, cuando el ambiente era desagradable (e.g., sin decoración, exceso de luz, cubiertos y platos desechables), PEA y SEA aumentaban.
Por otra parte, se ha señalado que el sabor de la comida también influye en el nivel de síntesis y excreción de NAE. Mennella et al. (2015a) realizaron un experimento en el que proporcionaron tres tipos de alimentos (dulces, amargos y «aceptables») a personas saludables, para después hacer una curva de monitoreo de las principales NAE. Estos autores encontraron que, ante sabores amargos, en 5min disminuían los niveles de AEA, a los 10min los de 2-AG y a los 15min los de PEA. En cambio, con sabores dulces, a los 10min aumentaban los niveles de AEA y 2-AG, y a los 15min los de OEA y N-linoleoil etanolamina (LEA). Por tanto, se puede decir que las NAE orexigénicas modifican sus niveles más rápido que las anorexigénicas.
Además del sabor, la composición de AG de la dieta juega un papel importante en los niveles de endocanabinoides y etanolaminas, como demostraron Artmann et al. (2008) al suministrar a grupos de ratas, durante una semana, cinco diferentes dietas que diferían en el aceite a consumir: palma, oliva, girasol, pescado y ácido araquidónico (AA). Posteriormente los roedores fueron sacrificados, y se encontró que el aceite de oliva inducía incremento en los niveles cerebrales de AEA, LEA, 2-AG y docosahexaenoil etanolamida (DHEA); el aceite de girasol incrementó los niveles de LEA y 2-AG, y AA los niveles de AEA y 2-AG. Además, en el yeyuno, el aceite de oliva aumentó los niveles de LEA, y el aceite de pescado los de DHEA; en cambio, en el hígado, el aceite de palma indujo mayores niveles de PEA. Esto puede explicarse porque cada NAE proviene de una fuente específica de AG (fig. 1 y tabla 2), por lo que los niveles de estos están correlacionados. Esto lo demostraron Joosten, Balvers, Verhoeckx, Hendriks y Witkamp (2010) al trabajar con mujeres posmenopáusicas bajo una condición de ayuno de una noche. Los niveles plasmáticos de AG libres y endocanabinoides fueron medidos, identificando correlaciones relevantes entre AA y AEA (0.42), PAL y PEA (0.54), OA y OEA (0.71), y EST y SEA (0.77). Resultados que indican que los niveles presentes de AG determinan los de NAE.
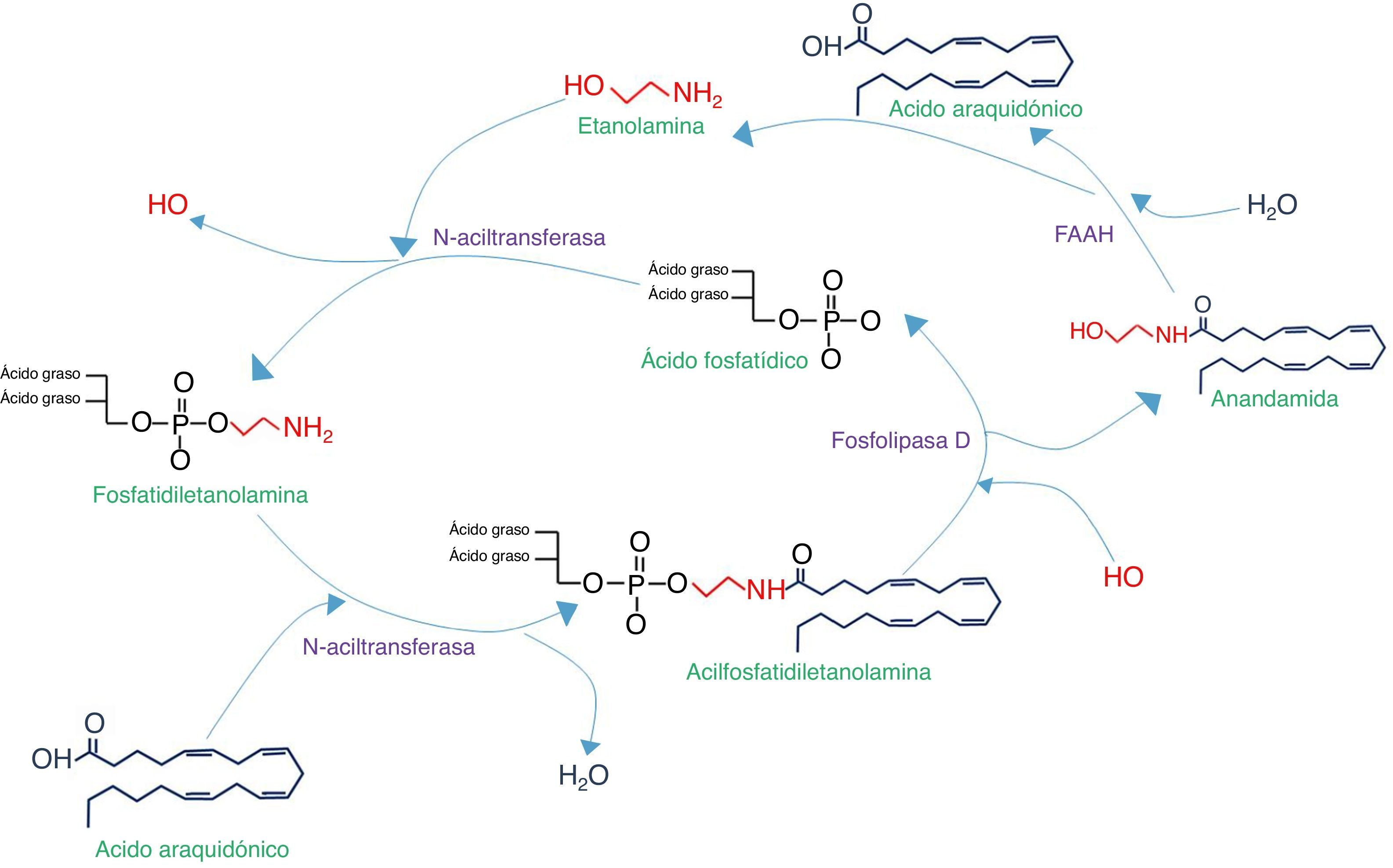
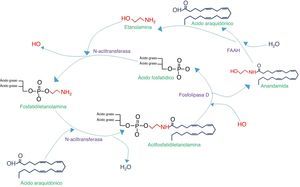
Síntesis y degradación de N-aciletanolaminas. Comienza con la acilación de la fosfatidiletanolamina con el ácido graso correspondiente (en este ejemplo, ácido araquidónico), por medio de la N-aciltransferasa. Posteriormente se cataboliza la acilfosfatidiletanolamina para liberar la aciletanolamida (en este caso anandamida), la cual se degradará con la enzima amidohidrolasa de ácidos grasos (FAAH), liberando etanolamina y el ácido graso precursor.
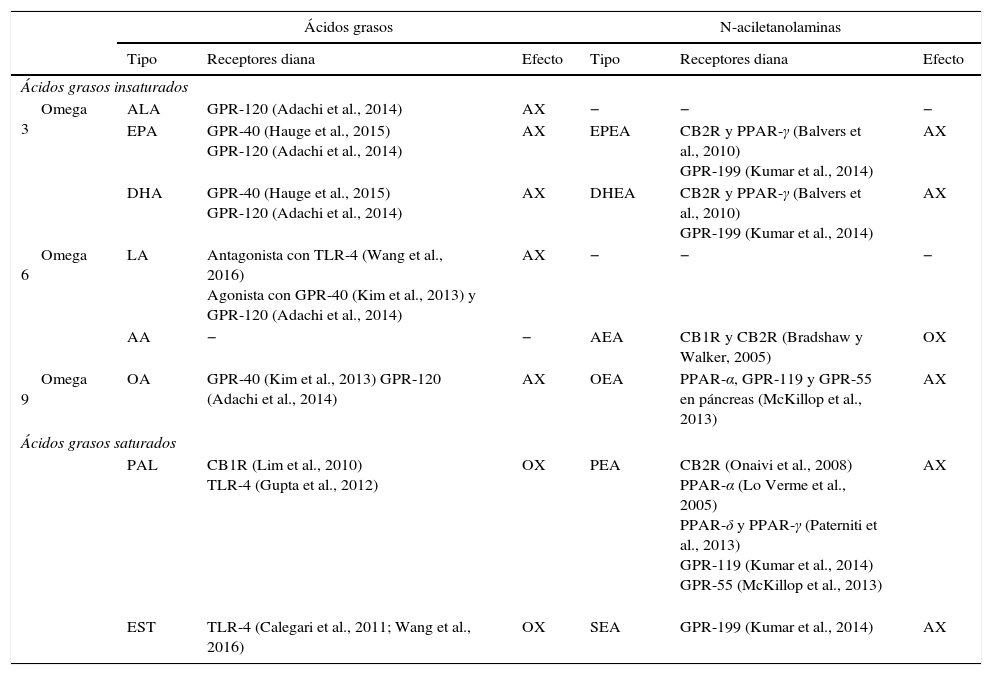
Efecto de los principales ácidos grasos y sus N-aciletanolaminas en el ciclo hambre-saciedad
| Ácidos grasos | N-aciletanolaminas | |||||
|---|---|---|---|---|---|---|
| Tipo | Receptores diana | Efecto | Tipo | Receptores diana | Efecto | |
| Ácidos grasos insaturados | ||||||
| Omega 3 | ALA | GPR-120 (Adachi et al., 2014) | AX | − | − | − |
| EPA | GPR-40 (Hauge et al., 2015) GPR-120 (Adachi et al., 2014) | AX | EPEA | CB2R y PPAR-γ (Balvers et al., 2010) GPR-199 (Kumar et al., 2014) | AX | |
| DHA | GPR-40 (Hauge et al., 2015) GPR-120 (Adachi et al., 2014) | AX | DHEA | CB2R y PPAR-γ (Balvers et al., 2010) GPR-199 (Kumar et al., 2014) | AX | |
| Omega 6 | LA | Antagonista con TLR-4 (Wang et al., 2016) Agonista con GPR-40 (Kim et al., 2013) y GPR-120 (Adachi et al., 2014) | AX | − | − | − |
| AA | − | − | AEA | CB1R y CB2R (Bradshaw y Walker, 2005) | OX | |
| Omega 9 | OA | GPR-40 (Kim et al., 2013) GPR-120 (Adachi et al., 2014) | AX | OEA | PPAR-α, GPR-119 y GPR-55 en páncreas (McKillop et al., 2013) | AX |
| Ácidos grasos saturados | ||||||
| PAL | CB1R (Lim et al., 2010) TLR-4 (Gupta et al., 2012) | OX | PEA | CB2R (Onaivi et al., 2008) PPAR-α (Lo Verme et al., 2005) PPAR-δ y PPAR-γ (Paterniti et al., 2013) GPR-119 (Kumar et al., 2014) GPR-55 (McKillop et al., 2013) | AX | |
| EST | TLR-4 (Calegari et al., 2011; Wang et al., 2016) | OX | SEA | GPR-199 (Kumar et al., 2014) | AX | |
AA: araquidónico 20:4; AEA: anandamida; ALA: α linolénico 18:3; AX: anorexigénico; DHA: docosahexaenoil 22:6; DHEA: docosahexaenoil etanolamida; EPA: eicosapentaenoico 20:5; EPEA: eicosapentaenoico etanolamida; EST: esteárico 18:0; LA: linoleico 18:2; OA: oleico 18:1; OEA: oleoiletanolamida; OX: orexigénico; PAL: palmítico 16:0; PEA: palmitoiletanolamida; SEA: estearoil etanolamida.
Aunque el consumo de LA provoca saciedad (Harden et al., 2012; Ogawa et al., 2012), este efecto solo dura los primeros minutos (Maljaars et al., 2009), debido a que este AG se convierte en AA, el cual es un precursor de AEA (Calder, 2013), cuyos niveles se elevan (Alvheim et al., 2013). Efecto que es dependiente de la cantidad de grasa ingerida, ya que entre mayor proporción de LA tenga el alimento, más se elevará la concentración de AA, lo que a su vez incrementará la AEA (Alvheim et al., 2014). Rigamonti et al. (2015) demostraron que esta última tiene un efecto orexigénico, tras realizar un experimento en personas con obesidad a las que, después de 12h de ayuno, se les proporcionó una barra de 200g de chocolate claro (1.000kcal) o su equivalente energético en pan con mantequilla. Estos autores encontraron que las personas que comieron chocolate presentaron mayores niveles de AEA, 2-AG y grelina, aunado a aumento en el apetito y disminución de la saciedad, pero sin diferir en las curvas de tolerancia a la glucosa o la insulina, efecto no atribuible a un equilibrio energético, por lo que Rigamonti et al. lo relacionaron con el fenómeno de «comer por placer».
Tanto AEA como 2-AG son agonistas de CB1R, y se ha observado —mediante microinyección de AEA en el hipotálamo de ratas— que estimulan el apetito y la ingesta de mayor cantidad de alimento. Efecto que se vio revertido con la administración de los antagonistas a CB1R: SR141716 (Jamshidi y Taylor, 2001) o AM281 (Ting, Chi, Li y Chen, 2015; Werner y Koch, 2003). En este mismo sentido, el agonista WIN55,212-2 incrementa la concentración de dopamina en la corteza prefrontal media, lo que induce mayor ingesta de alimento (Dazzi et al., 2014), mientras que su antagonista reduce el consumo de aquellos alimentos que se asocian al placer (Dore et al., 2014). Finalmente, DiPatrizio (2016) mostró que la activación de este receptor, presente en el intestino delgado, reduce la secreción de CCK y, con ello, decrementa la sensación de saciedad.
N-aciletanolaminas anorexigénicasEl consumo de OA tiene efectos benéficos en el metabolismo de la glucosa, y correlaciona con OEA (Gentilcore et al., 2006; Marí-Sanchis et al., 2011). Mennella, Savarese, Ferracane, Sacchi y Vitaglione (2015) hicieron un experimento en donde, después de ayuno de 10h, proporcionaron a personas saludables un desayuno que constaba de 30g de pan con 30ml de alguno de los siguientes aceites: girasol, girasol alto en OA u oliva. Posteriormente examinaron el efecto posprandial, midiendo la concentración de endocanabinoides a los 0, 30, 60, 90 y 120min. Mennella et al. observaron que con el consumo de aceites con alto contenido de OA fueron mayores los niveles de OEA, de modo que estas personas ingirieron menor cantidad de alimentos hipercalóricos. Esto como resultado de la unión de OEA al receptor activado de la proliferación del peroxisomas alfa (PPAR-α) presente en el intestino, el cual envía una señal —a través del nervio vagal— al núcleo supraquiasmático, en donde se induce la secreción de oxitocina, provocando sensación de saciedad. Además, OEA también es un ligando para GPR-119, presente en las células enteroendocrinasL, por lo que conduce a incremento en la secreción de GLP-1 (DiPatrizio y Piomelli, 2015).
Aunque el consumo de PAL tiene un efecto orexigénico (Cheng et al., 2015; Dinh et al., 2013), este ácido también está correlacionado con PEA (Joosten et al., 2010), el cual reduce el consumo de alimento. Raso et al. (2014) extirparon los ovarios a ratas para inducir una mayor ingesta de alimento y posteriormente suministrar durante cuatro semanas un tratamiento intraperitoneal de PEA. Las ratas fueron sacrificadas a la quinta semana, y se observó que presentaban niveles más altos de POMC y más bajos de AgRP; además, incrementaron los receptores de leptina en el hipotálamo, así como su señalización vía pSTAT3, disminuyendo los niveles de mediadores de resistencia a insulina, como el supresor de la señalización de citoquinas3 y la proteína-tirosina fosfatasa1B. En experimentos agudos también se ha encontrado que PEA, a través de la activación de CB2R, disminuye la ingesta de alimento. Diversos estudios respaldan la participación de este receptor en el ciclo hambre-saciedad. Onaivi et al. (2008) reportaron un experimento con ratones (cepas: C57BL/6, BALB/c y DBA/2), a los que después de ayuno de 12h les administraron el antagonista a CB2R AM630 o PEA (en ambos casos, 10mg/kg). Posteriormente los ratones fueron colocados en jaulas protegidas de la luz, con comida, y se midió la ingesta de alimento a los 30min, 1, 2, 4, 12 y 24h, observándose que con PEA disminuyó el consumo en las tres cepas, efecto que fue revertido al administrar AM630. Efecto antagónico que se ha documentado tanto en ratas bajo condición de ayuno (Werner y Koch, 2003) como en aquellas otras inyectadas con grelina para inducir apetito (Ting et al., 2015). Adicionalmente, la activación del CB2R incrementa la secreción de insulina (Suijun, Zhen, Ying y Yanfang, 2014), ya que su agonismo con JWH015 da como resultado que, en presencia de glucosa, aumenten los niveles de calcio, lo que provoca a su vez una mayor producción de insulina (Li, Jones y Persaud, 2010).
En lo que respecta a PEA, este puede activar al receptor PPAR-alfa de manera similar a OEA (Avraham et al., 2013), por lo que es probable que también pueda inhibir el apetito por medio de esa vía. Por su parte, OEA puede activar al receptor acoplado a proteína G-55 (GPR-55), presente en células β del páncreas, lo que estimula la secreción de insulina, al promover cambios en la concentración intracelular de calcio y AMPc (McKillop, Moran, Abdel-Wahab y Flatt, 2013). De igual forma se ha demostrado el efecto orexigénico del consumo de EST (Wang et al., 2016). Sin embargo este AG está correlacionado con SEA (Joosten et al., 2010), el cual tiene efectos anorexigénicos. Esto lo demostraron Terrazzino et al. (2004) al hacer un experimento agudo con ratones BALB/c, a los que después de ayuno de 18h les fue administrado (vía oral o intraperitoneal) el vehículo y SEA, PEA, OEA o LEA, para después poner en contacto a los roedores con alimento y medir su consumo a 1 y 2h, observándose que la administración por ambas vías mostró efectos anorexigénicos, a manera de dosis-respuesta. Además, estos autores encontraron que el mayor efecto saciante se generó con SEA, seguido de PEA, correlacionándose con una menor expresión de SCD-1, enzima asociada a los problemas de obesidad (Borengasser et al., 2012), comprobándose que al inhibirla o reducirla disminuye la curva de tolerancia a la glucosa, al aumentar la sensibilidad a la insulina (Kim et al., 2011).
Al respecto, se ha propuesto que las NAE pudieran regular la secreción de insulina a través del receptor acoplado a proteína GPR-199, presente en células β del páncreas (Sakamoto et al., 2006), ya que su agonismo incrementa el AMPc, al activar dicho receptor con OEA, PEA, LEA, SEA, DHEA o eicosapentaenoico etanolamida (EPEA) (Kumar, Kumar y Song, 2014). Además, en un estudio con personas delgadas vs. personas con obesidad (Di Marzo et al., 2009), se observó que las primeras mostraron menores niveles basales de AEA, que disminuyeron a los 60min de haber ingerido glucosa; en cambio, en las personas con obesidad tardaron 3h. Di Marzo et al. señalan que la insulina es la responsable de que disminuya AEA, fenómeno estrechamente relacionado con los indicadores antropométricos.
Por otra parte, se sabe que ALA es precursor de EPA y DHA, los que a su vez son precursores de EPEA y DHEA, respectivamente (Calder, 2013). Por ende, el consumo de estos AG reduce la producción endógena de AA y, con ello, también los niveles de 2-AG y AEA, además de incrementar el ácido ribonucleico mensajero (mRNA) de los receptores para la insulina y GLUT-4 en el músculo (Alvheim et al., 2012). Tanto EPEA como DHEA activan los receptores CB2R y PPAR-gamma (PPAR-γ), como lo demostraron Balvers et al. (2010) al realizar un cultivo de preadipocitos 3T3-L1 y estimularlos con lipopolisacáridos, EPEA y DHEA. Estos autores encontraron que disminuyó la concentración de IL-6, efecto que se vio reducido al bloquear uno de los dos receptores evaluados. Por tanto, es a través de dichas vías que pueden actuar estas NAE y provocar una sensación de saciedad.
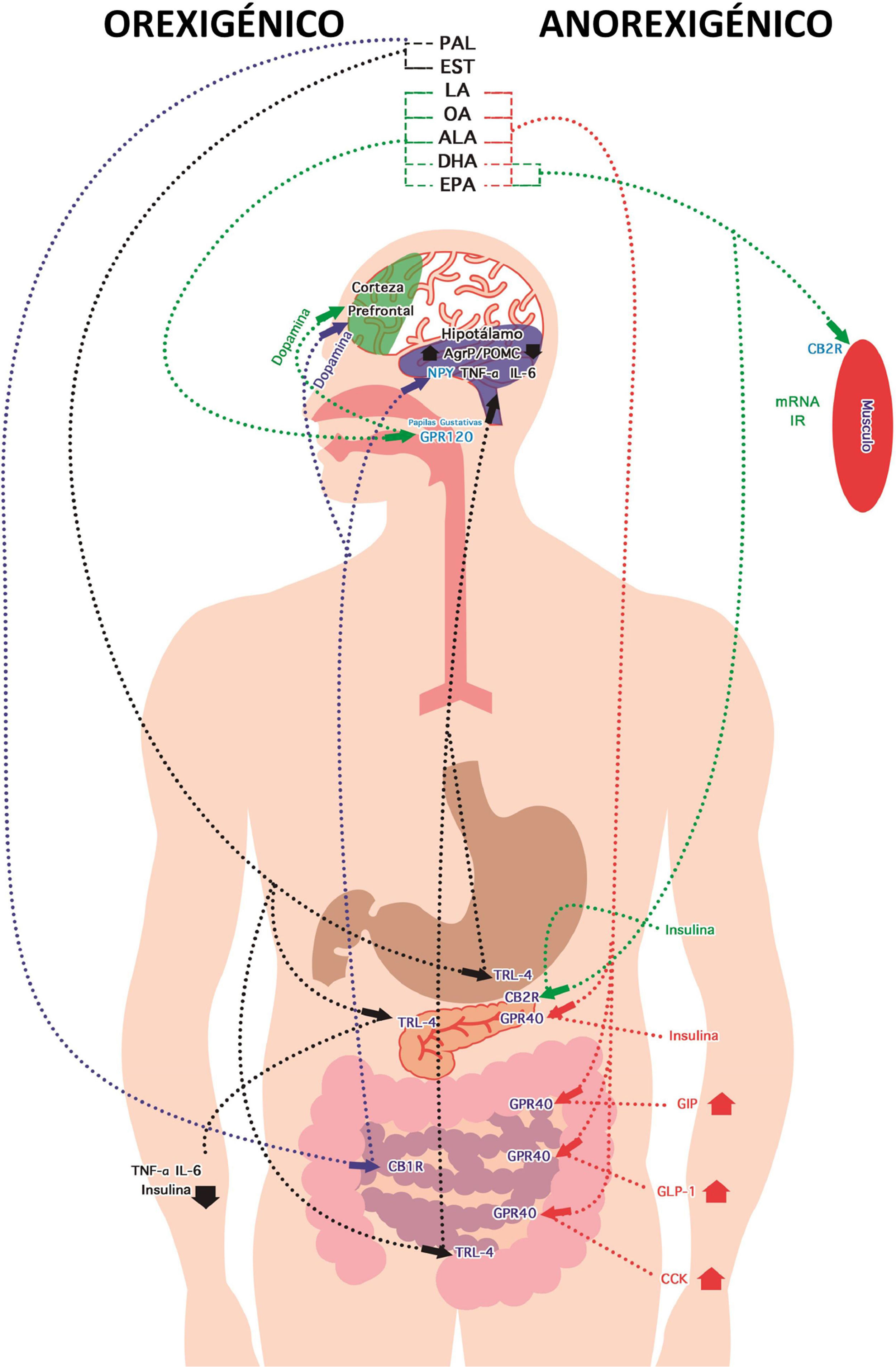
RecomendacionesDebe generarse un equilibrio en el ciclo hambre-saciedad regulado por el tipo de AG consumido, así como de las NAE derivadas de este. Por tanto, la cantidad de alimento consumido puede estar regulada por la composición de los AG que se ingieren (fig. 2). De manera general, entre más PAL y EST estén presentes, mayor efecto orexigénico se tendrá, lo que elevará el apetito, pero esto se verá revertido conforme incremente la concentración de otros AG, como OA, LA, ALA, EPA o DHA, que —por el contrario— tienen un efecto saciante. Así, el consumo de CR rica en PAL y EST (Barrado et al., 2007, 2008; Rubio, 2002) induce mayor apetito y demora la saciedad, ya que las NAE responsables de esto tardarán al menos 15min en comenzar a sintetizarse (Mennella et al., 2015a). Por tanto, dependiendo del tipo de AG consumido, y el receptor al que se una, se tendrá un efecto en la regulación de señales y hormonas que pueden alterar el metabolismo (Milligan, Ulven, Murdoch y Hudson, 2014) o el ciclo hambre-saciedad. Es por esta razón que se debe tener en cuenta la combinación de AG de los alimentos, ya que en base a ello se secretarán diferentes tipos de hormonas (Mennella et al., 2015a).
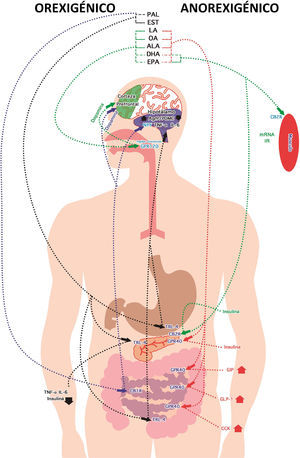
Efecto de los ácidos grasos en el ciclo hambre-saciedad. Orexigénico: el ácido palmítico (PAL) activa al receptor cannabinoide tipo1 (CB1R), induciendo incremento de neuropéptidoY (NPY). El ácido palmítico (PAL) y el ácido esteárico (EST) activan al receptor Toll tipo4 (TLR-4), incrementando el factor de necrosis tumoral-alfa (TNF-α), la interleucina6 (IL-6) y la relación entre la proteína relacionada con Agouti y la proopiomelanocortina (AgRP/POMC). Los ácidos linoleico (LA), oleico (OA), αlinolénico (ALA), docosahexaenoil (DHA) y eicosapenenoico (EPA) activan al receptor acoplado a proteína G 120 (GPR-120), induciendo aumento de dopamina. Anorexigénico: LA, OA, ALA, DHA y EPA activan al receptor acoplado a proteínaG40 (GPR-40), incrementando al polipéptido inhibidor gástrico (GIP), glucagón tipo1 (GLP-1) y colecistoquinina (CCK). DHA y EPA mejoran la secreción y la sensibilidad a insulina a través del receptor cannabinoide tipo2 (CB2R).
En México existe un consumo elevado de dietas ricas en hidratos de carbono y grasas saturadas (Estrada-Velasco et al., 2015), lo que provoca retraso en la saciedad y motivación para ingerir mayor cantidad de alimento. Un ejemplo de ello se encontró en el estudio realizado por Díaz y Franco (2012) con residentes de la zona norte y centro del país, quienes encontraron que aunque los participantes juzgaron como poco saludables los tacos (i.e., carne asada o frita envuelta en tortillas) y los sopes (i.e., tortillas gruesas de masa que se fríen en aceite, a las que encima se les ponen frijoles y queso, pero que además se las suele complementar con chorizo o algún tipo de carne), los consumen al menos una vez al mes.
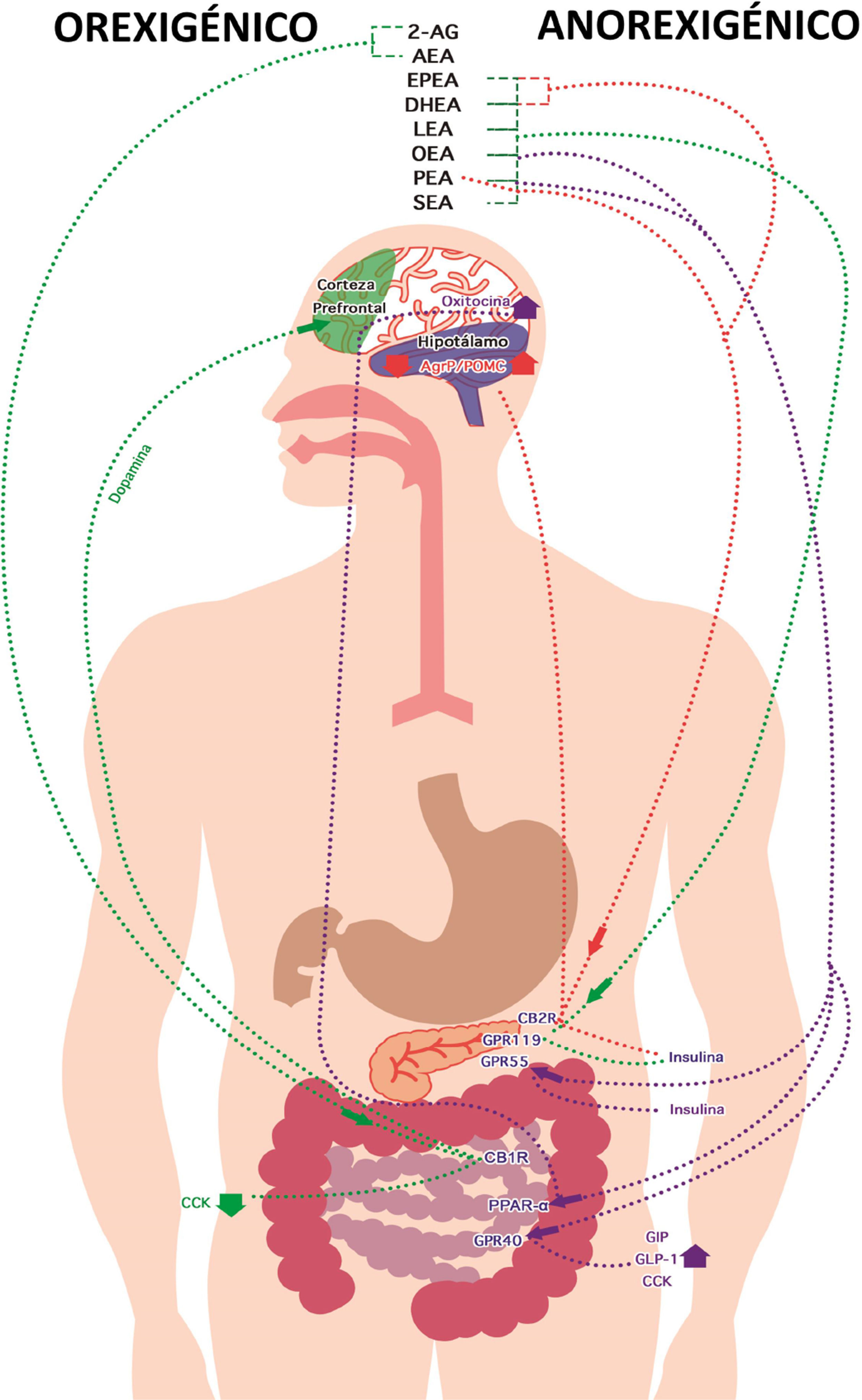
En alguna parte del proceso de elaboración de la mayoría de la CR, los ingredientes se fríen con aceite y, dependiendo del tipo de alimento, es la cantidad de aceite que absorberá. Por ejemplo, los alimentos cubiertos de harina absorben 15% del aceite usado en la cocción, 20% los empanizados y masa dulce, 10% las papas fritas «a la francesa» y 40% las papas fritas en rodajas (Montes et al., 2016), por lo que es necesario utilizar aceites con bajos niveles de AG orexigénicos y altos de anorexigénicos. Por ende, según los AG que se consumen, existe un equilibrio resultado de las NAE que se producen después de la ingesta de alimento, ya que muchas de ellas ayudan a regular el ciclo hambre-saciedad, al presentar efectos opuestos a su precursor. Tal es el caso de PEA y SEA, que inducen un efecto saciante, aunque estén correlacionadas con PAL y EST, respectivamente; o de AEA, que está relacionado con el «comer por placer», mostrando un efecto orexigénico, y correlacionándose con LA y AA (fig. 3). Por tanto, lo recomendable es ingerir alimentos que promuevan una concentración elevada de NAE e induzcan saciedad.
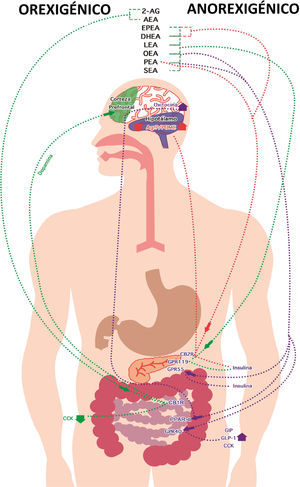
Efecto de las N-aciletanolaminas derivadas de ácidos grasos en el ciclo hambre-saciedad. Orexigénico: 2 araquidonilglicerol (2-AG) y anandamida activan al receptor cannabinoide tipo1 (CB1R), lo que disminuye la secreción de colecistoquinina (CCK) y aumenta la de dopamina. Anorexigénico: Eicosapentaenoico etanolamida (EPEA), docosahexaenoil etanolamida (DHEA), N-linoleoil etanolamina (LEA), oleoiletanolamida (OEA), palmitoiletanolamida (PEA) y estearoil etanolamida (SEA) activan al receptor acoplado a proteínaG119 (GPR-119) en el páncreas, incrementando la secreción de insulina. OEA y PEA activan al receptor acoplado a proteínaG55 (GPR-55), al receptor PPAR-alfa (PPAR-α) y GPR-40, lo que incrementa la secreción de insulina, oxitocina, polipéptido inhibidor gástrico (GIP), glucagón tipo1 (GLP-1) y CCK. EPEA, DHEA y PEA activan al receptor cannabinoide tipo2 (CB2R), aumentando la insulina y disminuyendo la relación entre la proteína relacionada con Agouti y la proopiomelanocortina (AgRP/POMC).
La ingesta de CR es uno de los factores que intervienen en el incremento de la cantidad de alimento consumido y, por tanto, del riesgo de desarrollar sobrepeso u obesidad. Entre los AG que contiene la CR destacan PAL y EST, que tienden a aumentar las señales orexigénicas que exacerban el apetito y el deseo de «comer por placer», además de que se relacionan con inflamación y resistencia a la insulina. Por tanto, en el proceso de elaboración de alimentos sería recomendable utilizar AG que promuevan de manera directa una disminución en la ingesta de alimento (e.g., OA, LA, ALA, EPA, DHA), o de AG precursores de NAE (e.g., EPA, DHA, OA), que incrementen las señales anorexigénicas.
FinanciaciónConsejo Nacional de Ciencia y Tecnología (CONACYT), a través de la beca No. 267736
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
| Abreviatura | Definición | Abreviatura | Definición |
|---|---|---|---|
| 2-AG | 2 araquidonilglicerol | GPR-120 | Receptor acoplado a proteína G 120 |
| AA | Ácido araquidónico | GPR-199 | Receptor acoplado a proteína G 199 |
| AEA | Anandamida | ICV | Intracerebroventricular |
| AgRP | Proteína relacionada con Agouti | IL-6 | Interleucina 6 |
| AG | Ácido graso | IR | Receptor a insulina |
| ALA | Ácido α linolénico | LA | Ácido linoleico |
| CB1R | Receptor cannabinoide tipo 1 | LEA | N-linoleoil etanolamina |
| CB2R | Receptor cannabinoide tipo 2 | NAE | N-aciletanolaminas |
| CCK | Colecistoquinina | NPY | Neuropéptido Y |
| CIH | Células inmortales del hipotálamo | OA | Ácido oleico |
| CR | Comida rápida | OEA | Oleoiletanolamida |
| DHA | Ácido docosahexaenoil | PAL | Ácido palmítico |
| DHEA | Docosahexaenoil etanolamida | PEA | Palmitoiletanolamida |
| EPA | Ácido eicosapentaenoico | POMC | Proopiomelanocortina |
| EPEA | Eicosapentaenoico etanolamida | PPAR-γ | Receptor PPAR-gamma |
| EST | Ácido esteárico | PYY | Péptido tirosina-tirosina |
| GLP-1 | Glucagón tipo 1 | SEA | Estearoil etanolamida |
| GLUT-1 | Transportador de glucosa 1 | THL | Tetrahidrolipstatina |
| GLUT-4 | Transportador de glucosa 4 | TNF-α | Factor de necrosis tumoral-alfa |
| GPR-40 | Receptor acoplado a proteína G 40 | TLR-4 | Receptor Toll tipo 4 |
| GPR-55 | Receptor acoplado a proteína G 55 | SCD-1 | Estearoil-CoA desaturasa-1 |
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.