El factor de crecimiento transformante β3 (TGF-β3) y el receptor III del factor de crecimiento transformante β (TGFβ-RIII), regulan las interacciones epitelio-mesenquimales. La falta de expresión de TGF-β3 y del TGF-βRIII provoca defectos en la fusión palatina.
ObjetivoObservar la inmunoexpresión del TGF-β3 y del TGF-βRIII en pacientes pediátricos con paladar hendido (PH), completo o incompleto no sindrómico.
Material y métodosEl diseño de estudio fue observacional, descriptivo, prospectivo y transversal. La muestra consistió de 20 pacientes con PH completo e incompleto, de cinco a 28 meses de edad. Se tomaron muestras del mucoperiostio de la hendidura palatina durante la palatoplastia. Para realizar la inmunohistoquímica, las muestras se procesaron en un aparato VENTANA BenchMark Ultra, con el anticuerpo TGF-β3 y TGFβ-RIII. Se valoró su expresión, mediante impresión global celular.
ResultadosLa inmunoexpresión del TGF-β3 fue mayor en las células epiteliales que en los fibroblastos de pacientes con PH completo e incompleto; sin embargo, la inmunoexpresión del TGFβ-RIII fue mayor en los fibroblastos que en células epiteliales de pacientes con paladar hendido completo.
ConclusionesSe concluyó que la falta de expresión del TGFβ-RIII en epitelio, podría tener relación con la falta de fusión de las crestas palatinas. Sería de gran interés realizar un análisis más profundo de la expresión de TGF-β3 y TGFβ-RIII, en distintas poblaciones celulares.
Transforming growth factor β3 (TGF-β3), and receptor III of transforming growth factor β (TGFβ-RIII), regulate epithelial mesenchymal interactions. The lack of TGF-β3 and TGFβ-RIII expression causes defects in palatal fusion.
ObjectiveTo observe the immunoexpression of TGF-β3 and TGFβ-RIII in pediatric patients with non-syndromic complete or incomplete cleft palate (CP).
Material and methodsThe study design was observational, descriptive, prospective and transversal. Samples were taken from 20 complete and incomplete CP patients from five to 28 months of age. Samples of mucoperiostium were removed from the cleft in the palate during palatoplasty. In order to perform immunohistochemistry, samples were processed with VENTANA Benchmark Ultra equipment, using TGF-β3 and TGFβ-RIII antibody. Immunoexpression was evaluated by means of global cell impression.
ResultsTGF-β3 immunoexpression was greater in epithelial cells than in fibroblasts of patients with complete and incomplete CP; however, TGFβ-RIII immunoexpression was greater within the fibroblasts than in epithelial cells of patients with complete cleft palate.
ConclusionsIt was concluded that the lack of TGFβ-RIII expression in the epithelium may be related to the lack of fusion of the palatal shelves. It would be of great interest to perform a more in-depth analysis of the expressions of TGF-β3 and TGFβ-RIII within different cell populations.
Durante la palatogénesis, la expresión del factor de crecimiento transformante β1 (TGF-β1) y el TGF-β2 aceleran la fusión de los procesos palatinos,1,2 mientras que el TGF-β3 que es sintetizado por células mesenquimales, contribuye a la dispersión del epitelio del borde medio (EBM) durante la fusión palatina,3–5 además regula las interacciones del epitelio con las células mesenquimales involucradas en la formación de paladar, piel, dientes, glándulas, entre otros órganos,6–9 por lo que la falla de señalamiento tanto del TGF-β como de la proteína morfogenética de hueso (BPM) conlleva a una variedad de deformidades craneofaciales incluyendo el paladar hendido.10
Por otra parte, el receptor tipo III, también llamado β-glucano, se distribuye en células mesenquimales y epiteliales, se puede unir a todas las isoformas del TGF-β,11 el cual puede ser anclado a la membrana o secretado en forma soluble,12–14 la pérdida del TGFβ-RIII impide la elongación del proceso palatino y su elevación, lo que ocasiona la hendidura,15 esto se da en parte por una reducción de la expresión de los genes TGF-β y el receptor tipo I de BMP, provocando una supresión del señalamiento hacia el TGFβ-RIII, que afecta el equilibro de dicha señalización para la formación apropiada del tejido.16
En algunos estudios realizados para evaluar la palatogénesis por medio de inmunohistoquímica, en muestras murinas in vivo e in vitro, se determinó que la expresión de TGF-β3, y TGFβ-RIII,17 en el paladar ocurre cuando las crestas tenían una orientación vertical, esta inmunoexpresión fue localizada en células epiteliales.
La distribución epitelial se conservó durante la elevación de las crestas palatinas, y destrucción del epitelio medial. Posterior a la fusión palatina, se observó una baja expresión de TGF-β3,17–22 por lo que algunos estudios previos mostraron inhibición de la señalización para la activación del TGF-β3 en muestras murinas tomadas del paladar hendido.23,24 No obstante, ratones deficientes en la expresión de TGF-β3 mostraron defectos en la fusión palatina, por lo que la expresión del TGF-β3 se limitó estrictamente al epitelio de la línea palatina media en prefusión.25–29
En cuanto al receptor, en un estudio experimental de ratón, se demostró que la expresión del TGFβ-RIII durante la palatogénesis ocurre a través del epitelio, y se localiza específicamente en el epitelio del borde medio durante la fusión de las crestas palatinas.30–32 Además, debido a la falta de la expresión de éste, conlleva a una alteración en la proliferación e inducción de apoptosis celular, así como a una afección endotelial, reducción de células mesenquimatosas, el cual afecta el desarrollo de osteoblastos.33
El objetivo del presente estudio, fue el de determinar la inmunoexpresión del TGF-β3 y del TGFβ-RIII en una muestra de tejido de la hendidura de pacientes infantiles con paladar hendido completo o incompleto no sindrómico, tratados con palatoplastia.
Previo a la toma de la muestra, se firmó el consentimiento informado y aprobación de la toma de muestra por el Comité Ético de Investigación del Hospital General «Dr. Manuel Gea González» y de los padres o tutores de cada paciente.
MATERIAL Y MÉTODOSSelección de la muestraLa muestra consistió en 18 pacientes que presentaron paladar hendido completo, y dos pacientes con paladar hendido incompleto; ambos no sindrómicos, de los cuales, ocho fueron del sexo femenino y 12 masculino, de cinco a 28 meses de edad, todos ellos programados para palatoplastia por primera vez.
Durante el estudio se procedió a recolectar una muestra de tejido sobrante del procedimiento quirúrgico, mismo que fue otorgado por el cirujano plástico a cargo, quien proporcionó el tejido sin implicar un riesgo adicional para la salud de los pacientes.
El tejido fue tomado de la mucosa del paladar de la hendidura de 0.3 a 0.5 cm, el cual fue fijado con formol en una solución buffer de fosfato al 10% (MEYER), las muestras fueron guardadas a 4 oC, durante ocho horas, posteriormente se colocaron en una solución de PBS.
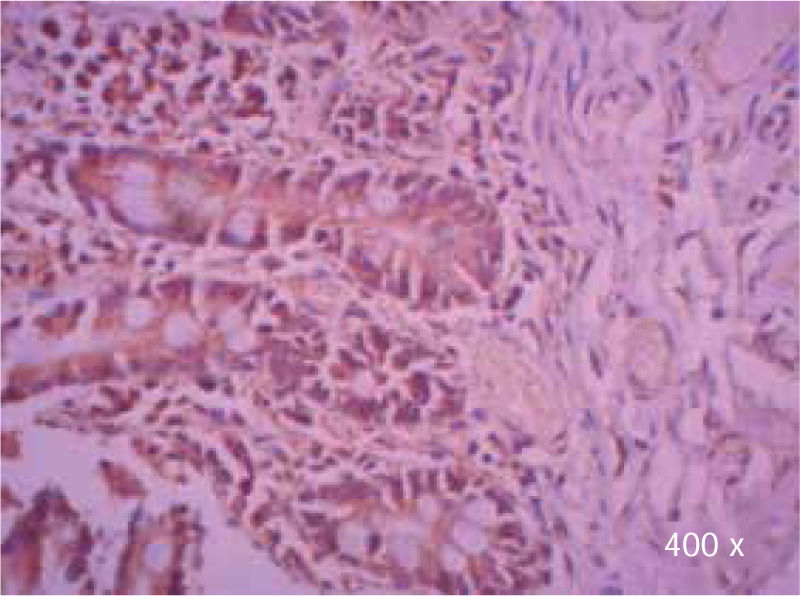
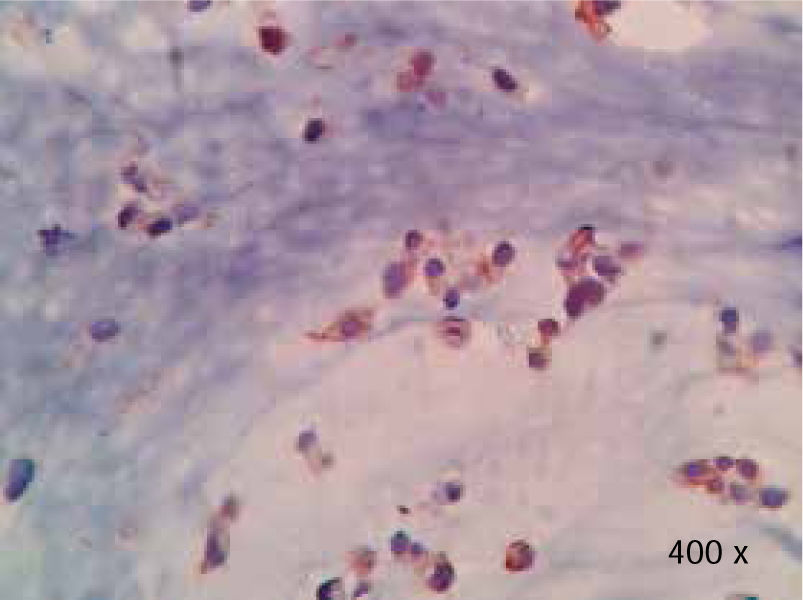
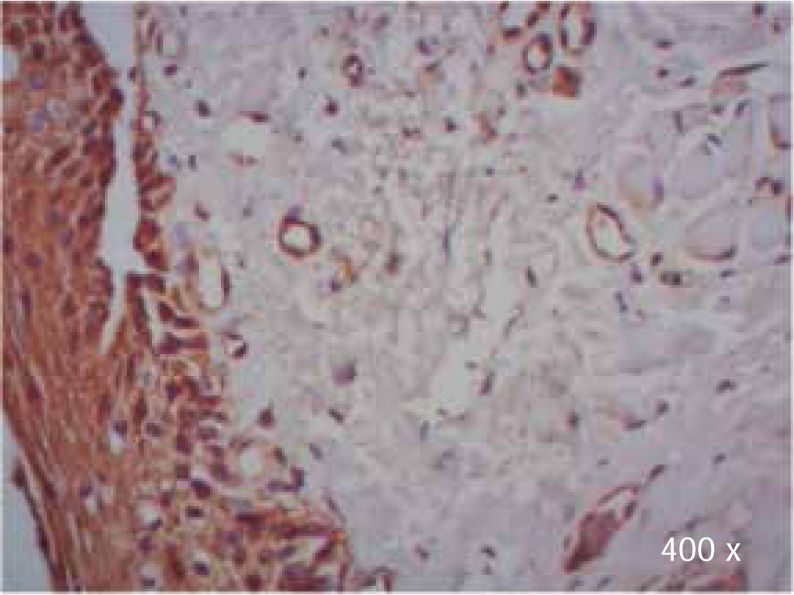
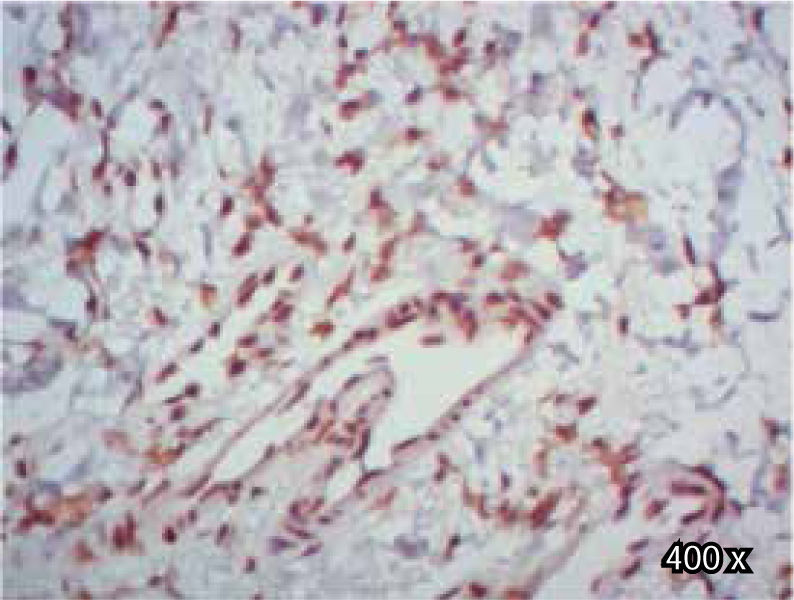
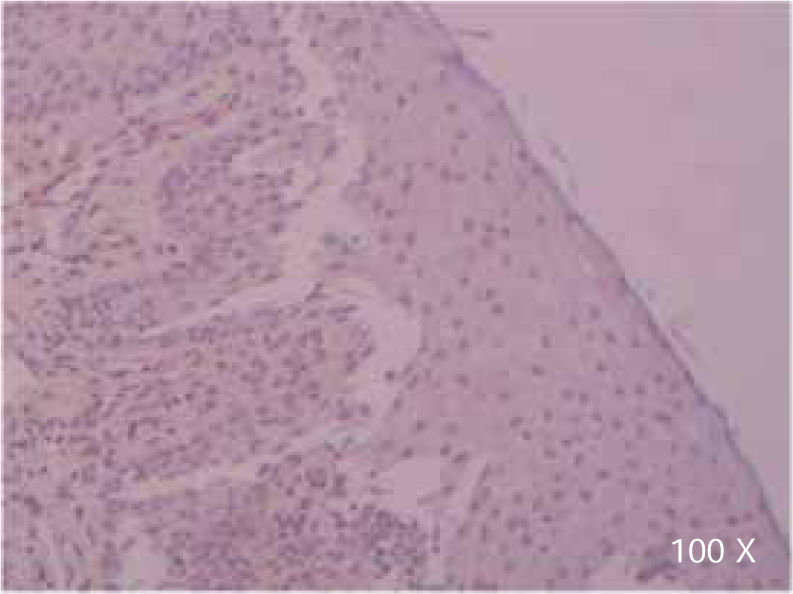
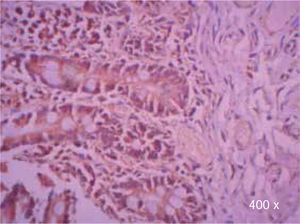
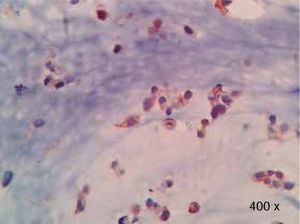
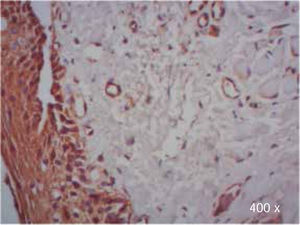
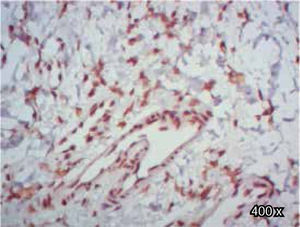
Preparación de la inmunohistoquímica para TGF-β3 y TGFβ-RIIISe realizaron cortes de cada muestra, de 3μ cada uno, con su respectivo control. El anticuerpo del TGF-β3 fue probado previamente en muestras de intestino delgado (Figura 1), mientras que el anticuerpo del TGFβ-RIII se probó previamente en muestras de la línea celular HepG2 (Figura 2), y páncreas de humano.
Las muestras de tejido, se dejaron secar y desparafinar a 60 oC durante toda la noche. La inmunohistoquímica se corrió en un aparato VENTANA BenchMark Ultra.
Para el anticuerpo monoclonal primario TGFβ-RIII (ab78421, abcam), se utilizó el sistema de detección UltraView (Referencia 760-500, lote E06611, caducidad 20-09-2016). Se seleccionó la opción de desparafinado a 72 oC, se realizó un acondicionamiento celular (CC1) por 20 minutos, el anticuerpo primario se incubó 20 minutos a 36 oC.
Para el anticuerpo policlonal TGF-β3 (sc-82, Santa Cruz Biotechnology, Inc.), se utilizó el sistema de detección OptiView (Referencia 760-700, lote F08259, caducidad 28-10-2017). Se seleccionó la opción de desparafinado a 72 oC, con el acondicionamiento celular (CC1) por 16 minutos, el anticuerpo se incubó por 12 minutos a 36 oC.
Evaluación de la expresión del TGF-β3 y TGFβ-RIII por medio de inmunohistoquímicaSe realizó la observación de los tejidos en un microscopio binocular (Axio Lab. A1). Las imágenes se tomaron con una cámara ZEISS Axiocam ERc 5s.
La observación y evaluación estuvo a cargo de un patólogo experto, quien valoró la presencia o ausencia de expresión de TGF-β3 y del TGFβ-RIII en las muestras, mediante la impresión global de las células que resultaron teñidas en diferentes zonas del tejido de la hendidura evaluado.
Análisis estadísticoLa información se analizó en el paquete estadístico SPSS, v 20.0. Se utilizó estadística descriptiva. Para las variables cualitativas, se emplearon porcentajes, y para las variables cuantitativas se emplearon medidas de tendencia central y dispersión.
Se utilizó χ2 para las variables nominales, para comparar, expresión de TGF-β3 y TGFβ-RIII, con paladar hendido completo e incompleto.
El nivel de significancia fue establecido cuando p < 0.05.
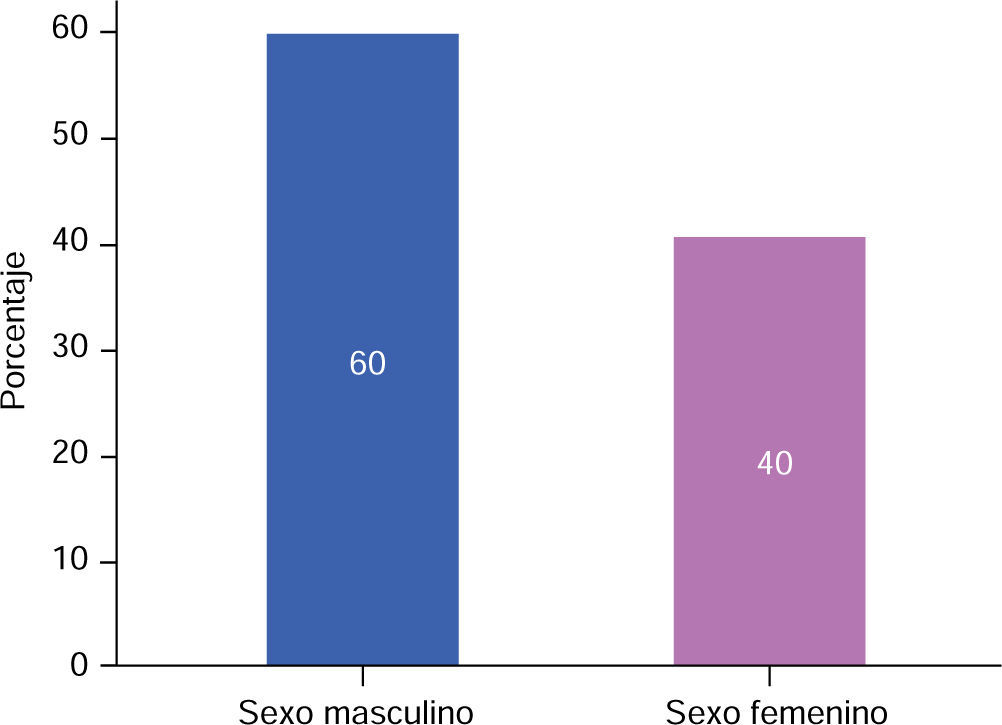
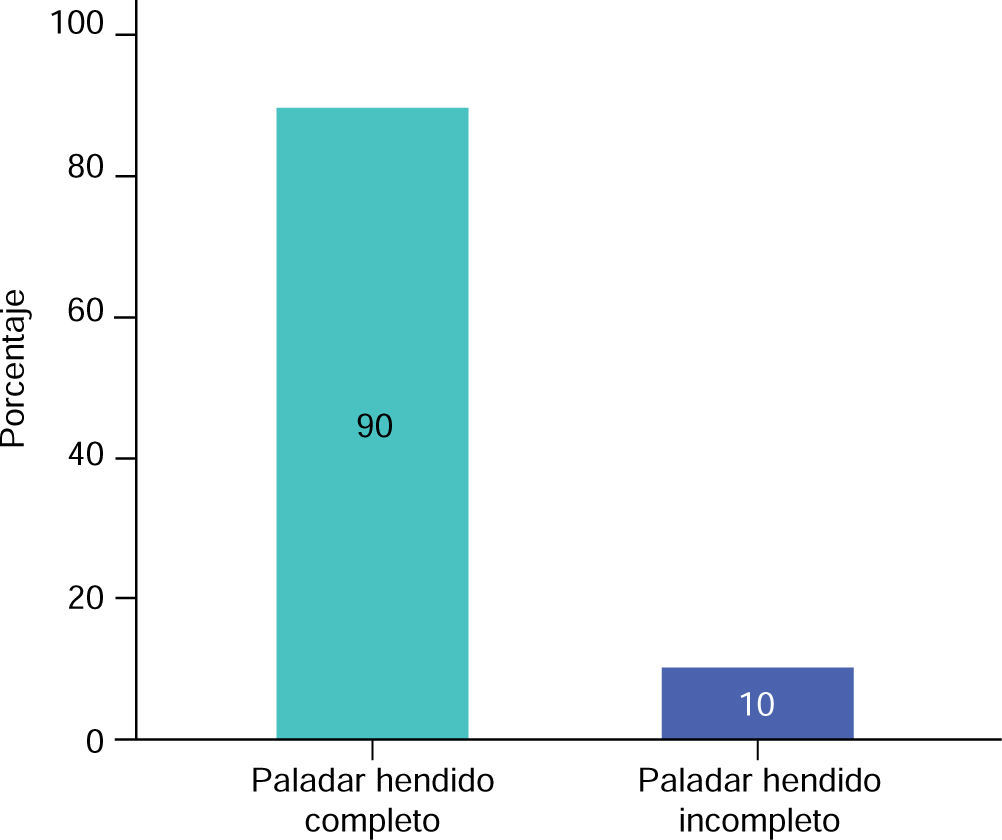
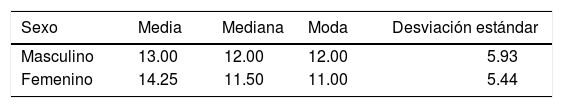
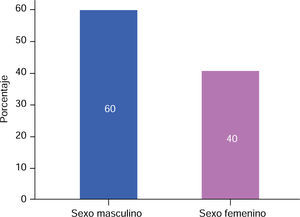
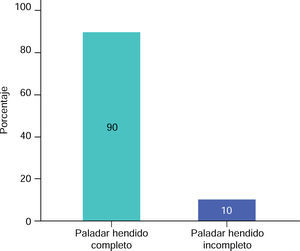
RESULTADOSEn este estudio la muestra de pacientes del sexo masculino, correspondió al 60% (Figura 3), con una media de 13.00 ± 5.93 meses de edad (Cuadro I), mientras que en los pacientes del sexo femenino correspondió al 40% (Figura 3), con una media de 14.25 ± 5.44 meses de edad (Cuadro I), de los cuales resultaron el 90% de casos con paladar hendido completo y 10% con paladar hendido incompleto (Figura 4).
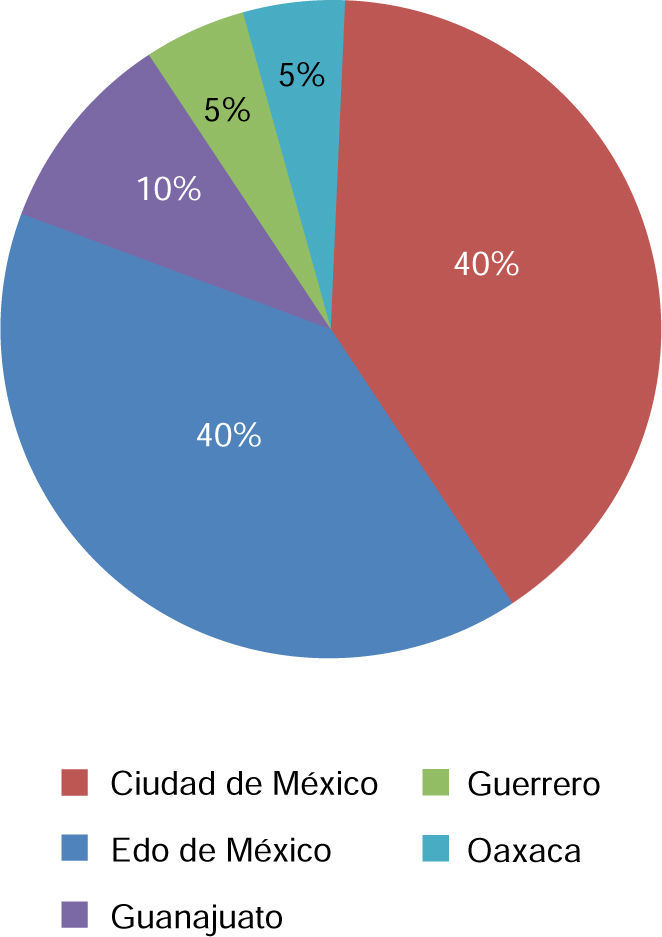
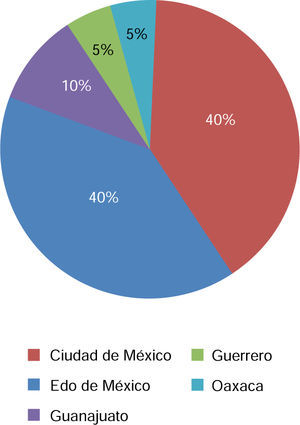
Los pacientes provenían del Estado de México (40%), Ciudad de México (40%), Guerrero (10%), Guanajuato (5%) y Oaxaca (5%) (Figura 5).
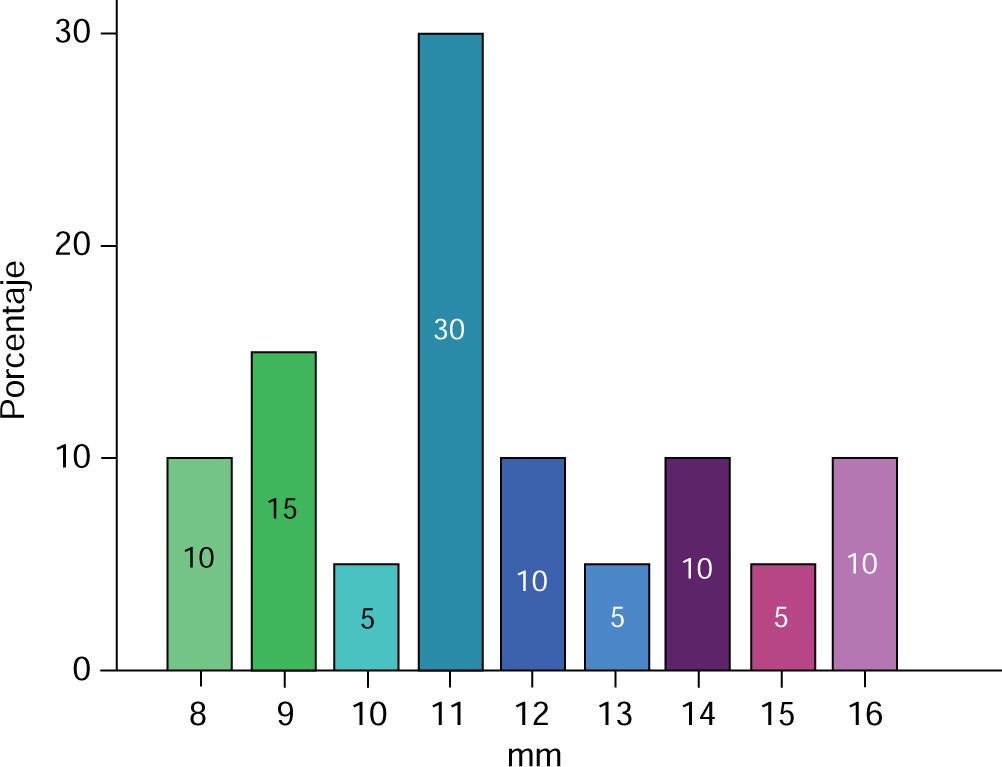
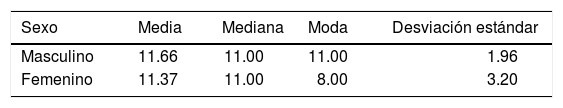
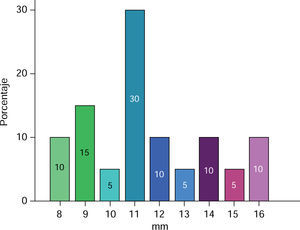
La medida de la hendidura palatina fue de 8 a 16 mm (Figura 6), la media para pacientes masculinos fue de 11.66 ± 1.96 mm y en pacientes femeninos de 11.37 ± 3.20 mm (Cuadro II).
Se observó mayor tamaño de la hendidura palatina en muestras de paladar hendido completo (11.83 ± 2.40), que en paladar hendido incompleto (9.00 ± 1.41).
Al comparar la frecuencia con la que se expresó TGF-β3 y TGFβ-RIII, se encontró lo siguiente:
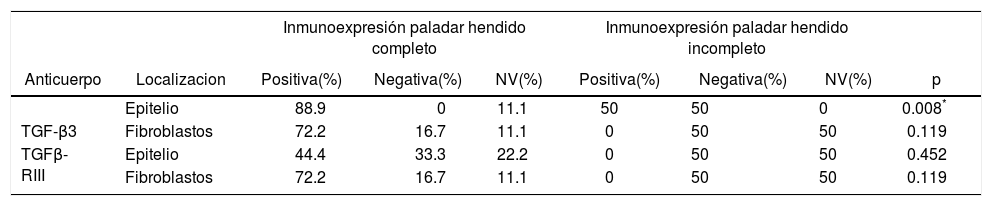
Se observó mayor expresión positiva de TGF-β3, en la membrana y citoplasma de células epiteliales, que en la membrana y citoplasma de fibroblastos en muestras de paladar hendido completo e incompleto (Cuadro IIIyFiguras 7y8).
*χ2. Expresión de TGF-β3 y TGFβ-RIII en células epiteliales y fibroblastos de paladar hendido completo e incompleto. Se observó mayor expresión positiva de TGF-β3, en epitelio, y mayor expresión positiva de TGFβ-RIII en fibroblastos
| Anticuerpo | Localizacion | Inmunoexpresión paladar hendido completo | Inmunoexpresión paladar hendido incompleto | p | ||||
|---|---|---|---|---|---|---|---|---|
| Positiva(%) | Negativa(%) | NV(%) | Positiva(%) | Negativa(%) | NV(%) | |||
| TGF-β3 | Epitelio | 88.9 | 0 | 11.1 | 50 | 50 | 0 | 0.008* |
| Fibroblastos | 72.2 | 16.7 | 11.1 | 0 | 50 | 50 | 0.119 | |
| TGFβ-RIII | Epitelio | 44.4 | 33.3 | 22.2 | 0 | 50 | 50 | 0.452 |
| Fibroblastos | 72.2 | 16.7 | 11.1 | 0 | 50 | 50 | 0.119 | |
En cuanto al TGFβ-RIII, se observó mayor expresión positiva en membrana y citoplasma de fibroblastos, que en membrana y citoplasma de células epiteliales, de paladar hendido completo. En muestras de paladar hendido incompleto, se observa tinción negativa de TGFβ-RIII (Cuadro IIIyFigura 9).
Al realizar la prueba de χ2, se observa p = 0.008* en casos de paladar hendido completo e incompleto, con expresión en TGF-β3, lo cual podría indicar una diferencia entre las poblaciones de estudio en cuanto al tipo de paladar hendido, por lo que sería importante aumentar el número de muestras de paladar hendido incompleto en estudios posteriores (Cuadro III).
DISCUSIÓNEste estudio determinó la inmunoexpresión del TGF-β3 y del TGFβ-RIII en una muestra de tejido de la hendidura completa e incompleta de pacientes masculinos y femeninos que fueron sometidos a palatoplastia en el Hospital General «Dr. Manuel Gea González». Dicha expresión fue evaluada por inmunohistoquímica en la membrana y citoplasma de células epiteliales y fibroblastos del tejido de la hendidura palatina en pacientes dentro de los primeros tres años de edad, de tal forma que este estudio representa uno de los primeros realizados en humanos, posterior al periodo embrionario. Al comparar la edad entre ambos sexos no se encontraron diferencias significativas, debido al protocolo de selección para realizar la cirugía de paladar hendido, llevado a cabo por el Departamento de Cirugía Plástica y Reconstructiva.
Por otro lado, las muestras evaluadas fueron en mayor cantidad en los pacientes con hendidura completa en comparación con hendidura incompleta, además, no hubo diferencia significativa entre el ancho de la hendidura completa con el sexo femenino y masculino, lo cual se debió a que los pacientes recibieron tratamiento de ortopedia prequirúrgica previo a la palatoplastia.
Durante la evaluación de las muestras con TGF-β3 en paladar hendido completo, se observó expresión positiva en todas las células del epitelio, lo cual concuerda con los datos observados en muestras murinas.17–22
Se detectó además del epitelio escamoso correspondiente a paladar, epitelio de tipo respiratorio, debido a la anatomía patológica resultante de la falta de fusión de las crestas palatinas, la cual permite la unión entre cavidad oral y nasal.34
Se observa que el epitelio escamoso y respiratorio fue positivo en la mayoría de los casos con paladar hendido completo, lo cual concuerda con lo reportado anteriormente en humanos, que indica que se ha detectado expresión moderada de TGF-β3 en células del epitelio respiratorio.35
La comparación de la expresión entre casos de paladar hendido completo e incompleto, no resultó adecuada desde el punto de vista estadístico, sin embargo, al observar la expresión de TGF-β3 en el citoplasma de epitelio de paladar hendido completo e incompleto, se observó una tendencia hacia la mayor expresión positiva de TGF-β3 en el epitelio de paladar hendido completo.
En cambio, al evaluar la expresión de TGFβ-RIII en células epiteliales de paladar hendido completo e incompleto, se observó una tendencia hacia una menor expresión positiva en epitelio, al compararla con la expresión de TGF-β3, lo cual difiere de algunos estudios previos,30–32 en los que mostraron que la expresión del TGFβ-RIII durante la palatogénesis ocurrió en el epitelio.
Esta diferencia entre nuestros datos y lo reportado en la bibliografía, podría proponer que exista una falla de señalización en la inhibición o disminución de la expresión del TGFβ-RIII en las células epiteliales.
Sin embargo, la expresión de TGF-β3 y TGFβ-RIII en fibroblastos, no tuvo diferencias.
Por otro lado, este estudio no coincide con los realizados en muestras murinas, ya que a pesar de ser ambas especies mamíferos,36 en humanos se observa en la mayoría de las ocasiones inmunoexpresión positiva, mientras que en muestras murinas se ha detectado ausencia de inmunoexpresión tanto de TGF-β3 como de TGFβ-RIII,16,23,24,37 lo anterior podría deberse a la diferencia entre la fisiopatología en humano y en ratón.
Además de lo anterior, la presencia de la expresión de TGF-β3 y TGFβ-RIII podría estar relacionada con la edad del paciente, por lo que la edad de estudio de los pacientes, representaría otra variación en cuanto a los resultados encontrados en ratones, será necesario evaluar la expresión de TGF-β3 y TGFβ-RIII, en muestras control de pacientes sanos, de 0 a 3 años de edad.
En estudios posteriores, sería interesante explorar las diferencias entre estos tipos de paladar hendido y las células que expresan TGF-β3 y TGFβ-RIII, por lo que sería necesario incrementar el número de muestras de paladar hendido incompleto.
Los resultados del presente estudio, se relacionan con lo previamente reportado para la colocación de injertos en fisuras palatinas de pacientes con LPH, ya que al utilizar plasma rico en plaquetas, al momento de formar el coágulo, pueden desprender factores de crecimiento como el derivado de plaquetas, factor de crecimiento endotelial vascular, factor de crecimiento transformador tipo β, factor de crecimiento epidérmico, factor de crecimiento fibroblástico, entre otros, por lo que permitiría inducir la expresión del TGFβ-RIII a nivel epitelial38–40 y así consolidar el injerto óseo, por lo que ésta es una razón más para continuar incrementando las investigaciones sobre este tema.
CONCLUSIONESDespués de realizar la inmunohistoquímica del TGF-β3 y TGFβ-RIII, se concluyó que la ausencia de expresión del TGFβ-RIII en epitelio de paladar hendido completo e incompleto, podría tener relación con la falta de fusión de las crestas palatinas.
Sería de gran interés continuar analizando más a fondo su expresión en más y distintas poblaciones celulares, además de fibroblastos y células epiteliales.
A todo el personal de la División de Estomatología-Ortodoncia, y de la División de Cirugía Plástica y Reconstructiva, del Hospital General «Dr. Manuel Gea González» quien facilitó la recolección de muestras. Al personal del Departamento de Patología Molecular e Inmunohistopatología, del Instituto Nacional de Cancerología, por todas sus aportaciones, disponibilidad, y enseñanzas durante el proyecto. Principalmente agradezco a las Q.F.B. Guadalupe Moncada Claudio, y Q.F.B. María de Lourdes Peña Torres, por su gran colaboración para la realización de la inmunohistoquímica. Agradezco al Instituto de Fisiología Celular, UNAM, principalmente al M. en C. Tonatiuh Molina Villa por su aportación y apoyo para la realización de cultivos celulares, indispensables para la obtención de los controles.
Residente de la División de Ortodoncia y Estomatología del Hospital General «Dr. Manuel Gea González»
Este artículo puede ser consultado en versión completa en http://www.medigraphic.com/ortodoncia
Subdirector de Patología y Encargado del Departamento de Patología Molecular e Inmunohistopatología del Instituto Nacional de Cancerología
Profesor invitado en Ortodoncia en el Hospital General «Dr. Manuel Gea González». Profesor Investigador Titular C en la Universidad Autónoma Metropolitana
Profesor adscrito de la División de Ortodoncia y Estomatología del Hospital General «Dr. Manuel Gea González»
Investigador Titular C, S N I 2, en el Instituto de Fisiología Celular, UNAM
Médico adscrito a la División de Cirugía Plástica y Reconstructiva del Hospital General «Dr. Manuel Gea González»
Profesor Titular de Metodología de Investigación, Bioestadística, Seminario de Tesis. BRIMEX Hospital ABC