Actualmente el glaucoma es la principal causa de ceguera irreversible a nivel mundial. En muchos países como el nuestro se desconoce la prevalencia real de la enfermedad, y a nivel mundial se estima que existirán para el año 2020 aproximadamente 5.9 millones de ciegos bilaterales a causa de glaucoma primario de ángulo abierto; esta ceguera es prevenible por lo que deben de identificarse aquellas personas que debido a sus características pudieran estar en riesgo, ubicándolas bajo el diagnóstico de sospecha de glaucoma.
Glaucoma is the leading cause of irreversible blindness worldwide. In many countries like ours the actual prevalence of the disease is not know. Globally is estimated by 2020 there will be approximately 5.9 million blind due to bilateral primary open-angle glaucoma, this blindness is preventable making important to identify those people that may be at risk because of their characteristics, placing them under the diagnosis of glaucoma suspect.
Dentro de las principales causas de ceguera en el mundo, el glaucoma ocupa el segundo lugar en la población adulta, adelantado por la catarata que a diferencia de este suele ser reversible tras una muy depurada y segura intervención quirúrgica. El tercer lugar lo ocupa la degeneración macular asociada a la edad en la cual, a diferencia de sus predecesores, la ceguera causada por esta no es evitable1.
El glaucoma ocasiona ceguera irreversible como la causada por la degeneración macular asociada a la edad, sin embargo la ceguera ocasionada por glaucoma puede evitarse realizando un diagnóstico temprano y estableciendo un tratamiento oportuno. El glaucoma comienza mucho tiempo antes de que se manifieste clínicamente, existen cambios genéticos, moleculares, bioquímicos, ultraestructurales y estructurales que terminan en la mayoría de los casos en un daño funcional irreversible; esta es la razón de la terminología actual de sospechoso de glaucoma (SG), que intenta identificar a aquellos individuos en una situación limítrofe entre el estado de salud y la presencia de glaucoma.
Aún más subrayan la necesidad de un diagnóstico adecuado cifras como 79.6 millones de personas con glaucoma para el 2020, que de estos 5.9 millones tendrán una ceguera bilateral, que el 50% de los pacientes con glaucoma desconoce que lo padecen2, y todavía más alarmante, que el 50% de los pacientes bajo tratamiento antiglaucomatoso no tienen la enfermedad3.
Definición de glaucoma primario de ángulo abiertoEl propósito de clasificar a los pacientes limítrofes de padecer la enfermedad es evitar en la medida de lo posible el daño en el nervio óptico y la disminución en la calidad de vida.
La definición de glaucoma ha ido afinándose con el tiempo. La Organización Mundial de la Salud define el glaucoma como un grupo de enfermedades que convergen en el establecimiento de una neuropatía óptica característica determinada por déficit estructural y funcional1.
Para la Sociedad Europea de Glaucoma este es un grupo de neuropatías ópticas crónicas y progresivas que tienen en común cambios morfológicos característicos en la cabeza del nervio óptico y en la capa de fibras nerviosas en ausencia de otra patología ocular o anomalía congénita. A estos cambios se asocian la muerte de células ganglionares de manera progresiva y pérdida del campo visual4.
La Academia Americana de Oftalmología define el glaucoma como una neuropatía óptica progresiva del adulto en la cual la presión intraocular (PIO) y otros factores de riesgo contribuyen al daño de las células ganglionares, de sus axones y a las características patológicas de la cabeza del nervio óptico, en ausencia de otra patología ocular que las causara y en presencia de un ángulo abierto5.
Para algunos autores, estas definiciones resultan demasiado detalladas, simplificando al glaucoma como el conjunto de neuropatías ópticas que convergen en la pérdida progresiva de células ganglionares y capa de fibras nerviosas6, sin establecer claramente la diferencia entre el ritmo de pérdida de sanos y glaucomatosos, definición por demás sencilla y confusa para lo que actualmente sabemos de la patología y cómo la abordamos.
En nuestra opinión el conjunto de definiciones es lo más completo para definir correctamente la enfermedad. La de la Organización Mundial de la Salud y la de la Sociedad Europea de Glaucoma mencionan el déficit estructural y funcional de la enfermedad, siendo esto posible medirlo desde estadios muy tempranos con tecnologías como la topografía de coherencia óptica de alta definición (estructura) y con la tecnología de doble frecuencia (FDT) (función); ambas tienen un alto poder de sensibilidad y especificidad, siendo incluso comparables entre una y otra. Por otro lado, la definición de la Academia Americana de Oftalmología deja ver la importancia de la PIO como principal factor de riesgo.
Definición de sospechoso de glaucomaLa Academia Americana de Oftalmología define al SG como aquel individuo con características clínicas o conjunto de factores de riesgo que implican un riesgo mayor para el desarrollo de glaucoma primario de ángulo abierto (GPAA). Las características clínicas que definen el SG primario de ángulo abierto están determinadas por una de las siguientes en cualquiera de los ojos, con un ángulo abierto por gonioscopia7 (tabla 1).
Características del sospechoso de glaucoma según la AAO
| Apariencia sospechosa de la cabeza del nervio óptico y capa de fibras nerviosas |
| Incremento de la relación copa/disco |
| Relación copa/disco asimétrica |
| Muesca o adelgazamiento del anillo neurorretiniano |
| Hemorragia de disco (en astilla) |
| Defecto de la capa de fibras nerviosas |
| Campos visuales sospechosos de daño glaucomatoso en ausencia de signos clínicos o de otras neuropatías |
| Defecto arqueado |
| Escalón nasal |
| Escotoma paracentral |
| Defecto altitudinal |
| Incremento de la desviación media |
| Hipertensión ocular consistente con campos visuales, fibras nerviosas y cabeza de nervio óptico normales |
| Ausencia de seudoexfoliación, dispersión pigmentaria y resección angular traumática |
La hipertensión ocular (HTO) ha sido casi suprimida en la definición actual de glaucoma, debido en gran medida a la imposibilidad práctica de encontrar en el paciente con GPAA un pico hipertensivo o variabilidad en la PIO, a razón del ritmo circadiano y algunos otros factores que pueden afectar la medida de la PIO en el consultorio. Como consecuencia, la definición actual de GPAA asocia a la HTO como riesgo basándose en los diversos estudios poblacionales que demuestran de una forma u otra la importante relación entre HTO, fluctuación de la PIO y el GPAA, dentro de los cuales encontramos: el estudio colaborativo del glaucoma de tensión normal (CNTG), el estudio de tratamiento en el glaucoma de manifestación temprana (EMGT), el estudio del tratamiento de la hipertensión ocular (OHTS), el estudio colaborativo del tratamiento inicial en el glaucoma (CIGTS) y el estudio de intervención en el glaucoma avanzado (AGIS).
Estudio colaborativo del glaucoma de tensión normalEn el CNTG el objetivo del tratamiento era reducir la PIO basal en un 30% mediante tratamiento médico, trabeculoplastia o trabeculectomía. La progresión del daño glaucomatoso en el campo visual se observó en el 12% del grupo en tratamiento y en el 37% del grupo no tratado o control, después de aislar el efecto en el campo visual ocasionado por la presencia de catarata. Es importante observar que a pesar del tratamiento un 12% de los pacientes progresó, lo que puede explicarse porque no en todos los casos, a pesar de una reducción del 30% de la PIO basal, se habría logrado una PIO meta8.
Estudio de tratamiento en el glaucoma de manifestación tempranaEl EMGT comparaba el tratamiento vs. el no tratamiento del glaucoma temprano, entendiéndose por temprano el glaucoma leve. El objetivo principal era evaluar la efectividad de reducir la PIO mediante tratamiento con betaxolol y trabeculoplastia en este tipo de pacientes, determinando su progresión mediante campimetría automatizada. Se encontró que una reducción del 25% de la PIO basal disminuía el riesgo de progresión en un 50% y que por cada milímetro de mercurio reducido de la PIO basal se disminuía el riesgo de progresión en un 10%9.
Estudio del tratamiento de la hipertensión ocularEl OHTS es uno de los estudios más citados en cuanto a glaucoma y su prevención; es un estudio multicéntrico, aleatorizado, prospectivo y clínico, cuyo objetivo principal era determinar si el tratamiento médico hipotensor podía retardar o prevenir el inicio de glaucoma en pacientes con HTO. Se reclutaron 1,636 pacientes entre los 40 y los 80 años de edad, con PIO entre 21 y 34mmHg, los cuales se aleatorizaron en 2 grupos, uno que recibió tratamiento y otro grupo que no lo recibió. La PIO se redujo a 24mmHg o un 20% de la basal. El desarrollo de glaucoma se determinó por la aparición de algún defecto glaucomatoso persistente en el campo visual o en la apariencia del nervio óptico.
La proporción acumulada para desarrollar glaucoma a 60 meses de seguimiento fue del 4.4% en el grupo bajo tratamiento y del 9% en el grupo no tratado, lo que significa un 50% de disminución del riesgo de desarrollar glaucoma en el grupo bajo tratamiento hipotensor.
Esta diferencia parece incrementarse con el tiempo. Este estudio a pesar de sus debilidades es uno de los más grandes en cuanto a muestra y de los más orientadores en cuanto a la PIO y su relación con glaucoma desde el punto de vista clínico10.
Estudio colaborativo del tratamiento inicial en el glaucomaEn este se involucraron a 607 pacientes con diagnóstico reciente de GPAA. Se comparó como tratamiento inicial la trabeculectomía vs. tratamiento médico hipotensor. Se realizó un algoritmo para determinar la PIO meta de cada paciente y se observó que el tratamiento quirúrgico logró disminuir la PIO basal en un 48% comparado con un 35% logrado con medicamentos. En ambos grupos no se logró demostrar progresión campimétrica11.
A pesar de que el mejor control tensional se logra con el tratamiento quirúrgico, en este estudio conllevó un mayor riesgo de pérdida visual significativa y desarrollo de catarata. Sin embargo con las técnicas quirúrgicas actuales estos riesgos podrían estar significativamente disminuidos.
Estudio de intervención en el glaucoma avanzadoEl AGIS es un estudio multicéntrico, aleatorizado y prospectivo en pacientes con GPAA avanzado (severo) no controlado a pesar de una terapia hipotensora máxima tolerada.
Estos pacientes se aleatorizaron entre 2 secuencias de tratamientos: el primero consistía en hacer una trabeculoplastia con láser de argón, luego trabeculectomía y posteriormente una segunda trabeculectomía si la PIO no se controlaba; y el segundo consistía en hacer una trabeculectomía, luego una trabeculoplastia con láser de argón y finalmente una segunda trabeculectomía igualmente si la PIO no se controlaba.
El análisis predictivo de este estudio demostró que aquellos pacientes con PIO mayores de 17.5mmHg en las primeras 3 visitas durante los primeros 6 meses de seguimiento tenían un riesgo de deterioro mayor que aquellos pacientes con presiones por debajo de los 14mmHg en el mismo periodo de tiempo. Otros análisis realizados en este estudio muestran que a menor presión y a menor fluctuación de la PIO entre visitas el riesgo de progresión en pacientes con glaucoma avanzado es menor12.
Otros factores de riesgoExisten otros factores de riesgo importantes además de la HTO: la edad, el antecedente heredofamilar positivo de glaucoma, hipotensión arterial, excavación papilar amplia, el grosor corneal central, la miopía alta y enfermedades sistémicas.
EdadLa prevalencia de HTO en blancos no hispanos mayores de 40 años es del 4.5% (variando del 2.7 a los 40 años hasta el 7.7% en aquellos entre 75 y 79 años de edad). En latinos la prevalencia se estima en un 3.5% (variando de un 1.7% en personas entre los 40 y 49 años de edad hasta un 7.4% en mayores de 80 años). El número de SG exacto se desconoce; se sabe que este es mucho mayor que el de los que realmente presentan la patología7. En población mexicana la prevalencia del glaucoma está entre un 2-4% de nuestra población.
Antecedente heredofamiliar de glaucomaEl antecedente de glaucoma en la familia es sumamente importante; entre el 10-20% de pacientes con glaucoma tienen antecedentes en la familia. El antecedente heredofamiliar positivo de primer grado incrementa el riesgo de padecer la enfermedad 3.7 veces13.
Excavación papilar amplia o asimétricaLa exploración de la cabeza del nervio óptico no debe limitarse a una mera cifra que represente su excavación; la descripción detallada enfocada hacia aquellos aspectos que resulten en una sospecha alta ayudan a comparar en el tiempo diferentes exploraciones, por lo que mientras más detallado se sea en su descripción mejores serán los argumentos para comparar los cambios de la cabeza de nervio óptico con el tiempo.
Esto es de especial importancia cuando no se tienen métodos fotográficos o computadorizados para su documentación.
Dentro de estos aspectos encontramos: el tamaño del nervio óptico, coloración, urgencia vascular, calibre vascular, disminución sectorial del calibre vascular, presencia de vasos circunlineales, excavación vertical y horizontal, grosor del anillo neurorretiniano, presencia de escotaduras, palidez sectorial o generalizada, grado y tipo de atrofia peripapilar, presencia o ausencia y características de la lámina cribosa, y la presencia de hemorragias en astilla que de presentarse en ausencia de enfermedades sistémicas como diabetes mellitus, hipertensión arterial o vasculitis son un dato diagnóstico de glaucoma4.
Grosor corneal centralBajo la perspectiva actual de los resultados del OHTS10, se encontró que aquellos pacientes con córneas por debajo de las 550micras tienen un riesgo incrementado en padecer glaucoma, incluso córneas con un grosor menor a la cifra mencionada pueden cursar con la enfermedad con PIO aparentemente más bajas.
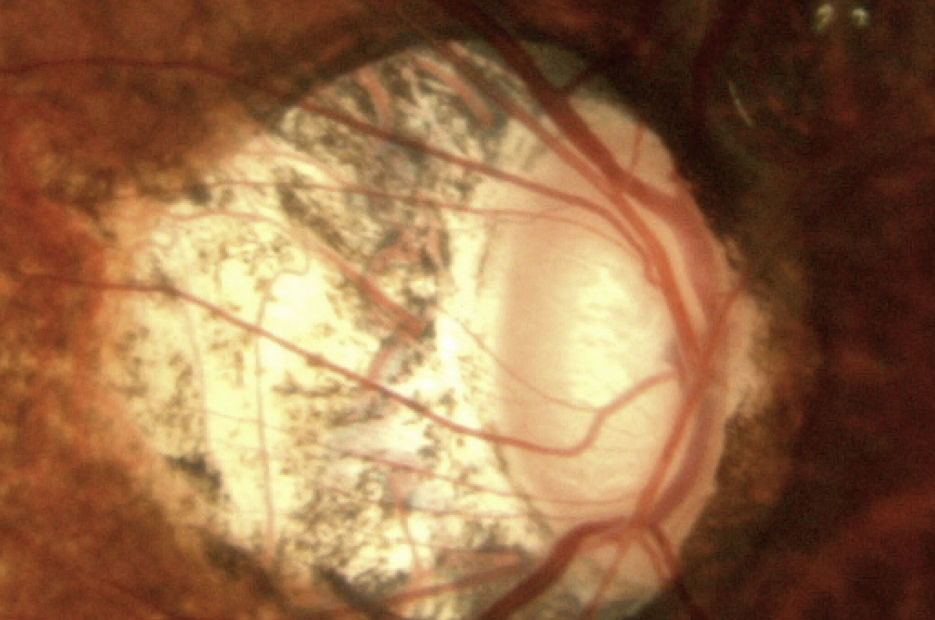
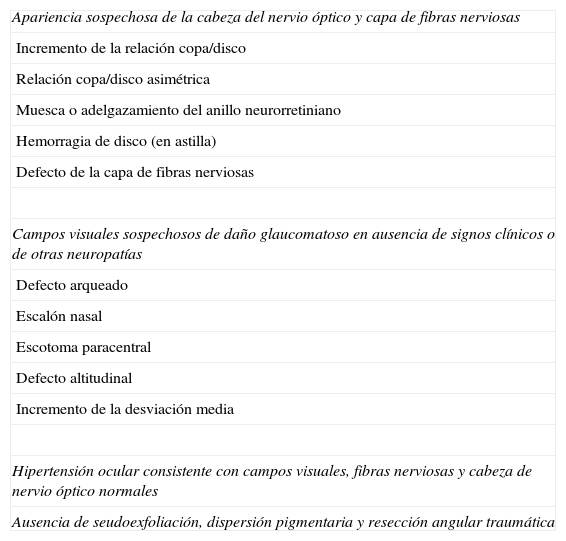
Miopía altaLa miopía es un factor de riesgo conocido, asociado con glaucoma, particularmente en individuos con más de 6 dioptrías14. Es común en estos pacientes, dadas su características anatómicas, encontrar un área de disco grande, una excavación amplia y una rotación del eje vertical de la papila (papila oblicua), que dificulta una evaluación minuciosa (fig. 1).
Enfermedades sistémicasLa hipotensión arterial se encuentra asociada con la aparición y progresión de daño por glaucoma, en especial en aquellos pacientes hipertensos en los cuales una sobremedicación en el tratamiento de la hipertensión puede llevar a la hipotensión arterial; los episodios de choque hipotensivo, trauma, cirugía vascular o hemorragia masiva son potencialmente perjudiciales en la irrigación de la cabeza del nervio óptico. La presencia de fenómenos vasoespásticos, locales o periféricos, tales como migraña y síndrome de Raynaud, se relaciona con el glaucoma de tensión normal. Igualmente la presencia de enfermedad cardiovascular y de hipertensión arterial es una asociación mencionada con este tipo de glaucoma.
En el caso de la diabetes mellitus, estudios recientes15–18 cuestionan su presencia como factor de riesgo, e incluso se cataloga como un factor de protección. Sin embargo, por lógica y siendo la diabetes mellitus una enfermedad con un blanco microvascular muy importante (observándose por la microangiopatía diversa que ocasiona la hiperglucemia crónica, no solo a nivel ocular), se hace difícil pensar que esta microangiopatía no afecte de manera selectiva a la cabeza del nervio óptico.
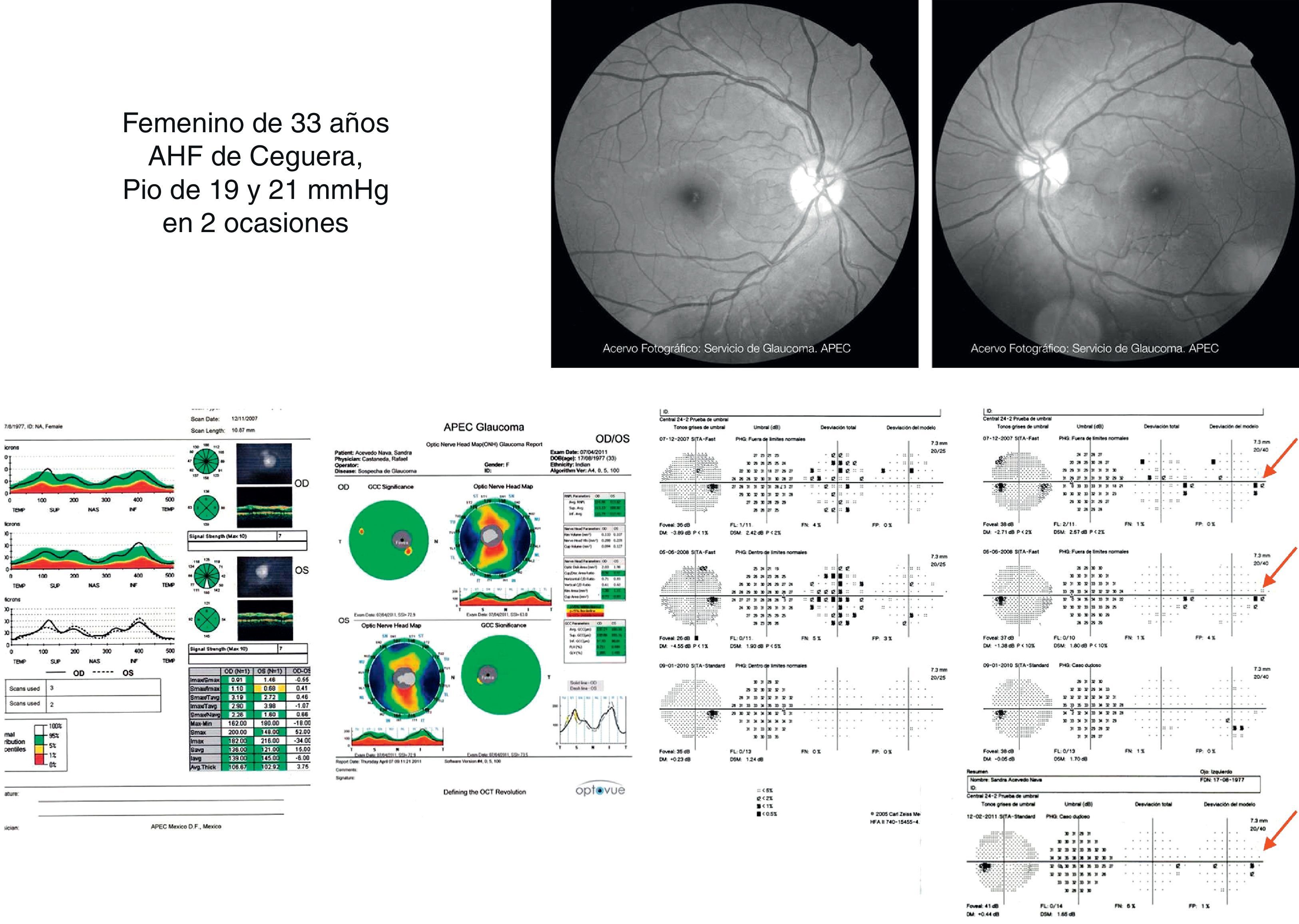
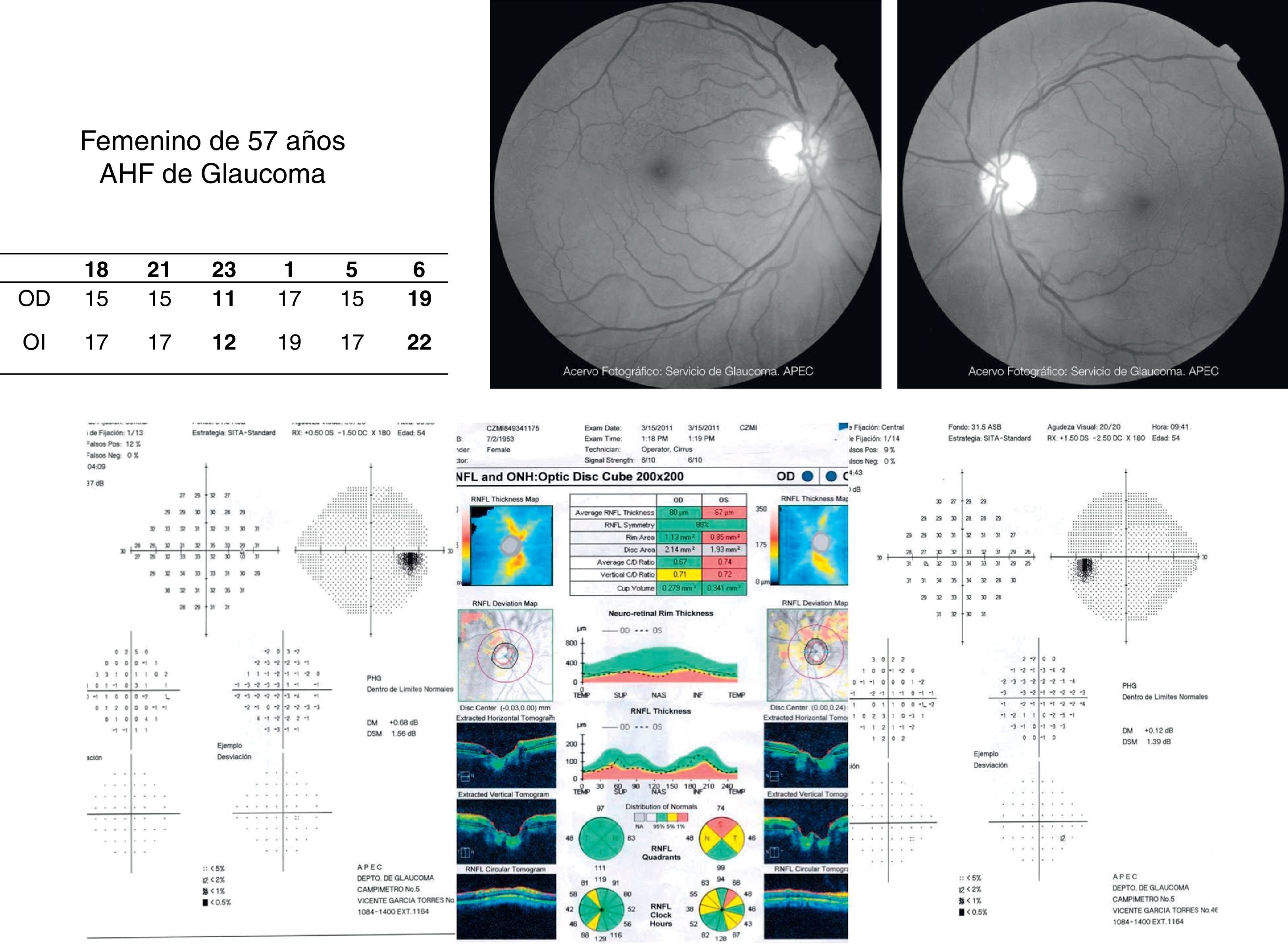
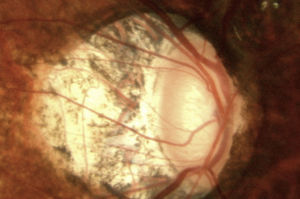
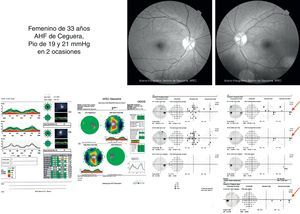
Estudios estructurales y funcionalesLa perimetría automatizada blanco/blanco es un estudio obligatorio en el paciente sospechoso de glaucoma y continúa siendo el «gold standard» para el diagnóstico y seguimiento de la enfermedad4. Como ya se ha mencionado, en el SG el campo visual podría ser normal o anormal, y puede observarse ausencia o presencia de los defectos campimétricos típicos de glaucoma como son: defectos paracentrales, aumento en la mancha ciega, escalón nasal, escotoma arqueado en el área de Bjerrum o cualquiera de la suma de estos. A pesar de esta ausencia o presencia de dichos defectos debe recordarse que un solo campo no descarta ni confirma la presencia de glaucoma; una serie de estudios confiables con la repetición de uno o más defectos tienen mayor peso para realizar un diagnóstico que los estudios realizados de manera esporádica (figs. 2 y 3). Actualmente se recomienda como mínimo una serie de 3 campos visuales blanco/blanco al año, por lo menos los primeros 2 años para realizar un diagnóstico adecuado y establecer el ritmo de progresión de la enfermedad3.
Mismo caso de la figura 2 en donde se observa una discreta asimetría en el OCT que correlaciona bien con el defecto encontrado en la perimetría blanco/blanco y el FDT.
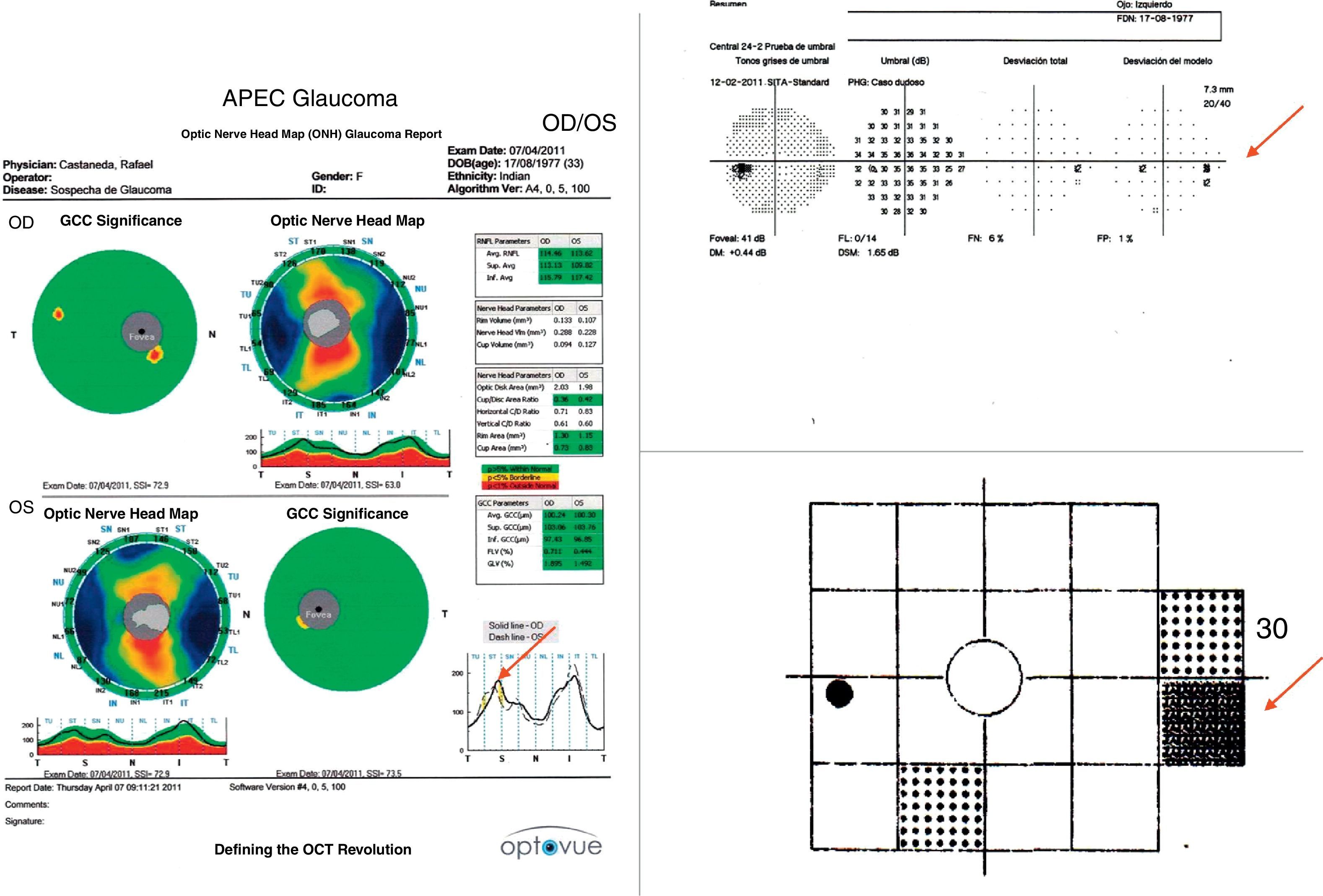
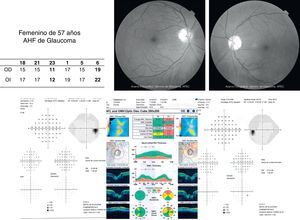
Los defectos de la capa de fibras nerviosas concordantes con campos visuales alterados hacen un diagnóstico seguro. En ocasiones podría no existir concordancia entre los estudios estructurales y funcionales, colocando al paciente en un término de sospecha o bien tratarse de un glaucoma preperimétrico (fig. 4). Es muy importante tener en mente la especificidad y sensibilidad que nos brindan en la actualidad los estudios funcionales y estructurales ya que ambos son necesarios para el establecimiento de un diagnóstico oportuno.
Para muchos autores las pruebas funcionales y estructurales que mejor logran un diagnóstico temprano son el OCT-HD y la tecnología de doble frecuencia19. La fotografía de nervio óptico y capa de fibras nerviosas es un estudio que debe tomarse en cuenta en especial en aquellos casos donde la perimetría automatizada o la tomografía de coherencia óptica no arrojen datos concluyentes.
Tratamiento del sospechoso de glaucoma de ángulo abiertoLos objetivos del manejo del SG son mantener una PIO dentro de un rango seguro que evite el riesgo de progresión (PIO meta), vigilar el campo visual y la capa de fibras nerviosas, buscando datos de progresión.
Existen elementos importantes que nos deben hacer notar la necesidad de tratamiento:
- a)
Deterioro del nervio óptico, capa de fibras nerviosas o campos visuales consistentes con daño por GPAA.
- b)
Desarrollo de anormalidades sutiles en el nervio óptico o capa de fibras nerviosas detectadas mediante fotografía o estudios estructurales.
- c)
Aparición de defecto con patrón glaucomatoso en el campo visual, confirmado por la misma prueba en 2 ocasiones, lo que indica que el paciente ha desarrollado la enfermedad.
- d)
HTO, en especial aquellos pacientes por encima de 26mmHg.
- e)
En algunos casos para disminuir el riesgo de desarrollo de la enfermedad, como en pacientes con nervio óptico muy sospechoso de daño glaucomatoso, historia familiar fuerte para GPAA, campos visuales limítrofes, ascendencia africana, miopía alta y seudoexfoliación.
Cualquiera de estos debe hablarse adecuadamente con el paciente exponiendo las ventajas del tratamiento vs. no tratamiento.
La decisión de tratar al paciente SG es delicada y compleja, y depende de factores oculares, sistémicos, psicológicos y sociales. Por lo general la decisión de iniciar el tratamiento se fundamenta en 2 aspectos principales: cuando el riesgo de desarrollar daño glaucomatoso sea inminente debido al nivel de PIO, fluctuaciones en la curva de presión horaria, antecedente heredofamiliar y estudios estructurales limítrofes; y cuando ante el conocimiento del paciente de la naturaleza irreversible del glaucoma este prefiere no correr el mínimo riesgo de desarrollar la enfermedad.
Se debe tener un mayor cuidado en aquellos pacientes SG que posean factores de riesgo alto, como PIO por encima de 21mmHg, curva de presión horaria positiva, excavación papilar mayor de 0.6, edad y antecedente heredofamiliar, pruebas estructurales anormales y campos visuales anormales.
El factor de riesgo más importante es la HTO, siendo el único que por sí solo puede ser indicativo de iniciar tratamiento hipotensor, ya que se ha demostrado en estudios en animales que PIO por encima de los 25mmHg alteran el flujo sanguíneo y axoplásmico a nivel del nervio óptico. En el OHTS, aquellos pacientes con PIO de 26mmHg o mayores y un grosor corneal central menor de 555micras que se dejaron sin tratamiento tuvieron un 36% de probabilidades de desarrollar daño en el nervio óptico durante el estudio comparado con un 2% de probabilidades en aquellos pacientes con PIO por debajo de 24mmHg y grosores corneales mayores de 588micras10. De tal manera que el hallazgo de una PIO mayor de este nivel es indicativo de iniciar tratamiento hipotensor tomando en cuenta que la historia de la enfermedad comienza con PIO altas o con picos de presión alta durante la madrugada. Esto nos hace colocar en el siguiente peldaño la curva de presión horaria, que a pesar de que es un método diagnóstico poco práctico arroja mucha información en especial cuando se busca un glaucoma incipiente; también en aquellos pacientes con una PIO alta o variaciones de la PIO por encima de 2.1mmHg20 en la curva horaria está indicado iniciar tratamiento hipotensor y realizar un seguimiento con estudios estructurales así como funcionales que detecten un daño incipiente, como la tecnología de doble frecuencia.
De interés especial es también el observar un estudio confiable de análisis de fibras nerviosas disminuido; en este caso es importante descartar cualquier otra patología retiniana que pudiera estar ocasionando esta alteración. Otros factores de riesgo importantes, o de alto riesgo, son el antecedente heredofamiliar, la excavación papilar y campos visuales alterados pero no diagnósticos.
Dentro de los factores de bajo riesgo están el grosor corneal central, la diabetes mellitus la hipertensión arterial sistémica, miopía mayor de 6dioptrías, la migraña y el vasoespasmo; cualquiera de estos en conjunto con uno de los factores de alto riesgo (con excepción de la curva horaria alterada y la PIO por encima de los 25mmHg) solo necesita seguimiento con estudios estructurales y funcionales con una periodicidad de 4 a 6meses.
En presencia de cualquier factor de riesgo por separado solo se deberá hacer seguimiento con estudios estructurales y funcionales así como una revisión clínica completa y de ser posible documentación fotográfica del nervio óptico cada año.
ConclusionesLa sospecha de glaucoma es un diagnóstico, involucra a aquel paciente limítrofe para el desarrollo de la enfermedad que necesita una vigilancia estrecha o incluso el establecimiento de tratamiento profiláctico como en el caso del hipertenso ocular. En nuestra experiencia el seguimiento del SG debe realizarse como mínimo durante 2 años sumando 3 campos visuales durante cada uno de estos y un mínimo de 3 pruebas estructurales durante este periodo de tiempo. En conjunto con la PIO, el grosor corneal central, la apariencia clínica del nervio óptico y la documentación mediante pruebas de estructura y función se puede tener la suficiente información para documentar la presencia de GPAA, así como su ritmo de progresión. Existirán casos en los que las pruebas podrían no tener ninguna variación o incluso mejorar con el tiempo; en estos casos recomendamos el espaciamiento de las visitas y de los estudios inclusive cada año de no notar ningún cambio.
El establecimiento del tratamiento en un SG debe seguirse puntualmente como se indica en líneas previas ya que debe ser siempre una decisión muy bien estudiada, tratando de evitar tratamientos innecesarios o el subdiagnóstico de una enfermedad incipiente.
La finalidad de este artículo es alertar al oftalmólogo acerca de la sospecha de glaucoma como un diagnóstico, que ayuda a catalogar de una manera ordenada a aquellos pacientes que sin tener la enfermedad se catalogan como limítrofes a razón de los factores de riesgo antes mencionados, o a identificar a aquellos pacientes con un GPAA incipiente.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.