La fragmentación de selvas tropicales puede modificar la abundancia y riqueza de especies de murciélagos, pero sus efectos en la composición temporal de los ensambles han sido menos estudiados. En este estudio se evalúa la riqueza de especies, diversidad, proporción de gremios tróficos y composición de ensambles de murciélagos filostómidos en bosques continuos (BC) y fragmentados (BF) durante 2 temporadas secas y 2 lluviosas en una selva de Los Chimalapas, Oaxaca, México. El estudio se realizó de marzo de 2010 a febrero de 2012, y se usaron redes de niebla como método de captura durante 144 noches, capturándose 1 840 individuos de 29 especies. Los resultados muestran que los BC siguen un patrón temporal de riqueza, dominancia, diversidad y proporción de gremios acorde a las variaciones en disponibilidad alimenticia en cada temporada del año. Los BF muestran poca variabilidad temporal en las características anteriores, pero alta variabilidad en la composición de ensambles comparados con los BC, que muestran mayor estabilidad. La fragmentación de hábitat podría intensificar la severidad de los cambios estacionales en la disponibilidad de recursos, lo que repercutiría en mayor variabilidad temporal en la composición de los ensambles.
The fragmentation of tropical forest may modify the abundance and species richness of bats, but its effects on the temporal composition of assemblages have been less understood. We evaluate the species richness, diversity, proportion of trophic guilds, and composition of nose-leaf bat assemblages in continuous (BC) and fragmented (BF) forest, during 2 dry and 2 rainy seasons in a forest of Los Chimalapas, Oaxaca, Mexico. In this study we conducted from March 2010 to February 2012, and bats were captured with mist nets during 144 nights. We captured 1 840 individuals of 29 species of nose-leaf bats. The results show that BC has a temporal pattern of richness, dominance, diversity, and proportion of trophic guild according to variations in food availability in each season. The BF show little temporal variability in the above features, but high variability in the composition of assemblages compared to BC, that show more stability. Habitat fragmentation may intensify the severity of seasonal changes in the availability of resources, which in turn may cause a greater temporal variability in the composition of assemblages.
El estudio de la fragmentación de hábitat y su impacto en las comunidades de distintos grupos animales y vegetales es un campo científico que ha tomado gran interés en las últimas décadas (Turner, 1996; Fahrig, 2003; Fischer y Lindenmayer, 2007), en particular en zonas tropicales, donde la deforestación cambió de uso de suelo de bosques a zonas de cultivo y el incremento de los asentamientos humanos se presentan de manera alarmante (Laurance y Cochrane, 2001; Wade et al., 2003). La selva tropical de Los Chimalapas, ubicada en el estado de Oaxaca, en el sureste de México, es una región en proceso de deforestación y fragmentación (Ceballos et al., 1998; Watson y Peterson, 1999; Salas-Morales et al., 2001; Asbjornsen y Gallardo-Hernández, 2004). Esta selva se encuentra dentro de la Región Terrestre Prioritaria Selva Zoque-La Sepultura (Salas-Morales et al., 2001) y junto con otras áreas del sureste de México, es considerada entre las grandes regiones tropicales en buen estado de conservación, con un elevado número de tipos de vegetación de influencia neotropical (e. g. selva alta perennifolia) y neártica (e. g. bosques de pino) (Binford, 1989; Salas-Morales et al., 2001). Esta diversidad de hábitat ha permitido la presencia de una elevada riqueza de especies de aves (Arizmendi y Márquez, 2000; Peterson et al., 2003a, b), mamíferos (García-García y Santos-Moreno, 2008; Olguín-Monroy et al., 2008), así como anfibios y reptiles (Casas-Andreu et al., 1996, 2004).
Los efectos de la fragmentación en diversos taxones han sido documentados frecuentemente como alteraciones en la abundancia y riqueza de especies (Fahrig, 2003), sin embargo, sus efectos sobre elementos más sutiles como la composición y estructura temporal (estacional) de los ensambles son menos comprendidos (Aguirre et al., 2003; Aguiar y Marinho-Filho, 2004; Mello, 2009; Presley et al., 2009a, b; Klingbeil y Willig, 2010). Los murciélagos representan un elemento importante de la biodiversidad en zonas tropicales, y se encuentran amenazados por los procesos de fragmentación y deforestación (Racey y Entwistle, 2003; Meyer y Kalko, 2008a). En particular, los murciélagos filostómidos (familia Phyllostomidae) tienen una gran importancia en la diversidad de murciélagos tropicales, por su elevada diversificación trófica y su papel preponderante en los ecosistemas tropicales como dispersores de semillas, polinizadores de una amplia variedad de especies vegetales y depredadores de artrópodos y vertebrados (Timm, 1994; Kalko, 1998; Estrada y Coates-Estrada, 2002; Patterson et al., 2003; Meyer y Kalko, 2008a). Previamente se ha documentado que los ensambles de murciélagos filostómidos también muestran afectaciones en la composición y estructura de especies como resultado de la fragmentación del hábitat (Estrada et al., 1993; Cosson et al., 1999; Medellín et al., 2000; Willig et al., 2007; Meyer y Kalko, 2008a, b).
En las regiones tropicales los cambios estacionales en los ambientes son considerables, y son determinados principalmente por las fluctuaciones en la precipitación, que determinan la fenología de fructificación y floración de muchas plantas (Janzen, 1967; Leigh et al., 1982; Howe, 1984; Van Schaiket al., 1993; Ramos-Pereira et al., 2010). La fructificación coincide con los máximos de lluvias, y la disponibilidad de este recurso disminuye en la temporada de sequía (Presley et al., 2009a, 2009b; Rothenwöhrer et al., 2011). Este mismo patrón estacional se presenta en la abundancia de insectos en el trópico (Wolda, 1978), que representan un recurso fundamental para murciélagos filostómidos insectívoros (Kalko et al., 1999; Kalka y Kalko, 2006). Estas variaciones en la disponibilidad alimenticia determinan cambios en la condición física, dieta, tiempo de reproducción y patrón de actividad de murciélagos filostómidos (Bonaccorso, 1979; Fleming et al., 1972; Fleming, 1988; Kunz y Díaz, 1995; Kunz e Ingalls, 1994; Racey y Entwistle, 2000; Aguiar y Marinho-Filho, 2004; Ramos-Pereira et al., 2010).
Las variaciones estacionales en la disponibilidad de recursos determinan la composición de ensambles de murciélagos filostómidos en selvas continuas en buen estado de conservación (Heithaus et al., 1975, Dinerstein, 1986; Fleming y Heithaus, 1986; Aguiar y Marinho-Filho, 2004; Mello, 2009; Ramos-Pereira et al., 2010). Sin embargo, aún no es claro cómo la fragmentación derivada de las actividades humanas (cambio de usos de suelo) modifica los patrones estacionales de composición de los ensambles de murciélagos filostómidos de selvas tropicales. Este estudio tiene el objetivo de evaluar y comparar la riqueza de especies, abundancia, dominancia, diversidad y composición de especies de ensambles de murciélagos filostómidos durante 2 temporadas secas y 2 lluviosas, en bosques continuos (BC) y bosques fragmentados (BF). También se evalúa si distintos gremios tróficos responden diferencialmente a la fragmentación, ya que se ha observado una respuesta diferente de los gremios tróficos a disturbios del hábitat (Meyer y Kalko, 2008a; Meyer et al., 2008). Por ejemplo, murciélagos frugívoros y algunos nectarívoros son menos susceptibles al disturbio comparado con otros gremios que muestran una respuesta negativa a la perturbación del hábitat (Fenton et al., 1992; Medellín et al., 2000; Estrada y Coates-Estrada, 2002; Evelyn y Stilles, 2003; Loayza y Loiselle, 2008; Willig et al., 2007; Meyer y Kalko, 2008a; Meyer et al., 2008). Por lo anterior, se espera que ensambles de BF muestren mayor variación temporal en la composición de especies, mientras que en BC la composición de los ensambles sea más estable, y que los gremios tróficos generalistas (frugívoros y nectarívoros) presenten mayor abundancia en BF.
Materiales y métodosÁrea de estudioEl paisaje de estudio se ubicó en el municipio de Santa María Chimalapa de la región del istmo de Tehuantepec de Oaxaca, México (Fig. 1), entre las coordenadas 16º55’-16º47’ N, 94º50’ O y 94º40’ O. Esta región se caracteriza por altitudes que van desde 200 hasta 2 400m snm (Anaya y Álvarez, 1994). El clima que predomina en la zona es principalmente cálido húmedo (Salas-Morales et al., 2001). Datos de precipitación y temperatura de 29 años (1971-2000) de la estación meteorológica Santa María Chimalapa (ubicada a 2kilómetros del área de estudio) indican que la estación seca comprende los meses de diciembre a mayo, con una precipitación mensual promedio de 84.0mm (EE=18.21) y una temperatura mensual promedio de 23.8° C (EE=0.93). La estación lluviosa va de junio a noviembre, con una precipitación mensual promedio de 302.7mm (EE=32.83) y temperatura mensual promedio de 25.6° C (DE=0.45) (Imta, 2000). La vegetación predominante en Los Chimalapas es la selva alta perennifolia (SAP), que ocupa aproximadamente el 48% de la superficie total (590 993 ha). La SAP se caracteriza porque los árboles sobrepasan los 30m de altura y mantienen sus hojas todo el año. Presenta una estructura compuesta por varios estratos verticales (Salas-Morales et al., 2001).
Área de estudio, sitios de muestreo y tipos de bosque en la selva tropical de Los Chimalapas. El primer recuadro superior izquierdo muestra (flecha) a la selva tropical de Los Chimalapas en México. El segundo recuadro muestra (cuadro) el área de estudio en el municipio de Santa María Chimalapa.
Se realizó un realce espectral de imágenes multibandas ortorectificadas (Landsat 7 ETM+) mediante el índice de vegetación diferencial normalizado (NDVI, por sus siglas en inglés, Sellers et al., 1992; Pettorelli et al., 2005) y posteriormente, se realizó una clasificación supervisada generándose 2 categorías, áreas con vegetación continua y áreas sin vegetación aparente. Se delimitaron áreas circulares potenciales de 4km de diámetro sobre el mapa procesado. Este tamaño representa un compromiso entre establecer un área suficientemente pequeña, donde los factores biogeográficos no difieran entre los sitios y un área suficientemente grande donde las mediciones de los parámetros de las comunidades (e. g. abundancia y riqueza de especies) sean el resultado de unidades muestreales estadísticamente independientes (Gorresen y Willig, 2004; Gorresen et al., 2005; Meyer y Kalko 2008a; Klingbeil y Willig, 2009).
Se recortaron las áreas circulares en el programa ArcGIS 9.3 (Esri, Redlands, CA, USA), y para cada una de ellas se obtuvieron 7 medidas de la estructura del paisaje: cobertura de bosque (%), densidad de fragmentos (fragmentos/100 ha), tamaño medio de los fragmentos medidos (ha), densidad de borde (m/ha), forma media de fragmentos (medida adimensional obtenida a través de una forma cuadrada teórica), índice de proximidad media (medida adimensional) y distancia media euclidiana al vecino más cercano (m) (McGarigal y McComb 1995, McGarigal y Cushman 2002, Leitão et al., 2006). Las medidas se calcularon con el programa FRAGSTATS v3.3 (McGarigal et al., 2002). Todas las áreas fueron caracterizadas por las medidas de estructura del paisaje y sometidas a una ordenación por medio de un análisis de componentes principales (ACP), pudiéndose verificar el reconocimiento de 2 grandes conjuntos: áreas de bosques continuos y fragmentados. Las áreas de bosques continuos se caracterizan por mayor proporción de cobertura de bosque (>84.96%), baja densidad de fragmentos (<1.27 fragmentos/100 ha) y menor densidad de borde (<38.59m/ha); y las áreas de bosques fragmentados se caracterizan por baja cobertura de bosque (<75.87%), alta densidad de fragmentos (>2.46 fragmentos/100 ha) y mayor densidad de borde (>62.07m/ha). Considerando los resultados del ACP se eligieron 12 de las 33 áreas circulares iniciales, 6 de bosque continuo (BC) y 6 de bosque fragmentado (BF), y los sitios de muestreo se ubicaron en el centro geométrico de estas áreas circulares. Los sitios estuvieron separados por una distancia mayor a 2km (ubicadas a altitudes de 160 a 300m snm, Fig. 1).
Captura de murciélagosEl estudio fue conducido de marzo de 2010 a febrero de 2012, que incluyó 2 temporadas secas y 2 lluviosas. Cada uno de los 12 sitios se muestreó durante 3 noches en cada estación. El intervalo de tiempo entre cada sesión de captura en cada sitio fue de 6 meses. En total se realizaron capturas durante 144 noches (12 sitios por 3 noches por 4 temporadas). En cada sitio se colocaron 8 redes de niebla de 6×2.5m, separadas aproximadamente por 20m, ubicadas en línea recta sobre los senderos de vegetación. Las redes se revisaron cada 30min durante un periodo aproximado de 8 h (18:00 h-02:00 h) cada noche, excepto en días con lluvia intensa donde el periodo de muestreo fue menor. Cinco redes se colocaron a nivel del sotobosque (<4m) y 3 en el dosel (>4m). El esfuerzo de muestreo total aplicado fue de 125 049.6m2 red hora (metros cuadrados de red-hora), y un esfuerzo promedio por temporada de 16 784.8m2 red hora (EE=953.28) para el BC y 14 477.6m2 red hora (EE=1 320.05) para el BF. No existen diferencias significativas en el esfuerzo promedio de muestreo aplicado entre ambos tipos de bosques (prueba de t para medias de 2 muestras independientes t=1.41, gl=6, p=0.206).
Cada ejemplar se identificó siguiendo claves para murciélagos (Álvarez et al., 1994; Medellín et al., 1997) y se clasificaron de acuerdo con la nomenclatura de Simmons (2005). Todos los adultos se marcaron con un sujeta-cable de nylon colocado como collar (peso del marcaje <0.05% del peso de los cuerpos), según la propuesta de Gannon (1994) y García-García et al. (2010). Los gremios tróficos se clasificaron con base en una serie de trabajos que describen los hábitos alimenticios de las especies registradas (`, 1998; Wetterer et al., 2000; Nogueira y Peracchi, 2003; Giannini y Kalko, 2004; Tschapka, 2004; Kalka y Kalko, 2006; Da Silva et al., 2008).
Análisis de datosSe evaluó qué tan completos estuvieron los inventarios a través de curvas de acumulación de especies basadas en muestras (Gotelli y Colwell, 2001). Las curvas se obtuvieron con 100 aleatorizaciones para eliminar el efecto del orden específico en que ingresan los datos en la construcción de las curvas. Este procedimiento se realizó con el programa EstimateS versión 8.2.0 (Colwell, 2011). Adicionalmente, se calculó el número esperado de especies que se presentan en cada temporada (secas y lluvias) mediante el estimador no paramétrico Jacknife de primer orden, que muestra un buen desempeño de sesgo, precisión y exactitud (Walther y Moore, 2005) y es recomendado para taxones móviles (Brose y Martínez, 2004). La completitud de los inventarios se obtuvo midiendo el porcentaje que representan las especies observadas respecto a las esperadas (Moreno y Halffter 2000).
Se comparó la riqueza, dominancia (índice de Berger-Parker) y diversidad (índice de entropía de Shannon con logaritmo natural, Jost et al., 2011) de murciélagos entre BC y BF en las diferentes temporadas mediante modelos nulos (curvas rarificadas, Gotelli y Graves, 1996; Gotelli y Colwell, 2011) en el programa Ecosim 7.0 (Gotelli y Entsminger, 2006). Las comparaciones entre las temporadas se basaron en la abundancia de la primera temporada seca de BC (tamaño de muestra menor) y la comparación a nivel de paisaje en la abundancia de BC. Se emplearon 1 000 iteraciones y la significancia estadística fue determinada por los intervalos al 95% de confianza generado por el programa (Colwell et al., 2012).
Se midió la abundancia relativa de los murciélagos y se construyeron curvas de rangos-abundancia, dividiendo el número de ejemplares de cada especie capturado entre el esfuerzo de muestreo (metros cuadrados de red-hora) y multiplicados por 100 (Straube y Bianconi, 2002). Se compararon de manera independiente la proporción de individuos (%) entre las diferentes categorías de gremios tróficos en BC y BF mediante el estadístico χ2. También se compararon la proporción de gremios tróficos entre diferentes temporadas de ambos tipos de bosque.
Se midió la similitud en la composición de los ensambles entre estaciones del año en BC y BF mediante del índice de similaridad de Horn, que es un índice basado en abundancia y es recomendado para comparaciones de múltiples ensambles (Jost et al., 2011). Se empleó un análisis de escalamiento multidimensional no métrico (NMDS, por sus siglas en inglés) para ordenar los ensambles de los sitios de BC y BF en cada temporada, y evaluar las diferencias en su composición de especies (McCune y Grace, 2002). Pese a que el NMDS es una técnica robusta no lineal, el resultado de la ordenación es sensible a muestras pequeñas (Clarke, 1993; McCune y Grace, 2002; Meyer y Kalko, 2008a). Por tal motivo, previo al análisis, se eliminaron muestras que presentaban pocos individuos (N≤10 y S<4) y se realizó una estandarización (%) de los datos. Se ingresaron en el análisis 41 de las 48 muestras posibles (2 tipos de bosques por 6 sitios por tipo de bosque por 4 temporadas) conteniendo a todas las especies registradas. Las diferencias en composición se probaron mediante un análisis de similitud (ANOSIM, índice de Horn), que es un procedimiento multivariado de permutación no paramétrico, que prueba la diferencia entre grupos de una comunidad previamente definidos basados en una matriz de disimilitud (Clarke, 1993). Todas las pruebas anteriores fueron realizadas en el programa PAST v2.17 (Hammer et al., 2001).
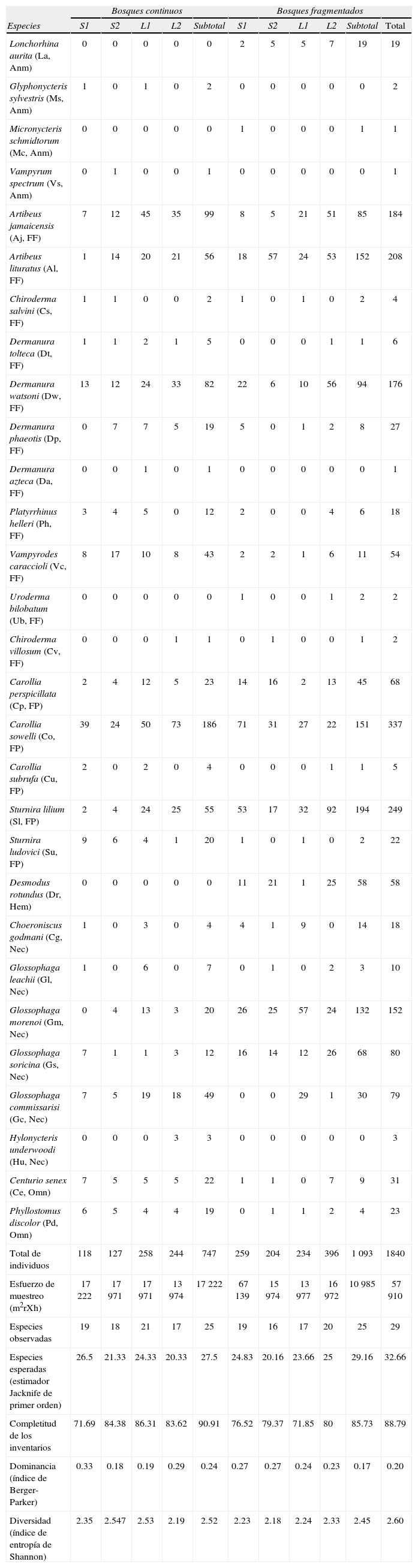
ResultadosSe capturaron, marcaron y liberaron 1 840 individuos de 29 especies de murciélagos filostómidos (Cuadro 1). En BF y BC se capturaron 1 093 (25 especies) y 747 (25 especies) individuos, respectivamente (Cuadro 1). Se capturó un número menor de individuos en las temporadas secas (n=245, 13.3% del total de capturas) y lluviosas (n=502, 27.2%) de BC comparados con las temporadas secas (n=463, 36.2%) y lluviosas (n=630, 34.2%) de BF. Los valores de completitud de los inventarios fueron moderados y similares en temporadas secas (72-84%) y lluviosas (72-86%) de ambos tipos de bosque.
Especies capturadas en cada estación de bosques continuos y fragmentados en la selva tropical de Los Chimalapas. Entre paréntesis se abrevia en el nombre de las especies y el gremio trófico (FF, frugívoros de Ficus; FP, frugívoros de Piper; Nec, nectarívoros; Omn, omnívoros; Anm, animalívoros; Hem, hematófagos). S1=secas, primer año; S2=secas, segundo año; L1=lluvias, primer año; S2=lluvias, segundo año
| Especies | Bosques continuos | Bosques fragmentados | |||||||||
| S1 | S2 | L1 | L2 | Subtotal | S1 | S2 | L1 | L2 | Subtotal | Total | |
| Lonchorhina aurita (La, Anm) | 0 | 0 | 0 | 0 | 0 | 2 | 5 | 5 | 7 | 19 | 19 |
| Glyphonycteris sylvestris (Ms, Anm) | 1 | 0 | 1 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 2 |
| Micronycteris schmidtorum (Mc, Anm) | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 1 |
| Vampyrum spectrum (Vs, Anm) | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 |
| Artibeus jamaicensis (Aj, FF) | 7 | 12 | 45 | 35 | 99 | 8 | 5 | 21 | 51 | 85 | 184 |
| Artibeus lituratus (Al, FF) | 1 | 14 | 20 | 21 | 56 | 18 | 57 | 24 | 53 | 152 | 208 |
| Chiroderma salvini (Cs, FF) | 1 | 1 | 0 | 0 | 2 | 1 | 0 | 1 | 0 | 2 | 4 |
| Dermanura tolteca (Dt, FF) | 1 | 1 | 2 | 1 | 5 | 0 | 0 | 0 | 1 | 1 | 6 |
| Dermanura watsoni (Dw, FF) | 13 | 12 | 24 | 33 | 82 | 22 | 6 | 10 | 56 | 94 | 176 |
| Dermanura phaeotis (Dp, FF) | 0 | 7 | 7 | 5 | 19 | 5 | 0 | 1 | 2 | 8 | 27 |
| Dermanura azteca (Da, FF) | 0 | 0 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 |
| Platyrrhinus helleri (Ph, FF) | 3 | 4 | 5 | 0 | 12 | 2 | 0 | 0 | 4 | 6 | 18 |
| Vampyrodes caraccioli (Vc, FF) | 8 | 17 | 10 | 8 | 43 | 2 | 2 | 1 | 6 | 11 | 54 |
| Uroderma bilobatum (Ub, FF) | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 2 | 2 |
| Chiroderma villosum (Cv, FF) | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 2 |
| Carollia perspicillata (Cp, FP) | 2 | 4 | 12 | 5 | 23 | 14 | 16 | 2 | 13 | 45 | 68 |
| Carollia sowelli (Co, FP) | 39 | 24 | 50 | 73 | 186 | 71 | 31 | 27 | 22 | 151 | 337 |
| Carollia subrufa (Cu, FP) | 2 | 0 | 2 | 0 | 4 | 0 | 0 | 0 | 1 | 1 | 5 |
| Sturnira lilium (Sl, FP) | 2 | 4 | 24 | 25 | 55 | 53 | 17 | 32 | 92 | 194 | 249 |
| Sturnira ludovici (Su, FP) | 9 | 6 | 4 | 1 | 20 | 1 | 0 | 1 | 0 | 2 | 22 |
| Desmodus rotundus (Dr, Hem) | 0 | 0 | 0 | 0 | 0 | 11 | 21 | 1 | 25 | 58 | 58 |
| Choeroniscus godmani (Cg, Nec) | 1 | 0 | 3 | 0 | 4 | 4 | 1 | 9 | 0 | 14 | 18 |
| Glossophaga leachii (Gl, Nec) | 1 | 0 | 6 | 0 | 7 | 0 | 1 | 0 | 2 | 3 | 10 |
| Glossophaga morenoi (Gm, Nec) | 0 | 4 | 13 | 3 | 20 | 26 | 25 | 57 | 24 | 132 | 152 |
| Glossophaga soricina (Gs, Nec) | 7 | 1 | 1 | 3 | 12 | 16 | 14 | 12 | 26 | 68 | 80 |
| Glossophaga commissarisi (Gc, Nec) | 7 | 5 | 19 | 18 | 49 | 0 | 0 | 29 | 1 | 30 | 79 |
| Hylonycteris underwoodi (Hu, Nec) | 0 | 0 | 0 | 3 | 3 | 0 | 0 | 0 | 0 | 0 | 3 |
| Centurio senex (Ce, Omn) | 7 | 5 | 5 | 5 | 22 | 1 | 1 | 0 | 7 | 9 | 31 |
| Phyllostomus discolor (Pd, Omn) | 6 | 5 | 4 | 4 | 19 | 0 | 1 | 1 | 2 | 4 | 23 |
| Total de individuos | 118 | 127 | 258 | 244 | 747 | 259 | 204 | 234 | 396 | 1 093 | 1840 |
| Esfuerzo de muestreo (m2rXh) | 17 222 | 17 971 | 17 971 | 13 974 | 17 222 | 67 139 | 15 974 | 13 977 | 16 972 | 10 985 | 57 910 |
| Especies observadas | 19 | 18 | 21 | 17 | 25 | 19 | 16 | 17 | 20 | 25 | 29 |
| Especies esperadas (estimador Jacknife de primer orden) | 26.5 | 21.33 | 24.33 | 20.33 | 27.5 | 24.83 | 20.16 | 23.66 | 25 | 29.16 | 32.66 |
| Completitud de los inventarios | 71.69 | 84.38 | 86.31 | 83.62 | 90.91 | 76.52 | 79.37 | 71.85 | 80 | 85.73 | 88.79 |
| Dominancia (índice de Berger-Parker) | 0.33 | 0.18 | 0.19 | 0.29 | 0.24 | 0.27 | 0.27 | 0.24 | 0.23 | 0.17 | 0.20 |
| Diversidad (índice de entropía de Shannon) | 2.35 | 2.547 | 2.53 | 2.19 | 2.52 | 2.23 | 2.18 | 2.24 | 2.33 | 2.45 | 2.60 |
La riqueza, dominancia y diversidad estimado de BC fueron superiores a BF a nivel de todo el paisaje, pero esta diferencia es sólo significativa (intervalos de confianza al 95%) en la dominancia (Fig. 2). En BC se presentan diferencias interanuales en diversidad en las 2 temporadas, y diferencias en dominancia sólo en la temporada seca. También se muestran diferencias entre temporadas en riqueza y diversidad en el segundo ciclo anual y diferencias en dominancia en los 2 ciclos. En BF no se presentan diferencias entre años ni entre temporadas. Entre tipos de bosque se presentan diferencias en riqueza y diversidad en la segunda temporada seca (S2) y primera lluviosa (L1), también en dominancia sólo en S2.
Riqueza de especies, dominancia (índice de Berger-Parker) y diversidad (índice de entropía de Shannon) rarefaccionada de murciélagos en la selva de Los Chimalapas. Las comparaciones entre las temporadas se basaron en los datos de la primera temporada seca (n=118) de bosques continuos y la comparación a nivel de paisaje en los datos de bosques continuos (n=747). Las barras de error representan el intervalo al 95% de confianza. BC=bosques continuos, BF=bosques fragmentados.
Seis especies fueron abundantes en los ensambles de ambos tipos de bosque: Artibeus jamaicensis, A. lituratus, A.watsoni, Carollia sowelli, Sturnira lilium y Glossophaga soricina, que en conjunto representan el 71% de todas las capturas. Las curvas de rango de abundancia muestran 3 clases de especies: raras (abundancia relativa de <0.01), moderadamente abundantes (≥0.0<0.10) y abundantes (≥0.10). C. sowelli fue la especie más abundante en las 2 temporadas secas de BC, mientras que en BF 6 especies fueron abundantes en S1 y 7 en S2, modificándose la composición de especies abundantes de una temporada seca a otra (Fig. 3). Este cambio en la composición de especies se presenta en las temporadas lluviosas de BF, donde 10 especies fueron altamente abundantes (6 especies en L1 y 9 en L2). En las temporadas lluviosas de BC, 6 especies fueron abundantes y la composición es similar en los 2 ciclos anuales.
Curvas de rangos de abundancia para las 4 temporadas de muestreo en bosques continuos y fragmentados. La abundancia relativa está en escala logarítmica y las especies están ordenadas en secuencia de abundancia decreciente. S1=secas, primer año; S2=secas, segundo año, L1=lluvias, primer año; S2=lluvias, segundo año. Las abreviaciones y el nombre completo de las especies se encuentran en el Cuadro 1.
Se capturaron especies de 6 gremios tróficos (Cuadro 1). Murciélagos frugívoros especialistas de Ficus (FF, S=1 especies, n=682 individuos), frugívoros especialistas de Piper (FP, S=5, n=638) y nectarívoros (Nec, S=6, n=342) destacaron por su riqueza de especies y abundancia en ambos tipos de bosque; mientras que las especies omnívoras (Omn, S=2, n=54), animalívoras (Anm, S=4, n=23) y hematófagas (Hem, S=1, n=58) fueron menos abundantes. Los murciélagos FF y FP fueron abundantes en todas las temporadas de ambos tipos de bosque, excepto en L1 de BF, donde las especies nectarívoras fueron más abundantes (Fig. 4). Los murciélagos FP (χ2=9.07, p=0.028) y nectarívoros (χ2=15.10, p=0.001) fueron significativamente más abundantes en las temporadas de BF comparado con BC. Los murciélagos hematófagos fueron abundantes y restringidos a BF. En BC se observaron diferencias entre temporadas en la proporción de gremios en el primer ciclo anual (χ2=14.04, p=0.007) y marginalmente no significativo en el segundo (χ2=8.89, p=0.063). No se presentaron diferencias interanuales en temporadas secas (χ2=2.26, p=0.687) y lluviosas (χ2=3.48, p=0.626). Los BF presentan diferencias entre temporadas en la proporción de gremios sólo en el segundo ciclo anual (χ2=222.26, p<0.001) y diferencias interanuales únicamente en la temporada lluviosa (χ2=52.73, p<0.001).
Proporción (% de total) de gremios tróficos (FF, frugívoros de Ficus; FP, frugívoros de Piper; Nec, nectarívoros; Omn, omnívoros; Anm, animalívoros; Hem, hematófagos) en cada temporada en bosques continuos y fragmentados. S1=secas, primer año; S2=secas, segundo año; L1=lluvias, primer año; S2=lluvias, segundo año.
El análisis de NMDS muestra un valor de estrés no tan bajo (0.24), indicando un poder explicativo moderado (valores de estrés <0.1 muestran buen desempeño, McCune y Grace, 2002; Clarke, 1993) y que las conclusiones que se extraigan deben tomarse con cautela. Los resultados muestran una separación de los ensambles de BC y BF en todas las temporadas, determinados principalmente por la primera dimensión. Las temporadas lluviosas de BC muestran mayor similitud y forman un grupo más compacto (círculo de línea continua) que las temporadas secas (óvalo de línea discontinua). Únicamente L2 de BF forma un grupo distinguible (óvalo de línea punteada) (Fig. 5). La composición de ensambles difiere significativamente entre todas las categorías (temporadas) de cada tipo de bosque (ANOSIM, R global=0.214, p<0.001). Las comparaciones pareadas muestran que no hay diferencias interanuales significativas en la composición de ensambles en temporadas secas y lluviosas en BC (R<0.06, p>0.30) y BF (R<0.05, p>0.29).Tampoco se presentan diferencias entre temporadas en los 2 ciclos en BC (R<0.21, p>0.10). Las diferencias que se presentan son en el segundo ciclo (R=0.22, p=0.048) en BF. Las comparaciones entre tipos de bosque muestran diferencias significativas entre S1 (R>0.33, p<0.03) y L2 (R>0.30, p<0.03) de BC y todas las estaciones secas y lluviosas de BF, respectivamente. También se presentan diferencias entre S2 de BC y L2 de BF (R=0.40, p=0.019), y entre L1 de BC y las 2 temporadas del segundo ciclo de BF (R>0.28, p<0.03).
Ordenación de los ensambles de 6 sitios de bosques continuos y fragmentados en cada temporada a lo largo de las dimensiones del Escalamiento Multidimensional no Métrico (NMDS), con base en el índice de similaridad de Horn. Las temporadas lluviosas muestran (círculo de línea continua) mayor similitud que las temporadas secas (óvalo de línea discontinua) de BC. Únicamente los ensambles de la segunda temporada lluviosa (L2) de BF forman un grupo distinguible (óvalo de línea punteada). S1=secas, primer año; S2=secas, segundo año; L1=lluvias, primer año; S=lluvias, segundo año.
Se registró alta diversidad y abundancia de murciélagos filostómidos, comparable con lo reportado para otras regiones del sureste de México (Medellín et al., 2000; Estrada y Coates-Estrada, 2002; Montiel et al., 2006; Castro-Luna et al., 2007; García-García y Santos-Moreno, 2008). La presencia de varias especies de murciélagos filostómidos de origen neotropical convierte a la selva de Los Chimalapas en uno de los últimos reservorios en la distribución norteña de estas especies (García-García y Santos-Moreno, 2008; Olguín et al., 2008). En particular, se registra alta abundancia de murciélagos frugívoros y nectarívoros que son fundamentales en los ecosistemas para la dispersión de semillas y polinización de plantas tanto en bosques perturbados como conservados (Charles-Dominique, 1986; Tschapka, 2004; Muscarella y Fleming, 2007).
También destaca la presencia en BC de Glyphonycteris sylvestris y Vampyrum spectrum, que no se capturaron en BF y los registros de estas especies son el primero y el segundo para la región (sexto para México), respectivamente (Santos-Moreno y Ruiz-Velásquez, 2011; Santos-Moreno et al., 2010). Ambas especies son localmente poco abundantes, y para el caso de V. spectrum está restringido a bosques en buen estado de conservación (Vehrencamp et al., 1977). En BF destaca la presencia exclusiva de Lonchorhina aurita y Micronycteris schmidtorum, que son especies insectívoras acechadores de follaje y que forrajean en áreas abiertas o bordes de la selva (Klingbeil y Willig, 2009). El registro de M. schmidtorum es el segundo para el estado de Oaxaca (Santos-Moreno y Gallardo-Sipriano, en prensa).
La riqueza, dominancia y diversidad en BC presentan diferencias interanuales en ambas temporadas y diferencias entre temporadas en el mismo ciclo anual. Estos cambios no se presentan en BF, que sólo muestra diferencias estacionales con los BC en el mismo ciclo anual. Previamente se ha documentado que existen variaciones estacionales y anuales en la riqueza de especies de murciélagos en bosques continuos (Heithaus et al., 1975; Aguirre et al., 2003; Aguiar y Marinho-Filho, 2004), que responden a la disponibilidad alimenticia en cada una de las temporadas (Aguirre et al., 2003; Aguiar y Marinho-Filho, 2004; Mello, 2009).
En términos generales, en BC la floración y fructificación de plantas coincide con la estación lluviosa y disminuyen en la estación seca (Presley et al., 2009a, 2009b; Ramos-Pereira et al., 2010; Rothenwöhrer et al., 2011); sin embargo, se ha observado que las selvas que han sufrido una fragmentación en un tiempo reciente muestran áreas (e. g. cultivos, pastizales, mosaicos de vegetación) donde se da una proliferación de plantas típicas de estados sucesionales primarios (Estrada y Coates-Estrada, 2002; Estrada et al., 2003; Willig et al, 2007), con floración y fructificación continuas, lo que promueve la presencia de especies de murciélagos frugívoros y nectarívoros durante todo el año (Fenton et al., 1992; Willig et al., 2007). Esta disponibilidad alimenticia en BF se reflejaría en una alta diversidad y abundancia de especies, en su mayoría frugívoras y nectarívoras, en todas las temporadas del año.
Los murciélagos frugívoros y nectarívoros mostraron mayor abundancia en ambos tipos de bosque en todas las temporadas, pero en particular murciélagos FP como: Carollia sowelli y Sturnira lilium y nectarívoros como: Glossophaga soricina y G. morenoi, que fueron más abundantes en todas las temporadas en BF. Se ha observado que en ambientes sucesionales primarios y medios se presenta alta proliferación de plantas de los géneros Cecropia, Piper y Solanum, que producen muchas flores y frutos (Charles-Dominique, 1986; Fleming, 1988; Tschapka, 2004; Vargas-Contreras et al., 2009). Esta disponibilidad alimenticia promueve la presencia y abundancia de murciélagos filostómidos oportunistas frugívoros y nectarívoros que tienen la capacidad de atravesar áreas abiertas y perturbadas (Brosset et al., 1996; Medellín et al., 2000; Estrada y Coates-Estrada, 2002; Faria 2006; Willig et al., 2007). La elevada abundancia de este grupo de filostómidos en BF sugiere que aún existe un potencial regenerativo en los ecosistemas (Willig et al., 2007). Por otro lado, una disminución generalizada de todos los gremios tróficos, incluyendo a los generalistas, podría indicar un impacto negativo de una deforestación extensiva (Charles-Dominique, 1986; Gorchov et al., 1993; Galindo-González et al., 2000; Willig et al, 2007).
Los resultados muestran que la composición de gremios en BC se modifica entre temporadas, pero estos cambios no se presentan de manera interanual. Un patrón diferente muestra los BF que presentan diferencia entre temporadas en el segundo ciclo anual. El patrón de composición de especies en BC resulta esperable, si se toma en cuenta la dinámica fenológica natural de muchas plantas explotadas por murciélagos filostómidos (Ramos-Pereira et al., 2010; Rothenwöhrer et al., 2011). Es posible que en BC se presente cierta estabilidad de la disponibilidad alimenticia en la dinámica entre temporadas e interanual, o que los cambios sean demasiado sutiles para afectar la composición de gremios. Por otro lado, el BF muestra mayor variabilidad en la composición de gremios, posiblemente debido a cambios temporales y espaciales impredecibles en la disponibilidad de flores y frutos (Croat, 1975; Foster, 1982; Howe 1983; Denslow et al., 1986; Levey, 1988). Se ha documentado que la fragmentación de hábitat altera la fenología de la plantas (tiempo y frecuencia de la producción de flores, frutos y hojas, Laurance et al., 2003), como producto de cambios impredecibles en factores ambientales como la humedad, temperatura, luminosidad y disponibilidad de nutrientes (Saunders et al., 1991; Kapos et al., 1997).
Se encontraron evidencias de mayor estabilidad en la composición de ensambles en temporadas lluviosas respecto a secas, principalmente en BC, y parcialmente en BF. Las diferencias (estacionales e interanuales) más importantes se observan en la composición de ensambles de ambos tipos de bosque. Se ha documentado que en bosques tropicales existe mayor disponibilidad de frutos en la estación lluviosa y este recurso disminuye en la estación seca, donde puede haber mayor disponibilidad de flores (Janzen, 1967; Heithaus et al., 1975; Milton et al., 1982; Laurance et al., 2003). Se ha observado que especies de los géneros Artibeus, Uroderma y Vampyressa se alimentan principalmente de frutos de Ficus y son considerados especialistas en este recurso (Giannini y Kalko, 2004). La disponibilidad de frutos de Ficus en la estación lluviosa de bosques perturbados es alta y disminuye en la estación seca, provocando que murciélagos que consumen este recurso diversifiquen su dieta y consuman frutos de Cecropia y Solanum que son abundantes durante todo el año (Milton et al., 1982; Olea-Wagner et al., 2007; Da Silva et al., 2008; Giannini, 1999; Klingbeil y Willig, 2010).
También se ha documentado que algunas especies frugívoras como: S. lilium y A. jamaicensis consumen néctar y polen en la estación seca como un recurso alternativo a su dieta principal (Heithaus et al., 1975) y murciélagos nectarívoros como: Glossophaga soricina, Leptonycteris curasoae y Musonycteris harrisoni modifican su patrón de consumo y polinización en bosques estacionales fragmentados (Quesada et al., 2003, 2004). La baja disponibilidad de alimento en la estación seca también provoca que Carollia perspicillata muestre mayores desplazamientos en búsqueda de alimento (Fleming y Heithaus, 1986; Cosson et al., 1999). Lo anterior sugiere que en las temporadas secas podría presentarse mayor diversificación en las dietas y movilidad en búsqueda de recurso. Este fenómeno podría producir una composición más variable en los ensambles durante las temporadas secas en comparación con las lluviosas. La fragmentación de hábitat también podría intensificar la severidad de los cambios estacionales en la disponibilidad de recurso alimenticio, lo que se manifestaría en una mayor variabilidad temporal en la composición de los ensambles de bosques perturbados respecto a los de bosques continuos, ya documentado previamente (Aguirre et al., 2003; Klingbeil y Willig, 2010).
Los resultados del presente estudio muestran cierta estacionalidad en la riqueza de especies, abundancia y composición de los ensambles de murciélagos de BC y la modificación en estos atributos en BF. Estos resultados se suman al conjunto de evidencias de los efectos de la fragmentación de hábitat sobre diversos aspectos ecológicos de los murciélagos y resalta la necesidad de conocer las implicaciones de este fenómeno, y la necesidad del diseño de estrategias de conservación de murciélagos en selvas tropicales en proceso de fragmentación y deforestación, en particular en la selva de Los Chimalapas, que es una zona de alta biodiversidad y que se encuentra bajo fuerte presión por las actividades humanas (Watson y Peterson, 1999; Salas-Morales et al., 2001; Peterson et al., 2003b; Asbjornsen y Gallardo-Hernández, 2004; Asbjornsen et al., 2005; García-García y Santos-Moreno, 2008).
El Conacyt de México otorgó una beca de estudios de posgrado (No. 228955) al primer autor. Esta investigación tuvo apoyo económico de la Secretaría de Investigación y Posgrado del Instituto Politécnico Nacional a través de los proyectos SIP-20100377, SIP-20110395 y SIP-20120962 y del Programa Institucional de Formación de Investigadores (PIFI). Se agradece a D. Mondragón, G. Ramos, R. del Castillo y R. Solano por las observaciones para la mejora del presente documento. Asimismo, se agradece a las autoridades del municipio de Santa María Chimalapa y a las personas que dieron asistencia en el trabajo de campo.