Conocer las preferencias de hábitat y abundancia relativa de mamíferos silvestres aporta información básica para programas de conservación o manejo. El pecarí labios blancos Tayassu pecari (Link, 1795), es una especie en peligro de extinción en México. En este estudio se evaluaron las preferencias del hábitat y la abundancia relativa de esta especie en la parte sur de la Reserva de la Biosfera de Calakmul y en el ejido Nuevo Becal, ambos sitios localizados en el estado de Campeche. Se establecieron 20km de transectos en cada sitio, registrándose las especies arbóreas presentes y el número de huellas de la especie durante 4 meses de la estación de lluvias y 2 meses de la época seca. Los análisis de uso de hábitat indican que aunque el mayor número de registros es en la selva mediana, los pecaríes de labios blancos prefieren la vegetación baja inundable. Después de recorrer 240km, se obtuvo una abundancia relativa de 0.53 huellas por km caminado. Brosimum alicastrum y Manilkara zapota fueron las especies arbóreas que presentaron la mayor abundancia de frutos en los 2 sitios. El pecarí de labios blancos es una especie muy vulnerable a la deforestación y otras perturbaciones antropogénicas en su hábitat, resulta entonces importante considerar una estrategia para la conservación del hábitat del pecarí de labios blancos, tomando en cuenta no sólo las áreas protegidas, sino también áreas comunales.
Investigating the habitat preferences and relative abundance of wild mammals provides basic information for conservation or management programs. The white-lipped peccary (Tayassu pecari, PLB, for its Spanish initials) is a species classified as in danger of extinction in Mexico. This study evaluated the habitat preferences and relative abundance of this species in the southern part of the Calakmul Biosphere Reserve and the ejido Nuevo Becal, both sites are located in the state of Campeche. Twenty kilometers of transects were established at each site, in each of these sites we recorded the tree species present and the number of tracks during 4 months of the rainy season and 2 months of the dry season. The analysis of habitat use indicates that although the highest number of records occurred in the medium semi-perennial forest, the PLB preferred the low flooded forest. After surveying 240km, we obtained a relative abundance of 0.53 signs per km walked. Brosimun alicastrum and Manilkara zapota were the tree species that had the highest abundance of fruits in the 2 sites. White-lipped peccary species is very sensitive to deforestation and other anthropogenic disturbances, so it is important to develop a strategy for the conservation of the habitat of the species considering not only the protected areas, but also the communal areas.
La selección del hábitat está influenciada por los atributos y necesidades de las especies, así como las características propias del mismo que incluyen el alimento disponible y otros recursos clave, como el agua (Arthur et al., 1996; Morrison et al., 2006). La abundancia y disponibilidad de los recursos determinan la presencia y el tamaño de las poblaciones de las especies; sin embargo, los cambios en la disponibilidad de estos recursos pueden influir en la abundancia de las especies en tiempo y espacio (Rautenstrauch y Krausman, 1989; Mandujano y Gallina, 1995), revelando así su papel fundamental en los movimientos de los individuos (Nathan, 2006).
El pecarí de labios blancos (Tayassu pecari) (PLB) es una especie de ungulado silvestre Neotropical de amplia distribución abarcando desde el norte de Argentina hasta el sur de México (Sowls, 1997). Es considerado como un indicador del estado del hábitat, debido a su intolerancia a la perturbación, ya que desaparece rápidamente de áreas que han sido colonizadas por el hombre (March, 1990). Los principales problemas que enfrenta el pecarí de labios blancos son la pérdida de su hábitat y la cacería (Robinson y Redford, 1994), que han provocado la reducción de su rango histórico de distribución en México en un 84% (Altrichter et al., 2012). Por esta razón, el pecarí de labios blancos es considerado una especie en peligro de extinción en México (Semarnat, 2010) y cerca de considerarse amenazado (Near Threatened) en todo su rango de distribución, de acuerdo con las listas rojas de la UICN (Keuroghlian et al., 2013).
El hábitat preferido por el pecarí de labios blancos es el bosque tropical de tierras bajas, especialmente de áreas extensas (>30 000 ha) y en buen estado de conservación, donde alcanzan sus mayores abundancias (Sowls, 1997). Sin embargo, dentro del bosque tropical, el pecarí de labios blancos se muestra selectivo; por ejemplo, en Perú esta especie prefiere los lechos de riachuelos de tierra firme húmeda y los bosques húmedos en las planicies inundables (Bodmer et al., 1997), y en México particularmente en la península de Yucatán ante la ausencia de selvas altas prefieren la selva mediana y la selva baja inundable (Reyna-Hurtado et al., 2009); sin embargo, en los estados de Chiapas, Oaxaca y Veracruz, el hábitat preferido son las selvas altas perennifolias extensas, que cuentan con más agua y recursos alimentarios que las selvas medianas y bajas (Naranjo y Bodmer, 2007).
Se ha demostrado que la selección del hábitat y los movimientos estacionales entre tipos de vegetación del pecarí de labios blancos están relacionados con la disponibilidad de alimento. Carrillo et al. (2002) mostraron que en el Parque Nacional Corcovado, Costa Rica, el pecarí de labios blancos utilizó más el bosque “primario” durante el periodo que corresponde con el pico de mayor producción de frutos. En la Reserva de la Biosfera de Calakmul (RBC) Reyna-Hurtado et al. (2009) mostraron que los pecaríes de labios blancos prefieren las selvas medianas donde encuentran frutos, y las aguadas en la época de secas y los bajos inundables en la época de lluvias. Sin embargo, en las zonas con cacería alrededor de la RBC, los mismos autores mostraron que la especie prefiere los bajos inundables sobre los demás tipos de vegetación (Reyna-Hurtado y Tanner, 2005).
Son pocos los trabajos que aportan información sobre el impacto antropogénico en las poblaciones de pecarí de labios blancos que habitan áreas donde hay influencia humana. Esta información es, sin embargo, de gran relevancia, puesto que las áreas comunales son muchas veces las que conectan grandes reservas y mantienen, además, poblaciones importantes, por lo que tienen gran impacto en la conservación de la especie a nivel regional. El presente estudio pretende determinar las preferencias de hábitat y la abundancia relativa del PLB en la RBC y en el ejido Nuevo Becal, un ejido adyacente al área protegida, donde existen actividades extractivas en los bosques, incluyendo la cacería, que ejercen gran presión sobre la fauna silvestre. Se plantean las siguientes hipótesis que: 1) la presión de cacería tiene influencia sobre el uso del hábitat del PLB, provocando que los hábitats preferidos sean distintos en la reserva y en el ejido, y 2) la presión de cacería está ejerciendo un efecto negativo sobre las poblaciones de la especie, que se debería traducir en un índice de abundancia relativa menor en el ejido que en la reserva.
Materiales y métodosÁrea de estudioEl municipio de Calakmul se ubica en el sureste del estado de Campeche, México, entre los 19°15’17” N, 90°10’89” O. Las elevaciones varían entre 100 y 380m snm (García, 2003). Predomina el clima cálido subhúmedo con lluvias en verano y con menos de 60mm de precipitación en el mes más seco (Aw1). La temperatura media anual es de 24.6° C y la precipitación media anual oscila entre 1 200 y 1 500mm en el centro y 1 500 y 2 000mm en el sur (García et al., 2002). En esta región se encuentran numerosos cuerpos de agua llamados localmente aguadas, que son reservorios importantes de agua, debido a la ausencia de una red hidrológica de superficie permanente (García, 2003). Dentro del municipio de Calakmul se encuentran los 2 sitios de estudio, la porción sur de la Reserva de la Biosfera de Calakmul y el ejido Nuevo Becal (Fig. 1).
La Reserva de la Biosfera de Calakmul fue establecida en 1989, tiene una extensión de 7 231.25km2 en su totalidad con aproximadamente 4 000km2 al sur de la carretera Escárcega-Chetumal (Morales y Magaña, 2001). El ejido Nuevo Becal (ENB) se ubica en las coordenadas 18°40’07.7” N, 89°12’34.3” O, adyacente a la RBC (Fig. 1). El ejido tiene una extensión de 520km2, de los cuales la mitad está destinada como área forestal permanente, donde sólo se permite el aprovechamiento forestal y la cacería. En general, se estima que más de 80% del ejido presenta cobertura forestal.
La vegetación que existe en la RBC y el ejido Nuevo Becal incluye: 1) selvas medianas subperenifolias que se caracterizan por presentar árboles que alcanzan alturas entre 15 y 25m, de los cuales aproximadamente un 25% tira sus hojas en la época de secas; 2) selvas bajas inundables subperenifolias, comúnmente llamados bajos, que presentan árboles dominantes con menos de 15m de altura; 3) selvas bajas secas que se caracterizan por presentar árboles con alturas menores de 15m y donde entre 75-100% de los árboles dominantes pierden sus hojas en épocas de secas y 4) vegetación secundaria que se desarrollan una vez que la vegetación original ha sido eliminada por actividades humanas y fenómenos naturales (Pennington y Sarukhan, 1998).
Métodos de colección de datosPara la recopilación de datos se clasificó a la vegetación presente de acuerdo con Pennington y Sarukhan (1998), en los 4 tipos principales ya mencionados: selva mediana subperenifolia, selva baja inundable, selva baja y vegetación secundaria. Con ayuda de gente local y expertos en el área se logró la plena identificación de los tipos de vegetación presentes en la RBC y en el ENB.
TransectosSe establecieron 6 transectos en el ENB para un total de 20km. Los transectos en el ejido se establecieron al azar en las zonas forestales de la comunidad, evitando un radio de al menos 7km del poblado. En el área de conservación (RBC), se utilizaron 7 transectos en su mayoría ya establecidos para estimar abundancias de mamíferos en investigaciones previas, con un total de 20km. Estos transectos también han sido establecidos al azar y abarcan desde la entrada a la zona sur hasta 40km adentro, siguiendo el camino principal de acceso.
Proporción del tipo de hábitat disponibleSe ubicaron 398 puntos de muestreo en total para la vegetación en ambos sitios, un punto por cada 100m de km recorrido. En cada punto se registraron las especies arbóreas presentes y se identificó el tipo de vegetación. Se consideró a la muestra de vegetación obtenida en cada transecto como representativa de la vegetación presente en cada sitio. Por lo tanto, se utilizaron estos datos para estimar la frecuencia relativa de cada tipo de vegetación en cada sitio de estudio.
Preferencias de hábitatSe registraron todos los signos confiables de presencia del PLB en los transectos, y se incluyeron, además, avistamientos de la especie por campesinos cazadores, aplicando una entrevista sencilla, siguiendo la guía previamente usada por Reyna-Hurtado y Tanner (2007). Posteriormente, se visitó cada sitio identificado con el entrevistado correspondiente para obtener las coordenadas geográficas y registrar el tipo de vegetación asociado, se ubicaron solamente los sitios de encuentro inicial entre el cazador y los PLB y estos sitios se anexaron a la base de datos de localizaciones de los PLB, en relación con el tipo de hábitat.
Abundancia relativaSe estimó la abundancia relativa de los pecaríes de labios blancos por medio de un índice que consiste en el número de huellas de la especie por km de transecto, TEH, Tasa de Encuentro de Huellas (Reyna-Hurtado y Tanner, 2007). Todos los transectos fueron recorridos mensualmente durante 6 meses, entre agosto de 2011 y enero de 2012. Se registraron todas las huellas de PLB presentes a un metro de cada lado de la línea del transecto.
Disponibilidad de alimento y aguaLos datos para evaluar la disponibilidad de alimentos fueron obtenidos durante los recorridos del transecto al mismo tiempo que las huellas de PLB. Se obtuvo un índice de abundancia de frutos utilizando la metodología propuesta por Altricher et al. (2001). El método consiste en que después de encontrar un fruto en el suelo, se busca el árbol de donde presuntamente proviene, siempre y cuando éste se encuentre a una distancia perpendicular no mayor de 5m de la línea central del transecto. Una vez ubicado el árbol se registraron todos los frutos encontrados en un cuadro de 2m2 debajo de la copa. También se registró el tipo de vegetación donde se encontró cada fruto. Para registrar la presencia o ausencia de lombrices y otros invertebrados bajo la hojarasca, se establecieron 3 parcelas de 5m2 por tipo de vegetación por sitio de estudio, ubicadas en los transectos. Cada mes, durante los recorridos de los transectos, se muestrearon estas parcelas, removiendo la hojarasca en la superficie del suelo con el fin de observar la presencia o ausencia de invertebrados. Para determinar la disponibilidad de agua en los 2 sitios de estudio, se buscaron inicialmente todas las aguadas cercanas a los transectos (<30m). Se registraron de esta manera 6 aguadas en el ejido Nuevo Becal y 4 en la RBC. En cada recorrido mensual de los transectos se registró la presencia o ausencia de agua en estas aguadas.
Análisis estadísticosPara el análisis de uso de hábitat, se comparó la disponibilidad de los 4 tipos de vegetación (%) contra la frecuencia de huellas obtenidas en los transectos y los registros confiables obtenidos en las entrevistas en cada uno de los tipos de vegetación, usando el programa HABUSE (Byers et al., 1984), el cual realiza una prueba de Chi Cuadrada y calcula intervalos de Bonferroni. Las abundancias relativas se obtuvieron con el índice TEH.
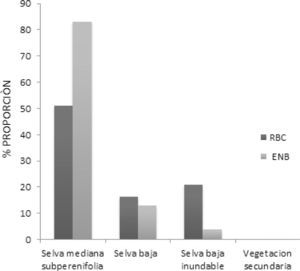
ResultadosHábitat disponibleEn ambos sitios de estudio, la selva mediana subcaducifolia fue el tipo de vegetación dominante, representando 83% en el ENB y 52% en la RBC (Fig. 2). La selva baja fue representada de manera similar en los 2 sitios: 17% en la RBC y 13% en el ENB, pero la selva baja inundable fue 3 veces menos frecuente en el ejido (4%) que en la RBC (21%).
Preferencias de hábitat en la RBCEl número de registro de presencia de la especie en la RBC no fue suficiente para realizar el análisis estadístico de preferencias del hábitat; sin embargo, de los 17 registros obtenidos en la RBC el mayor número se encontró en la selva mediana (n=12), seguido de la selva baja inundable (n=5) y ninguno en la selva baja seca.
Preferencias de hábitat en el ENBCon base en las entrevistas aplicadas a 18 cazadores y los registros de huellas en los transectos, se obtuvo un total de 43 registros confiables de la presencia de PLB en la zona ejidal (datos de cazadores n=31; huellas n=12). El análisis de preferencias de hábitat en el ejido indicó que el número de observaciones fue menos de lo esperado en la selva mediana, la evitan, mientras que fue mayor de lo esperado en la selva baja inundable considerada como la preferida por los PLB. Para la selva baja y el bosque secundario no hubo evidencia de preferencia (Cuadro 1). (X2=84.98, p<0.0001).
Preferencias de hábitat por el pecarí de labios blancos en el ejido Nuevo Becal, Calakmul, Campeche, México. Con base en 43 de registros obtenidos en los 4 tipos de vegetación presentes en el ejido. Los símbolos -,+,=denotan si el tipo de vegetación fue usado menos, más o igual de lo esperado, respectivamaente
| Tipo de vegetación | Número de observaciones | Número esperado | χ2 |
| Selva mediana subperinifolia | 22(−) | 35.69 | p<0.001 |
| Selva baja inundable | 9(+) | 1.72 | |
| Selva baja | 7(=) | 5.59 | |
| Vegetación secundaria | 5(=) | 0.43 |
Se registró un total de 29 huellas de pecarí de labios blancos en los 240km de transectos recorridos, correspondiendo a una abundancia relativa de 0.53 huellas/km total para los 2 sitios, de manera particular la abundancia relativa en cada sitio fue de 0.10 huellas/km con 12 registros encontrados en 120km recorridos en el ejido y de 0.14 huellas/km con 17 registros encontrados en 120km recorridos en la RBC.
Disponibilidad de alimento y aguaUn total de 56 especies de plantas fueron registradas a lo largo de los transectos establecidos en los sitios de estudio. De 8 especies registradas como potencialmente consumibles para los PLB, B. alicastrum, M. zapota, Pouteria campechiana, Ampelocera hottlei, Cratavea tapia, Byrsonima crassifolia, Citrullus vulgaris y Metopium Brownei (Sowls, 1997; Fragoso, 1997; Altrichter et al., 2001; Beck, 2006), sólo 2 especies B. alicastrum (Ramón) y M. zapota (zapote) representaron el 57.10% de los frutos registrados en el suelo de los 2 sitios de estudio, con 41.76 y 15.33%, respectivamente. Se ha demostrado que ambas especies son parte de las especies preferidas en la dieta del PLB (Pérez-Cortez y Reyna-Hurtado, 2008).
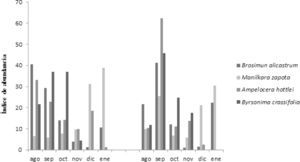
La disponibilidad estacional de los frutos varía según la especie y en cada sitio de estudio. Durante el tiempo de la investigación los frutos de B. alicastrum estuvieron presentes los 6 meses de muestreo en los 2 sitios de estudio, alcanzando el mayor índice en los meses con estación lluviosa, -agosto y septiembre, en los 2 sitios. Mientras que los frutos de M. zapota estuvieron presentes en todos los meses, alcanzando su mayor índice en los meses de diciembre y enero en la RBC, y en septiembre y enero en el ejido Nuevo Becal. En cuanto a los frutos de A. hottlei (Ya□axnik) estuvo presente en grandes cantidades sólo en el mes de septiembre en el ejido Nuevo Becal, superando el índice de B. alicastrum en este sitio para este mes y a B. crassifolia quien obtuvo su mayor índice de abundancia en los meses de septiembre y octubre en los 2 sitios (Fig. 3).
Las lombrices son parte importante en la dieta de los PLB (Reyna-Hurtado, 2007), son un alimento que está disponible únicamente en épocas de lluvias y, principalmente, en la selva baja inundable (63%). Durante el periodo de muestreo en la RBC y el ejido Nuevo Becal el agua siempre estuvo disponible en las “aguadas” ubicadas cerca de los transectos y también en estanques naturales como algunas piedras llamadas sartenejas, que tienen depresiones donde se retiene el agua de lluvia. Debido a la época en que se desarrolló el estudio, que abarcó 4 meses de estación lluviosa, agosto-noviembre, también hubo agua en las zonas de selva baja inundables o bajos.
DiscusiónHábitat disponibleEn los 2 sitios muestreados, los hábitats preferidos para el pecarí de labios blancos fueron con vegetación en buen estado de conservación y se observó que evitaban el bosque perturbado. Leopold (1959) y March (1990) mencionan que el PLB es una especie indicadora del buen estado de conservación de las selvas y desaparece muy rápido en áreas perturbadas, prefiriendo siempre áreas bien conservadas. En este estudio el mayor porcentaje de hábitat disponible para esta especie fue la selva mediana, pero el hábitat preferido en la zona ejidal fue la selva baja inundable, esta preferencia puede estar relacionada a la cantidad de invertebrados que son parte fundamental en la dieta de los PLB, dado que la mayor parte de este estudio se llevó a cabo durante la época de lluvias cuando hay abundancia de invertebrados. Además, la selva baja inundable proporciona cobijo y protección al ser el hábitat más denso y con una menor influencia humana en comparación con la selva mediana, donde se da una mayor influencia humana debido a la gran cantidad de recursos que ahí se encuentran (Reyna-Hurtado y Tanner, 2005). Sin embargo, estudios previos han demostrado que en la RBC el hábitat preferido es la selva mediana (Reyna-Hurtado et al., 2009), esta preferencia se puede atribuir a que al ser un área protegida los PLB pueden distribuirse libremente sin la presión de caza en la selva mediana donde la disponibilidad de alimento es alta. Este hecho resalta la importancia de conservar tanto áreas de selva baja inundable como áreas de selva mediana disponibles para el PLB, sobre todo, en sitios con asentamientos humanos como en el ENB, el cual cuenta con una extensión considerable de selva mediana y baja inundable importantes para la conservación de los grupos de PLB que aún existen en zonas ejidales adyacentes a la RBC.
Este estudio confirma que las áreas ejidales del sur de Campeche y la parte sur de la RBC aún representan importantes áreas de conservación para el PLB, dado que se encontró un índice similar de abundancia relativa entre el área protegida y el área de cacería; si bien, el índice fue mayor en la RBC lo que confirma lo documentado por Reyna-Hurtado (2009) y resalta la necesidad de preservar grandes extensiones de bosques en buen estado de conservación tanto en áreas protegidas como en los ejidos.
Preferencias de hábitatLos PLB han demostrado ser especialistas en relación con su hábitat preferencial, lo que los hace una de las especies más importantes como indicadoras de la calidad del hábitat. Reyna- Hurtado y Tanner (2005) en un estudio en las mismas áreas mencionan que los PLB mostraron la mayor preferencia de hábitat dentro de toda la comunidad de ungulados al utilizar solamente selvas medianas y selvas bajas inundables, y nunca encontraron la especie en vegetación secundaria. En este estudio se analizaron las preferencias de hábitat en una zona con cacería y se encontró que efectivamente los PLB prefieren la selva baja inundable, pero también con el método de entrevistas se encontró que a veces incursionan en vegetación secundaria, lo cual podría deberse al aumento en la extensión de parcelas destinadas para el campo o podemos suponer que ha habido un incremento en la desaparición de selva mediana ahora transformada en acahuales en lo que va del 2002, de cuando se recolectaron los datos de Reyna-Hurtado y Tanner (2005) a la fecha. Una posible tercera opción puede ser el uso de registros en este presente estudio de cazadores locales, los cuales muchas veces cazan al PLB de manera oportunista en las ocasiones en que penetran a las milpas para consumir el producto de la cosecha.
Abundancia relativaReyna-Hurtado y Tanner (2007) concluyen que de toda la comunidad de ungulados de la región de Calakmul, el pecarí de labios blancos es el más afectado por las actividades humanas y desaparece rápidamente de áreas perturbadas, contrario a otras especie de ungulados como el pecarí de collar (Briceño et al., 2011) y el venado cola blanca quien se ve favorecida por un mosaico de vegetación secundaria (Reyna-Hurtado y Tanner, 2007). En diversos estudios donde se ha usado número de huellas como índice de abundancia se han registrado valores superiores a las encontradas en este estudio para esta especie con escalas temporales y espaciales similares. Reyna-Hurtado y Tanner (2007) en sitios sin conservación y en la RBC encontraron 0.11 y 0.33/km, respectivamente, donde el PLB fue una de las especies junto con el tapir que mostró la mayor diferencia de abundancia relativa en zonas de caza y no caza. De manera similar en este estudio comparando los 2 sitios, se encontró un mayor índice en la RBC que en el ejido de Nuevo Becal. Naranjo (2002), en la selva Lacandona, encontró que la abundancia del PLB fue casi 7 veces mayor en un área de no caza que en una zona de cacería. En los bosques amazónicos Pérez (1996) reporta que el PLB raramente estuvo presente en áreas de acceso a zonas de cacería y asentamientos humanos. Todos estos resultados resaltan la vulnerabilidad del pecarí labios blancos a la presión de cacería.
Asimismo, los movimientos de los grupos podrían estar influenciando nuestros resultados; por ejemplo, Vickers (1991) estudió los patrones de caza en la Amazonía ecuatoriana y encontró en un periodo de 10 años que las tasas de cosecha para el PLB fueron muy variables, esto lo atribuyó a los movimientos ocasionales de grandes grupos fuera de la zona hacia un lugar menos perturbado, e incluso muy alejado del área con asentamientos humanos. Considerando que los grupos pueden desplazarse hasta 100km2 como se ha demostrado en la RBC (Reyna-Hurtado et al., 2009), estos movimientos son llevados a cabo en épocas de lluvias, principalmente, época en que el alimento y el agua está disponible en mayor cantidad, sobre todo, por la disponibilidad del B. alicastrum. Se necesita estudiar los patrones de movimientos de los grupos de PLB en las zonas ejidales para comprender mejor este comportamiento de la especie en zonas de cacería.
Pudimos conocer que los cazadores del ejido consideran a los PLB muy importantes para la conservación de las selvas que aún quedan en el ejido Nuevo Becal y que están dispuestos a participar en cualquier programa de conservación y manejo para esta especie en peligro, sin embargo, al mismo tiempo un 93% de los campesinos entrevistados mencionan que si se encuentran con algún grupo de PLB tratarán de cazarlo, ya que dependen en gran medida de esta especie para conseguir proteína animal, además de que proporcionan una fuente para obtener recursos económicos al vender carne de manera interna en el ejido (obs. propia: Marcos Briceño). Este hecho resalta la necesidad de plantear estrategias de extracción que conlleven a un aprovechamiento sustentable.
Este estudio al igual que las investigaciones antes señaladas demuestran que los PLB seguirán teniendo una fuerte presión de cacería y se deberá considerar una oportuna estrategia de conservación para la especie en los sitios que están adyacentes a la RBC, ya que estas zonas son áreas prioritarias para la especie.
Consideramos que aunque no estudiamos el tema en esta investigación, se debe poner atención a la posible transmisión de enfermedades por animales domésticos lo que de manera directa e indirecta podrían estar influenciando en la abundancia encontrada para la especie en el ejido Nuevo Becal, aunque carecemos de datos en este tema, Fragoso (1997) encontró evidencia que apoya la hipótesis de que la transmisión de enfermedades en esta especie por los animales domésticos son responsables de la desaparición de las poblaciones de PLB en el norte amazónico de Brasil en la década de 1980. Este es un tema de investigación que necesita abordarse en el futuro en la región de Calakmul.
Alimento disponibleLos frutos de B. alicastrum y M. zapota se encuentran entre las 10 especies de importancia en la dieta del PLB y representan casi un 80% de frecuencia de especies consumidas (Pérez-Cortez y Reyna-Hurtado, 2008) por esta especie, y fueron las que presentaron el mayor índice de abundancia. Estos resultados concuerdan con lo documentado por Reyna-Hurtado (2007) y Pérez-Cortez y Reyna-Hurtado (2008) quienes indican que son de las 2 especies más importantes para la dieta del PLB. Es importante señalar que estas especies estuvieron presentes en mayor proporción en selvas medianas (B. alicastrum) y bajas secas (M. zapota). Lo que indica la importancia ecológica que desempeñan los PLB al ser consumidores de especies registradas en selvas conservadas como la selva mediana y selvas bajas, ya que por medio de la dispersión al mismo tiempo participan en el mantenimiento de las selvas, al preservar la diversidad de árboles (Beck, 2006).
Este estudio proporcionó información útil para diseñar un plan de manejo integral y conservación de esta especie en peligro de la fauna silvestre del trópico húmedo. Se demostró que el hábitat disponible y preferencial, así como la presión humana afectan de manera directa a la preferencia y uso de los tipos de vegetación por parte de las poblaciones de PLB y esto se ve reflejado también en su abundancia relativa. Todos estos factores deben ser considerados en los planes de conservación de esta especie en áreas con asentamientos humanos.
Los PLB son una especie que muestra una preferencia por determinados hábitat, sobre todo, los que se encuentran en buen estado de conservación. Las asociaciones vegetales como la selva mediana y los bajos inundables proporcionan recursos primordiales para el manteniendo de la especie como el alimento y agua, y deberían estar sujetas a programas para su conservación.
Conservar al PLB es fundamental, para el buen funcionamiento de los ecosistemas naturales y para el mantenimiento de la diversidad de especies de árboles al ser éste un depredador de frutos y semillas, su aprovechamiento debería estar condicionado a la mejor manera posible para un uso sustentable del mismo, o en todo caso, suspender por grandes periodos de tiempo su aprovechamiento, o dar tasas de extracción mínimas controladas, ya que es una de las especies más vulnerable a la extinción, eso lo demuestra el bajo índice de abundancia encontrado, inclusive en áreas de conservación. Trabajar en conjunto con las autoridades comunitarias es una prioridad para asegurar que dichos planes de conservación sean apropiados e implementados de común acuerdo con los dueños de los bosques comunitarios, quienes al final son los mejores guardianes de sus propios recursos.
Cabe mencionar que la búsqueda de un aprovechamiento sustentable de los recursos naturales requiere el entendimiento de las interacciones entre naturaleza y sociedad, así como la combinación de diferentes formas de conocimiento y aprendizaje que permitan a los diferentes actores sociales trabajar en conjunto, aun cuando la información sea incierta y limitada (Kates, 2001). Asimismo, se necesita brindar oportunidades viables de subsistencia a los habitantes de comunidades rurales, ya que cualquier discurso conservacionista será desechado si ellos no tienen los recursos para cubrir sus necesidades básicas (Montiel et al., 1999) y de no hacerlo se llegará a la total desaparición de especies vulnerables como el PLB.
Se agradece a la Dirección de la Reserva de la Biosfera de Calakmul, Campeche y autoridades del ejido Nuevo Becal por la disposición para el desarrollo de este trabajo. También a Conacyt por el apoyo económico que proporcionó al primer autor por medio del programa de Becas Mixtas durante su estancia de 4 meses en el Departamento de Ecología de la Universidad de Sherbrooke, Canadá. A Wiliam Aguilar-Cordero y José Salvador Flores-Guido por sus comentarios a este artículo; así como a los colaboradores en el trabajo de campo Mauro Sanvicente, Dulce Noriega, Sadao Pérez, Martine Fugère, Simon Létourneau-Robert, Sonia Van Wijk, Nicolás Arias-Domínguez y Mainor Hernández-García.