La obesidad es un problema de salud pública en diversos países, principalmente en Norteamérica. Se ha observado que sujetos que presentan obesidad manifiestan numerosas alteraciones psiquiátricas, entre ellas: depresión, ansiedad y trastorno por atracón. Por ello, diversos estudios han llegado a la conclusión de que las hormonas gastrointestinales fungen un papel crucial en el establecimiento de conductas, siendo la orexigénica grelina y la anorexigénica leptina 2 de las hormonas con mayor participación activa. Dicha intervención se debe a que ambas hormonas presentan receptores en sistema nervioso central, primordialmente en áreas del sistema límbico, regulador crucial de conductas hedónicas. Por lo tanto, en la presente revisión bibliográfica describiremos el papel de la grelina y la leptina sobre la expresión de conductas psicopatológicas comunes en sujetos que padecen obesidad.
Obesity is a public health problem in many countries, mostly in North-America. It has been observed that people with obesity manifest psychiatric disorders, with the main ones being, depression, anxiety and binge eating disorder. Therefore, many studies have concluded that the gastrointestinal hormones have a crucial role in the establishment of behaviours, with the orexigenic ghrelin and the anorexigenic leptin being 2 of the hormones with more active participation. Such intervention is because both hormones have receptors in the central nervous system, primarily in limbic system areas, which is a decisive regulator of hedonic behaviours. In the present review a description is presented on the role of ghrelin and leptin over the expression of psychiatric disorders common in obese people.
La obesidad (índice de masa corporal [IMC]>30kg/m2) se define como el exceso en la proporción del tejido adiposo1; consecuencia de un ingreso calórico superior al gasto energético del individuo2. Es considerada un problema inflamatorio, sistémico, crónico y recurrente que causa diversas complicaciones3. Esta enfermedad se ha relacionado con diversos problemas metabólicos y fisiológicos ampliamente estudiados; además de psicopatológicos. Respecto a estos últimos, se han demostrado asociaciones significativas entre obesidad, depresión y ansiedad, siendo esta asociación más fuerte en personas con obesidad grave (IMC>35kg/m2) y mujeres4,5. Un estudio reciente reportó que las personas que presentan mayores niveles de ansiedad son las de menor escolaridad, niños y jóvenes4. Además, sujetos con obesidad manifiestan alteraciones en las vías de recompensa, lo que podría explicar el comportamiento parecido a las adicciones y la incapacidad de estos pacientes para adaptar la ingesta de alimentos a sus necesidades fisiológicas6. La regulación del consumo de alimento está determinada por distintas hormonas que cumplen funciones metabólicas y hedónicas, tal es el caso de la grelina con funciones orexigénicas y la leptina con anorexigénicas. Ambas hormonas presentan receptores en el sistema nervioso central, principalmente en áreas del sistema límbico, lo cual parece indicar su participando en la regulación de conductas hedónicas, como consumo de alimento, depresión y ansiedad, principales desórdenes psicopatológicos que exhiben los sujetos con obesidad. Para poder comprender dicha relación, se lleva a cabo la presente revisión bibliográfica.
Epidemiología de la obesidadEl 65% de la población a nivel mundial vive en países donde el sobrepeso y la obesidad son la principal causa de defunción, falleciendo alrededor 3.4 millones de personas adultas por su causa7.
La OMS en 2014 reportó que desde 1980 la obesidad se ha duplicado en todo el mundo. En 2008, el 35% de las personas adultas de 20 o más años de edad presentaban sobrepeso y el 11% eran obesas. De este grupo, más de 200 millones pertenecían al género masculino y cerca de 300 millones al femenino7. La prevalencia de obesidad en Europa varía del 7-27% y es de alrededor del 32.2% en EE. UU.8. En México, según la Encuesta Nacional de Salud, el 38.8% de la población presenta sobrepeso y el 32.4% obesidad9. Además, del 2000 a 2012 se incrementó un 15.4% la prevalencia combinada (sobrepeso y obesidad); aunado al aumento de 1.3 unidades en IMC; siendo los sujetos con nivel socioeconómico alto, de zonas urbanas y del norte del país quienes mostraron mayores niveles de obesidad9.
Comportamiento en niños y adolescentes con obesidadEn el caso de niños con obesidad o sobrepeso, se ha identificado la presencia de insatisfacción corporal, baja autoestima corporal y académica, además de mayores niveles de ansiedad y depresión10,11. Asimismo, se han reportado diferencias por género, donde los niños presentan mayor puntaje en autoestima global y académica, pero menor en autoestima social y mayor insatisfacción corporal en comparación con las niñas10. Posterior a un tratamiento para reducir tallas, se encontró disminución significativa en los niveles de ansiedad y depresión en ambos géneros11. El incremento de obesidad abdominal e IMC son factores que actualmente ayudan a predecir el desarrollo de fobia social, desorden de pánico y distimia en niños12.
En adolescentes de 11 a 17 años de edad con obesidad grave se ha reportado que, a diferencia de los adolescentes con sobrepeso-obesidad leve-moderada, los primeros presentan mayores niveles de ansiedad, depresión y trastornos de alimentación13.
La sintomatología bulímica y psicopatológica de los adolescentes con obesidad (12-17 años de edad) se ha asociado con problemas de ansiedad y somatización en las madres, aunado a una relación significativa entre la gravedad de los síntomas bulímicos y el grado de sintomatología emocional (depresión y ansiedad), independientemente del grado de obesidad14. Al analizar por género, se reportó que las niñas manifiestan una correlación positiva entre síntomas somáticos y circunferencia de cintura e IMC; en niños fue entre depresión y ansiedad por separación y circunferencia de cintura e IMC12.
Comportamiento en adultos con obesidadSe ha demostrado que a medida que aumenta la ganancia de peso, se incrementa la posibilidad de padecer desórdenes de personalidad por evitación, desorden antisocial y paranoia, siendo la prevalencia mayor en mujeres15. Además, los sujetos con obesidad muestran predisposición a la depresión, ansiedad y trastorno por atracón16, siendo las personas con este último padecimiento quienes muestran menor autoestima y mayor prejuicio por el peso17. En mujeres con obesidad se identificó que los bajos niveles de cortisol urinario están relacionados con el trastorno por atracón, depresión, síntomas obsesivo-compulsivos, somatización y sensibilidad interpersonal18.
Neuroanatomía de la obesidadLas investigaciones dedicadas a estudiar las correlaciones neuronales de la obesidad en humanos se enfocan principalmente en estudios funcionales asociados a la visualización de imágenes de comida.
Neuroanatomía de la obesidad en niños y adolescentesNiños con obesidad muestran mayor actividad de corteza prefrontal en respuesta a imágenes de comida durante el ayuno19. Posteriormente, al consumir alimento, presentan un incremento en la actividad de corteza orbitofrontal e ínsula19,20. Esto aunado a la reducción de actividad en corteza prefrontal, regiones límbicas, corteza somatosensorial, corteza parietal y corteza visual19.
En adolescentes con alto riesgo de padecer obesidad, se ha demostrado mayor actividad de caudado, opérculo parietal y opérculo frontal en respuesta a comida21. Además, mujeres adolescentes con obesidad presentan mayor volumen de materia blanca en giro temporal medial bilateral, giro fusiforme izquierdo, giro parahipocampal bilateral, opérculo rolándico izquierdo, estriado dorsal derecho y giro occipital medial izquierdo22.
Neuroanatomía de la obesidad en adultosTras el consumo de alimento, los adultos con obesidad muestran mayor actividad en corteza prefrontal dorsolateral, corteza orbitofrontal lateral, giro frontal superior, cíngulo posterior y corteza entorrinal23. Además, ante la visualización de imágenes de comida con alto contenido calórico, aumenta la actividad de corteza orbitofrontal lateral, caudado y cíngulo anterior23.
Al realizar una comparación entre el grosor cortical de cíngulo dorsal anterior, ínsula anterior y corteza parietal posterior, los sujetos con obesidad presentan mayor grosor que los sujetos con sobrepeso o normopeso24; aunado a mayor volumen de materia gris en hipocampo derecho25. Personas propensas a la obesidad exhiben menor volumen de materia gris total22 en ínsula, corteza orbitofrontal medial y cerebelo26. La disminución del volumen de materia gris en el giro frontal superior bilateral y giro frontal medial fue asociada al incremento gradual del IMC22.
En mujeres con obesidad, las elecciones impulsivas se relacionan con menor actividad de giro frontal superior, giro frontal medial y lóbulo parietal inferior; prediciendo una mayor ganancia de peso en 1-3 años27,28. De igual manera, la mayor actividad del núcleo caudado derecho27 y la menor amplitud del potencial evocado P300 en corteza prefrontal medial al realizar tareas de discriminación de imágenes de comida se relacionaron con la gradual ganancia de peso29,30.
En la tabla 1 se muestra un resumen de los hallazgos neuroanatómicos en sujetos con obesidad.
Hallazgos neuroanatómicos en sujetos con obesidad
| Déficit funcional o estructural | Incremento funcional o estructural |
|---|---|
| - Giro frontal superior bilateral (volumen de materia gris)22,27,28-Giro frontal medial (volumen de materia gris)22,27,28-Corteza parietal (grosor cortical)24,27,28-Ínsula (grosor cortical)24 (volumen de materia gris)26- Corteza prefrontal (EEG)29-Cíngulo dorsal anterior (grosor cortical)24- Volumen total de materia gris22-Corteza orbitofrontal medial (volumen de materia gris)26-Cerebelo (volumen de materia gris)26-Giro frontal inferior27 | -Núcleo caudado21,23,27-Corteza orbitofrontal19,21,23-Ínsula19,21-Estriado dorsal30 (volumen de materia blanca)22-Opérculo rolándico izquierdo (volumen de materia blanca)22-Opérculo parietal y frontal21-Giro temporal medial bilateral (volumen de materia blanca)22-Giro fusiforme izquierdo (volumen de materia blanca)22-Giro parahipocampal bilateral (volumen de materia blanca)22-Giro occipital medial izquierdo (volumen de materia blanca)22-Hipocampo (volumen de materia gris)25-Corteza prefrontal19-Corteza prefrontal dorsolateral23-Giro frontal superior23-Cíngulo23-Corteza entorrinal23-Putamen21-Tálamo21 |
La grelina es una hormona con función orexigénica sintetizada fundamentalmente por el estómago y actúa como ligando de los receptores para secretagogos de la hormona del crecimiento y sus péptidos liberadores31. Es conocida como la hormona del hambre puesto que sus niveles circulantes aumentan antes de las comidas y disminuyen tras la ingesta de alimento.
Además de sus conocidos efectos sobre la conducta alimentaria, la grelina está implicada en diversos procesos fisiológicos como el sueño, estado de ánimo, memoria y procesos de recompensa, por lo que se ha relacionado con desórdenes psiquiátricos como la anorexia y esquizofrenia, adicciones y alteraciones metabólicas como la obesidad32. Esto es debido a que entre sus sitios de acción se han identificado diversas áreas multifuncionales; entre ellas el hipotálamo, hipocampo, amígdala, complejo dorsovagal (área postrema, núcleo del tracto solitario, núcleo dorsal motor del vago) y vías dopaminérgicas33–35.
Niveles de grelina durante el desarrollo en sujetos con obesidadEn niños con obesidad, los niveles de grelina son inferiores que en niños con normopeso36–38, condición que se mantiene al llegar a la adolescencia38–40. Sin embargo, los niveles de grelina durante la adolescencia son menores a los reportados durante la niñez38,40. Al llegar a la edad adulta, los sujetos con obesidad mantienen preprandrialmente niveles de grelina (total y activa) inferiores a los de los sujetos con normopeso36–43. Aunado a lo anterior, los sujetos con obesidad presentan menor disminución de grelina posprandial que los sujetos con normopeso39,40,44. En mujeres adultas con obesidad y sometidas a dieta para bajar de talla, se mostró que los niveles de grelina aumentaron gradualmente del mes 0 al mes 6, siendo quienes presentaban menor ingesta calórica las que mostraban menores niveles de grelina41,45. Sin embargo, otro estudio reportó que no había diferencias en el nivel de grelina tras una intervención para bajar de peso37. Esto puede ser debido al tipo de dieta recibida puesto que, de manera general, las mujeres con obesidad presentan menores niveles de grelina que las mujeres con sobrepeso41. Junto a ello, las mujeres con sobrepeso muestran una relación positiva entre los niveles de grelina y la ingesta calórica, además de una correlación negativa entre niveles de grelina y resistencia a insulina, presión sanguínea sistólica y ritmo cardiaco41.
Grelina-sistema mesolímbico-conductaEn respuesta a imágenes de comida y postadministración intravenosa de grelina en sujetos sanos y con normopeso, se activa bilateralmente amígdala, hipocampo derecho, pulvinar izquierdo e ínsula, corteza orbitofrontal, sustancia nigra, área tegmental ventral, caudado y áreas visuales46. Cuando a sujetos sanos con normopeso se les ofreció una comida palatable (malteada), se encontraron niveles de grelina disminuidos pospandrialmente, lo cual se asoció a la disminución de actividad en regiones relacionadas con la recompensa: mesencéfalo, amígdala, globo pálido, hipocampo, ínsula y corteza orbitofrontal medial47. Esto contrasta con resultados encontrados en sujetos con obesidad, en quienes se aprecia una menor reducción en la actividad cerebral en comparación con sujetos no obesos19 y una mayor actividad de corteza prefrontal y regiones límbicas tras la alimentación19,23.
En mujeres con obesidad se ha demostrado una correlación positiva entre los niveles de grelina y los niveles de cortisol plasmático tras la ingesta de alimento48. Además, mujeres con obesidad presentan niveles de grelina pre- y posprandialmente similares (respuesta fallida), menor capacidad de afrontamiento y mayor consumo de alimento en comparación con mujeres con obesidad y con respuesta normal a la grelina48. Estas últimas muestran una reducción en los niveles de ansiedad, estrés y cortisol plasmático tras la ingesta de alimento, situación que no ocurre en mujeres con respuesta fallida48.
En modelos animales empleando ratas macho adultos se encontró que la administración de grelina en VTA o núcleo accumbens incrementa gradualmente la ingesta de alimento49. Además, la administración de grelina en VTA aumenta los niveles extracelulares de dopamina en núcleo accumbens cuando el animal presenta acceso a comida, de lo contrario, se observó un decremento de DA con respecto al nivel basal50. Un estudio permitió determinar que los efectos de grelina en VTA regulan la conducta motivada por la recompensa (alimentos palatables) más que sobre la ingesta regular de alimento, efecto que no fue observado cuando se administró en núcleo accumbens51. También se vio que tras la depleción de células dopaminérgicas en VTA por la administración de 6-hidroxidopamina, se redujo el efecto de la grelina sobre la ejecución de tareas para obtener alimento en ratas52.
LeptinaLa leptina es una hormona anorexigénica que contiene 167 aminoácidos53. Se expresa principalmente en tejido adiposo blanco pero también se ha encontrado en células endocrinas y exocrinas como mucosa gástrica, placenta, glándula mamaria, ovario, músculo esquelético, glándula pituitaria, médula ósea, tejido linfoide, glándulas salivales y páncreas54–56.
La localización de los receptores a leptina (LepR) en estructuras límbicas sugiere su rol directo en procesos emocionales57. En humanos se han identificado 6 isoformas que van de LepRa a LepRf58. La isoforma más larga, el LepRb, se expresa en hipotálamo, específicamente en: núcleo arcuato, núcleo ventromedial, núcleo dorsomedial, área hipotalámica lateral, núcleo paraventricular, amígdala y sustancia nigra59–64. Tanto la leptina gástrica como la de tejido adiposo median su acción en hipotálamo, regulando la ingesta de alimento a corto plazo y el gasto energético a largo plazo respectivamente65.
Niveles de leptina durante el desarrollo en sujetos con obesidadHa sido demostrado que el incremento en los niveles de leptina es un factor que está relacionado con el incremento de IMC66, bajos niveles de actividad física67 y predisposición a la obesidad68.
Las personas con obesidad presentan concentraciones de leptina superiores a las de sujetos sanos; esto es debido al incremento en el número y tamaño de los adipocitos. Como consecuencia de ello, se esperaría una reducción en la ingesta de alimento y aumento del gasto energético, sin embargo, ocurre lo contrario, fenómeno que se conoce como resistencia a la leptina69–73. La causa de la resistencia a leptina no ha sido esclarecida, sin embargo, se han postulado varias posibilidades como: alteraciones de leptina circulante para cruzar la barrera hematoencefálica74,75, inhibición de cascadas de señalización de leptina en diversos grupos neuronales76, deficiencia y/o mutaciones en los genes de leptina y sus receptores76–79, señalización a la baja de las respuestas celulares a leptina71,80 e inflamación81.
Debemos recordar que la obesidad es un problema inflamatorio y dicho fenómeno favorece el incremento de lipopolisacáridos, proteína C reactiva y ciertas citocinas como la interleucina 1 y el factor de necrosis tumoral alfa82–84. Tales moléculas fomentan el incremento de las concentraciones de leptina circulante85–89. Por su parte, la proteína C reactiva favorece la permeabilidad de la barrera hematoencefálica para leptina, pero las concentraciones elevadas de proteína C reactiva inhiben la unión de esta hormona a los receptores de membrana, contribuyendo a la presencia de resistencia a leptina90.
Durante la niñez, los niveles de leptina aumentan de forma similar en mujeres y hombres, sin embargo, al llegar a la adolescencia, los niveles de esta hormona se incrementan en mujeres y disminuyen en hombres, lo que ha sido relacionado con la acumulación de grasa por efecto de hormonas sexuales91,92, siendo el desarrollo de resistencia a leptina un factor constante en sujetos con obesidad en cualquier edad estudiada68,93.
Leptina-sistema límbico-conductaLa leptina actúa sobre neuronas dopaminérgicas del VTA y área hipotalámica lateral, dando como resultado la disminución de la ingesta de alimento, presencia de depresión y ansiedad. Esto es debido a que modula la actividad de neuronas dopaminérgicas reduciendo su tasa de disparo, alterando la actividad de la tirosina hidroxilasa y del trasportador activo de dopamina94,95.
La activación del cuerpo estriado ventral inducida por las respuestas a señales de hambre se ha relacionado positivamente con las concentraciones de leptina e IMC6. Por ello se ha propuesto que la alteración de la regulación por retroalimentación homeostática de las vías de recompensa podría explicar el comportamiento y la incapacidad de los pacientes con obesidad para adaptar la ingesta de alimentos a las necesidades fisiológica6.
Se ha reportado que en sujetos con obesidad la resistencia a leptina afecta el estado de ánimo, favoreciendo la presencia de depresión y ansiedad96,97. Junto a esto, se ha encontrado una relación positiva entre los niveles de leptina y diferentes trastornos alimenticios como anorexia nerviosa, bulimia nerviosa y trastorno por atracón98. Mujeres con este último desorden presentan concentraciones elevadas de leptina circulante98,99.
Algunos estudios clínicos en sujetos deprimidos y con obesidad han reflejado resultados contradictorios, mostrando la presencia de niveles elevados100–102 o disminuidos103–106 de esta hormona anorexigénica; mientras que otro estudio no encontró asociación entre estas 2 variables107. La variabilidad en los resultados puede ser explicada por la complejidad de la respuesta a leptina en pacientes con obesidad que generalmente presentan niveles altos de dicha hormona108.
En hombres con obesidad, se han reportado niveles incrementados de leptina asociados a la presencia de depresión y aislamiento social; fenómenos considerados factores de riesgo para enfermedades cardiovasculares109. Además, los niveles altos de leptina y grasa visceral son considerados factores predictores de depresión108.
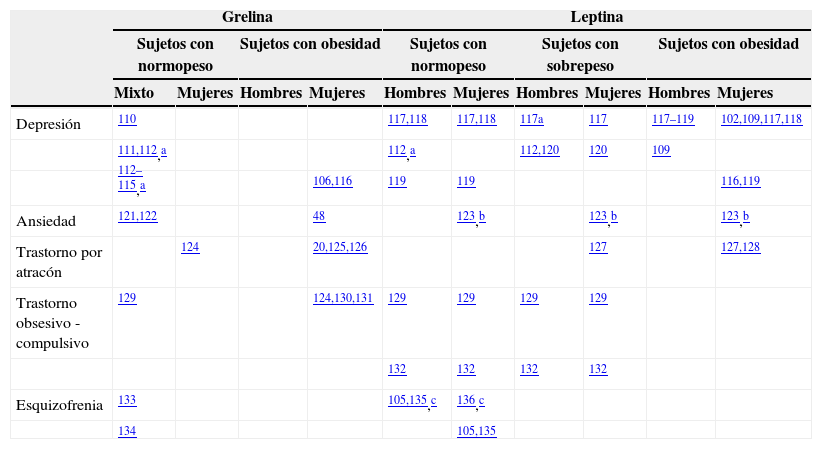
En la tabla 2 se muestran algunos hallazgos de niveles de grelina y leptina en sujetos con normopeso, sobrepeso y obesidad y su relación con desórdenes psiquiátricos.
Desórdenes psiquiátricos y su relación con niveles de grelina y leptina en sujetos con sobrepeso
| Grelina | Leptina | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Sujetos con normopeso | Sujetos con obesidad | Sujetos con normopeso | Sujetos con sobrepeso | Sujetos con obesidad | ||||||
| Mixto | Mujeres | Hombres | Mujeres | Hombres | Mujeres | Hombres | Mujeres | Hombres | Mujeres | |
| Depresión | ||||||||||
| Ansiedad | ||||||||||
| Trastorno por atracón | ||||||||||
| Trastorno obsesivo -compulsivo | ||||||||||
| Esquizofrenia | ||||||||||
Los sujetos que padecen obesidad presentan mayor predisposición a desarrollar desórdenes psiquiátricos que los sujetos con normopeso. Aunque la prevalencia de desórdenes psiquiátricos no es mayor en estos, la incidencia de depresión, ansiedad, trastorno por atracón y menor autoestima social se presentan con mayor frecuencia en esta enfermedad. Es importante mencionar que la mayoría de los estudios realizados en niños, adolescentes y adultos con obesidad son correlacionales, por lo que no es posible determinar con exactitud si la psicopatología es la causa o la consecuencia de la obesidad.
A nivel neuroquímico, principalmente en área tegmentaria ventral y núcleo accumbens, se ha demostrado la actividad de la grelina como reguladora de conductas motivadas por la recompensa, por ejemplo el efecto hedónico al consumir alimentos palatables. Esto aunado al efecto de la leptina como moduladora de la actividad dopaminérgica, que al reducir la tasa de disparo de estas neuronas genera un efecto antihedónico, o el denominado anoréxico. Al respecto no existe un patrón que nos indique si los niveles a la baja o al alta de estas hormonas favorecen el desarrollo de desórdenes psiquiátricos. Los reportes son contradictorios, lo que puede ser debido a que las variables no son homogéneas entre las investigaciones realizadas; algunos reportan hallazgos en hombres, otros en mujeres, en niños, en sujetos con alteraciones metabólicas, dietas calóricas, dietas hipocalóricas y ejercicio, dietas a corto o a largo plazo, entre otros. Lo que es una constante son los niveles de grelina que aumentan antes del consumo de alimento y disminuyen después de la ingesta, siendo inferiores y sin reducción significativa después del consumo de alimento en sujetos con obesidad. Lo contrario ocurre en cuanto a leptina, ya que sujetos con obesidad presentan altos niveles y desarrollan a largo plazo resistencia al efecto de dicha hormona. Sin embargo, poco se ha estudiado respecto al efecto directo o indirecto de las hormonas gastrointestinales sobre otras áreas cerebrales que influyen en la modulación del comportamiento. Sujetos que padecen obesidad presentan mayor actividad de núcleo caudado, corteza orbitofrontal, ínsula y estriado dorsal; y menor actividad en giro frontal superior, giro frontal medial, corteza parietal e ínsula. El estudio de estas áreas nos podría ayudar a comprender la relación obesidad-trastornos psiquiátricos, considerando para ello la mayor homogeneidad de las variables en las muestras para dichos estudios y sus réplicas.
FinanciaciónNo se recibió ningún patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.