El cáncer mamario es la principal causa de mortalidad por enfermedades neoplásicas en la mujer, en México y el mundo. El estudio de la expresión génica es una parte fundamental para el entendimiento del origen del cáncer, así como el análisis del origen de promotores de mutaciones, los cuales están involucrados en el desarrollo del cáncer. Recientemente se han publicado estudios que demuestran que mutaciones en las células somáticas, alteraciones en el ambiente hormonal materno, variantes heredadas y portadores de mutaciones somáticas en sus genomas y conductores de mutación, relacionados con la expresión de receptores hormonales de estrógenos, progesterona, el HER-2 y leptina, son temas relacionados con la elucidación de subtipos moleculares de cáncer mamario, los cuales son analizados en esta revisión. El manejo de los subtipos moleculares en la clínica permitirá estadificar u otorgar un grado de diferenciación celular específico que muy probablemente ayudará al clínico a tener más herramientas preventivas y de decisión para tratamientos específicos y por ende, un periodo de sobrevida mayor al paciente. El analizar los subtipos moleculares y los receptores hormonales, permitirá conocer más acerca del origen del cáncer mamario, además de identificar caminos para desarrollar terapias eficientes preventivas.
Breast cancer is the leading cause of death from neoplastic disease in women, in Mexico and the world. The study of gene expression is a key part for understanding the origin of the cancer, as well as analysis of origin promoter mutations, which are involved in cancer development, recently published studies demonstrate that mutations in the somatic cells, alterations in maternal hormonal environment, and inherited variants carrying mutations in their genomes somatic mutation and drivers mutations related to the expression of estrogen receptors, progesterone receptor, HER-2 and leptin, are issues related to the elucidation of molecular subtypes of breast cancer, which are analyzed in this review. The management of molecular subtypes in clinical staging or grant will allow a degree of specific cell differentiation most likely help the clinician to be more preventive and decision tools for specific treatments and therefore a greater survival period patient. The analysis of molecular subtypes and hormone receptors, will reveal more about the origin of breast cancer, and identify ways to develop effective preventive therapies.
Introducción
La definición de cáncer data de 1600 años A.C. en papiros descubiertos en Egipto, en los que se describe técnicas quirúrgicas en al menos 8 tipos de tumor observados en la glándula mamaria, siendo su tratamiento por cauterización. Hoy día, el cáncer es una preocupación mundial debido a que el porcentaje de mortalidad a largo plazo aumentará drásticamente con el paso de los años1.
Este desagradable escenario requiere de nuevas herramientas que permitan la detección temprana, una mejor estratificación de los diferentes tipos de tumor para guiar la terapia y el desarrollo de terapias efectivas preventivas.
Se ha descrito que la glándula mamaria del adulto está compuesta por al menos 3 líneas celulares incluyendo células mioepiteliales, células de epitelio ductal y células de epitelio alveolar. Estos tipos de células son de epitelio de la capa basal de los ductos y los alvéolos, línea del lumen de los ductos y proteínas para la síntesis láctea, respectivamente.
El desarrollo y remodelación de la glándula mamaria durante la pubertad, embarazo, lactancia e involución es compleja y dinámica2. Estos procesos incluyen proliferación celular rápida, diferenciación y apoptosis.
Una población de células tipo progenitora o células madre reside en la glándula mamaria, y podrían satisfacer las necesidades de proliferación celular y reemplazo celular varias veces. Por análisis del estado de metilación de marcadores polimórficos de DNA en genes ligados al X, Tsai et al. Mostraron que el tejido completo de lóbulos de la glándula mamaria, retiene el mismo patrón de inactivación del cromosoma X en todas las líneas celulares. Esto sugiere un origen clonal de la glándula mamaria. En varios estudios tanto in vitro como in vivo se ha demostrado que las células progenitoras están en la parte superior de la jerarquía en los linajes de las células mamarias2-6. Lo cual determina un importante camino hacia el entendimiento del origen del cáncer mamario, y por lo tanto, al estudio de las células progenitoras de la glándula mamaria como dianas terapéuticas.
Origen epigenético del cáncer mamario
Hilaviki en su estudio sugiere que en el desarrollo del cáncer mamario están involucrados diferentes mecanismos en el ambiente hormonal fetal, que podrían estar relacionados originalmente in útero y necesariamente tienen que ver con la información genética heredada a través de las células somáticas de madres a hijas, manteniéndose así a lo largo de su vida, este fenómeno es conocido como "epigenética". Las modificaciones epigenéticas podrían dirigir cambios en el desarrollo de la glándula mamaria, así como incrementar la vulnerabilidad de blancos epiteliales para la transformación maligna7. Algunas modificaciones epigenéticas que se pueden presentar en el genoma durante el desarrollo fetal se muestran en la tabla 1.
Las vías propuestas que modifican los efectos del ambiente hormonal fetal o incrementan la susceptibilidad de cáncer mamario en el adulto, han generado la hipótesis de que la exposición fetal a estradiol E2, leptina o un inductor de obesidad dietético (OID), la cual induce alto peso al nacer, modifican las características heredables de la glándula mamaria por inducción de cambios epigenéticos. Estos cambios son manifestados en el adulto por expresión alterada de, por ejemplo, ER y MAPK, y por alteración de la morfología de glándula mamaria, la cual induce cambios en las unidades terminales ductales lobulares7.
En el trabajo de Hilaviki se concluye que la identificación de genes blanco alterados epigenéticamente y sus ligandos, podría dirigir estrategias para prevenir esta enfermedad en algunas mujeres7.
Con toda la información que se ha generado del origen del cáncer mamario, se demuestra que como tumor sólido posee heterogeneidad histológica y funcional. Debido a esto, las lesiones genéticas tienen un principal papel en el fenotipo del tumor, pero se han acumulado evidencias de que los subtipos de cáncer de mama estudiados podrían derivar de diferentes orígenes celulares. La identificación de estos blancos es crucial para la detección temprana del cáncer y para mejor predicción del comportamiento del tumor, y últimamente, podría dirigir terapias preventivas para individuos con alto riesgo de desarrollar cáncer1.
Variantes heredadas y aberraciones somáticas adquiridas en cáncer mamario
La elucidación de los subgrupos de cáncer de mama y sus conductores moleculares requiere vistas integradas del genoma y transcriptoma de un número representativo de pacientes. En un estudio reciente de Curtis et al. de la Universidad de Cambridge en el Reino Unido, se presentó un análisis integrado de número de copias y de expresión génica en una muestra inicial de 997 tumores mamarios primarios, y luego la validaron con 995 tumores con seguimiento clínico a largo plazo. El objetivo principal fue encontrar variantes heredadas -variantes del número de copias (CNVs), los polimorfismos de nucleótidos únicos (SNPs)- y aberraciones somáticas adquiridas (CNAs), además del transcriptoma, las cuales fueron asociadas con la expresión en el 40% de los genes con el mapeo dominado por cis y trans que actúan CNA. Lo cual significa que al comparar los estudios de variación genómica con los resultados de expresión génica, el 40% de las alteraciones genómicas tenían efecto sobre las alteraciones en los niveles de expresión.
Para poder conocer la expresión génica en el cáncer de mama, la información de los CNAs es de potencial interés, ya que estos actúan sobre los niveles de expresión; en el estudio de Curtis se realizaron análisis de 10 grupos y detectaron 10 agrupamientos, que sugieren la existencia de 10 subtipos de cáncer de mama. Lo cual, comprobaron por medio de un análisis estadístico de agrupamiento en 10 clases a las 995 muestras de validación. En este grupo al parecer existe una coincidencia a las diferentes agrupaciones que se obtuvieron, es decir, cada subgrupo se caracteriza por su inestabilidad, por la información genética que presenta respecto a ciertas regiones del genoma o respecto a ciertos genes que participan en las rutas que se encuentran desrreguladas, por la aparición de deleciones en genes que codifican factores de transcripción, entre otros.
Este estudio llego a la conclusión de que existen múltiples subtipos cáncer de mamario. También se demuestra que pueden existir variaciones en poblaciones y que utilizando esta clasificación, la cual está relacionada con, por ejemplo, los niveles de expresión génica, se podría facilitar la identificación de futuras dianas terapéuticas para el cáncer mamario. Por otro lado, con estos hallazgos se puede clasificar a las pacientes de acuerdo al riesgo en alto, las cuales tienen receptores estrogénicos (RE) positivos y otro subgrupo de pronóstico favorable desprovisto de CNA8.
En general, con estudios de expresión génica se podrían ofrecer nueva estratificaciones moleculares del cáncer mamario en cada población, derivado del impacto CNA en el transcriptoma.
La variación genética heredada y las aberraciones genómicas adquiridas contribuyen a la iniciación y progresión del cáncer de mama. Aunque CNAs son características dominantes del cáncer mamario esporádico.
Mutaciones conductoras y mutaciones pasajeras en cáncer mamario
Todos los tipos de cáncer son portadores de mutaciones somáticas en sus genomas. Un subtipo conocido como mutaciones conductoras, confieren una ventaja clonal selectiva en las células cancerosas y son causalmente implicadas en la oncogénesis, son mutaciones pasajeras. Las mutaciones conductoras y el proceso mutacional en el cáncer mamario aún no está comprensivamente explorado, es por ello que Stephens y su equipo de trabajo analizaron los genomas de 100 tumores con cambios somáticos en el número de copias y mutaciones en los exones codificantes de genes que codifican proteínas. Sorpresivamente, el número de mutaciones somáticas varía marcadamente entre los tumores. En este estudio encontraron fuertes correlaciones entre el número de mutaciones, la edad a la cual el cáncer era diagnosticado, el grado histológico y múltiples características mutacionales observadas. Las mutaciones conductoras fueron identificadas en muchos nuevos genes cancerígenos incluyendo AKT2, ARID1B, CASP8, CDKN1B, MAP3K1, MAP3K13, NCOR1, SMARCD1 y TBX3. El estudio concluye que en los tumores analizados se encontraron mutaciones conductoras en al menos 40 genes cancerígenos y 73 diferentes combinaciones de genes cancerígenos mutados. Los resultados indican una importante diversidad en esta común enfermedad.
Los niveles de expresión en cáncer mamario encontrados en los diversos subtipos moleculares, están fuertemente relacionados con la expresión de RE, receptores de progesterona (RP) y HER2, los cuales son las más comúnmente empleados. En el estudio anteriormente citado, cabe señalar que se emplearon tumores con RE en 79 de ellos y 21 los cuales fueron negativos a este receptor, este dato es muy importante, debido a que el grado histológico también está correlacionado, y nos indican mal pronóstico, por ejemplo, un cáncer mamario con grado histológico III, en éste existe con mayor frecuencia la asociación con triple marcador negativo, en estas pacientes el manejo de la enfermedad es más complicado que en las grado histológico i, en el que se observa un patrón celular definido y RE y RP positivos8.
Relación con la expresión de receptores de estrógenos, receptores de progesterona y HER2
Existen diversos compuestos que actúan como factores de crecimiento o mitógenos en las células cancerosas, como lo son citocinas, hormonas, proteínas, neurotransmisores, entre otros, mediante su anclaje, con receptores específicos que se encuentran en las células blanco9,10. Dichos receptores están acoplados a proteínas con actividad tirosina/serina/treonina cinasas, fosfatasas, lipidocinasas, proteínas G y ciclasas de nucleótidos, que activan diferentes vías de señalización intracelular, que culminan con la activación de la transcripción de diversos genes, que regulan el metabolismo, ciclo celular, apoptosis, diferenciación, entre otras funciones11.
La existencia de un tipo de receptor en una célula hace que ésta sea sensible o responda a los efectos biológicos, de la sustancia por la que es a fin el receptor.
Se ha visto que la presencia de diversos receptores en células neoplásicas de diferentes orígenes, permite que muchas sustancias actúen como mitógenos, al activar genes que promueven la carcinogénesis; promoviendo la transformación maligna de las células, su desarrollo y progresión, ejemplo de estos genes son: c-myc, cyclin D1, p21 waf1, cjun, junB, erg-1 y Bcl-2, por citar algunos. Por lo tanto, el bloqueo de los receptores reprime la estimulación positiva de las células neoplásicas por dichos factores de crecimiento, al degradar al receptor, al unirse y evitar su unión con el mitógeno, o desde bloquear su expresión génica (knock out)12-14.
En el cáncer de mama, la determinación de los RE, RP y HER2 ha permitido la elección de terapias más adecuadas para cada tipo de cáncer mamario, reflejándose en la clínica en una mejor respuesta al tratamiento, pronóstico y mejora de los pacientes15.
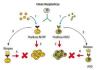
En la figura 1 se esquematiza la función de los receptores en la sensibilización de la célula ante sustancias que actúan como mitógenos, y su importancia clínica para la selección del tipo de tratamiento en cáncer de mama para receptores hormonales (RE/RP) y HER2.
Figura 1. Función de los receptores en la sensibilización a factores de crecimiento y su importancia clínica como factor predictivo al tratamiento. (1) El mitógeno se une al receptor. (2) Se activan genes que promueven la proliferación celular. (3) La determinación del tipo de receptor, permita la selección del tratamiento más oportuno, que bloquea a los receptores (acción mitógena inhibida). (A) El uso de tamoxifeno y (B) trastuzumab; en cáncer de mama positivo a receptores hormonales y HER2, respectivamente, disminuye la proliferación de las células. NOTA: Se ha reportado la mutación de la proteína HER2, que la hace activa sin necesidad de unirse a su ligando (EGF), formando homodímeros, por lo que sus efectos en la promoción de la carcinogénesis se ve aumentada en estos casos16.
Receptores de estrógenos y progesterona
Los RE pertenecen a la súper familia de receptores nucleares, al actuar y encontrarse preferentemente en el núcleo celular. Se conocen 3 tipos de receptores de estrógenos: REα, REβ y REm (membrana). Los 2 primeros forman dímeros en el núcleo, después de unirse con su estrógeno (estradiol 17, E2), los cuales se unen al ADN activando la transcripción de genes, como lo son el c-fos y c-myc, los cuales están fuertemente relacionados con carcinogénesis17.
También se ha descrito que los REα y REβ, promueven la transcripción mediante la participación de proteínas Sp1 Y AP-118.
Por otro lado, el REm, también es conocido como receptor de efectos "no genómicos", no actúa directamente sobre el ADN, sino que activa diversas vías de señalización como lo son MAPK y Akt, las cuales se ven sobreestimuladas en diversos tipos de cáncer y cumplen una función importante en el desarrollo y progresión de células neoplásicas. Los REm actúan como una respuesta rápida a los efectos del estradiol por parte de la célula.
La determinación de los RE tiene gran utilidad como marcador tumoral, ya que se ha descrito que los tumores mamarios positivos a RE, presentan características de: ser bien diferenciados, con baja proliferación, tiempo prolongado de supervivencia libre de enfermedad y buena respuesta a terapia dirigida a RE. Mientras que los tumores negativos a RE, son poco diferenciados, aneuploides, altamente proliferativos y baja respuesta a tratamientos anti-RE19.
Los receptores REα y REβ son los más estudiados en cáncer de mama, de hecho su importancia clínica radica en la sobreactivación de la transcripción de genes oncogénicos (cfos, c-myc) por los estrógenos en mujeres, que a través de estos receptores promueven el desarrollo de un fenotipo maligno en las células, al producir un descontrol del ciclo celular y apoptosis. Además, los recientes estudios de la participación de REm en carcinogénesis, aumenta su contribución de los RE en la carcinogénesis mamaria. Lo anterior permite considerar actualmente a los niveles elevados de estrógenos en el organismo, como un factor de riesgo al desarrollo de cáncer de mama20.
Dada la importancia de los estrógenos y sus receptores en la carcinogénesis mamaria, el desarrollo de una terapia dirigida contra los RE, ha permitido ofrecer un mejor pronóstico a los pacientes con cáncer de mama positivo a RE, revelado por inmunohistoquímica. El tratamiento más común en estos pacientes es el uso de tamoxifeno, un inhibidor de los receptores de estrógenos, conocido también como SERM (por sus siglas en inglés, Selective Estrogen Receptor Modulator), ya que permite inhibir los efectos de los estrógenos en células neoplásicas de cáncer de mama, sin alterara los efectos benéficos que tiene sobre hueso, sistema cardiovascular y nervioso21.
Un gran problema es que también se ha observado el desarrollo de resistencia a tamoxifeno por parte de las células neoplásicas en glándula mamaria, dicha resistencia se ha atribuido a un mecanismo mediado por los coactivadores de los RE22-24. Además, también dicha resistencia se ha atribuido a un mecanismo de bloqueo de los inhibidores de RE a nivel intracelular por otras hormonas como la leptina, como lo es el caso del fulvestrant, en un estudio realizado por Garofalo en el 200425.
Los RP son sintetizados en mayor cantidad en tejidos sensibles a estrógenos, como lo es el tejido mamario. Se ha atribuido que la expresión de RP, son resultado de la acción biológica de los estrógenos, lo cual explica mayores niveles de RP en mujeres premenopáusicas que en posmenopáusicas26.
Comúnmente se reportan a la par los RE y RP, en un resultado de inmunohistoquímica, los cuales tienen valor predictivo en respuesta a la terapia endocrina, como se muestra en la tabla 2.
Se ha visto que la determinación de RP, es ligeramente mayor a la de RE, en cuanto valor predictivo en respuesta al tratamiento endocrino26.
En los receptores hormonales es importante mencionar que la progesterona puede llegar a afectar los resultados de inmunohistoquímica, en la fase lútea del ciclo menstrual donde se ven elevadas las concentraciones de progesterona saturarán sus receptores presentes en las células de cáncer de mama y por tanto, dan falsos negativos. Por otro lado, los estrógenos no afectan los resultados dada su baja concentración en el organismo30.
La presencia de los receptores de estrógenos en las células neoplásicas de cáncer de mama ha sido demostrada por diversos estudios de inmunohistoquímica, en el 2008 Cammara encontró que el 76.92% de pacientes entre 40-49 años de edad, fueron positivos a RE y RP31.
Por otro lado, Azizun en el mismo año encontró una frecuencia del 32.70% de cáncer de mama positivo a RE y un 23.50% a RP32.
Fiorio, entre los resultados en un estudio realizado en el 2008, encontró que el 64% de los casos de cáncer de mama presentaron un perfil RE(+)/RP(+), de un total de 59 muestras de biopsias de cáncer de mama, de las cuales el 76% (45 biopsias) correspondieron por histopatología a carcinoma ductal invasor33.
Con lo anterior queda demostrada la presencia de los RE y RP en biopsias de pacientes con cáncer de mama. Ahora, dentro de estas pacientes con positividad a RE se ha visto que aproximadamente el 70% responde satisfactoriamente al tratamiento con tamoxifeno, dando como resultado en una mejoría del paciente26,34,35. Existe evidencia, de la disminución en un 50% la recidiva y en un 28% la mortalidad, en pacientes con cáncer de mama que tomaron dicho tratamiento por 5 años. Por lo que también se ha propuesto el uso de tamoxifeno como media preventiva, al desarrollo de cáncer de mama positivo a RE y RP15.
Por último, Martunen y Ozet encontraron que el tamoxifeno eleva los niveles de leptina en mujeres posmenopáusicas36,37.
Receptores de leptina
La leptina es una hormona, también conocida como adipocitocina, que se sintetiza y secreta principalmente en el tejido adiposo y cuya función en el organismo es la de regular su equilibrio energético.
La leptina actúa a través de su anclaje con el dominio extracelular de su receptor específico de membrana, expresados en tejidos como placenta, páncreas, estómago, glándulas adrenales, células hematopoyéticas, hígado, pulmón y corazón38.
Son diversos los estudios que por inmunohistoquímica han revelado la sobreexpresión de receptores de leptina obr en muestras de tejido de cáncer de mama de diferente estadio, desde primario hasta metastásico39,40.
En las células neoplásicas la leptina activa la vía de señalización JAK2/STAT3, la cual termina con la activación de genes como lo son: c-myc, cyclin D1, p21 waf1, c-jun, junB, erg-1 y Bcl-2, los cuales están fuertemente involucrados en el crecimiento y proliferación celular.
Actualmente se realizan muchos trabajos de investigación sobre la leptina en el cáncer mamario, por 2 razones principalmente. Primero, se ha demostrado que la leptina actúa como mitógeno en las células neoplásicas de cáncer de mama y de otros orígenes. Segundo, que los niveles de leptina se correlacionan positivamente con los valores de índice de masa corporal (IMC)41. Los niveles elevados de leptina presentes en pacientes con obesidad, representan la causa por la que alteraciones en la cantidad de tejido adiposo en el cuerpo (obesidad y sobrepeso) sean consideradas un factor de riesgo en el desarrollo de cáncer de mama, con una explicación a nivel bioquímico-molecular.
En cuanto a la sobreexpresión tanto de leptina como de sus receptores, en el 2009 en Francia, Jardé et al. encontraron una sobreexpresión de leptina en la línea celular MCF-7 (derivada de células cancerosas de mama), además demostraron que la exposición de estas células a leptina inducía la expresión de ARN mensajero tanto de leptina como de sus receptores42. Sugiriendo la capacidad de la leptina de autorregular la amplificación de su actividad en las células. Por otro lado, Ishakawa en el 2004, encontró que el 34% de las biopsias de cáncer de mama eran positivas para receptores de leptina, el paciente presentó metástasis avanzada, mientras que aquellos que carecían de dichos receptores no presentaron metástasis (0%)43. Estos resultados permiten inferir la función de la leptina como promotor de la invasión celular y la función que cumplen sus receptores (obR), para que la leptina ejerza su acción biológica sobre las células. En adición, un estudio realizado por Revillon en el 2006 reveló que niveles elevados de RNA mensajero de isoformas cortas de receptores de leptina estaban asociados a una disminución del tiempo, en el cual pacientes diagnosticados con cáncer de mama presentaban una remisión después de la cirugía de extirpación de la masa tumoral44.
Receptores HER2
Existen 4 miembros de receptores del factor de crecimiento epidérmico: EGFR- HER1, HER2, HER3 y HER4, las cuales participan en procesos bioquímicos dentro de la célula que regulan la diferenciación, proliferación y sobrevida de las células. De éstas, la de mayor estudio en cáncer de mama es la HER2, aunque ya hay estudios que le atribuyen también participación a EGFR, al formar heterodímeros con HER2. En las células cancerosas podemos tener ya sea un aumento en el número de la proteína HER2, del gen HER2/ neu o ambas. Lo cual permite que sus efectos biológicos sobre las células se vean amplificados, al interactuar con el ligandos EGF, en conjunto con EGFR ( HER1)45.
La sobreexpresión de la proteína y/o gen se presenta en aproximadamente el 25% de las pacientes con cáncer de mama (un cuarto de la población con esta enfermedad). La determinación de la sobreexpresión de HER2 se realiza por inmunohistoquímica, mientras que el número de copias del gen de HER2/neu, se realiza por FISH y CISH.
Los receptores HER2 al encontrarse en mayor numero en la células neoplásicas de cáncer de mama, facilitan su desarrollo y progresión mediante la activación de diversas vías de señalización intracelular como: MAPK, Akt, RAS, y STAT´s46,47.
Actualmente, existe una terapia específica para las pacientes con cáncer de mama HER2 positivo. Son 2 los fármacos aprobados por la FDA: trastuzumab (Herceptin), el cual inhibe la formación de los dímeros de HER2 en la membrana celular, los cuales son la forma activada del receptor HER2; y lapatinib (Tyker), el cual actúa a nivel del dominio tirosina cinasa del receptor HER2. Dichos tratamientos han venido a mejorar el pronóstico y recuperación de las pacientes con cáncer de mama HER2 positivo48.
Recientes estudios han demostrado la existencia de una correlación entre la expresión de leptina y su receptor con la expresión de HER2.
Relación entre los receptores
en un estudio realizado por ray en el 2007, se encontró que la leptina induce la expresión de los RE en líneas celulares negativas a este receptor (MDA-MB-361, MDA-MB-231 y SKBr-3)49. Lo anterior concuerda con Fusco, que en el 2010, concluye a partir de sus estudios que la leptina induce la expresión del REα en células MCF-7. La importancia del aumento de RE por parte de la leptina se hace evidente en un estudio de inmunohistoquímica en biopsias de cáncer de mama, realizado por Hee Sun en Corea, el cual concluyó que aquellos pacientes positivos a leptina pero negativos a la expresión de cualquiera de los receptores: RE y RP, presentaban un mayor tiempo libre de enfermedad50, dicho en otras palabras, la condición: leptina(+)/receptor hormonal(-) indicaba un buen pronóstico, mientras que por el contrario aquellos pacientes con un perfil leptina(+)/receptor hormonal(+) presentaban remisión después de una cirugía de extirpación de alguna masa tumoral en alguno de los senos. Por lo tanto, la importancia del perfil leptina(+)/receptor hormonal(-) radica en que, la leptina puede inducir la expresión de RE, o sea cambiar a un perfil leptina(+)/receptor hormonal(+), que indica un mal pronóstico según lo encontrado por Hee Sun, por lo que podría sugerirse, el uso de la determinación de leptina y sus receptores (a la par de los receptores de hormonas) como marcadores tumorales pronósticos y con ello, el desarrollo de una terapia dirigida a ésta y sus receptores, evitando la reaparición de alguna tumor, pero ahora positivo a RE, en pacientes obesas y con sobrepeso (niveles elevados de leptina)49.
Mencionemos que dentro de un tumor existe heterogeneidad en las células, producto del acúmulo de mutaciones a lo largo de su proliferación, por lo que clonas negativas a RE pueden volverse positivas, por acción de la leptina.
También hay que considerar los efectos del tamoxifeno sobre los niveles de leptina y la función de esta última como mitógeno en la células neoplásicas de cáncer de mama, en el seguimiento de la respuesta al tratamiento en pacientes con cáncer de mama RE positivo y con un IMC elevado, donde ahora pueden aparecer células neoplásicas sensibles a leptina (positivas a receptores obR).
En cuanto a los receptores HER2, en el 2008 Fioro encontró una correlación entre la expresión de leptina y su receptor con la expresión de HER2, donde el 75% de las muestras correspondieron a carcinomas ductales invasivos. También se observó que la leptina induce la fosforilación de HER2 en la tirosina 1.248 en HER2 in vitro, observándose el máximo efecto a un concentración de 200 ng/mL de leptina en los cultivos celulares. En la clínica se ha observado que aquellas biopsias que son positivas a RE y RP, son negativas para HER2 y viceversa, en la mayoría de los casos15,33.
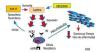
Sobre la relación entre receptores HER2 y hormonales (RE /RP), se ha encontrado que las células neoplásicas positivas a ambos receptores son resistentes a la terapia con tamoxifeno, posiblemente por acción de HER 2, por lo que en pacientes HER2(+): RE(+)/RP(+), el uso combinado de tamoxifeno y trastuzumab, puede dar una mejor respuesta antitumoral, que si se usaran solos. Dicha evidencia se sustenta en el estudio realizado por Witters48,50 (fig. 2).
Figura 2. Resumen de la relación entre receptores. obRB: Receptor de leptina; Re: receptor de estrógenos; HER2: receptor del factor de crecimiento epidérmico 2.
Alternativas epigenéticas para prevenir el cáncer mamario
Recientemente se ha demostrado en un estudio realizado en la Universidad del Centro de Cáncer de Hawaii en Honolulu, que el gen L3BMTL1 es un gen supresor de tumor asociado con el ejercicio físico. En pacientes que se ejercitaban, se encontró desmetilado este gen, indicando un aumento en la expresión génica. Dicho estudio se realizó en 348 pacientes y plantearon la posibilidad de que el ejercicio podría ejercer un efecto anticancerígeno por acción del L3BMTL1, como gen supresor de tumor. En este estudio concluyeron que el gen L3BMTL1 debería emplearse como marcador pronóstico en pacientes con cáncer mamario51.
Conclusiones
La determinación de los tipos de moleculares del cáncer mamario ha permitido la elección del tratamiento más apropiado para cada paciente. Por otro lado, los recientes hallazgos sobre las aplicaciones de estudios de expresión génica, de variantes heredadas (CNVs, SNPs) y CNA, así como el estudio de mutaciones conductoras y mutaciones pasajeras, dilucidarán a corto plazo el genoma del cáncer mamario, esto permitirá hacer más eficaces las terapias diseñadas para cada tipo o subtipo molecular y con ello, prolongar el tiempo de sobrevida libre de enfermedad, producto de una buena respuesta al tratamiento. El estudio de la epigenética nos explica en esta revisión que es de gran beneficio implementar medidas de ejercitación física en las pacientes, lo cual se verá reflejado en expresión de genes supresores de tumor que protegerán la información genética de las pacientes portadoras de dichos genes. Por otro lado, los recientes hallazgos sobre la relación entre los efectos agonistas de la leptina en la expresión de RE y HER2, el diseño de nuevos bloqueadores de ésta y de sus receptores, permitirá hacer más eficaces las terapias diseñadas para cada tipo de cáncer mamario, evitando la aparición de células heterogéneas en cuanto a los receptores que expresan y con ello, prolongar el tiempo de sobrevida libre de enfermedad, producto de una buena respuesta al tratamiento49.
Por otro lado, estudios de epigenética dan indicios para explicar que a través de la activación física se puede favorecer la expresión de genes supresores de tumores, que protegerán frente a la aparición de cáncer de mama52.
Financiamiento
No se recibió ningún patrocinio para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
* Autor para correspondencia:
Paseo Tollocan esq. Paseo Colón,
Toluca, México.
Teléfono/Fax: (+52) 722 2194122.
Correo electrónico:
jonnathangsb@yahoo.com.mx (J. G. Santillán Benítez).