Los receptores del péptido liberador de la gastrina (GRP-r) se sobreexpresan en cáncer de mama y próstata. La bombesina (BN) se une específica y fuertemente a GRP-r, esto es el fundamento para marcar la BN con radiación gamma. El TAT (49-57) es un péptido que penetra fácilmente la membrana celular por lo que, conjugado a diferentes proteínas, actúa como un “caballo de Troya” al aumentar la internalización de fármacos a la célula. El radiofármaco 99mTc-N2S2-TAT (49-57)-Lys3-BN fue sintetizado con la finalidad de utilizarse en una etapa temprana de la carcinogénesis, para el diagnóstico y terapia del cáncer de mama.
ObjetivoDeterminar la internalización mediante el ensayo cometa del radiofármaco con y sin TAT, induciendo daño al DNA.
Materiales y métodosSe emplearon linfocitos humanos, con los siguientes protocolos: a) TAT-BN, b) 99mTc-Lys3-BN; c) 99mTc-TAT (49-57)-Lys3-BN y d) grupo control. Se realizó el ensayo cometa y se evaluó la cinética de internalización a 0, 5, 10, 15, 30 y 60minutos en 3 repeticiones con cada uno, con actividades de 2.9, 6.6, 9.01 y 14.8 MBq. Se leyeron 100 células por tiempo y tratamiento, se determinó el Tail momento (TM). Se aplicó Kruscal-Wallis con p≤0.05 para la comparación entre los tratamientos.
ResultadosEl daño causado por el 99mTc-TAT-BN es mayor y diferente significativamente a los 30minutos, respecto al control, mientras que 99mTc-BN y TAT-BN no los son.
ConclusionesEsto demuestra que el TAT-BN favorece la internalización del radiofármaco.
Gastrin-releasing peptide receptors (GRP-r) are overexpressed in breast and prostate cancer cells. Bombesin (BN) binds specifically and strongly to GRP-r and this is the basis for BN labeling with gamma ray emitting radionuclides. TAT (49-57) is a peptide that readily penetrates the cell membrane so that, when it is conjugated to different proteins, it can act as a “Trojan horse” facilitates drug internalization to the cell. The radiopharmaceutical 99mTc-N2S2-TAT (49-57)-Lys3-BN was designed for diagnosis and therapy at early stage of breast cancer. Objective: To determine the role of TAT in the kinetics of radiopharmaceutical internalization measured by DNA damage induction by means of comet assay.
Materials and methodsHuman lymphocytes were treated with the following a) TAT-BN, b) 99mTc-BN, or c) 99mTc-N2S2-TAT (49-57)-Lys3-BN, also an untreated group was conformed. The internalization was evaluated at 0, 5, 10, 15, 30 and 60minutes after exposure with 3 repetitions each, and for radiopharmaceuticals with 2.9, 6.6, 9.0 and 14.8 MBq activities. DNA damage was scored in 100 cells per time and treatment, as tail moment (TM). A Kruskal-Wallis variance analysis with p≤0.05 was applied for comparison between treatments.
ResultsThe damage caused by 99mTc-N2S2-TAT (49-57)-Lys3-BN is significantly higher than that caused by 99mTc-BN and TAT-BN.
ConclusionThis demonstrates that TAT favors the internalization of the radiopharmaceutical.
En México, el cáncer de mama representa la segunda causa de muerte en mujeres de 30 a 60 años1, esto involucra un gran problema de salud pública. Por eso es importante contar con nuevas formas que nos permitan detectar el cáncer de mama en una etapa temprana. Una de las nuevas alternativas es por medio del uso de los radiofármacos de tercera generación, estos se emplean en medicina nuclear para obtener imágenes de blancos moleculares específicos y son únicos en su capacidad para detectar in vivo sitios bioquímicos, tales como receptores y enzimas2.
El radiofármaco 99mTc-N2S2-TAT (49-57) Lys3-BN podría permitir para el diagnóstico la proyección de imagen clínica específica de tumores de pecho y próstata, debido a los receptores y a los componentes que contiene2. Los receptores del péptido liberador de la gastrina (GRP-r) se encuentran distribuidos en muchos órganos, pero se sobreexpresan en la membrana de las células malignas, especialmente en las de cáncer de mama y próstata3. Los GRP-r se unen específicamente a la bombesina (BN), este fuerte enlace es el fundamento para marcar la BN con radionúclidos emisores de radiación gamma para la obtención in vivo de imágenes de GRP-r por técnicas de medicina nuclear molecular4. Es importante señalar que después de la interacción receptor-ligando (GRP-r-BN) en la membrana celular, una parte del complejo es internalizado al citoplasma celular5-8. Por otro lado, se sabe que el dominio básico de la proteína TAT del HIV-1, es decir el TAT (49-57), es un péptido que penetra o atraviesa fácilmente la membrana celular por lo que, conjugado a diferentes fármacos, proteínas, péptidos y nanopartículas, actúa como un “caballo de Troya” al incrementar de forma significativa la internalización celular de los diferentes fármacos o biomoléculas9.
Por tanto, el [99mTc]N2S2-TAT(49-57)-Lys3-BN podría incrementar de manera significativa la internalización del radiofármaco y con ello, el contraste de las lesiones cancerosas en las imágenes, mejorando la sensibilidad y especificidad de los estudios diagnósticos. Considerando que la internalización se incrementará, las emisiones auger del 99mTc, podrían jugar un papel fundamental en la energía depositada dentro de la célula (dosis de radiación absorbida) con un posible efecto sinérgico en la terapia del cáncer10. El ensayo cometa descrito por Singh et al., permite demostrar el daño al DNA de forma rápida y sin empleo de cultivos celulares. Consiste en células embebidas en un gel de agarosa grado electroforesis para brindarles soporte, posteriormente, se exponen a una corriente eléctrica que propicia la migración de los fragmentos del ADN dañado11. Por lo tanto, el objetivo del presente estudio fue evaluar la internalización del radiofármaco 99mTc-N2S2-TAT (49-57) Lys3-BN, empleando el ensayo cometa en linfocitos humanos.
Materiales y métodosAgarosa de bajo punto de fusión (GIBCO BRL), agarosa de punto de fusión normal (GIBCO BRL), eluato de Na 99mTcO4 obtenido de un generador 99Mo/99mTc GETEC-ININ, Triton X-100 (Sigma), Trizma (Sigma), NaCl (Merck), KCl (Ferment), DMSO (Merk), HCl (Baker), EDTA (Sigma), TRIZMA (Sigma), KH2PO4 (J. T. Baker), NaH2PO4 (Sigma), NaOH (Merck), Et-Br (GIBCO-BRL), CH3-OH (J. T. Baker), K2CrO4 (Reasol) CH3-CH2-OH (J. T. Baker), CH3CN (Mallinckrodt), CH3COONH3 (J. T. Baker), TFA (Sigma), SnCl2 (Sigma), MEC (J. T. Baker)
Obtención de la muestraSe extrajeron de 2 a 3mL de sangre periférica de 3 individuos clínicamente sanos, por punción venosa, en un tubo con 0.1mL de heparina por cada mL de sangre.
Se realizaron 3 réplicas del ensayo cometa por actividad radiactiva. Se sometieron a los siguientes tratamientos: a) péptido TAT-BN; b) 99mTc-BN; c) 99mTc-TAT-BN y d) sin tratamiento, el cual fue tomado como grupo control.
Marcado de radiofármacosPara el marcado de 99mTc-N2S2-TAT(49-57)Lys3-BN o 99mTc-TAT-BN en un vial, se colocó 1mg de N2S2-TAT(49-57)-BN, este fue disuelto en 1mL de solución salina. A 10 µL de esta solución se le adicionaron 4 µL de buffer de tartrato de sodio (50mg/mL de tartrato de sodio en NH4OH/NH4CH3COOH 0.1 M, pH 9.5), 4 µL de solución SnCl2 (10mg de SnCl2 en 10 µL HCl concentrado diluido en 10mL de agua inyectable) y 25 µL de pertecneciato de Sodio (99mTcO4-Na). Finalmente, se mezcló y se dejó incubar durante 15minutos a temperatura ambiente. Las actividades empleadas para el marcado son 2.9, 6.6, 9.01 y 14.8 MBq. La pureza radioquímica fue evaluada por HPLC fase reversa.
Por otro lado, el marcado del radiofármaco 99mTc-EDDA/HYNIC-Lys3-BN o 99mTc-BN, se realizó colocando 1mg de HYNIC-BN en 200 µL de etanol al 10%, y 800 µL de agua inyec-table previamente nitrogenada. A 20 µL de esta solución se le adicionaron 500 µL de EDDA/TRICINA, 500 µL de pertecneciato (99mTcO4-Na) y 20 µL de solución de SnCl2 (10mg de SnCl2 en 10 µL HCl concentrado diluido en 10mL de agua inyectable), y se colocó en baño seco a 90°C durante 15minutos. Las actividades empleadas para el marcado son 2.9, 6.6, 9.01 y 14.8 MBq. La pureza radioquímica fue evaluada por HPLC fase reversa.
Ensayo cometa (Singh et al., 1988)Preparación de laminillas: en un portaobjetos se colocaron 200 µL de agarosa de punto de fusión normal (APFN) al 0.75%, con ayuda de la punta de la micropipeta se extiende formando una capa homogénea, 15 µL de linfocitos (25,000 células) se añaden en un tubo de 1mL con 100 µL de agarosa de bajo punto de fusión (ABPF) al 0.75% disuelta en buffer de fosfatos. Se mezclan y se colocan en los portaobjetos embebidos previamente con el APFN. Se le coloca un cubreobjetos, se deja que solidifiquen a 4°C durante 5minutos, se retira cuidadosamente el cubreobjetos por desplazamiento y se agregan 100 µL de ABPF y el cubreobjetos. Se deja solidificar a 4°C durante 4 a 5min y se retira el cubreobjetos. Los geles se sumergen en solución de lisis recién preparada (NaCl 2.5 M, EDTA 100mM, Tris 10mM, NaOH 0.25 M, Tritón 1 %, DMSO 10 %, pH 10) durante 24 horas protegidas de la luz.
Corrimiento electroforético: las laminillas se sacan de la solución de lisis y se colocan en la cámara de electroforesis de manera horizontal, cubriéndolas con el amortiguador de electroforesis a 4°C (10 N de NaOH, 200mM de EDTA, pH 13) durante 40minutos. Posteriormente, se exponen a una corriente eléctrica de 25 V a 300mA durante 40minutos, usando una fuente de poder (Sigma Techware PS250-1). Una vez transcurrido el tiempo, las laminillas se enjuagan con solución de neutralización (Tris 0.4 M, pH 7.5) 3 veces por 3minutos y se colocan en metanol 5minutos. Todo el procedimiento se hace en condiciones de luz tenue para evitar el daño adicional al DNA.
Las laminillas se tiñen con bromuro de etidio (20 µL/mL) y se examinan al microscopio de fluorescencia equipado con un filtro de excitación de 515-516 nm y un filtro barrera de 590 nm. El daño se evaluó analizando 100 células (n=3) por laminilla en cada tiempo, con el software Comet Assay IVTM (Perceptive Instruments), y el daño se evaluó con el Tail Moment (TM).
ResultadosMarcado de radiofármacosEl análisis por HPLC fase reversa, mostró un tiempo de retención de 10.7minutos, con una pureza radioquímica de 99.5% e impurezas en un tiempo de retención de 3.5minutos de 0.5%. La determinación de la pureza radioquímica del marcado del péptido N2S2-TAT (49-57)-Lys3-BN fue similar a lo reportado por Santos et al.11, con una pureza radioquímica de 92%. Las actividades que se utilizaron para el radiomarcado fueron de 2.9 MBq, 6.6 MBq, 9.01 MBq y 14.8 MBq. Para el marcado EDDA/HYNIC-BN se realizó el protocolo reportado por Ferro et al.2, con una pureza radioquímica mayor a 90% utilizando las mismas actividades.
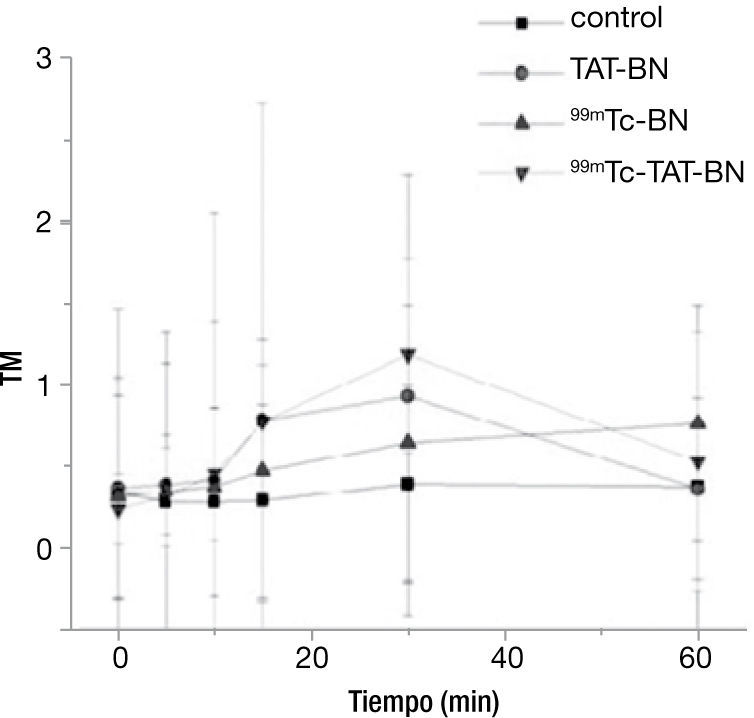
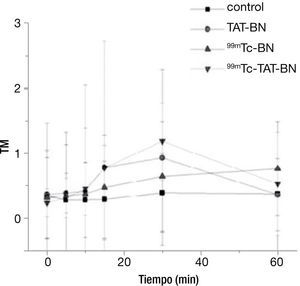
Ensayo cometaEl efecto del daño al DNA por los diferentes tratamientos en los linfocitos con una actividad de radiación de 2.9 MBq se puede observar en la figura 1, en donde durante los primeros 15minutos, el comportamiento de todos los tratamientos fue homogéneo, sin mostrar diferencia significativa entre los mismos, sin embargo es importante destacar el incremento de la respuesta por los 2 radiofármacos y el péptido a los 30minutos. Se realizó la prueba de Kruscal-Wallis para demostrar diferencia significativa entre los tratamientos con el control, se encontró significancia con p≤0.05 al minuto 30, pero cuando llegan al minuto 60, hay reparación del ADN (fig. 1).
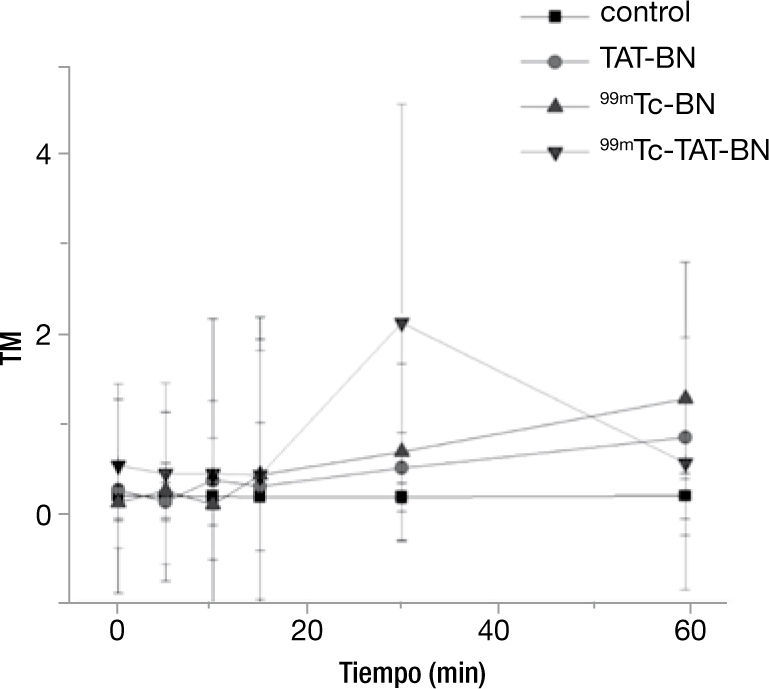
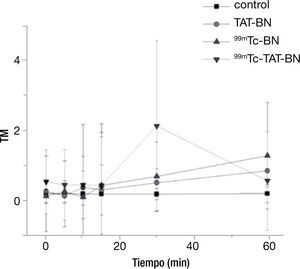
Se pudo observar claramente que al emplearse una actividad de 6.6 MBq existió un aumento en el minuto 30 por parte del radiofármaco 99mTc-TAT-BN, debido a que existe una mayor internalización al núcleo celular y por la emisión de electrones auger de baja energía. Para comprobarlo, se aplicó la prueba de Kruscal-Wallis con una p≤0.05, la cual mostró que durante los primeros 15minutos no existió diferencia significativa respecto al control por parte de los tratamientos, en cambio al llegar al minuto 30 todos los tratamientos tiene diferencias con respecto al testigo, pero en mayor cantidad con el radiofármaco 99mTc-TAT-BN (fig. 2).
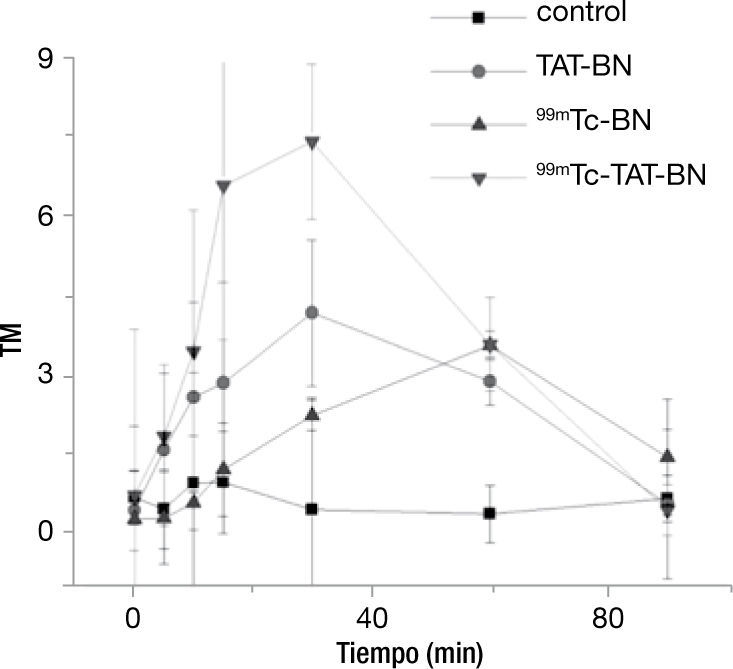
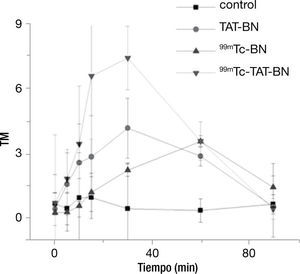
La cinética de daño al DNA con 9.01 MBq se representa en la figura 3, en donde existió efecto genotóxico por parte de los tratamientos a los que se expusieron, sin embargo, se puede apreciar que el radiofármaco complejo 99mTc-TAT-BN produjo mayor daño a los pocos minutos de exponer a los linfocitos, y que existe un incremento gradual hasta alcanzar el minuto 30, posteriormente hay un decremento cuando llega a los 60 y 90minutos. En este experimento con una actividad 9.01 MBq se incrementó el tiempo hasta los 90minutos, para determinar si se mantenía el daño o existía un proceso de reparación del mismo. Los tratamientos del péptido TAT-BN y 99mTc-TAT-BN mostraron diferencia significativa con respecto al control desde el minuto 5 hasta alcanzar el valor máximo de daño al DNA con esta actividad al minuto 30, sin embargo al minuto 60 hay una disminución del efecto genotóxico pero continúa siendo significativo hasta llegar el minuto 90, donde ya no lo es. Cabe destacar que el radiofármaco 99mTc-BN durante los primeros 15minutos produjo un daño no significativo con respecto al testigo, comenzó a incrementar su valor al minuto 30 y 60, donde alcanza su punto máximo y decae a los 90minutos (fig. 3).
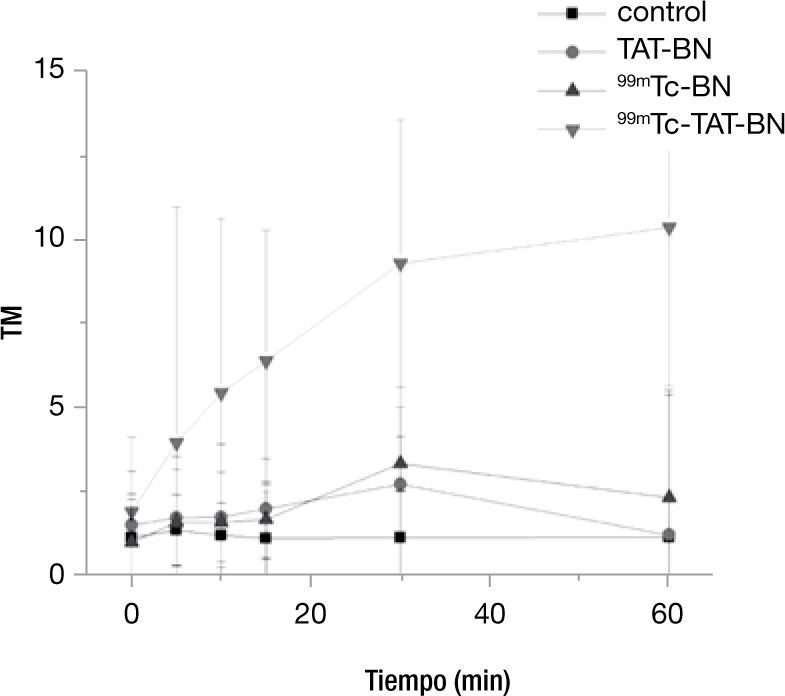
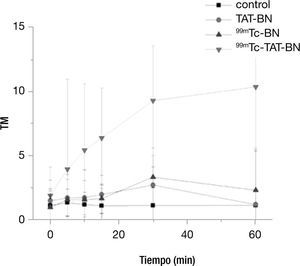
En la figura 4 podemos observar el comportamiento con una actividad de 14.8 MBq, el cual coincide con el descrito en la literatura con 99mTc-TAT-BN, en donde existe un incremento en el daño por la internalización del TAT y por la emisión de los electrones auger por parte del 99mTc. La prueba de Kruscall-Wallis mostró que en todos los tratamientos existe diferencia significativa respecto al control p≤0.05.
DiscusiónExisten diversas formas para la evaluación del daño al DNA, en esta investigación utilizamos el ensayo cometa que fue descrito por Singh et al.11, por ser una técnica que permite detectar de manera fácil y rápida el daño que puede existir en el DNA, a nivel de células individuales, evaluado por el TM.
Se han realizado muchos trabajos empleando esta técnica, sin embargo, son pocos los que realizan en los radiofármacos. Pedraza et al. (2001) evaluó el efecto genotóxico inducido por la incorporación de los radiofármacos de 99mTc en la célula, determinado por esta técnica en linfocitos de ratón in vitro utilizando 99mTc-HMPAO y 99mTc-gentisico induciendo 98% y 94% de células con rompimiento de DNA nuclear, respectivamente, concluyeron que el daño fue producido por la acción de los electrones auger producto del decaimiento de 99mTc, depositando toda la energía en la célula, donde 99mTc-HMPAO se incorporó en el citoplasma, y 99mTc-gentisico, se unió a la membrana celular, por lo tanto, los electrones auger pueden causar daño importante al DNA, cuando el radionúclido se incorpora en el radio de acción de algunos micrones del núcleo12.
El efecto genotóxico producido por el péptido TAT-BN es por la habilidad que tiene la proteína TAT de penetrar al núcleo celular, esto ha sido reportado por Green13 y Frankel14, quienes observaron la habilidad de los 86 aminoácidos del virus de inmunodeficiencia humana tipo 1 (HIV-1) llamado TAT que penetraba a las células y activaba la transcripción. Subsecuentemente, encontraron que una región básica de la proteína en los residuos 49-57 era responsable de esta habilidad de penetrar a las células. Por otro lado, Futaki en el 2005, realizó una revisión de cómo actúa el TAT en la internalización celular, concluyó que el segmento de la proteína TAT en los residuos de 48-60 contiene 6 argininas y 2 lisinas, y éstas son responsables del carácter hidrofílico y naturaleza básica del péptido, y que conjugándose a proteínas de fusión se internalizarán eficientemente en las células y existirá una influencia en funciones de la célula, como ciclos celulares15.
Otra causa por la que el TAT podría fragmentar el DNA es porque, induce proliferación celular, esto fue descrito por Bettaccini en 200516, quienes evaluaron el crecimiento de células epiteliales mamarias expuestas a diferentes dosis de TAT (0, 10, 50, 100 y 500 ng/mL), la actividad la midieron por análisis colorimétrico de XTT, monocapas y PCR. Con los 2 primeros, identificaron una respuesta significativa en la proliferación en dichas células, la PCR la utilizaron para detectar alteraciones del receptor, factor de crecimiento y expresión de la transcripción de citocina después de la exposición al TAT, con estos resultados llegaron a la conclusión de que el TAT tiene un efecto mitogénico sobre las células mamarias, que estimulan la expresión de genes de significancia patogénica en la infección VIH y realza la expresión de las citocinas, estos resultados podrían correlacionarse con el aumento de cometas producido por TAT-BN sin marcar con 99mTc.
En relación con 99mTc-BN sin TAT, Ferro et al.2 realizó un ensayo de internalización de este radiofármaco utilizando células PC-3, las cuales dividieron en 2 grupos: bloqueadas y sin bloquear, y fueron expuestas a 99mTc-EDDA/HYNIC-BN en diferentes tiempos de incubación a saber: 2, 4, 6 y 24 horas, mi-dieron la actividad internalizada, y obtuvieron el 8% de internalización a las 2 horas y 11.5% a las 4 horas en el grupo sin bloquear, determinaron que existió diferencia significativa en comparación con las bloqueadas. En nuestros resultados el comportamiento de este radiofármaco se internalizó a los 60minutos medidos con la técnica de ensayo cometa, por lo tanto, el sistema y condiciones implicadas en el presente estudio ofrece una mejor estrategia para detectar la internalización celular por medio de la fragmentación al DNA.
Por otro lado, en esta investigación, con relación al 99mTc-TAT-BN el efecto que produjo a los 30minutos con todas las actividades empleadas es debido a la internalización del TAT al núcleo celular y por la emisión de electrones auger producidos por 99mTc. Los resultados que obtuvimos en los experimentos con una actividad de 14.8 MBq, se puede observar que 99mTc-N2S2-TAT(49-57)-BN, 99mTc-EDDA/HYNIC-BN y el péptido TAT-BN internalizaron en el núcleo celular, esto también fue demostrado por Santos en el 2009, quien realizó la cinética de internalización de estos 2 radiofármacos en células de cáncer de mama MCF7, MDA y PC3; de cáncer de próstata, mostraron resultados importantes en la internalización en las 3 líneas celulares, las cuales se inhibieron significativamente al ser incubadas con la BN. Sin embargo, existió mayor penetración del radiofármaco que contenía el TAT, ya que se encontraba en mayor proporción en el citoplasma y el que tenía sólo BN se encontraba en la membrana mostrando gran diferencia10. También, podemos mencionar los resultados de Constantini et al.17, quien propuso el mecanismo por el cual atraviesa el TAT la membrana celular y transporta su carga dentro de la célula, hipotetizaron que existe una interacción inicial de la carga entre los grupos catiónicos de la guanidina y residuos de arginina con las proteínas y fosfolípidos de la célula de superficie que están cargados negativamente por los grupos fosfato y sulfato17.
En cuanto al efecto de los electrones auger, Faraggi et al.18 probó que el 111In emite 14.7 electrones auger por decaimiento con una energía de 6.75 KeV, y que la radiación de dosis absorbida en el núcleo estimando ser de 2 a 35 veces del doble o mayor del decaimiento en el núcleo, comparado con el decaimiento ocurrido dentro del citoplasma o en la célula de superficie, estas propiedades hacen que el 111In y otros emisores de electrones auger, sean altamente citotóxicos y dañen al DNA cuando decaen cerca del núcleo de célula, teóricamente haciéndolas altamente selectivas para matar a las células cancerosas18. Buchegger et al., reportó que la doble hélice de DNA presenta un diámetro aproximado de 2 nanómetros, y que en un decaimiento típico de la radiación de los electrones auger, la energía más alta ocurre en rangos de 1 y 2 nanómetros. Esto significa, que la energía local calculada por un emisor de electrones auger incorporado al DNA afectará a la doble hélice con una energía de 1.6 MGy o más, esta energía de radiación es en gran parte suficiente para dañar a la doble hélice del DNA sobre las distancias de varios nucleótidos19.
En el presente estudio las cinética del inducción del daño al DNA por los diferentes tratamientos y actividades radiactivas, mostraron que existe una reparación del DNA producido por 99mTc-N2S2-TAT-BN y el péptido TAT-BN, tal como lo reportan Cossio (2004) empleando el ensayo cometa, quienes evaluaron el efecto de la temperatura sobre la reparación del daño genético inducida por radiación ultravioleta en células sanguíneas humanas, utilizando muestras de voluntarios clínicamente sanos y de pacientes que tenían xeroderma pigmentoso (XP), los resultados que obtuvieron en la exposición de los leucocitos a la fuente de luz UV, mostraron que no hubo diferencias entre los valores reportados antes de la irradiación en el tiempo 0, pero al alcanzar el minuto 30 se produjo un aumento significativo de la longitud total de migración de las células sanas hasta 10.96 ± 0.88 y de los XP 6.54 ± 0.81. Las longitudes totales de las células sanas disminuyeron (7.34 ± 0.97) a los 60minutos de exposición, mientras que en las XP se observó un ligero aumento. Proponen que la disminución de la longitud total del cometa está relacionado con las acción de las polimerasas y las ADN ligasas que actúan sintetizando y sellando la molécula, cuya actividad depende en gran medida de la disponibilidad de precursores de la síntesis de ADN presentes en la célula20.
Los resultados de esta investigación muestran que la fragmentación del DNA a diferentes actividades de radiación del radiofármaco puede llegar a ser una buena herramienta para el diagnóstico, ya que, si bien existe un efecto genotóxico en el linfocito, este tiene la habilidad de repararse con actividades bajas a los 60minutos, produciendo el daño basal con una actividad de 14.8 MBq, lo que redunda en beneficio del paciente.
ConclusionesEn conclusión, el daño al DNA producido por el radiofármaco 99mTc.TAT-BN en 30 y 60minutos con las actividad de 2.9, 6.6, 9.01 y 14.8 MBq, es por la internalización del TAT al núcleo celular y por la emisión de electrones auger del decaimiento del 99mTc, dado por la cantidad de energía que se produce en un volumen pequeño.
FinanciamientoEsta investigación fue parcialmente financiada por el proyecto 2806-2009 de la UAEM, y el proyecto CB-908 del ININ.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
AgradecimientosLos autores agradecemos al Dr. Jorge Serment, Dr. Madrigal, Biol. David Becerra, M. Virginia Cruz, M. Leticia Santos, Q. Noé Cruz, Q. Blanca Ocampo, M. Enrique Morales, Q. Andrea, Biol. Diana Espinoza, Dra. Sandra García y al Sr. Ángel Reyes, por su apoyo en la realización de este trabajo.