Los prematuros de extremo bajo peso frecuentemente requieren usar ventilación mecánica (VM). En los últimos años se ha desarrollado una gran variedad de ventiladores que proveen distintas modalidades y dan información precisa de los volúmenes que entregan, permitiendo optimizar el nivel de soporte. El objetivo de esta revisión es describir las principales prácticas de manejo ventilatorio en el prematuro.
Existen muchas modalidades cuya utilidad clínica ha sido evaluada en estudios controlados, pero quedan varias dudas sin resolver. Es claro que permiten optimizar y disminuir la duración de la VM, lo que podría disminuir el daño pulmonar, pero los efectos en mejorar resultados como displasia broncopulmonar (DBP) y/o muerte no son tan claros. Es necesario tener un mayor número de estudios controlados que aporten evidencias sólidas para recomendar alguna de las modalidades.
En nuestra experiencia, tratamos de usar la VM lo menos posible intentando un retiro rápido. En estos casos usamos la modalidad de ventilación mandatoria intermitente sincronizada+presión de soporte (SIMV+VPS). En aquellos niños más enfermos en que creemos requerirán VM por un tiempo más prolongado preferimos usar la modalidad asisitida-controlada (AC). En ambas situaciones idealmente con la adición de garantía de volumen. Una vez que el paciente se ha estabilizado y presente respiración espontánea, debe considerarse el retiro de la VM habitualmente a CPAP, previa carga con metilxantinas. Puede considerarse también extubación a ventilación nasal con presión positiva intermintente sincronizada (VNPPI-S) en centros que dispongan de modo sincronizado.
Dado que existen varias modalidades y tipos de ventiladores, es recomendable que dentro de una unidad se escojan algunas y el equipo clínico esté familiarizado con su uso.
Extremely preterm infants frequently require mechanical ventilation (MV). In recent years, a wide variety of ventilators have been developed that provide different modes and precise information on the volumes they deliver, allowing health professionals to optimize ventilation and level of support. The objective of this review is to describe different ventilatory practices in preterm infants.
There are many modalities and their clinical utility has not been well evaluated in large controlled studies and various questions remain unresolved. It is clear that they allow optimize and reduce MV duration, which could reduce lung damage. However, their effects on improving outcomes such as bronchopulmonary dysplasia (BPD) and/or death are not so clear. It becomes necessary to have a greater number of controlled studies that provide solid evidence in order to recommend a specific modality.
In our experience, we try to use MV as little as possible by attempting a quick extubation. In these cases we use the synchronized intermitent mechanical ventilation+pressure support (SIMV+VPS) mode. In those sicker and/or smaller infants who we believe will require MV for a longer time, we prefer to use the assist control AC mode. In both situations ideally with the addition of volume guarantee. Once the patient has stabilized and presents spontaneous respiration, extubation should be considered, usually to CPAP, after loading with methylxanthines. Extubation to S-NIPPV can also be considered in centers that have possibility of synchronized mode.
Since there are several modalities and types of ventilators, it is recommended that within a unit, a selection be made in order for the clinical team to become familiar with their use.
Los problemas respiratorios son muy comunes en los recién nacidos (RN) prematuros, en especial en aquellos de extremo bajo peso al nacer (<1 kilo o menores de 28 semanas). Ellos tienen menor capacidad de secretar surfactante por lo que frecuentemente desarrollan enfermedad por membrana hialina (EMH). Por otra parte, su pared torácica es más débil y distensible, lo que, asociado a la debilidad de sus músculos respiratorios e irregularidad de su ritmo respiratorio, les hace más difícil mantener un volumen pulmonar adecuado conduciendo a apneas, fatiga y falla respiratoria. Por ello, la mayoría requiere soporte respiratorio; ya sea invasivo con intubación endotraqueal y ventilación mecánica (VM) o no invasivo, a través de una interfase nasal con presión positiva continua de la vía aérea (CPAP) o ventilación no invasiva (VNI) con o sin oxígeno.
Con el desarrollo del cuidado intensivo neonatal, el soporte ventilatorio y uso de surfactante, la sobrevida de los RN prematuros extremos con problemas respiratorios ha mejorado en forma importante en las últimas décadas1,2. Sin embargo, los pulmones y vías aéreas inmaduras del prematuro extremo son susceptibles a daño: existe abundante evidencia de que las altas presiones y/o cambios de volumen que son sometidos durante la VM, como también las altas concentraciones de oxígeno producen una reacción inflamatoria, detención del crecimiento y daño pulmonar. También la VM invasiva se asocia a mayor riesgo de infecciones y compromiso neurológico3,4. Todo esto conduce al desarrollo de la displasia broncopulmonar (DBP), esta última es más frecuente mientras más inmaduro es el niño, y mientras más tiempo use la VM3,5,6.
Para disminuir estas consecuencias, en los últimos años se han estudiado estrategias menos invasivas y distintos modos de ventilación. Una de las estrategias ha sido evitar la intubación y VM con el uso muy precoz o profiláctico del CPAP, uso precoz de surfactante idealmente con técnicas menos invasivas que evitan la VM y cuando se requiera uso de ventilación gentil. Si bien con ellas se ha disminuido significativamente la DBP y/o muerte en prematuros <1500g con síndrome de dificultad respiratoria (SDR)7, la evidencia no ha sido muy concluyente en los prematuros extremos. Recientemente Doyle et al.8 presentan un gran cohorte de prematuros <28 sem en los últimos años y comparan las distintas estrategias ventilatorias. Ellos describen que a pesar de un menor uso de VM invasiva y mayor uso de CPAP encontraron una discreta mayor incidencia de DBP y evidencias de obstrucción bronquial a los 8 años. Esto también coincide con varios estudios randomizados y controlados que comparan el uso precoz de CPAP vs VM en prematuros en que no han demostrado una incidencia claramente menor de DBP9,10. La posible explicación de esto es que muchos de ellos han incluido a prematuros muy pequeños de 23–25 semanas y/o <700g en los que el riesgo de falla respiratoria es más alto, usaron surfactante más tardíamente y requirieron mayores concentraciones de oxígeno mientras estaban en la estrategia menos invasiva11. Esto no quiere decir que debamos usar VM invasiva en estos niños, existen muchas demostraciones de las ventajas de las estrategias menos invasivas en niños un poco mayores, y muchas veces podemos intentarlas en niños más pequeños, pero debemos estar muy atentos y no retrasar el uso de surfactante y VM en aquellos que la requieran, el desafío es encontrar la indicación correcta en el tiempo correcto para cada niño.
En el presente artículo no vamos a discutir detalles sobre las estrategias de uso de surfactante con o sin VNI en prematuros extremos, sino que las estrategias de ventilación mecánica en aquel niño que la requiere. El objetivo de esta revisión es describir las principales prácticas de manejo ventilatorio en el prematuro.
2Ventilación sincronizadaGracias a los avances de la tecnología se han desarrollado una gran variedad de ventiladores mecánicos con la capacidad de sincronizarse con el esfuerzo respiratorio del RN. Ellos proveen distintas modalidades y nuevos monitores en línea que entregan información de la función pulmonar que permite aumentar la seguridad de la VM. Lo fundamental de estas técnicas es que entregan gran parte del control de la ventilación al paciente. En la ventilación sincronizada o gatillada por el paciente, la fase inspiratoria de la VM es iniciada en respuesta al esfuerzo respiratorio del paciente. De esta forma, se sincronizan los inicios de las respiraciones espontáneas y las mecánicas, lo que no ocurre en la ventilación mandatoria intermitente (IMV) tradicionalmente usada en RN. Algunos de los ventiladores permiten además terminar la inspiración coordinadamente con el esfuerzo espiratorio del paciente con la disminución del flujo inspiratorio en su fase final12,13. Este tipo de ventilación está disponible en ventiladores ciclados por tiempo/limitados por presión y en ventiladores controlados por volumen. Existen las siguientes modalidades:
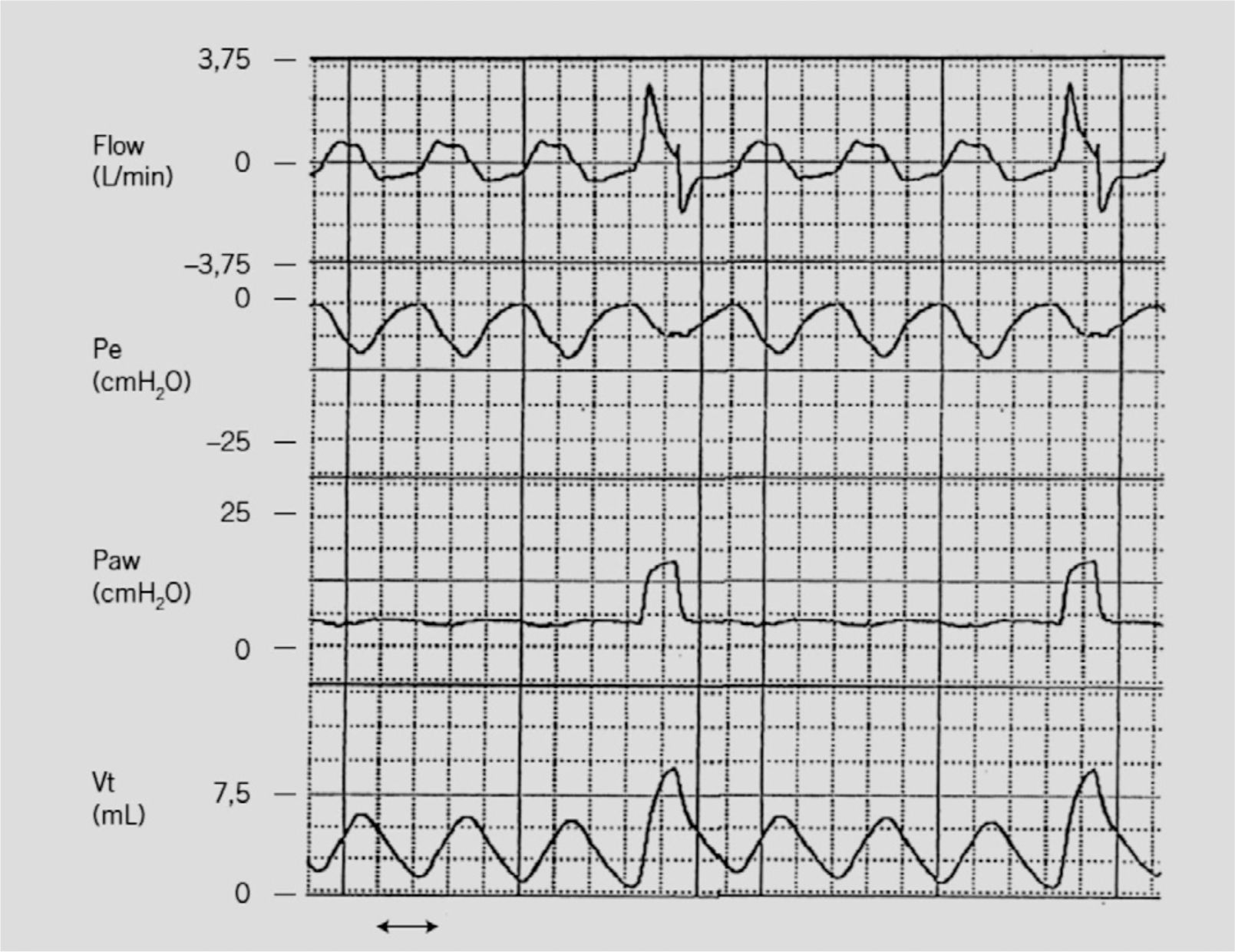
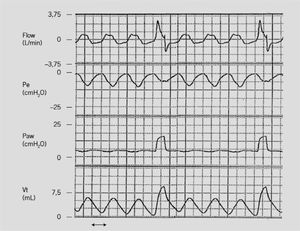
Ventilación mandatoria intermitente sincronizada (SIMV). En ella el ventilador entrega respiraciones mecánicas en forma intermitente a una frecuencia fijada por el clínico, pero, a diferencia de la IMV tradicional, estas respiraciones mecánicas están sincronizadas con el esfuerzo inspiratorio del paciente (si éste respira). El paciente puede tener respiraciones espontáneas entre las mecánicas que son apoyadas por la presión positiva al final de la espiración (PEEP) (Fig. 1).
Ventilación mandatoria intermitente sincronizada (SIMV). Registro simultáneo de curva de flujo de vía aérea, presión esofágica (deflección negativa ilustra al esfuerzo respiratorio del paciente dado por la contracción diafragmática), presión de vía aérea y volumen corriente generado en un RN. Como se observa, las respiraciones mecánicas están sincronizadas y coinciden con el inicio del esfuerzo.
Ventilación asistida/controlada (AC). En ella cada respiración espontánea del paciente gatilla o es “asistida” por una respiración mecánica completa. Si el paciente no respira, el ventilador entrega respiraciones mecánicas a la frecuencia fijada por el clínico para asegurar una ventilación adecuada. Algunos respiradores sólo sincronizan el inicio de la respiración y el tiempo inspiratorio es fijo, requiriendo ajustes para evitar atrapamiento aéreo. En otros, se puede sincronizar el término de la inspiración con el inicio del esfuerzo espiratorio del paciente y el tiempo inspiratorio es variable de acuerdo al esfuerzo del paciente.
Ventilación con presión de soporte (VPS). Es un modo de ventilación que se diseñó para apoyar las respiraciones espontáneas en adultos que requerían VM. La VPS da una presión inspiratoria adicional a las respiraciones espontáneas, con el objetivo de disminuir el trabajo respiratorio que impone el respirar a través del tubo endotraqueal y circuito del ventilador. Es una modalidad gatillada por el paciente, limitada por presión y ciclada por flujo, en la cual el esfuerzo inspiratorio del paciente es asistido por un aumento del flujo inspiratorio (lo que da un aumento de presión). Este flujo inspiratorio adicional es variable en relación al esfuerzo del paciente ya que termina la inspiración al detectarse el inicio de la espiración. Esta modalidad es casi idéntica a la AC cuando se usa sola, aunque no todos los ventiladores que entregan la modalidad AC tienen capacidad de terminar la inspiración. No existe uniformidad en la nomenclatura entre los distintos ventiladores lo que crea confusión. Algunos ventiladores en modalidad VPS no tienen una frecuencia de respaldo, por lo que requiere que el paciente tenga un esfuerzo respiratorio suficiente.
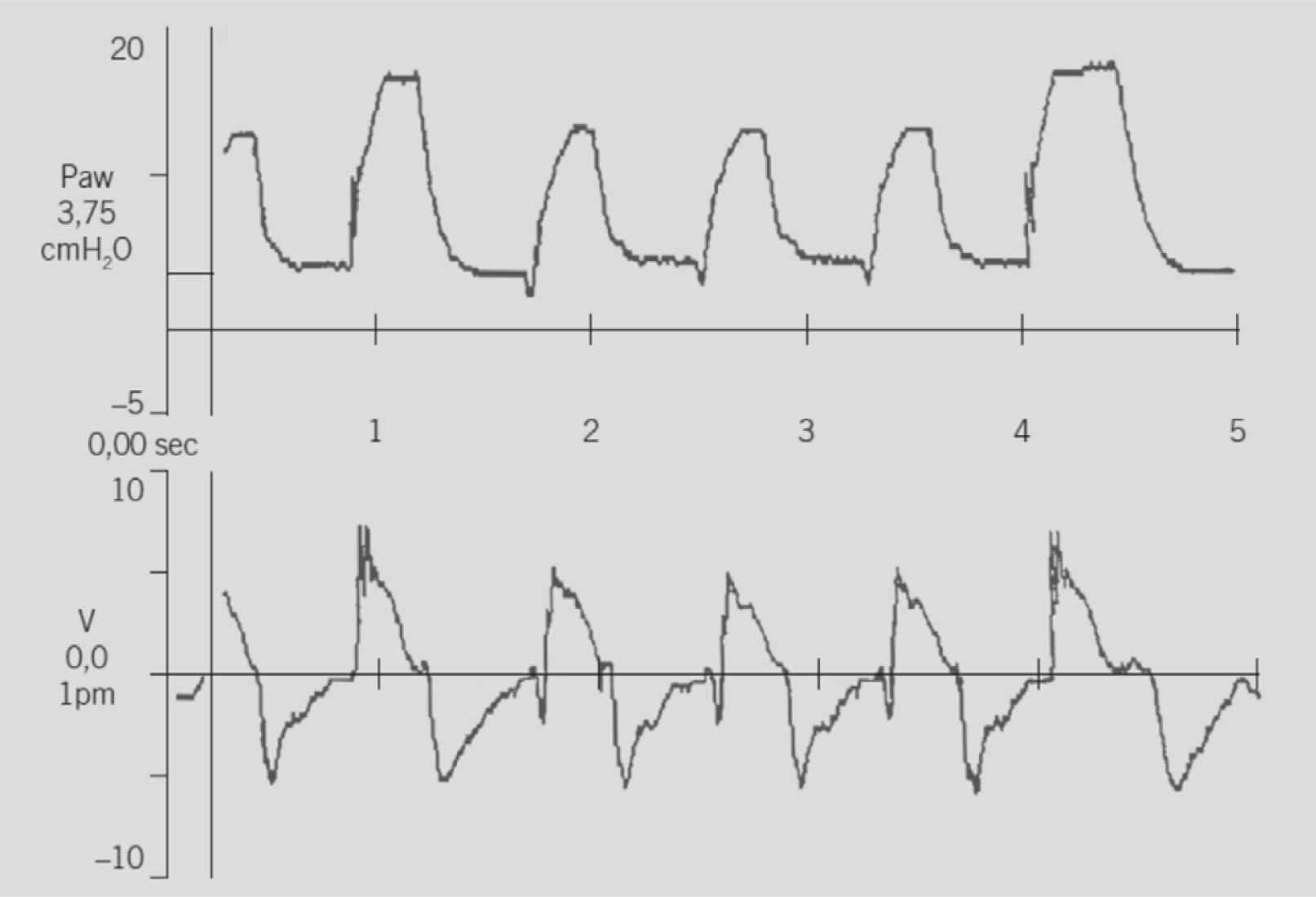
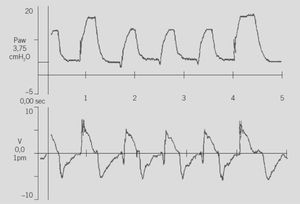
SIMV+PS: La mayoría de los ventiladores permiten usar la modalidad SIMV en conjunto con VPS (SIMV+VPS): el ventilador entrega ventilaciones mecánicas con cierta presión y tiempo en forma intermitente y las respiraciones espontáneas entre las mecánicas son “apoyadas” por la PS, la que se usa con un nivel menor al soporte mecánico (Fig. 2). Algunos ventiladores lo expresan como un porcentaje de la presión inspiratoria máxima (PIM) de las ventilaciones mecánicas o simplemente se programa un límite de presión para este soporte. En general se recomienda partir con el 50% al 60% de la diferencia entre la PIM- PEEP.
Ventilación con objetivo de Volumen (VOV) o Volumen garantizado (VG). Esta modalidad híbrida, en que se combina el control del volumen con algunas de las modalidades previas, la entregan varios ventiladores neonatales y puede usarse combinada con SIMV, AC o VPS. En esta modalidad se fija un volumen corriente (Vc) para entregar en las respiraciones mecánicas (habitualmente entre 4 y 6mL/kg) y el ventilador va ajustando para cada respiración el tiempo, flujo y presión inspiratoria para que entregue ese volumen. Además del Vc se fijan los límites de presión y los parámetros basales o respaldo según la modalidad de ventilación elegida: Muchas veces el ventilador consigue usar menos presión y tiempo para entregar el volumen deseado.
3Estudios clínicosExisten varios estudios en RN que han demostrado que la ventilación sincronizada mejora el intercambio gaseoso, reduce el trabajo respiratorio y los episodios de “lucha” con el ventilador. También se ha demostrado reducción en las fluctuaciones de la presión arterial y niveles de catecolaminas. Todo esto pudiera disminuir la incidencia de complicaciones como escapes de aire (neumotórax), DBP en especial las formas más severas y hemorragia intracraneana (HIC), lo que se ha reportado en varios trabajos14–16. Los metanálisis de los distintos estudios han mostrado consistentemente una reducción significativa de la duración de la VM. Sin embargo, hasta el momento no existe evidencia clara de que la ventilación sincronizada disminuya en forma importante complicaciones como DBP y/o muerte17,18. Si bien existen varios estudios, no son homogéneos, prueban distintos ventiladores con múltiples modalidades por lo que se hace difícil su comparación. Por otra parte, estos ventiladores pueden gatillarse inapropiadamente por artefactos o no gatillarse por fallas en el sensor lo que requiere de más ajustes y cuidado que la ventilación tradicional. Existen pocos datos de sus efectos, en especial a largo plazo en RN. Tampoco existe evidencia clara sobre qué modalidad de ventilación es mejor.
Varios estudios evalúan a corto plazo la modalidad AC comparada con IMV tradicional, los que muestran mejorías en el intercambio gaseoso y menor soporte ventilatorio tanto en la fase aguda como en la recuperación de prematuros con SDR. Sin embargo, en uno de estos estudios esta modalidad no fue exitosa en prematuros <28 semanas. Algunas de estas diferencias están relacionadas con los equipos utilizados, varios de los cuales han mejorado significativamente en el último tiempo, después de las publicaciones. A pesar de que la evidencia no es tan clara, esta modalidad AC es la elegida en muchos centros como modo de ventilación en la fase aguda de RN con falla respiratoria. Esto probablemente porque es más uniforme, requiere el menor esfuerzo del paciente y garantiza una ventilación minuto adecuada en caso de apnea o pobre esfuerzo ventilatorio. Como en este modo cada esfuerzo del paciente es “asistido” por una ventilación mecánica, no es infrecuente observar hipocapnia-hiperventilación debida a las altas frecuencias y/o presiones que pueden alcanzarse y en ocasiones debidas a autociclado. Es muy importante que el neonatólogo esté atento y reduzca las presiones inspiratorias para evitar lo anterior. Por otra parte, algunos de los ventiladores que dan esta modalidad no tienen capacidad para terminar la inspiración cuando el RN comienza la espiración y por lo que puede haber algo de “lucha” con el ventilador. También si el RN elige frecuencias respiratorias altas y el Ti es fijo puede producirse atrapamiento aéreo, con sus consecuencias como escapes aéreos (se observó una mayor tendencia no significativa en los metaanálisis iniciales, pero en la mayoría de los estudios los ventiladores no podían cortar la inspiración). Por eso requiere más ajustes y lo ideal es usarla con ventiladores que permitan cortar la inspiración. Si no es posible aconsejamos fijar el Ti en 0,3 seg al usarla en prematuros <1000g.
En relación a SIMV varios estudios muestran mejorías en oxigenación, función pulmonar, entrega de Vc más estable y menores variaciones en flujo vascular cerebral. Bernstein et al.19 compararon en un estudio prospectivo controlado y multicéntrico el uso de SIMV versus IMV desde el primer día en 327 RN con SDR. Este estudio incluyó a niños de un amplio rango de peso y distintas patologías que complican su análisis. Entre los resultados destacan que la SIMV fue tan o más eficaz que la IMV y que los niños que la usaron requirieron una menor presión media de la vía aérea. Si bien no se demostró una menor duración de VM o de DBP en el total de la población, al hacer análisis de subgrupo, se encontró una significativa disminución de las formas severas de DBP en los prematuros <1000g y una mejor ganancia de peso en ellos. No hubo diferencias significativas en mortalidad, incidencia de HIC, escapes de aire ni otras complicaciones. En base a esto, muchos centros han adoptado esta modalidad que es la más frecuentemente utilizada en prematuros que requieren de VM. Hasta el momento no existe evidencia clara que demuestre ventajas de AC versus SIMV tanto en la fase aguda de una enfermedad respiratoria, ni de cuál es el mejor método de retirada del ventilador.
La modalidad VPS ha sido introducida más recientemente en varios de los ventiladores neonatales. En RN se ha demostrado que reduce el trabajo respiratorio y la asincronía con el respirador. Cuando la VPS se usa como modalidad única es muy similar a la modalidad AC, aunque el flujo inspiratorio variable de la VPS puede beneficiar a pacientes con enfermedades con resistencia pulmonar aumentada. De hecho, existen reportes de mejorías en mecánica pulmonar y mayor facilidad para el retiro del ventilador en pequeñas series de prematuros ventilados con DBP20.
Más recientemente se han publicado estudios combinando SIMV+VPS. Osorio et al.21, demostraron que la adición de VPS a SIMV permite disminuir la frecuencia de las respiraciones mecánicas manteniendo una adecuada ventilación e intercambio gaseoso. Reyes y cols.22, compararon en un gran estudio randomizado y controlado el uso de SIMV+VPS versus SIMV en 107 prematuros <1000g. Ellos usaron una PS 30%-50% de la diferencia entre el PIM-PEEP. Los RN tratados con SIMV+VPS alcanzaron precozmente parámetros mínimos de VM y fueron extubados antes, pero no hubo diferencias en DBP y/o muerte. Sin embargo, un subanálisis de los RN de peso entre 700 y 1.000g mostró una menor dependencia de oxígeno en los tratados con SIMV+VPS. En base a esto y la experiencia clínica, esta es una de las modalidades más frecuentemente usadas.
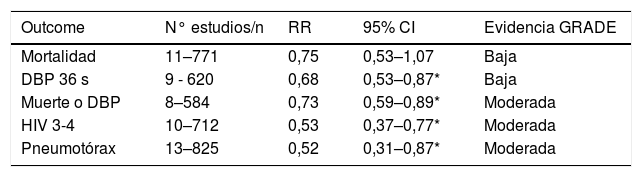
En relación a las modalidades que adicionan control de la ventilación por objetivo de volumen (VOV), son relativamente nuevas en las UCI neonatales, aunque existen varios estudios en RN con resultados promisorios. Ellos muestran que la adición de VG con un volumen de 4 a 6mL/kg a distintas modalidades de ventilación sincronizada, disminuye las presiones utilizadas, mantiene Vc y ventilación más estable, disminuye citoquinas proinflamatorias y permitiría reducir la duración de la VM23,24. Dos meta-análisis recientes de varios estudios que compararon ventilación sincronizada con adición de VOV (la mayoría usando VG) versus SIMV en prematuros, muestran una menor duración de VM, una disminución de la incidencia de pneumotórax, HIC y DBP (ver Tabla 1), también se observó una mejor sobrevida libre de DBP (disminución del outcome combinado DBP y/o muerte). Sin embargo, la evidencia es moderada ya que la mayoría de los estudios son pequeños y no son ciegos25,26. Actualmente existen varios estudios en curso que esperamos confirmen esta importante evidencia. Algunos autores recomiendan usar VG combinado con AC o PSV ya que estas modalidades al apoyar todas las respiraciones espontáneas, se asocian con un Vc espirado más estable, mejor oxigenación y disminución de la taquipnea en comparación con la SIMV+VG27.
Resumen de los principales resultados de un metaanálisis de 13 estudios que comparan ventilación sincronizada con objetivo de volumen vs ventilación sincronizada limitada por presión
| Outcome | N° estudios/n | RR | 95% CI | Evidencia GRADE |
|---|---|---|---|---|
| Mortalidad | 11–771 | 0,75 | 0,53–1,07 | Baja |
| DBP 36 s | 9 - 620 | 0,68 | 0,53–0,87* | Baja |
| Muerte o DBP | 8–584 | 0,73 | 0,59–0,89* | Moderada |
| HIV 3-4 | 10–712 | 0,53 | 0,37–0,77* | Moderada |
| Pneumotórax | 13–825 | 0,52 | 0,31–0,87* | Moderada |
Adaptado de Klingenberg C et al. Cochrane Database of Systematic Reviews 2017. *=p<0.05. Abreviaturas: DBP= Displasia broncopulmonar; HIV=Hemorragia intraventricular
Consejos prácticos para VOV: En pacientes prematuros <1000g con EMH se recomienda iniciar la ventilación con VG con un Vc programado de 4,5 a 5,0ml/kg (el sensor adiciona un espacio muerto de 0,8 a 1ml) y de 4,0 a 4,5ml/kg para recién nacidos >1000 gr. Los ajustes subsiguientes se hacen en incrementos de 0,5ml/kg, habitualmente en el rango de 4,0 a 6,0ml/kg para lograr valores de PaCO2 aceptables28. Los pacientes crónicos con DBP y ventilación prolongada habitualmente tienen daño de su vía aérea y pulmonar que aumenta el espacio muerto, pueden necesitar un Vc programado más alto (6 a 8ml/k) para mantener una adecuada ventilación. Respecto a la selección de la presión inspiratoria máxima (PIM) límite (ó Pmax): durante la ventilación con VG el PIM límite no es el mismo que el PIM entregado, ya que en esta modalidad de VG ajusta el PIM para lograr el Vc programado. El PIM límite programado debe ser lo suficientemente alto para permitir fluctuaciones del PIM promedio o PIM de trabajo. Si el Pmax está muy cerca del PIM de trabajo, las alarmas de Vc bajo sonarán frecuentemente, ya que muchas veces no se alcanza el Vc. Recomendamos iniciar la ventilación con VG con un PIM limite unos 5cms de H20 por sobre el PIM de trabajo, ajustándolo de acuerdo a la observación clínica de un adecuado movimiento torácico en relación al esfuerzo respiratorio del paciente y su intercambio gaseoso. El paciente y el ventilador deben ser re-evaluados si el PIM de trabajo aumenta progresivamente o si se mantiene persistentemente alto, o si el ventilador avisa frecuentemente “volumen corriente bajo”. Las causas principales son: aumento en fugas por el tubo endotraqueal (TET), sensor sucio/húmedo, espiración forzada, contracción muscular que se opone a la ventilación, empeoramiento de la mecánica pulmonar, escapes de aire, monointubación o TET acodado.
Consideraciones especiales: Si bien estas nuevas modalidades demuestran beneficios, requieren de más ajustes de varios parámetros adicionales: sensibilidad de gatillación, VG, límites de presión y ventilación, alarmas, etc. y cuidados estrictos del sensor de flujo o pneumotacógrafo que permite gatillar la ventilación y las mediciones. Estos ventiladores pueden gatillarse inapropiadamente por artefactos, fugas o líquido en sensor, o no gatillarse por fallas en el sensor. Todo esto requiere de más cuidados que la ventilación tradicional que si no se hacen bien, pueden perjudicar a nuestros pequeños pacientes. Si bien la mayoría de los equipos compensan por fugas alrededor del tubo, si estas son >35% es difícil que funcione apropiadamente y muchas veces ocurre autogatillado. El sensor de flujo debe ser posicionado con el enchufe o líneas de medición apuntando hacia arriba para disminuir la condensación o que entre agua en el sensor. También no debe ubicarse en un punto más bajo que la boca del niño ya que puede acumularse condensación. No es apropiado disminuir la humedad del circuito para evitar la condensación. Debe procurarse una adecuada calefacción del gas inspirado a 37°C idealmente con circuitos con cable calefactor. En niños muy pequeños <600g el sensor puede adicionar un espacio muerto importante, lo que puede dificultar la ventilación si están muy enfermos, por ello hay que evaluar caso a caso y en algunos no usarlo.
4Otras modalidadesVentilación Asisitida Ajustada Neuralmente (NAVA) (Neurally Adjusted Ventilatory Assist). Este nuevo modo ventilatorio usa la señal eléctrica de la contracción diafragmática, la cual es detectada mediante un electrodo esofágico (introducido en usa sonda nasogástrica), lo que determina el comienzo de la inspiración, entregando una PIM variable proporcional en relación a la señal eléctrica detectada, no está influenciado por fugas de la vía aérea, puede ser utilizado para ventilación invasiva y ventilación nasal no invasiva (VNI). Puede usarse como modalidad de asistencia (similar al AC ó VPS sola) o también para gatillar una SIMV (SIMV-NAVA). Estudios pilotos usando NAVA como asistencia han mostrado muy buena sincronía al ser comparado con SIMV tradicional, mantiene un intercambio gaseoso efectivo con un menor PIM y menor trabajo respiratorio29,30. Sin embargo, en los prematuros extremos que pueden tener un pobre esfuerzo respiratorio, la asistencia en ellos puede resultar insuficiente al asistir con menores presiones y Vc e hipoventilar. Se puede concluir que esta modalidad apoya con más intensidad al niño con un mejor patrón respiratorio, entregando una mayor asistencia de Vc, lo que potencialmente podría retrasar el retiro del ventilador. Si bien existen algunos estudios promisorios, son pequeños y la evidencia es insuficiente para recomendar su uso31. Donde creemos puede tener una mayor aplicabilidad es en ventilación no invasiva usándola como VNPPIS-NAVA para sincronizar las ventilaciones asistidas.
Muchos de los ventiladores actuales pueden tener la opción de la administración de oxígeno servo-controlada. Esto permite aumentar el tiempo de mantención de los niveles de saturación de oxígeno dentro de los rangos deseados, disminuyendo el tiempo y episodios tanto de hiperoxia como de hipoxia32 lo que podría influir en el desarrollo neurológico y la retinopatía observada en muchos de estos niños. Sin embargo, la evidencia todavía es insuficiente para demostrar disminución de estas secuelas33.
5Retiro del Ventilador MecánicoUna vez que el paciente se ha estabilizado y presente respiración espontánea, debe considerarse el retiro del ventilador. No existen evidencias claras de cuál es el mejor método de retiro34. Tanto la hipocarbia como hipercarbia severa se han asociado con alteraciones a largo plazo35 y deben evitarse. Procurar un nivel de CO2 con hipercarbia moderada ayuda a disminuir el tiempo de VM36,37. Como ya se comentó, el usar la VOV permite la reducción automática de las presiones más rápido. La mayoría de los niños requerirá la VM por un período corto, en especial aquellos con EMH que mejoran rápido luego del uso de surfactante, permitiendo disminución de los parámetros de VM. En esos casos se recomienda una extubación precoz, aun en los prematuros más pequeños38. En general la extubación es exitosa cuando estamos usando una presión media ≤7-8cms H20 y FiO2 ≤0,4. La administración previa de metilxantinas como aminofilina y especialmente cafeína, facilitan y reducen las fallas de extubación, como también las apneas39,40. La cafeína también ha demostrado reducción en DBP y mejor desarrollo neurológico a largo plazo40,41. Lo usual es administrar una dosis de carga de 20mg/kg el día previo a la extubación seguido de una dosis de mantención de 5-10mg/kg/día.
Soporte Ventilatorio No Invasivo (VNI) en la prevención de la falla post extubación: Se recomienda algún método de asistencia ventilatoria no invasiva, para prevenir el fracaso de extubación en prematuros extremos. Varios estudios y metaanálisis han demostrado que el uso de CPAP disminuye la falla post extubación, necesidad de reintubación y apneas42. Así mismo, se ha visto que el extubar a un nivel de presión de CPAP mayor: 6-8cm H2O mejora las chances de éxito43.
Sin embargo, algunos pacientes fallan y requieren de reintubación. Es por ello que varios estudios han evaluado los posibles beneficios de la Ventilación Nasal con Presión Positiva Intermitente (VNPPI), que es la forma más común de VNI, en disminuir la tasa de falla en el periodo post extubación comparada con CPAP. Esta puede entregarse en 2 modalidades: Sincronizada (VNPPI-S) y no sincronizada (VNPPI-NS), la que se conoce también como “CPAP ciclado”. Los efectos benéficos han sido especialmente consistentes en estudios que se han realizado con la modalidad sincronizada. Sin embargo, en VNPPI-NS, los resultados no son concluyentes. Un metaanálisis reciente muestra una consistente disminución de la falla de extubación con el uso de NIPPV en especial en el modo sincronizado, al compararlo con CPAP nasal44. Sin embargo, esta tendencia no tiene la misma consistencia en la forma no sincronizada y en ambos modos no muestra diferencias en la prevención de muerte o DBP. Los autores concluyen que se requiere un mayor número de estudios controlados con VNPPI-NS para dilucidar si esta modalidad es superior a CPAP en prevenir la falla post extubación.
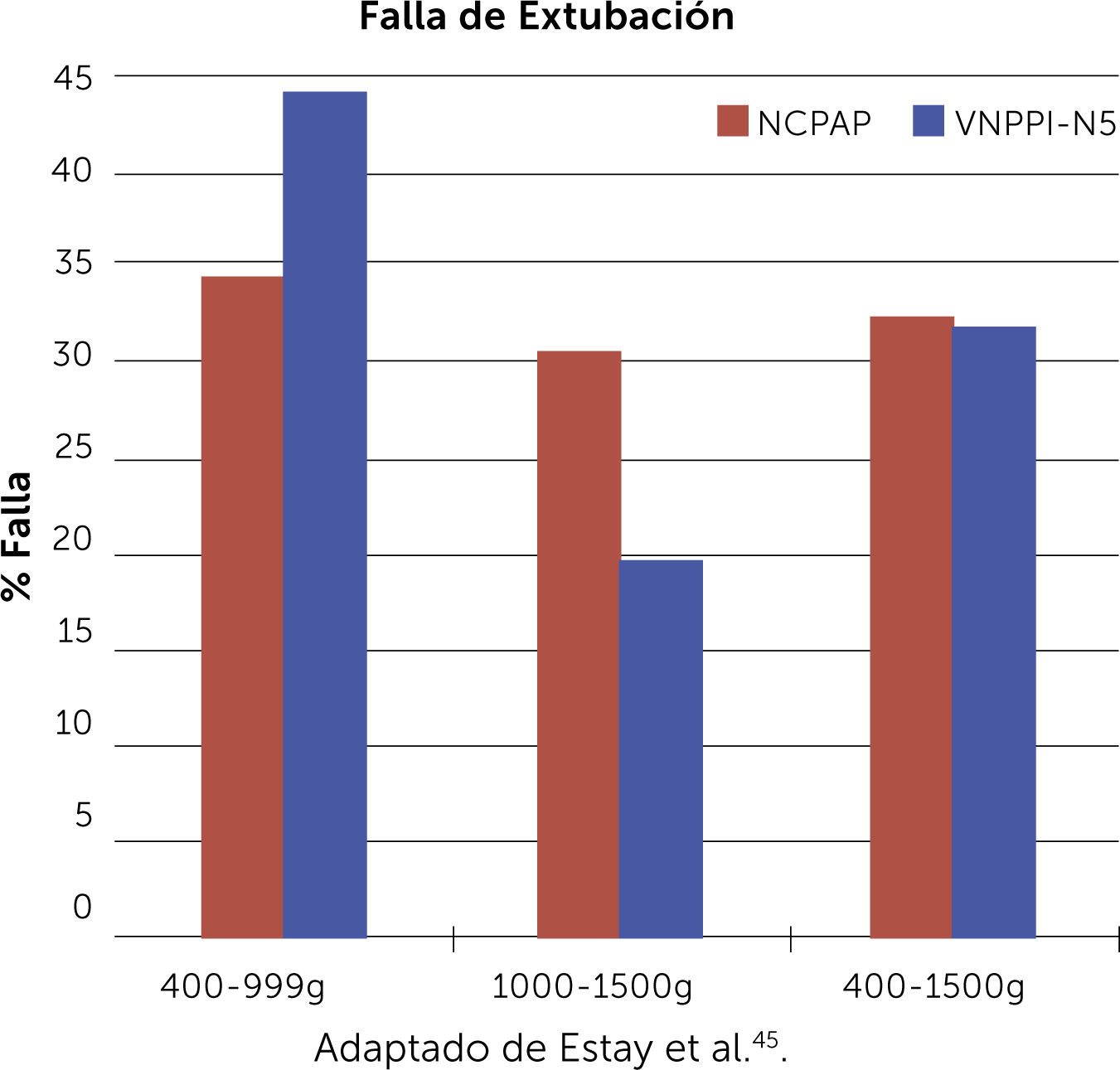
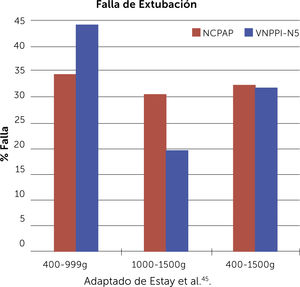
Más recientemente, en un estudio multicéntrico, controlado, aleatorizado y abierto realizado en 9 unidades de la red Neocosur45, se reclutaron 211 prematuros ≤1500g con SDR post extubación, 109 recibieron VNPPI-NS no sincronizado y 102 CPAP nasal convencional. No se encontraron diferencias significativas entre estas 2 estrategias. La tasa de falla post extubación fue: 30,3% para VNPPI-NS vs 32,4% para CPAP nasal (Gráfico 1). Tampoco se encontraron diferencias en la tasa de DBP y/o muerte, necesidad de soporte respiratorio, duración de oxigeno terapia, ni de otras complicaciones. Estos hallazgos sugieren que, a diferencia de la modalidad sincronizada, la VNPPI-NS no es superior a CPAP nasal en prevenir el fracaso post extubación y se requiere de más estudios controlados, para definir el real impacto en especial prematuros <1000g.
Tasa de falla de extubación en los 2 grupos estudiados, no se observan diferencias significativas entre VNPPI-NS y CPAP nasal. Adaptado de Estay et al.45.
Los autores declaran no tener conflictos de interés.