El ex-utero intrapartum treatment (EXIT) es una estrategia de parto que permite brindar soporte cardiopulmonar al feto con el objetivo de realizar una intervención vital durante la transición a la vida extrauterina. El EXIT proporciona tiempo para el abordaje de una variedad de malformaciones potencialmente mortales en un ambiente de máximo control fisiológico.
Según la finalidad de tratamiento, se han descrito distintos tipos de EXIT, incluyendo EXIT-to-airway (para el control de la vía aérea fetal), EXIT-to-ECMO (para la colocación de cánulas de oxigenación por membrana extracorpórea), EXIT-to-resection (para la resección de masas que impiden la ventilación o el retorno venoso) y EXIT-to-separation (para el abordaje de siameses). El objetivo general de un EXIT es mejorar la seguridad de procedimientos que resultan críticos para la supervivencia del recién nacido.
La relajación uterina máxima y controlada para maximizar la perfusión placentaria y fetal, manteniendo el bienestar fetal y materno, son los paradigmas de cualquier tipo de EXIT. El aspecto más importante de una intervención en soporte placentario es consolidar un equipo multidisciplinario altamente capacitado, bien coordinado y preparado para cualquier contingencia. Una evaluación prenatal completa, incluyendo ultrasonido, ecocardiografía fetal, resonancia magnética y pruebas genéticas, es imprescindible para la selección de pacientes. La planificación preoperatoria exhaustiva, las reuniones de equipo ad-hoc y las simulaciones quirúrgicas para casos desafiantes son estrategias críticas para lograr los mejores resultados clínicos.
El presente artículo describe el algoritmo de estudio prenatal, la planificación preoperatoria, los aspectos técnicos, los principios básicos y los fundamentos del procedimiento EXIT.
Ex-utero intrapartum treatment (EXIT) is a delivery strategy that allows for providing fetal cardiopulmonary support while performing a vital intervention during the transition to newborn life. EXIT provides time to address a variety of life-threatening congenital malformations in an environment of maximum physiological control.
Depending on the treatment purpose, different types of EXIT have been described; including EXIT-to-airway (to establish a fetal airway), EXIT-to-ECMO (for extracorporeal membrane oxygenation circuit cannulation), EXIT -to-resection (for the resection of masses that impair ventilation or venous return), and EXIT-to-separation (for the approach of conjoined twins). The overall goal of an EXIT is to improve the safety of procedures that are critical to the survival of the newborn.
Maximal but controlled uterine relaxation to ensure placental perfusion and thus fetal oxygenation, while maintaining fetal and maternal well-being, are the paradigms of any type of EXIT. The most important aspect of any intervention on placental support is to consolidate a highly trained, well-coordinated, multidisciplinary team that is prepared for every contingency. A comprehensive prenatal assessment, including ultrasound, fetal echocardiogram, MRI, and genetic testing, is imperative for the selection of patients. Extensive preoperative planning, ad-hoc team meetings, and surgical simulations for challenging cases are critical strategies to achieve the best clinical outcomes.
This article outlines the prenatal work-up, preoperative planning, technical aspects, basic principles, and fundamentals for a successful EXIT procedure.
El ex-utero intrapartum treatment (EXIT) es una estrategia de parto que permite brindar soporte cardiopulmonar al feto con el objetivo de realizar una intervención vital durante la transición a la vida extrauterina, permitiendo transformar una emergencia neonatal en un entorno clínicamente controlado1.
El procedimiento EXIT permite abordar distintas patologías del feto. La intubación endotraqueal, la traqueostomía, la colocación de cánulas de para oxigenación por membrana extracorpórea (ECMO) y la resección de una masa que comprime el mediastino, son algunas de las intervenciones fetales que pueden realizarse en EXIT.
Los principios centrales de un EXIT son promover la relajación uterina para garantizar el intercambio feto-materno, preservar la circulación uteroplacentaria y realizar una intervención fetal suficiente para prevenir el distrés neonatal2. El abordaje multidisciplinario durante las etapas pre, intra y post parto, en el marco de un equipo altamente capacitado en intervención fetal, son aspectos críticos para ofrecer los mejores resultados clínicos, en un ambiente seguro para la madre y el feto.
Los primeros protocolos de EXIT fueron escritos en 1997 por Mychaliska et al. en San Francisco UCSF, luego de que múltiples casos se publicaran en la literatura3. El mismo grupo de autores fue quien posteriormente acuñó el acrónimo “EXIT” para esta estrategia. Desde entonces, los avances científicos en anestesiología obstétrica y el fortalecimiento en la evaluación y atención multidisciplinaria en medicina fetal permitieron una mejora progresiva en la seguridad de intervenciones perinatales como el EXIT, cambiando el paradigma de manejo de muchas malformaciones congénitas4,5.
La realización de un procedimiento EXIT implica considerar numerosos principios y detalles técnicos. En este artículo, discutiremos los conceptos básicos, las indicaciones, los fundamentos y los detalles técnicos para lograr una intervención segura y exitosa.
2Subtipos de EXITEl procedimiento EXIT, originalmente descrito para asegurar la vía aérea previo al pinzamiento del cordón umbilical, permite hoy abordar un heterogéneo grupo de malformaciones congénitas. Según el objetivo de tratamiento, se han descrito diferentes categorías de EXIT (Tabla 1).
Subtipos de EXIT e indicaciones
| EXIT-to-Airway | Obstrucción extrínseca de la vía aérea:EpignatusMicrognatia severaEpulisMalformaciones vascularesTeratomaBocio |
| Obstrucción intrínseca de la vía aérea:CHAOS (atresia laríngea, quistes, membranas o estenosis, atresia o estenosis traqueal).Extracción de balón traqueal en hernia diafragmática congénita. | |
| EXIT-to-ECMO | Hernia diafragmática congénita severa.Cardiopatías congénitas.Vía aérea imposible de asegurar por otros medios (exit-to-airway o exit-to-resection). |
| EXIT-to-resection | Malformaciones congénitas de las vías aéreas pulmonares (CPAM).Tumores orales: epignatus, épulis.Tumores cervicales: malformaciones vasculares, teratomas.Teratomas mediastinales o sacrococcígeos |
| EXIT-to-separation | Siameses |
EXIT-to-airway permite el manejo de las vías respiratorias de fetos con tumores o malformaciones que causan obstrucción intrínseca o extrínseca de las vías respiratorias superiores, como teratomas, malformaciones linfáticas, micrognatias o síndrome de obstrucción congénita de la vía aérea superior (CHAOS). La obstrucción congénita de la vía aérea superior representa la indicación más frecuente de EXIT. El objetivo de esta práctica es asegurar la vía aérea del feto a través de distintas estrategias como la intubación, la endoscopía, la traqueostomía, entre otras6.
EXIT-to-ECMO facilita el apoyo hemodinámico de afecciones pulmonares o cardíacas graves, como la hernia diafragmática congénita (HDC) grave, la estenosis aórtica grave y la hipoplasia de corazón izquierdo, o en cualquier situación en la que la vía aérea no se haya podido garantizar por otros medios antes del pinzamiento del cordón1,7. Las ventajas de esta estrategia son evitar el barotrauma, la hipoxia, la acidosis y la inestabilidad hemodinámica durante las maniobras de reanimación neonatal. Originalmente descrito para el manejo de la HDC severa, actualmente es un procedimiento discutido por la falta de evidencia a favor del beneficio de esta práctica. Sin embargo, limitaciones tales como tamaños muestrales pequeños, sesgos de selección, y la importante variación en los protocolos de uso de EXIT-to-ECMO en HDC entre centros, debilitan el poder estadístico de los reportes8–10.
EXIT-to-resection puede emplearse en fetos con grandes tumores o malformaciones orales, cervicales o torácicos que impiden la ventilación pulmonar o el retorno venoso por compresión de las estructuras mediastínicas, como las malformaciones congénitas de las vías aéreas pulmonares (CPAM) o los teratomas mediastinales. En el caso de tumores orales o cervicales, como el épulis, el epignatus, los teratomas cervicales, entre otros, esta estrategia es a veces necesaria para lograr acceder y asegurar la vía aérea. Es importante mencionar que la resección de masas en EXIT no debe necesariamente seguir un criterio oncológico o cosmético, ya que los objetivos en esta instancia son asegurar la vía aérea, permitir la ventilación y descomprimir las estructuras cardiovasculares11,12.
EXIT-to-separation se describió luego de una limitada cantidad de reportes de siameses abordados en EXIT para controlar la vía aérea y analizar detalles específicos de la anatomía compartida, como un puente a la separación13–15. Dada la limitada experiencia reportada, la necesidad de EXIT en este escenario debe ser analizada para cada caso en particular.
3Evaluación prenatalLa evaluación prenatal integral dentro de un enfoque multidisciplinario es la base de una adecuada selección de candidatos para EXIT. A pesar de los avances en las tecnologías de evaluación prenatal y la estandarización de los algoritmos de estudio, la identificación de predictores específicos para la selección de pacientes para EXIT sigue siendo desafiante. Los objetivos de esta evaluación son caracterizar la malformación, identificar anomalías asociadas y precisar elementos patológicos que nos permitan definir la necesidad de un parto en soporte placentario.
La ecografía prenatal es el estudio básico de cribado que permite reconocer un gran número de anomalías congénitas. Según las recomendaciones actuales del Colegio Americano de Obstetricia y Ginecología (ACOG), la vigilancia prenatal debe incluir al menos un examen de ultrasonido entre las semanas 18 y 22 de gestación16. Este escaneo permite realizar una primera valoración de la anatomía fetal, descartar defectos congénitos asociados, y establecer la edad gestacional y la ubicación placentaria. Una vez detectada cualquier malformación, la ecografía prenatal es el método ideal de seguimiento. Dependiendo de la patología, este estudio puede repetirse cada 2 a 4 semanas.
La resonancia magnética fetal (f-RMI), utilizando secuencias T2 sin gadolinio, debe incluirse siempre que se sospeche una anomalía que pueda requerir de una intervención en EXIT. Este estudio de imágenes permite una mejor caracterización de la malformación17,18. Por ejemplo, en fetos con tumores cervicales y obstrucción de la vía aérea, el grado de desplazamiento de la misma puede analizarse más detalladamente en la f-RMI, a través del índice TEDI (tracheoesophageal displacement index). Si este índice es ≥12mm, el paciente debe ser considerado para EXIT-to-airway. De igual manera, para fetos con CHAOS, la f-RMI es superior a la ecografía para localizar el sitio y la longitud de la obstrucción, lo cual tiene gran valor para la planificación del lugar anatómico de traqueostomía en EXIT19,20.
El ecocardiograma fetal debe realizarse como parte de la evaluación cardiológica para descartar defectos estructurales y funcionales asociados. Este estudio también permite medir el pico de velocidad sistólica de la arteria cerebral media para diagnosticar anemia fetal. Esta complicación acompaña a algunos tumores de gran volumen que presentan secuestro vascular o sangrado intratumoral, y se asocia a un aumento en la mortalidad fetal21.
El estudio genético invasivo, a través de una amniocentesis o una biopsia de vellosidades coriónicas, es indispensable para descartar aneuploidías o alteraciones en el microarray. Si bien el protocolo debe ser individualizado de acuerdo al escenario clínico, la evaluación genética es indispensable para determinar el pronóstico de ciertas malformaciones, valorar la relación costo-beneficio de un tratamiento invasivo como el EXIT y guiar las recomendaciones de equipo22,23.
4Plan preoperatorio y enfoque de equipoEl abordaje prenatal de un feto candidato a EXIT es eminentemente multidisciplinar y debe al menos incluir especialistas en medicina materno-fetal, obstetras, neonatólogos, cirujanos fetales, enfermeras, radiólogos pediátricos, anestesiólogos, cardiólogos fetales, genetistas y trabajadores sociales, de acuerdo a cada caso en particular.
La planificación preoperatoria, las reuniones de equipo ad-hoc y las simulaciones quirúrgicas para casos desafiantes son elementos críticos de cualquier tipo de procedimiento en EXIT24. La derivación temprana a un centro preparado es imperativa si el equipo no puede replicar este entorno, teniendo en cuenta que muchos pacientes necesitan manejo de polihidramnios, parto prematuro en EXIT o incluso EXIT de emergencia, con un equipo de guardia disponible 24 horas.
El espectro de opciones de manejo incluye la interrupción del embarazo (según la legislación local), la terapia paliativa de confort al nacimiento, la intervención neonatal, el EXIT stand-by al nacimiento o el parto con diferentes niveles de soporte placentario (parto vaginal en soporte placentario, cesárea en soporte placentario o ex-utero intrapartum treatment)22. La selección de la mejor estrategia requiere realizar un equilibrio entre la viabilidad fetal, los recursos disponibles, el beneficio de la intervención y los riesgos materno-fetales25. Considerando el alto nivel de coordinación de equipo y los recursos que requiere este procedimiento, programar el EXIT es siempre ideal. Sin embargo, el parto prematuro es una complicación frecuente, especialmente en presencia de polihidramnios26. Si la gestante presenta signos de parto inminente (como polihidramnios recurrente o cuello uterino corto), programar un EXIT pretérmino en forma electiva puede ser una estrategia necesaria, considerando siempre la necesidad de un EXIT de emergencia, mediante un equipo en alerta diaria predefinido.
Finalmente, la mejor manera de prepararse para un EXIT es considerando el peor escenario clínico y quirúrgico posible, disponiendo de todos los recursos necesarios para recorrer todas las estrategias del algoritmo de manejo de cada malformación y resolver cualquier potencial complicación27. Con este propósito, los checklists o listas de verificación de instrumentos son recursos valiosos que cada institución puede diseñar para su propio uso.
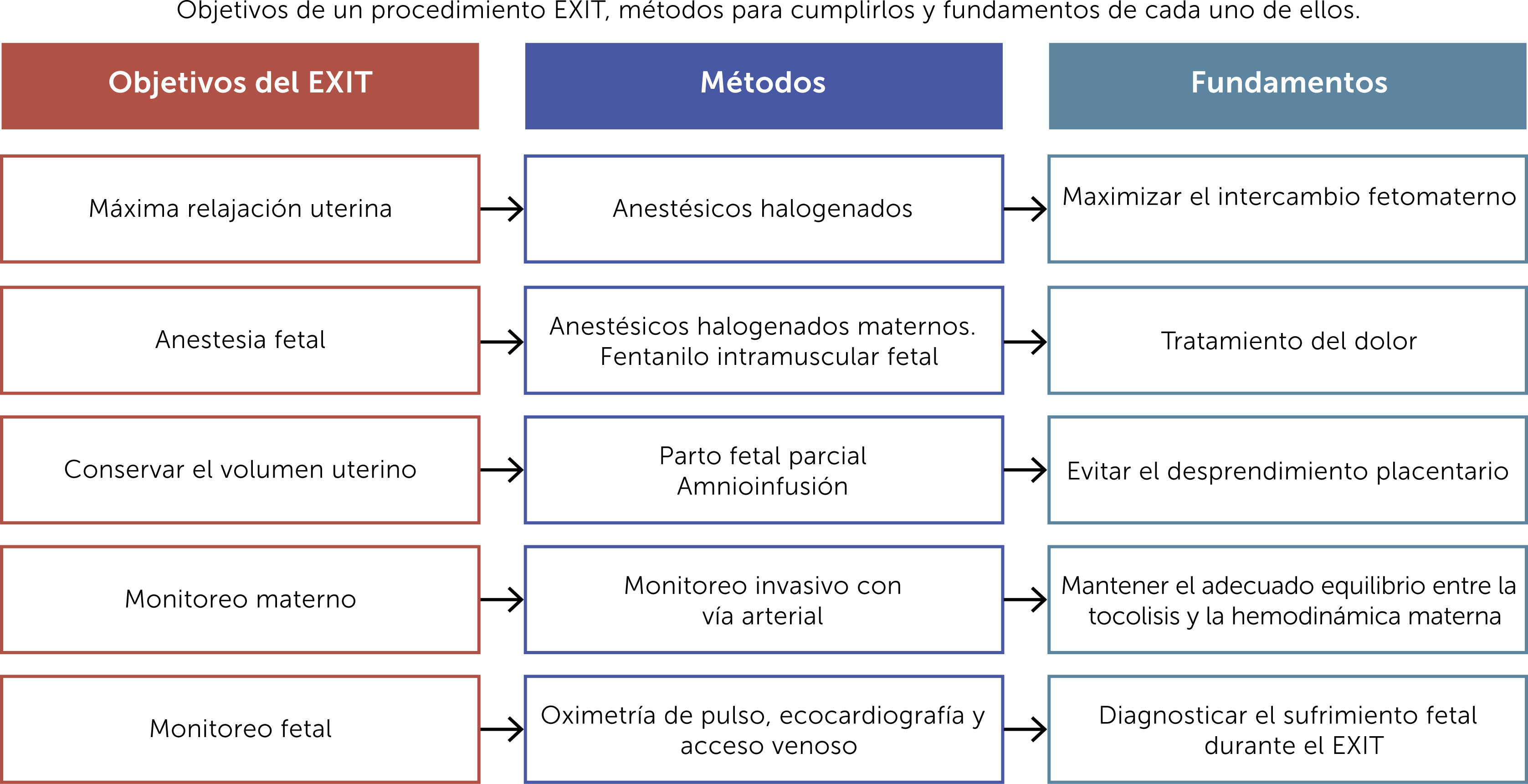
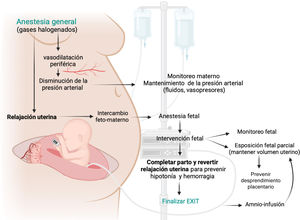
5Objetivos de un exitPreservar el intercambio gaseoso uteroplacentario durante un procedimiento EXIT requiere mucho más que mantener intacto el cordón umbilical1. Los siguientes objetivos representan los principios y fundamentos de cualquier subtipo de EXIT (Fig. 1):
-Proveer máxima y controlada relajación uterina, utilizando anestesia general profunda, para promover la vasodilatación uterina, mantener el intercambio feto-materno y asegurar la adecuada oxigenación fetal. La frecuencia cardíaca fetal y el tono uterino son marcadores útiles del efecto tocolítico3.
-Mantener adecuada anestesia fetal. La profundidad y el nivel de anestesia fetal requerido dependerá de la complejidad de la intervención fetal. Los anestésicos inhalatorios maternos, al cruzar la circulación uteroplacentaria, representan la principal fuente de anestesia fetal. Sin embargo, en procedimientos que puedan ocasionar dolor en el feto, la analgesia deberá respaldarse con un cóctel anestésico-analgésico (fentanilo, vecuronio y atropina) por vía intramuscular fetal28.
-Conservar el volumen uterino para evitar el desprendimiento placentario. El parto fetal parcial con mínima exposición (usualmente cabeza y ambos brazos) y el uso de amnioinfusión intermitente son maniobras críticas para mantener el volumen uterino y prevenir el desprendimiento placentario. Estas maniobras también minimizan la pérdida de calor fetal y el riesgo de compresión del cordón umbilical y por tanto ayudan a mantener la estabilidad del feto durante la intervención1,29.
-Monitoreo y mantenimiento de la presión arterial materna. La relajación uterina, que per-se genera hipotensión materna, debe equilibrarse cuidadosamente con la administración de fluidos y agentes vasoactivos para mantener la estabilidad hemodinámica materna y la adecuada perfusión uteroplacentaria29.
-Monitoreo fetal. El bienestar fetal puede afectarse por numerosos factores durante un EXIT, como son la insuficiente relajación placentaria, la compresión del cordón, el inadecuado manejo del dolor, el desprendimiento placentario, entre otros. El monitoreo fetal, mediante ecocardiografía fetal continua y un pulsioxímetro, permite detectar estas complicaciones y corregirlas antes de que generen secuelas en el feto1.
-Revertir oportunamente la relajación uterina. Una vez finalizada la intervención fetal, el equipo debe completar el parto y rápidamente revertir la relajación uterina. Esta coordinación es clave para prevenir la hemorragia uterina que acompaña al desprendimiento de placenta de un útero relajado29,30.
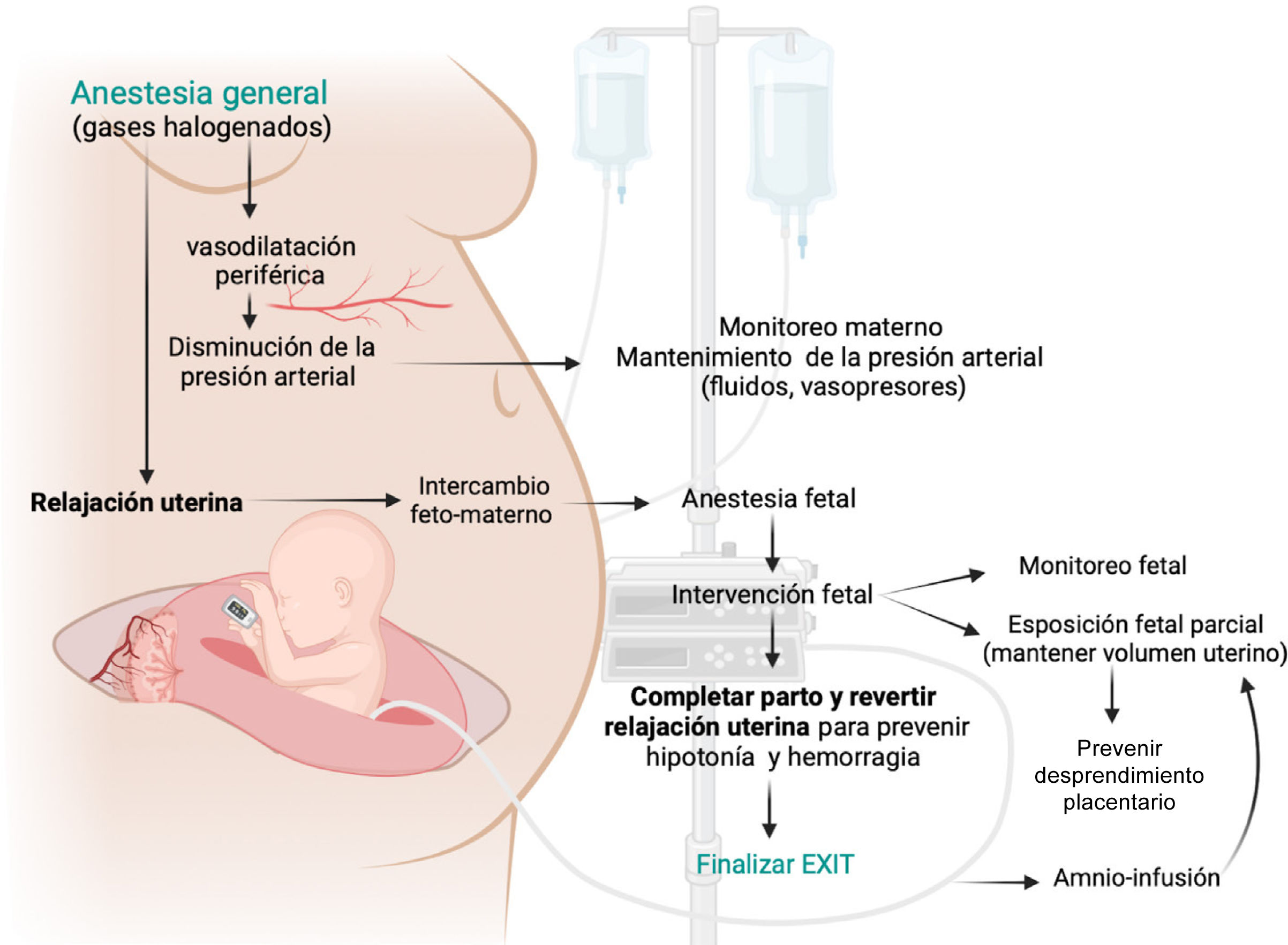
6Consideraciones anestésicasEl equipo de anestesia juega un papel esencial durante un EXIT. Las características únicas de este procedimiento, en el cual se brinda atención tanto a la madre como al feto, requiere la participación de anestesiólogos que estén familiarizados con el protocolo y la fisiología materno-fetal. Si bien la combinación de fármacos utilizados durante la inducción y el mantenimiento de la anestesia puede variar, la utilización de agentes inhalatorios para alcanzar un plano profundo de anestesia general junto con una adecuada relajación uterina es uno de los estándares de este procedimiento31,32. Los anestésicos inhalatorios halogenados proveen tres componentes esenciales al EXIT (Fig. 2): Anestesia materna, relajación uterina (para asegurar la perfusión placentaria y la oxigenación fetal) y anestesia fetal. Si se necesita relajación uterina adicional, se pueden utilizar nitratos (nitroglicerina) o agonistas beta-adrenérgicos (terbutalina). Como se mencionó anteriormente, el protocolo de relajación uterina debe equilibrarse adecuadamente con la necesidad de fluidos y vasopresores para preservar la estabilidad hemodinámica materna y también la presión de perfusión uterina. Este delicado equilibrio, que posee poco margen de error, busca satisfacer las necesidades fisiológicas dentro de un ambiente seguro para la madre y el feto31.
El monitoreo hemodinámico materno debe ser invasivo, utilizando una vía arterial. El manejo del dolor incluye la colocación de un catéter epidural. La inducción anestésica se inicia con una secuencia rápida utilizando propofol intravenoso y un relajante muscular como succinilcolina (o rocuronio) seguido de intubación endotraqueal. La fase de mantenimiento se logra utilizando un anestésico inhalatorio (desflurano) titulado según el tono uterino (evaluado por palpación directa). El desflurano se utiliza con preferencia debido a su capacidad para ser titulado rápidamente. Frecuentemente, los niveles requeridos de anestesia general producen hipotensión materna. La administración de vasopresores y fluidos debe garantizarse para mantener una presión arterial media materna >60mmHg, o dentro del 20% de la presión arterial basal de la paciente33.
La anestesia fetal se logra mediante el pasaje transplacentario de inhalatorios y la administración intramuscular fetal de fentanilo (20μg/kg), atropina (20μg/kg) y vecuronio (0,2mg/kg). Este cóctel debe administrarse antes de cualquier incisión en el feto y puede repetirse cada hora de intervención si se requiere. El monitoreo fetal es necesario para comprobar el bienestar fetal y garantizar el suficiente intercambio gaseoso uteroplacentario. Esto se puede lograr mediante un pulsioxímetro colocado en la mano fetal y una ecocardiografía fetal continua. La bradicardia fetal y la disfunción miocárdica del feto no son eventos infrecuentes durante un EXIT. La colocación de un acceso vascular fetal se recomienda para abordar cualquier complicación y eventualmente poder administrar fluidos, hemoderivados o drogas vasoactivas durante el EXIT34. Fármacos como la epinefrina y atropina deben estar disponibles en el campo quirúrgico. La obtención de gases en sangre de cordón puede ser un buen recurso para guiar la terapia de un feto en distrés. Si bien la saturación arterial fetal es 60-70%, valores mayores a 40% representan suficiente oxigenación. La compresión del cordón tiene que sospecharse siempre que el feto se muestre inestable, y puede corregirse reposicionando al feto y administrando mayor amnioinfusión.
La última fase del manejo anestésico comienza con el pinzamiento del cordón, donde revertir la relajación uterina es crítico para prevenir la complicación más temida: la atonía uterina y la consecuente hemorragia postparto30. Esto puede lograrse con la administración de uterotónicos como la oxitocina, agregando metilergonovina, carboprost o misoprostol según necesidad.
7Aspectos técnicosMantener el manejo multidisciplinario es fundamental al momento de realizar el procedimiento EXIT35. Anestesiólogos, obstetras, especialistas en medicina materno fetal, neonatólogos, cirujanos fetales, instrumentistas quirúrgicos y un cardiólogo fetal son esenciales durante este procedimiento.
Antes de iniciar la intervención, se recomienda colocar a la madre en decúbito intermedio lateral izquierdo utilizando un realce para evitar la compresión de la vena cava inferior y maximizar el retorno venoso36. Antes de proceder a la histerotomía, se debe realizar una ecografía para confirmar la posición fetal (para minimizar la manipulación una vez que el útero está abierto) y marcar los márgenes placentarios (para evitar lesiones y hemorragias)37,38. Si el feto se encuentra en posición podálica, se puede realizar una versión cefálica externa si se requiere39. Es importante tener en cuenta que el polihidramnios severo puede aplanar la placenta impidiendo la visualización ecográfica de sus bordes. Una amnioreducción previa a la histerotomía suele ser adecuada para mejorar el mapeo y también para evitar la descompresión aguda del polihidramnios y el consiguiente riesgo de desprendimiento placentario38.
La incisión tipo Pfannenstiel suele ser apropiada. Sin embargo, ante una placenta anterior, puede ser necesaria una laparotomía mediana. Por lo tanto, el tipo de incisión dependerá del mapeo placentario, considerando que la adecuada exposición uterina es fundamental para tener buen control del procedimiento1. Idealmente, la histerotomía se realizará utilizando un dispositivo hemostático de grapado uterino (Premium Poly CS® stapler,
Covidien. MN, USA). Si no estuviera disponible, se puede realizar con un sellador tisular o utilizando suturas hemostáticas en los bordes de la histerotomía.
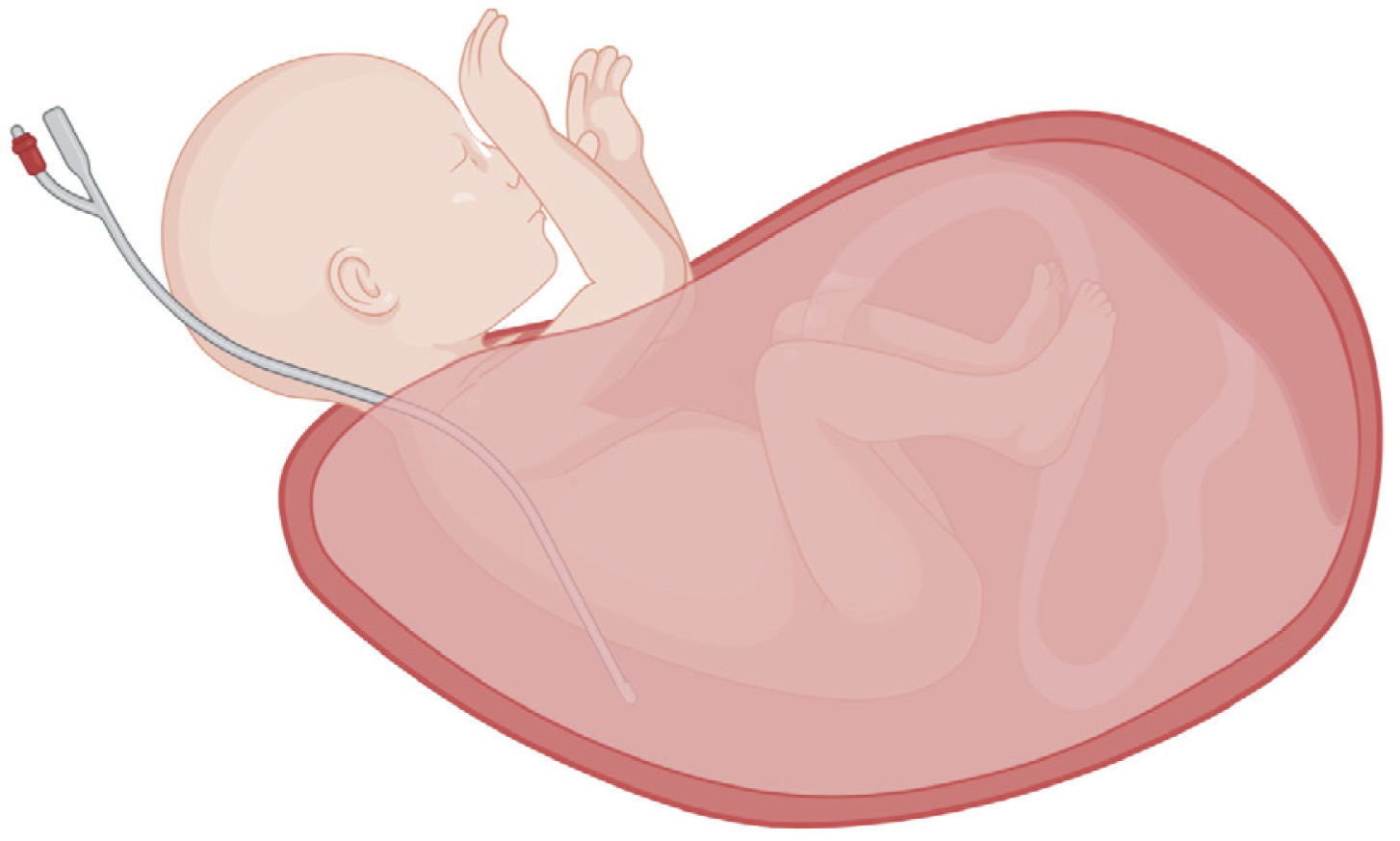
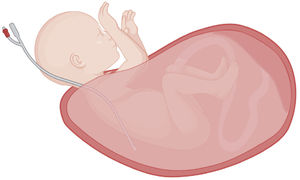
La exposición fetal debe ser sólo la indispensable para lograr la maniobrabilidad del procedimiento, a fin de minimizar la pérdida de calor fetal, mantener el volumen uterino y disminuir el riesgo de compresión del cordón umbilical40 (Fig. 3). Normalmente se expone la cabeza y ambos brazos, manteniendo el borde uterino a nivel de las axilas fetales. Un catéter tipo Foley colocado en la cavidad uterina junto al tórax fetal permitirá la infusión de una solución cristaloide a temperatura corporal.
Exposición fetal necesaria para un EXIT. La exposición del feto durante un EXIT debe ser sólo la indispensable para lograr la maniobrabilidad del procedimiento. El presente diagrama representa la exteriorización de un feto desde la cavidad uterina, con exposición de la cabeza, el cuello y ambos brazos, por ejemplo, para el control de la vía aérea superior. El parto parcial del feto, junto con la colocación de una sonda intrauterina de amnioinfusión paralela al tórax, contribuyen a mantener el volumen uterino y a reducir la pérdida de calor y el riesgo de compresión del cordón. Creado con software BioRender.
Numerosos estudios destacan el acceso trans-uterino como el modo de parto más adecuado para realizar un procedimiento con soporte placentario22 El parto por cesárea permite acompañar el procedimiento de una tocólisis profunda, lo cual posibilita realizar intervenciones más prolongadas y predecibles en tiempo, al postergar el desprendimiento placentario de manera deliberada y controlada. Esta versatilidad de tiempo que brinda este acceso en EXIT es extremadamente importante, ya que la valoración prenatal nos permite predecir con ciertas limitaciones el grado de complejidad de la intervención necesaria en soporte placentario. En este escenario, es importante tener en cuenta que el parto vaginal en soporte placentario no incluye tocólisis, y por tanto el tiempo para realizar un procedimiento, una vez que el área a intervenir sobrepasa el periné, es extremadamente limitado y poco ergonómico. En consecuencia, esta vía de parto debe reservarse para intervenciones cortas, sencillas y predecibles, teniendo en cuenta el riesgo de transfusión feto-placentaria y el momento impredecible del desprendimiento de la placenta.
9Grados de soporte placentarioEl EXIT constituye el máximo nivel de soporte placentario, al incorporar la relajación uterina y con ello promover la vasodilatación y la perfusión feto-placentaria41. De esta manera, este procedimiento permite realizar intervenciones fetales complejas y relativamente prolongadas, en un ambiente de máximo control sobre la fisiología del parto. De modo diferente, una intervención en soporte placentario sin tocólisis, es decir, retrasando el pinzamiento del cordón, pero sin potenciar la perfusión feto-placentaria, se denomina “operación en soporte placentario” - OOPS (operation on placental support) o POPS (procedure on placental support). Esta estrategia, no interfiere en la fisiología de las contracciones uterinas, por lo tanto, es menos invasiva, pero también menos controlada y menos predecible, ya que las contracciones derivan inevitablemente en el desprendimiento de la placenta y la finalización del procedimiento. Esto hace que un OOPS sea sólo adecuado para intervenciones breves (1-20 minutos según el reporte de algunos autores22,42), lo cual es muchas veces difícil de asegurar. El OOPS puede realizarse por cesárea o por vía vaginal (VDPS - vaginal delivery on placental support), representando este último, el mínimo grado de soporte placentario, por la casi nula versatilidad de tiempo y maniobrabilidad que brinda.
El nivel de soporte placentario necesario para cada paciente debe analizarse caso por caso en la etapa prenatal. Esta elección debe realizarse teniendo en cuenta que el EXIT brinda tiempo valioso de intervención y constituye el mayor nivel de control sobre la fisiología feto-materna. Por tanto, este último debe considerarse siempre que el procedimiento pueda potencialmente superar la complejidad de una intubación endotraqueal1,22,43.
10ComplicacionesA pesar de los numerosos beneficios del EXIT, existen ciertos riesgos maternos y feto-neonatales que deben considerarse e incluirse en el proceso de consentimiento informado.
Hemorragia materna: Una vez iniciado el EXIT, el principal riesgo materno es la hemorragia intraparto (por desprendimiento de la placenta) o postparto (por atonía uterina inducida por anestésicos inhalatorios)44. Algunos grupos reportan un promedio de pérdida hemática materna de 800ml (500-2000ml) y tasas de transfusión del 13-23%45,46. Para reducir este riesgo, es esencial una apertura uterina controlada y hemostática, mantener el volumen uterino a través del parto parcial del feto y la amnioinfusión, mapear adecuadamente los márgenes placentarios antes de la histerotomía, y lograr una adecuada coordinación entre el equipo quirúrgico y el anestésico para rápidamente revertir la relajación uterina una vez finalizada la intervención. Disponer de un plan de contingencia es crítico en la preparación de un EXIT. La disponibilidad de sangre compatible y fármacos uterotónicos en quirófano, y la preparación para realizar un taponamiento intrauterino, colocar suturas de compresión uterina, finalizar prematuramente el EXIT o en situaciones extremas, realizar una histerectomía de emergencia, constituyen estrategias fundamentales para combatir esta emergencia29.
Complicaciones de la herida materna e infecciones: La incidencia de endometritis y de complicaciones de la herida, como la infección, o la dehiscencia uterina en futuros embarazos, es ligeramente mayor en un EXIT comparado con lo reportado para una cesárea47,48
Lesión fetal hipóxico-isquémica: La complicación más importante del feto en EXIT es la lesión hipóxico-isquémica. El principal mecanismo es la inadecuada relajación uterina y el subsiguiente compromiso del intercambio útero-placentario49,50. El desprendimiento placentario y la compresión del cordón durante el procedimiento también pueden provocar una mala perfusión fetal. El espectro de compromiso fetal es amplio y va desde la bradicardia durante el procedimiento, la lesión cerebral hipóxica hasta la muerte. La monitorización fetal durante el EXIT permite reconocer el sufrimiento fetal y actuar en consecuencia13,44.
11ConclusionesEl procedimiento EXIT es una estrategia de parto desarrollada para transformar una emergencia neonatal potencialmente fatal en un ambiente clínico controlado. Aunque un EXIT podría interpretarse erróneamente como una cesárea, estos procedimientos son opuestos por concepto. En una cesárea buscamos una contractilidad uterina eficaz y un feto despierto y activo, respetando la fisiología del parto. Por el contrario, el EXIT es un parto sumamente intervenido, en un entorno de anestesia fetal profunda y relajación uterina máxima para mantener la circulación placentaria durante períodos potencialmente prolongados.
El aspecto más importante de cualquier procedimiento en soporte placentario es consolidar un equipo multidisciplinario altamente capacitado y bien coordinado, capaz de brindar atención de alta calidad al binomio materno-fetal a lo largo del embarazo y el parto. La planificación preoperatoria exhaustiva es un componente crítico para un EXIT exitoso. A lo largo de nuestra experiencia, hemos reforzado el concepto de que la mejor manera de prepararse para un EXIT es considerando el peor escenario clínico y quirúrgico para asegurarnos que el equipo esté listo para cualquier contingencia. Como un EXIT requiere un alto nivel de coordinación del equipo y muchas de las condiciones que requieren de esta estrategia se asocian con mayor incidencia de parto prematuro de emergencia44, creemos que cualquier estrategia que facilite la organización, como las simulaciones, los checklist, los protocolos y las cadenas telefónicas para la activación del equipo de EXIT de emergencia pueden ser de suma importancia para lograr los mejores resultados clínicos posibles.
Declaración de conflicto de interésLos autores declaran no tener conflictos de interés.