Los sujetos con infección por Virus de inmunodeficiencia humana (VIH) tienen mayor susceptibilidad de adquirir infecciones por su deterioro inmunológico. Según el deterioro inmunológico y el uso de terapia antiretroviral (TARV) en niños y adultos VIH (+), la intensidad de la respuesta inmune a las vacunas es menor que la población general. Por este motivo es preferible administrar vacunas una vez que la TARV haya permitido la inmunoreconstitución, y se recomiendan dosis de refuerzo. Por otra parte, las vacunas vivas atenuadas deben ser usadas con precaución, y están contraindicadas en inmunosupresión severa.
Patients with Human Immunodeficiency Virus (HIV) are more susceptible to acquiring infections due to their immune deterioration. The intensity of the immune response to vaccines is lower than general population, depending on immune status and the use of antiretroviral therapy (ARV). For this reason, it is preferable to administer vaccines once ART has allowed immune reconstitution, and booster doses are recommended.
On the other hand, live vaccines should be used with caution, and are contraindicated in severe immunosuppression.
La infección por el virus de la inmunodeficiencia humana (VIH) es uno de los problemas de salud pública actuales más relevantes a nivel mundial. Afecta a personas de toda edad, pero presenta una mayor frecuencia en individuos jóvenes. Según ONUSIDA, el año 2018 vivían en el mundo cerca de 38 millones de infectados, de los cuales 1,7 millones correspondían a menores de 15 años1. La infección por VIH se puede adquirir a lo largo de la vida de forma vertical (desde una madre infectada a su hijo durante la gestación, periparto o por lactancia materna), vía sexual (sexo anal o vaginal sin protección, y menos frecuente sexo oral), o por vía sanguínea (compartir jeringas, trasplante de tejidos u órganos, accidentes cortopunzantes). En adultos la forma más frecuente de adquisición del VIH es la vía sexual, y en niños, la transmisión vertical (TV)2-4.
En Chile, hay 71.000 personas viviendo con VIH, con una tasa global de 0,5% en la población general, sin embargo, aproximadamente un 80% de los casos se concentran en poblaciones específicas de riesgo, como los hombres que tienen sexo con hombres, trabajadores sexuales y personas transgénero, con un alza constante de nuevos casos anuales durante la última década, alcanzando hasta 6.948 casos durante el año 2018, de los cuales un 37% correspondieron a extranjeros1,5. En nuestro país, desde 1987 a diciembre de 2019 se han diagnosticado 460 casos de VIH pediátrico, siendo más del 90% de ellos por TV6.
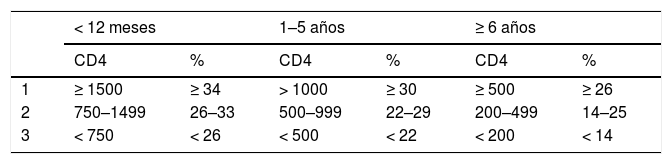
La principal alteración inmunológica que ocurre en los pacientes infectados es la depleción de linfocitos T ayudadores (LT CD4+) sistémicos y en sistema linfoide, principalmente en mucosa gastrointestinal, determinando translocación bacteriana a la circulación, y la activación crónica del sistema inmune, que se traduce en una desregulación inmunológica y un estado de inmunodeficiencia, por mecanismos no conocidos en su totalidad7. En el caso de los niños, inicialmente presentan una hiper-gammaglobulinemia policlonal inespecífica, con disminución de anticuerpos específicos contra infecciones, por menor traspaso materno de IgG, y son incapaces de producir inmunoglobulinas distintas de la IgM debido a la falta de LT CD4+, por lo que se comportan como hipo-gammaglobulinémicos o agammaglobulinémicos funcionales. Además, en los países desarrollados, los hijos de madre VIH (+) no reciben lactancia materna, disminuyendo también la inmunidad pasiva dada por ella8,9. Es importante recordar que los niños tienen recuentos de LT CD4+ normalmente más altos que los adultos, por esto las etapas inmunológicas según el recuento y porcentaje de LT CD4+ es distinto en niños menores de 1 año, niños entre 1 y 5 años, y niños mayores de 6 años10 (Tabla 1).
Etapas inmunológicas VIH basadas en LT CD4+ según edad establecidas por CDC
| < 12 meses | 1–5 años | ≥ 6 años | ||||
|---|---|---|---|---|---|---|
| CD4 | % | CD4 | % | CD4 | % | |
| 1 | ≥ 1500 | ≥ 34 | > 1000 | ≥ 30 | ≥ 500 | ≥ 26 |
| 2 | 750–1499 | 26–33 | 500–999 | 22–29 | 200–499 | 14–25 |
| 3 | < 750 | < 26 | < 500 | < 22 | < 200 | < 14 |
CDC: Centers for Disease Control and Prevention, VIH: virus de la inmunodeficiencia adquirida.
Adaptado de “Revised Surveillance Case Definition for HIV Infection- United States 2014. MMWR 2014;63(RR-03): 1-10. PMID: 24717910.
De no mediar una terapia anti-retroviral (TARV) oportuna y eficiente, y una adecuada adherencia a la misma, al cabo de tiempos variables la infección por VIH se traducirá en un deterioro inmunológico progresivo que afecta tanto a la inmunidad celular como a la humoral, objetivándose en la disminución de los LT CD4+, lo que se relaciona inversamente con la carga viral (CV) de VIH en sangre y con un mayor riesgo de infecciones oportunistas y neoplasias. La TARV produce mejoría de la inmunosupresión, primariamente a través de la generación de linfocitos T naive, más que la expansión de LT de memoria, como sucede en los adultos, pero no logra corregir el daño en las respuestas de las células B de memoria, y disminución vida media de células plasmáticas11,12.
Estos factores explican el marcado aumento del riesgo en pacientes con VIH a infecciones por Streptococcus pneumoniae, Haemophilus influenzae tipo b, Neisseria meningitidis, Salmonella typhi, virus influenza, varicela, hepatitis A o progresión acelerada en infecciones por virus de hepatitis B (VHB), hepatitis C, virus papiloma humano (VPH), y la reactivación del virus varicela-zoster (VVZ)13-18, incluso estando en TARV. Como estrategias preventivas, es necesario implementar el acceso universal a TARV, cambios conductuales (tabaquismo, sexo seguro, entre otros), uso de profilaxis especificas según recuento de LT CD4+, y la administración de vacunas para control de enfermedades inmunoprevenibles.
CONCEPTOS GENERALES DE RESPUESTA INMUNE A VACUNAS Y SU SEGURIDAD EN VIH/SIDALa respuesta a vacunas en pacientes con VIH es defectuosa, menor y de más corta duración que en el inmunocompetente. Algunos estudios han demostrado una menor protección a largo plazo8,9, incluso en niños con máxima supresión de CV de VIH y con LT CD4+ normales. Estas interpretaciones han sido hechas en base a niveles de anticuerpos, lo cual debe ser analizado con cautela, ya que existen controversias respecto de los correlatos de protección utilizados y del rol que la inmunidad celular tendría en infecciones específicas. A pesar de esto, es preferible la protección parcial versus la ausencia de protección, ya que la efectividad e impacto de las estrategias vacunales en esta población previenen un alto número de eventos y costos asociados a su manejo, por lo que se debe ser cauto y flexible para establecer recomendaciones19.
Los pacientes con VIH que son vacunados estando en TARV generalmente montan una adecuada respuesta de anticuerpos, aunque de menor intensidad que los no infectados, por lo que se recomiendan dosis de refuerzo después de iniciada. La TARV no permite reestablecer la inmunidad a las vacunas que se recibieron previo a su incorporación. Si el paciente comenzó a vacunarse durante fases de inmunodepresión severa, se desconoce cuál es el momento óptimo para iniciar la revacunación después de iniciada la TARV, pero es recomendable llevarla a cabo a los 6 meses de la normalización de las cifras de LT CD4+, para dar tiempo a que se recupere la función inmunológica, y cuando se haya conseguido la supresión virológica. Dado que los hijos de madre con VIH que se infectan inician TARV precozmente, es probable que mantengan una inmunidad funcional que les permita responder de mejor forma a las vacunas, en comparación con aquellos de diagnóstico más tardío9.
Ha existido incertidumbre si la activación inmune provocada por las vacunas podría acelerar la progresión de la infección por VIH, al producir un aumento de la CV y eventual riesgo de progresión del deterioro inmunológico. El fundamento de esto es que los estímulos antigénicos a los LT CD4+ facilitaría la replicación viral. Estudios con vacuna antigripal mostraron aumento transitorio de la viremia por 6-8 semanas, con posterior retorno a su basal20. Sin embargo, estudios actuales con TARV no han demostrado ningún descenso en cifras de LT CD4+ ni que faciliten progresión a SIDA, ni otros resultados adversos. En general, se considera que los beneficios de la vacunación sobrepasan los riesgos de una eventual viremia post vacuna19.
Las vacunas inactivadas han demostrado un perfil de seguridad adecuado en estos pacientes, por lo que no están contraindicadas, aunque su respuesta inmune pueda ser inadecuada en la enfermedad avanzada, lo que se podría optimizar vacunando en etapas precoces de la infección por VIH o después de la supresión virológica y la reconstitución inmune con TARV, según el recuento de LT CD4+20. La seguridad de las vacunas en niños con VIH se ha reportado en varios estudios, sin describirse mayor número de reacciones serias con vacunas contra difteria, tétanos, pertussis, hepatitis A, hepatitis B, influenza o neumocócicas en comparación con el resto de la población19,21. Las vacunas vivas atenuadas, formalmente contraindicadas en pacientes con recuentos de LT CD4+ <200 cel/mm3 en adultos ó <15% en niños, poseen una información creciente que permite evaluar su riesgo beneficio de manera individual y en general pueden indicarse con recuentos de LT CD4+ superiores a 200 o 350 cel/mm3. Aunque la eficacia de la vacuna generalmente se vea comprometida, los beneficios de administrar vacunas superan los riesgos19,21 (Tabla 2).
Indicación de vacunas en pacientes con VIH/SIDA, según su estado clínico e inmunológico
| Vacunas | Etapas clínicas N, A y B | Etapa clínica C (SIDA) | ||||
|---|---|---|---|---|---|---|
| Etapa inmunológica | Etapa inmunológica | |||||
| 1 | 2 | 3 | 1 | 2 | 3 | |
| Inactivadas | Si | Si | Sib | Si | Si | Sib |
| Sarampión/Rubéola/Parotiditis | Si | Sia | No | No | No | No |
| Varicela/Herpes Zoster | Si | Sia | No | No | No | No |
| Fiebre Amarilla | Si | Si | No | No | No | No |
Etapas clínicas: N: asintomático; A: síntomas leves; B: síntomas moderados (excepto neumonitis intersticial linfoide); C: síntomas graves (SIDA).
Etapas inmunológicas: 1. Sin inmunosupresión; 2: inmunosupresión moderada; 3: inmunosupresión grave.
Adaptado de: Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo 2018; Programa Nacional de Inmunizaciones, Ministerio de Salud, Gobierno de Chile, Disponible en https://vacunas.minsal.cl/wp-content/uploads/2019/02/MANUAL-VACUNAS-ESPECIALES.pdf.
Por este motivo, debemos procurar mantener el calendario de vacunas actualizado y complementado, evitando el retraso en esquemas de vacunación y poniéndolo al día lo antes posible, incluyendo a sus contactos cercanos, con estrategias basadas en el individuo. Para llevar a cabo esto debemos conocer y considerar los intervalos entre las vacunas, los esquemas acelerados, la solicitud de vacunas especiales, las aprobaciones vigentes y, finalmente, sus contraindicaciones19,20,22. En este aspecto las guías internacionales difieren en sus recomendaciones de dosis o de intervalo en los refuerzos para algunas vacunas, por lo que este artículo se centrará en las recomendaciones emitidas desde nuestro Programa Nacional de Inmunizaciones (PNI) en sus Recomendaciones para la vacunación de pacientes con necesidades especiales por patologías o situaciones de riesgo, las cuales consideran tres escenarios asociados a VIH/SIDA que tienen indicaciones particulares, como lo son pacientes pediátricos con infección por VIH/SIDA; hijos de madre con infección por VIH, expuestos al contagio durante el embarazo; y adolescentes y adultos infectados con VIH22, los que detallaremos brevemente en este manuscrito. Dado que algunos casos de pacientes nacidos fuera de Chile pudieran tener esquemas de vacunación incompletos o no verificables, se recomienda actualizar sus inmunizaciones acordes a recomendaciones ministeriales vigentes.
I. RECOMENDACIONES EN HIJO DE MADRE SEROPOSITIVA VIH, NO INFECTADOSLos hijos de madre VIH (+) con protocolo de prevención de TV completo tiene menos de 2% de riesgo de adquirir la infección. Sin embargo, recién a los 3-4 meses de vida se sabrá si se infectaron o no, con el resultado de la tercera reacción de polimerasa en cadena para detectar el VIH que se les solicita a los 3 meses de vida de acuerdo con la norma ministerial chilena23. Por lo tanto, al nacer aún no se sabe su estatus VIH. Por otra parte, estudios han demostrado que los hijos de madre VIH expuestos no infectados también tienen alteraciones inmunológicas, probablemente por la exposición in útero al mismo virus, a la TARV, a un menor traspaso materno de inmunoglobulinas, a que se les contraindica la lactancia materna, y a cambios en su microbiota, entre otros24. Por esto, pese a no estar infectados con VIH, tienen mayor susceptibilidad a infecciones que un niño no expuesto al VIH25.
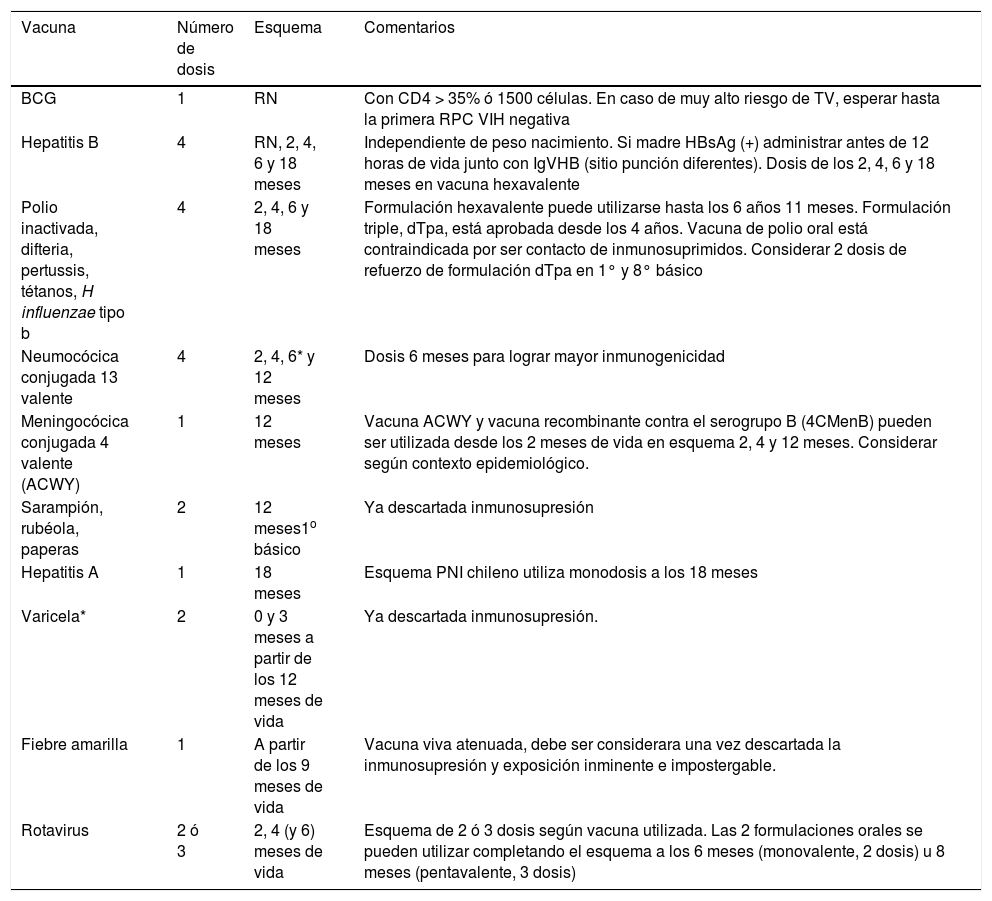
Las recomendaciones de vacunación para los hijos de madre VIH no infectados incluyen a todas las vacunas rutinarias incorporadas al PNI, excepto consideraciones con BCG, además de incorporar vacunas complementarias (Tabla 3).
Vacunas recomendadas en Hijos de Madre VIH, no infectados
| Vacuna | Número de dosis | Esquema | Comentarios |
|---|---|---|---|
| BCG | 1 | RN | Con CD4 > 35% ó 1500 células. En caso de muy alto riesgo de TV, esperar hasta la primera RPC VIH negativa |
| Hepatitis B | 4 | RN, 2, 4, 6 y 18 meses | Independiente de peso nacimiento. Si madre HBsAg (+) administrar antes de 12 horas de vida junto con IgVHB (sitio punción diferentes). Dosis de los 2, 4, 6 y 18 meses en vacuna hexavalente |
| Polio inactivada, difteria, pertussis, tétanos, H influenzae tipo b | 4 | 2, 4, 6 y 18 meses | Formulación hexavalente puede utilizarse hasta los 6 años 11 meses. Formulación triple, dTpa, está aprobada desde los 4 años. Vacuna de polio oral está contraindicada por ser contacto de inmunosuprimidos. Considerar 2 dosis de refuerzo de formulación dTpa en 1° y 8° básico |
| Neumocócica conjugada 13 valente | 4 | 2, 4, 6* y 12 meses | Dosis 6 meses para lograr mayor inmunogenicidad |
| Meningocócica conjugada 4 valente (ACWY) | 1 | 12 meses | Vacuna ACWY y vacuna recombinante contra el serogrupo B (4CMenB) pueden ser utilizada desde los 2 meses de vida en esquema 2, 4 y 12 meses. Considerar según contexto epidemiológico. |
| Sarampión, rubéola, paperas | 2 | 12 meses1o básico | Ya descartada inmunosupresión |
| Hepatitis A | 1 | 18 meses | Esquema PNI chileno utiliza monodosis a los 18 meses |
| Varicela* | 2 | 0 y 3 meses a partir de los 12 meses de vida | Ya descartada inmunosupresión. |
| Fiebre amarilla | 1 | A partir de los 9 meses de vida | Vacuna viva atenuada, debe ser considerara una vez descartada la inmunosupresión y exposición inminente e impostergable. |
| Rotavirus | 2 ó 3 | 2, 4 (y 6) meses de vida | Esquema de 2 ó 3 dosis según vacuna utilizada. Las 2 formulaciones orales se pueden utilizar completando el esquema a los 6 meses (monovalente, 2 dosis) u 8 meses (pentavalente, 3 dosis) |
VIH: virus de la inmunodeficiencia humana; RPC: reacción de polimerasa en cadena.
1. Vacuna BCG: La vacuna BCG, al ser una vacuna viva atenuada, está contraindicada en inmunosupresión26. La recomendación de la OMS y de la norma chilena es que se puede administrar la vacuna si el recién nacido (RN) tiene un recuento de LT CD4+ >35% o 1500 cel/mm3. Es preferible considerar el recuento absoluto >1500 cel/mm3 que el porcentaje, ya que RN puede tener leucopenia (dando un porcentaje normal de CD4). Se sugiere diferir en caso de protocolo de prevención de TV incompleto, o madre diagnosticada al parto, considerando eventual riesgo de diseminación de BCG en caso de que el niño estuviera infectado y con posibilidad de progresar a SIDA22,23,27,28. Cada país debe evaluar, según su contexto epidemiológico, el eventual riesgo de diseminación BCG versus riesgo de formas diseminadas de tuberculosis27.
2. Vacuna hepatitis B: La seroprevalencia de hepatitis B en población VIH es mayor que la población general, compartiendo la forma de TV. En Chile, todas las gestantes con VIH o con factores de riesgo son estudiadas con antígeno de superficie (HBsAg). En la situación de que la madre tenga positivo el HBsAg, el RN debe recibir antes de 12 horas de vida la vacuna contra la hepatitis B e inmunoglobulina específica anti VHB. Si la madre tiene HBsAg negativo, solo corresponde la vacuna rutinaria al RN, que se incorporó desde abril del 201929-31, y luego continuar con calendario PNI.
3. Vacuna Hexavalente: Vacuna inactivada contra polio, difteria, pertussis, tétanos, H influenzae tipo b y hepatitis B. La deben recibir en forma rutinaria de acuerdo con el PNI a los 2, 4, 6 y 18 meses. La inmunización con vacuna viva atenuada oral contra la polio (VPO) está contraindicada en hijos de madre seropositivas, ya que posee un período de excreción fecal prolongado, y eventual riesgo de poliomielitis paralítica por virus vacuna en el niño o terceras personas que conviven con el lactante y están infectados por VIH. En Chile, desde el año 2018 se utiliza vacuna polio inyectable inactiva (IPV) en todas sus dosis32.
4. Rotavirus: vacuna viva atenuada, de administración oral. No está incorporada en forma programática ni como solicitud especial en nuestro país. Hay escasa información sobre seguridad y eficacia de esta vacuna en lactantes con potencial inmunosupresión. Sin embargo, dado que la administración de la vacuna (a las 6-8 semanas de vida) es previo al diagnóstico de infección por VIH, y las cepas de rotavirus de la vacuna son considerablemente atenuadas, guías norteamericanas y europeas la recomiendan en niños expuestos (infectados o no) independiente del recuento de LT CD4+19,33,34.
5. Vacuna neumocócica: Se recomienda un esquema primario de 3 dosis, seguidas de una dosis de refuerzo de vacuna neumocócica conjugada (PCV), a los 2, 4, 6 y 12 meses de vida. El fundamento para agregar la vacuna de los 6 meses es por su menor nivel de anticuerpos maternos, y probable menor inmunogenicidad22,35,36.
6. Vacuna meningocócica: La vacuna tetravalente conjugada ACWY es inactivada y se debe recibir de acuerdo con calendario PNI a los 12 meses de edad. Según escenario epidemiológico, existen formulaciones conjugadas que pueden ser administradas desde las 6 semanas de vida, en esquema de 2 ó 3 + 122. La vacuna meningocócica recombinante contra serogrupo B, de 4 componentes (4CMenB), también es inactivada y se puede administrar desde los 2 meses de edad, en esquema de 2 + 1, a los 2, 4 y 12 meses. Desde el año de vida puede usarse en esquema de 2 dosis, separadas por 2 meses, sin tope de edad. No hay reportes de seguridad relevantes en pacientes con VIH, pero al ser una vacuna no infectiva, no tendría contraindicación37.
7. Vacuna sarampión, rubéola, parotiditis (trivírica): Vacuna viva atenuada, se administra a los 12 meses y en primero básico. No tiene contraindicación en este grupo, ya que no tiene excreción viral, y a la edad de la primera dosis habitualmente está aclarado el estatus VIH del lactante38.
8. Vacuna hepatitis A: Se recomienda administrar dosis rutinaria de vacuna Hepatitis A a los 18 meses22.
9. Varicela: Vacuna a virus vivo atenuado, recomendada de manera semejante a la de niños no expuestos a partir de los 12 meses de vida, sin embargo, desde el segundo semestre del 2020 será incorporada en nuestro PNI, con una dosis a los 18 meses. Es recomendable administrar dos dosis con un intervalo mínimo de 3 meses, considerando que están en contacto con familiares o terceras personas potencialmente inmunosuprimidas por VIH22,34.
10. Vacuna difteria, pertussis y tétanos (triple): Vacuna inactivada; se debe recibir en forma rutinaria de acuerdo con el PNI en primero y octavo básico.
11. Vacuna virus papiloma humano: Vacuna inactivada tetravalente, administrada en esquema de 2 dosis, separadas por 12 meses en cuarto y quinto básico.
12. Vacuna influenza: Deben recibirla anualmente a partir de los 6 meses de vida, acorde a los esquemas habituales recomendados. Todos los niños menores de 9 años que son vacunados por primera vez deben recibir dos dosis de vacuna, separadas por un intervalo de un mes. La dosis para niños de 6 a 35 meses es de 0,25ml, administrada por vía intramuscular, mientras que en los niños de 36 meses o más la dosis es de 0,5ml22.
13. Vacuna fiebre amarilla: Vacuna virus vivo atenuada, se puede utilizar desde los 9 meses de edad, ya descartada la infección vertical por VIH, si la exposición es inminente e impostergable39.
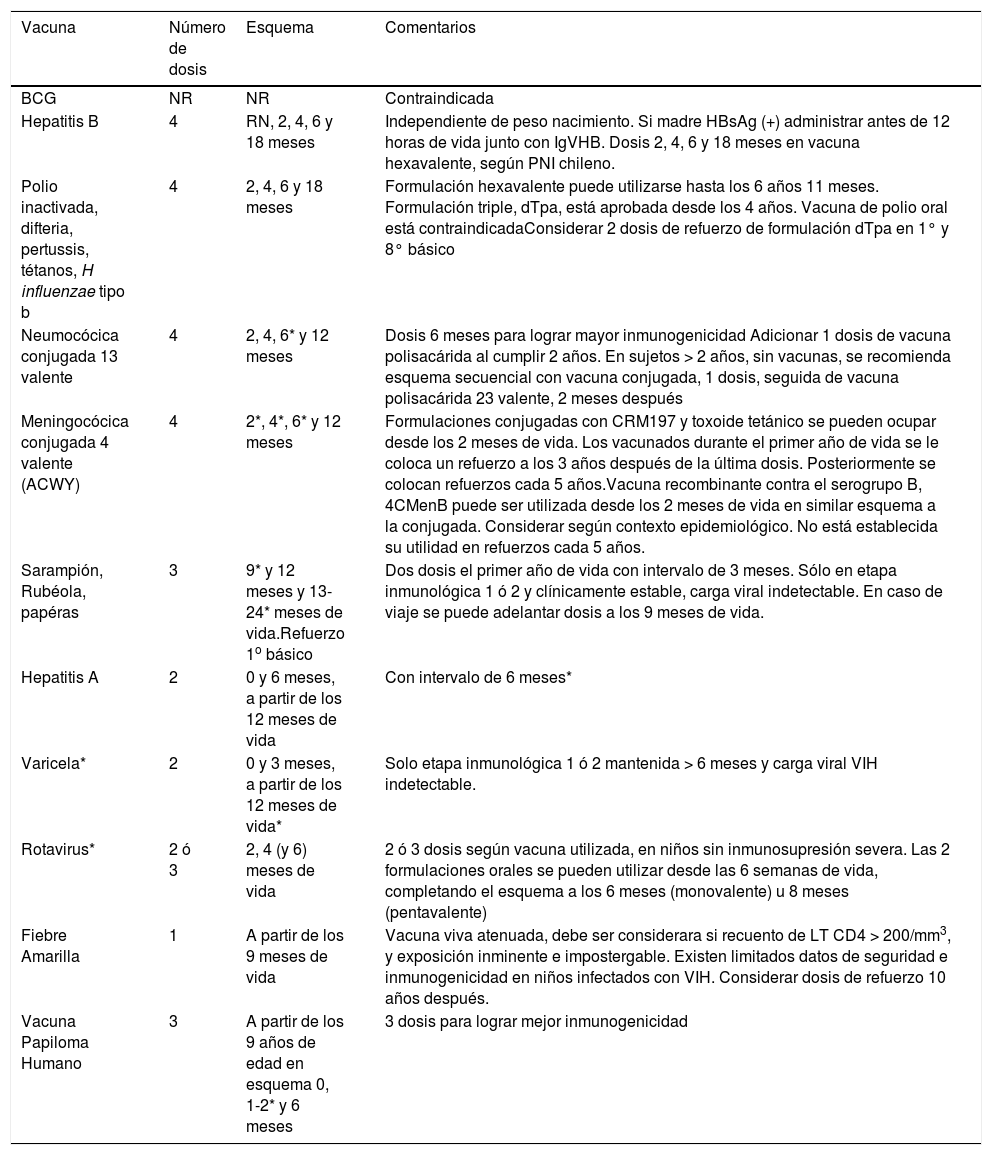
II. RECOMENDACIONES EN NIÑOS INFECTADOS POR VIHComo conceptos generales, niños con VIH pueden recibir las vacunas rutinarias en esquema y dosis habituales, con excepción de vacunas contra neumococo, rotavirus, trivírica, varicela e influenza, las cuales tienen consideraciones especiales para cada una, que se describirán posteriormente. La única vacuna contraindicada es BCG y antiguamente la vacuna VPO. Los niños infectados con VIH, que recibieron el esquema primario de vacunas antes de iniciar la TARV, pueden haber perdido la memoria inmunológica para algunas vacunas, por lo cual se recomiendan dosis de refuerzos, que se deben administrar cuando haya recuperación clínica y/o inmune, por al menos por 6 meses a opinión de los expertos, aunque el momento óptimo de revacunación no se ha establecido (Tabla 4).
Vacunas recomendadas en niños con VIH/SIDA
| Vacuna | Número de dosis | Esquema | Comentarios |
|---|---|---|---|
| BCG | NR | NR | Contraindicada |
| Hepatitis B | 4 | RN, 2, 4, 6 y 18 meses | Independiente de peso nacimiento. Si madre HBsAg (+) administrar antes de 12 horas de vida junto con IgVHB. Dosis 2, 4, 6 y 18 meses en vacuna hexavalente, según PNI chileno. |
| Polio inactivada, difteria, pertussis, tétanos, H influenzae tipo b | 4 | 2, 4, 6 y 18 meses | Formulación hexavalente puede utilizarse hasta los 6 años 11 meses. Formulación triple, dTpa, está aprobada desde los 4 años. Vacuna de polio oral está contraindicadaConsiderar 2 dosis de refuerzo de formulación dTpa en 1° y 8° básico |
| Neumocócica conjugada 13 valente | 4 | 2, 4, 6* y 12 meses | Dosis 6 meses para lograr mayor inmunogenicidad Adicionar 1 dosis de vacuna polisacárida al cumplir 2 años. En sujetos > 2 años, sin vacunas, se recomienda esquema secuencial con vacuna conjugada, 1 dosis, seguida de vacuna polisacárida 23 valente, 2 meses después |
| Meningocócica conjugada 4 valente (ACWY) | 4 | 2*, 4*, 6* y 12 meses | Formulaciones conjugadas con CRM197 y toxoide tetánico se pueden ocupar desde los 2 meses de vida. Los vacunados durante el primer año de vida se le coloca un refuerzo a los 3 años después de la última dosis. Posteriormente se colocan refuerzos cada 5 años.Vacuna recombinante contra el serogrupo B, 4CMenB puede ser utilizada desde los 2 meses de vida en similar esquema a la conjugada. Considerar según contexto epidemiológico. No está establecida su utilidad en refuerzos cada 5 años. |
| Sarampión, Rubéola, papéras | 3 | 9* y 12 meses y 13-24* meses de vida.Refuerzo 1o básico | Dos dosis el primer año de vida con intervalo de 3 meses. Sólo en etapa inmunológica 1 ó 2 y clínicamente estable, carga viral indetectable. En caso de viaje se puede adelantar dosis a los 9 meses de vida. |
| Hepatitis A | 2 | 0 y 6 meses, a partir de los 12 meses de vida | Con intervalo de 6 meses* |
| Varicela* | 2 | 0 y 3 meses, a partir de los 12 meses de vida* | Solo etapa inmunológica 1 ó 2 mantenida > 6 meses y carga viral VIH indetectable. |
| Rotavirus* | 2 ó 3 | 2, 4 (y 6) meses de vida | 2 ó 3 dosis según vacuna utilizada, en niños sin inmunosupresión severa. Las 2 formulaciones orales se pueden utilizar desde las 6 semanas de vida, completando el esquema a los 6 meses (monovalente) u 8 meses (pentavalente) |
| Fiebre Amarilla | 1 | A partir de los 9 meses de vida | Vacuna viva atenuada, debe ser considerara si recuento de LT CD4 > 200/mm3, y exposición inminente e impostergable. Existen limitados datos de seguridad e inmunogenicidad en niños infectados con VIH. Considerar dosis de refuerzo 10 años después. |
| Vacuna Papiloma Humano | 3 | A partir de los 9 años de edad en esquema 0, 1-2* y 6 meses | 3 dosis para lograr mejor inmunogenicidad |
HBsAg: antígeno de superficie de virus hepatitis B; PNI: programa nacional de inmunizaciones; dTpa: vacuna de toxoides diftérico y tetánico, asociada con componente de pertussis, acelular.
1. Vacuna BCG: Está contraindicada, independiente de su estado inmune, ya que algunos estudios retrospectivos demostraron un mayor riesgo de diseminación BCG en niños que desarrollan posteriormente SIDA. Este riesgo asociado puede ser mayor, especialmente considerando que el efecto preventivo de la vacuna BCG contra tuberculosis en niños con VIH ha mostrado ser menor26. Sin embargo, la posición de la OMS de febrero de 2018 plantea que individuos con VIH, clínica e inmunológicamente estables, es decir LT CD4+ en etapa 1 de acuerdo con la edad, que viven en zonas de alta endemia de TB, y que están recibiendo TARV, pueden ser vacunados con BCG. Esto se fundamenta en que, en esos países, la población con VIH tiene un mayor riesgo de formas diseminadas de TB, y por lo tanto en este escenario el potencial beneficio sobrepasa el riesgo del uso de la vacuna BCG27. Para la realidad epidemiológica chilena, es una vacuna contraindicada en niños infectados.
2. Vacuna hepatitis B: Dado que la infección por VHB comparte las formas de transmisión con VIH, es frecuente la coinfección en adultos. Se debe administrar vacuna VHB monovalente a todos los RN independiente de su peso de nacimiento, edad gestacional y recuento de LT CD4+, continuando con la vacunación programática de los 2, 4, 6 y 18 meses, incluida en la vacuna hexavalente del PNI. Como ya mencionamos, en caso de ser hijo de una madre con hepatitis B crónica, el RN debe recibir vacuna e inmunoglobulina específica antes de las 12 horas de vida. En caso de que el paciente no haya recibido vacuna contra el VHB el primer año de vida, se recomienda una serie de 3 dosis de vacuna VHB a los 0, 1 y 6 meses, previa determinación de HBsAg. Guías europeas y de norteamericanas (AIDS info), sugieren la determinación de anticuerpos anti-HBsAg para evaluar la respuesta inmune 2 meses después de la tercera dosis, utilizándose el mismo nivel protector que la población general, > 10mIU/ml28,29,40.
3. Vacuna contra difteria, pertussis y tétanos: Contenida en la vacuna hexavalente, se recomienda en forma programática de acuerdo con nuestro PNI, sin problemas de seguridad al ser una vacuna no infectiva. Si el paciente no recibió las vacunas el primer año de vida, se debe hacer puesta al día con esquema de 3 + 1, distribuidas a los 0, 1, 2 y 6 meses. La vacuna hexavalente se puede administrar a partir de las 6 semanas de vida y hasta los 6 años 11 meses, después de los 7 años de vida sólo se puede administrar vacunas con componente acelular de pertussis, dTpa. Deben continuar con dosis de refuerzo de dTpa en primero y octavo básico, acorde al PNI22.
4. Vacuna Polio: Los niños con VIH tienen contraindicada las VPO mono, bi o trivalentes, por las razones mencionadas anteriormente. La IPV puede ser recibida en forma rutinaria, ya sea en su presentación única, o como componente de la vacuna hexavalente34.
5. Vacuna H influenzae tipo b (Hib): Se recomienda su administración en forma rutinaria según PNI, con edad mínima a partir de las 6 semanas de vida. Niños mayores de 12 meses y menores de 59 meses que no recibieron vacuna o sólo una dosis el primer año de vida, deben recibir dos dosis adicionales con intervalo de 8 semanas. Niños mayores de 5 años y hasta los 18 años sin esquema primario deben recibir una dosis de vacuna Hib22.
6. Vacuna Rotavirus: Se recomienda la vacunación frente al rotavirus en esquema 2 o 3 dosis (según vacuna administrada) a los 2, 4 y 6 meses de vida de en lactantes con infección por el VIH sin inmunodepresión grave, definido como LT CD4+ en porcentaje ≥ a 15% y ≥750 cel/mm333.
7. Vacuna neumocócica: Estudios han demostrado una menor producción de anticuerpos y efectividad contra serotipos vacunales en niños VIH, incluso en etapa inmunológica 1 y en TARV exitosa35,36. Por esto se recomienda esquema primario de PCV con dosis a los 2, 4 y 6, con un refuerzo a los 12-15 meses. Posteriormente, a los 2 años de vida administrar vacuna neumocócica polisacárida 23 valente (PPSV23), seguido de una única dosis de refuerzo 5 años después. En caso de que un niño haya iniciado su esquema con vacuna PVC 7 o 10 valente, se recomienda una dosis de PCV 13 y posteriormente un refuerzo con PPV23. Niños que no hayan recibido PCV el primer año de vida, se recomienda administrar vacuna PCV 13 en esquema de dos dosis después de los 2 años de vida, seguido de PPSV23 dos meses, y repetir de forma única en 5 años22.
8. Vacunas meningocócicas: Por su mayor riesgo de enfermedad meningocócica invasora (EMI), el Minsal recomienda adelantar la vacunación anti meningocócica conjugada ACWY, incorporada a los 12 meses de vida en PNI chileno, a los 2 meses de vida, en esquema de 2, 4, 6 y 12 meses, con una dosis de refuerzo a los 3-5 años, a través de formulario de solicitud especial de vacunas22. La vacuna meningocócica recombinante contra serogrupo B (4CMenB) podría utilizarse en esquema semejante a la conjugada para los menores de 1 año. Desde el año de vida puede usarse en esquema de 2 dosis, separadas por 2 meses, sin tope de edad. La necesidad de dosis de refuerzo de esta vacuna no está establecida, pero podría ser utilizada de forma semejante a vacunas conjugadas tetravalentes36. No hay reportes de seguridad relevantes en pacientes con VIH, pero al ser una vacuna no infectiva, no tendría contraindicación.
9. Vacuna sarampión, rubéola y parotiditis (trivírica): Al ser una vacuna infectiva, está contraindicada en inmunodepresión severa, como la etapa inmunológica 3. Por lo tanto, se recomienda en forma rutinaria a los 12 meses de vida en niños en etapa inmunológica 1, y en etapa inmunológica 2, siempre que no haya otros factores de riesgo de progresar a inmunosupresión severa, por ejemplo, CV VIH elevada o dudas respecto de adherencia a TARV. Se recomienda administrar una segunda dosis de vacuna trivírica durante el segundo año de vida, con intervalo de al menos 4 semanas con otras vacunas vivas (trivírica o varicela), para lograr precozmente inmunidad protectora. Niños con infección perinatal por VIH que fueron vacunados previo al inicio de TARV efectiva, deben recibir 2 dosis, con intervalo mínimo de 4 semanas, una vez que hayan logrado la reconstitución inmune con la TARV; LT CD4+ en etapa 1 según edad por más de 6 meses, y CV indetectable38.
10. Vacuna hepatitis A: Vacuna inactivada, segura e inmunogénica. Es muy bien tolerada, produciendo sólo en forma ocasional efectos locales (dolor, enrojecimiento y tumefacción) y generales (fiebre, mialgias, cefalea, anorexia, náuseas). Se incorporó en lactantes desde el 2013 en las regiones de Arica y Parinacota y Tarapacá, el 2014 en algunas comunas de Bío Bío y desde marzo del 2018 en nuestro PNI, en monodosis a los 18 meses. En el caso de niños con VIH se recomienda administrarla en dos dosis, con un intervalo de 6 meses19,22,41.
11. Vacuna varicela: Los niños con VIH tienen mayor riesgo de desarrollar varicela grave, incluso letal, dependiendo del estado inmune. Estudios de inmunogenicidad de esta vacuna varicela en niños con VIH demuestran una mejor seroconversión y persistencia de los títulos de anticuerpos anti-varicela cuando se administran dos dosis de vacuna, y al menos 3 meses posterior a inicio de TARV42. Se recomienda administrar la vacuna en niños asintomáticos, en etapa inmunológica 1, con CV indetectable y buena adherencia a TARV. Administrar la primera dosis a partir de los 12-15 meses de vida, con una segunda dosis 3 meses posterior22, lo cual deberá coordinarse con la incorporación en nuestro PNI, a los 18 meses, desde el segundo semestre del 2020. La vacuna tetravírica (sarampión-Rubéola-parotiditis-varicela) no se ha estudiado en niños VIH, por lo cual no se recomienda.
12. Vacuna virus papiloma humano: La infección por VPH en pacientes con SIDA adquiere características de mayor intensidad, como la papilomatosis peri genital gigante18. Esta vacuna no tiene contraindicación en pacientes inmunosuprimidos al ser una vacuna inactiva. Se recomienda administrar, para hombres y mujeres, a partir de los 9 años de vida, idealmente antes del inicio de actividad sexual ya que logra mayor inmunogenicidad, en esquema de 3 dosis (0, 1-2 meses – 6 meses)22.
13. Vacuna influenza: Debe administrarse anualmente, a partir de los 6 meses de vida, acorde a los esquemas habituales recomendados, incluyendo a los contactos domiciliarios. Todos los niños menores de 9 años que son vacunados por primera vez deben recibir dos dosis de vacuna, separadas por un intervalo de un mes. La dosis para niños de 6 a 35 meses es de 0,25ml, administrada por vía intramuscular, mientras que en los niños de 36 meses o más la dosis es de 0,5ml. Esta formulación es dinámica, y ya existen en Chile vacunas tetravalentes aprobadas con dosificación única de 0,5ml independiente de la edad del sujeto22. Nuestro PNI usa exclusivamente formulaciones trivalentes. No existe recomendación preferente respecto de opciones vacuna tri o tetravalente. Debe evitarse la vacunación de los individuos en los que existan antecedentes de aparición de un síndrome de Guillian-Barré en las 6 semanas posteriores a la administración de vacuna antigripal. Temporalmente no es recomendable vacunar a personas cursando una enfermedad aguda severa. Para una mejor inmunogenicidad, se recomienda su administración con recuentos de LT CD4+ >200 cel/mm3. No han sido descrito efectos adversos diferentes a la población general ni efectos negativos en recuento de linfocitos LT CD4+ ni CV19.
14. Vacuna fiebre amarilla: Vacuna de virus vivo atenuada, la que debe ser considerada con precaución, solo en caso de exposición inminente acorde a recomendaciones internacionales, si es que se encuentra asintomático, con LT CD4+ >350 cel/mm3 en adultos o etapa inmunológica 1 en niños según edad39,43. No se recomienda su uso en casos de etapas SIDA y/o inmunosupresión severa.
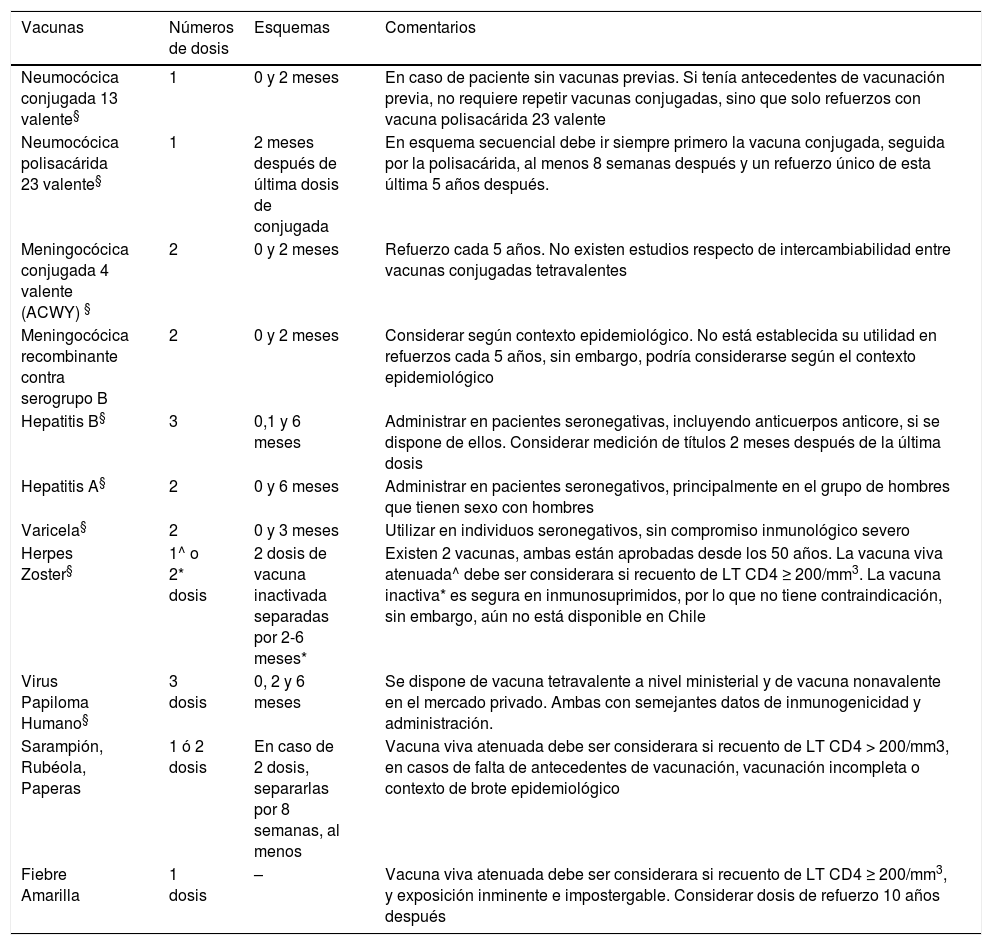
III. RECOMENDACIONES EN ADOLESCENTES Y ADULTOS INFECTADOS POR VIHComo conceptos generales, adolescentes y adultos con VIH pueden recibir las mismas vacunas rutinarias que los no infectados, con excepción de vacunas vivas atenuadas, formalmente contraindicadas con niveles de LT CD4+ <200 cel/mm344 (Tabla 5).
Vacunas recomendadas en adolescentes y/o adultos con VIH/SIDA
| Vacunas | Números de dosis | Esquemas | Comentarios |
|---|---|---|---|
| Neumocócica conjugada 13 valente§ | 1 | 0 y 2 meses | En caso de paciente sin vacunas previas. Si tenía antecedentes de vacunación previa, no requiere repetir vacunas conjugadas, sino que solo refuerzos con vacuna polisacárida 23 valente |
| Neumocócica polisacárida 23 valente§ | 1 | 2 meses después de última dosis de conjugada | En esquema secuencial debe ir siempre primero la vacuna conjugada, seguida por la polisacárida, al menos 8 semanas después y un refuerzo único de esta última 5 años después. |
| Meningocócica conjugada 4 valente (ACWY) § | 2 | 0 y 2 meses | Refuerzo cada 5 años. No existen estudios respecto de intercambiabilidad entre vacunas conjugadas tetravalentes |
| Meningocócica recombinante contra serogrupo B | 2 | 0 y 2 meses | Considerar según contexto epidemiológico. No está establecida su utilidad en refuerzos cada 5 años, sin embargo, podría considerarse según el contexto epidemiológico |
| Hepatitis B§ | 3 | 0,1 y 6 meses | Administrar en pacientes seronegativas, incluyendo anticuerpos anticore, si se dispone de ellos. Considerar medición de títulos 2 meses después de la última dosis |
| Hepatitis A§ | 2 | 0 y 6 meses | Administrar en pacientes seronegativos, principalmente en el grupo de hombres que tienen sexo con hombres |
| Varicela§ | 2 | 0 y 3 meses | Utilizar en individuos seronegativos, sin compromiso inmunológico severo |
| Herpes Zoster§ | 1^ o 2* dosis | 2 dosis de vacuna inactivada separadas por 2-6 meses* | Existen 2 vacunas, ambas están aprobadas desde los 50 años. La vacuna viva atenuada^ debe ser considerara si recuento de LT CD4 ≥ 200/mm3. La vacuna inactiva* es segura en inmunosuprimidos, por lo que no tiene contraindicación, sin embargo, aún no está disponible en Chile |
| Virus Papiloma Humano§ | 3 dosis | 0, 2 y 6 meses | Se dispone de vacuna tetravalente a nivel ministerial y de vacuna nonavalente en el mercado privado. Ambas con semejantes datos de inmunogenicidad y administración. |
| Sarampión, Rubéola, Paperas | 1 ó 2 dosis | En caso de 2 dosis, separarlas por 8 semanas, al menos | Vacuna viva atenuada debe ser considerara si recuento de LT CD4 > 200/mm3, en casos de falta de antecedentes de vacunación, vacunación incompleta o contexto de brote epidemiológico |
| Fiebre Amarilla | 1 dosis | – | Vacuna viva atenuada debe ser considerara si recuento de LT CD4 ≥ 200/mm3, y exposición inminente e impostergable. Considerar dosis de refuerzo 10 años después |
$: Solicitar vacunas a través de “Formulario Solicitud Especial Vacunas”. Adaptado de https://vacunas.minsal.cl/wp-content/uploads/2019/02/MANUAL-VACUNAS-ESPECIALES.pdf.
1. Vacuna hepatitis B: Se recomienda la detección sistemática y la inmunización contra el VHB para todas las personas infectadas por el VIH para prevenir la infección primaria. Las personas infectadas por el VIH tienen menos probabilidades de eliminar el VHB y mayor riesgo de infección crónica45. Se utiliza vacuna inactivada en base a DNA recombinante, en esquema de tres dosis, 0, 1 y 6 meses, para adolescentes y adultos. El PNI la incorporó el 2005 desde los 2 meses de edad, por lo que actualmente los adolescentes hasta los 15 años debieran estar vacunados contra VHB. En caso de interrupción del esquema vacunal entre la primera y segunda dosis, se debe administrar cuanto antes, espaciándola por al menos 4 meses con la tercera dosis. Si esta interrupción ocurre entre la segunda y tercera dosis se debe poner al día cuanto antes. En casos específicos, en que se requiera completar inmunización en períodos más breves, se puede utilizar el esquema acelerado 0, 7 y 21 días, con dosis de refuerzo a los 6 o 12 meses. En ningún caso se requiere reiniciar esquemas vacunales. Varios estudios han demostrado una respuesta inmunológica superior al utilizar doble dosis de vacuna (40μg vs 20μg), por lo cual las guías clínicas de Estados Unidos, Inglaterra y Francia recomiendan estas dosis en adultos con VIH, a pesar de una mayor frecuencia de efectos adversos locales40,44. También existe una vacuna con coadyuvante que se recomienda en estos pacientes, pero no está disponible en Chile. Las guías recomiendan medir niveles de anticuerpos anti HBs cuatro semanas post vacunación y anualmente en adolescentes de alto riesgo. Si estos niveles de anticuerpos son <10mIU/mL se debe repetir la serie de 3 dosis40.
2. Vacuna tétanos: Vacuna inactivada, introducida en nuestro PNI desde 1973, administrándose actualmente en período de lactante, con refuerzos en 1° básico, 8° básico y en embarazadas desde las 28 semanas de gestación. En caso de exposición por accidente, en adolescentes y adultos con VIH se recomienda la misma conducta que en la población general, según el tipo de herida e intervalo con último refuerzo. Preferir formulación combinada con Pertussis (dTap) en caso de adolescentes que no la hayan recibido anteriormente. Se recomienda refuerzos cada 10 años46, aunque las guías británicas sugieren refuerzos cada 5 años en pacientes mayores de 50 años. No está incluida en la guía chilena para adultos con VIH.
3. Vacuna neumocócica: Se utilizan PCV 13 y PPV 23, ambas inactivadas, en esquema secuencial, separadas por al menos 8 semanas, con un refuerzo único de PPSV23 a los 5 años22. En caso de vacunación previa con PPSV23, debe administrarse PCV 13 un año después. Se debe administrar una dosis única adicional de PPSV23 después de los 65 años, al menos cinco años después de la dosis anterior de PPSV23. En general, no se administran más de tres dosis de por vida de PPSV2319. No hay estudios que comparen la eficacia de PCV 13 con PPSV23 en este grupo. Los datos de inmunogenicidad y eficacia han sido contradictorios, sin embargo, en base a estudios realizados con PCV7, se considera que la PCV 13 es más inmunogénica que la PPSV23, mientras que esta última ofrece un repertorio más amplio de serogrupos. En caso de que la vacunación se concreta durante inmunosupresión o en concomitancia con profilaxis anti Pneumocystis jirovecii se podría considerar medir su inmunogenicidad. PCV13 se puede administrar con cualquier recuento de LT CD4+, pero puede ser preferible diferir la administración de PPSV23 hasta que obtener un recuento de LT CD4+ ≥200 cel/mm319. No hay reportes de seguridad especial en este grupo de pacientes. La vacunación en adultos se inició el 2007 con PPSV23, introduciéndose a partir del 2010 en el PNI para adultos mayores de 65 años47. La población de adolescentes no ha sido vacunada programáticamente contra neumococo, puesto que fue introducida desde el 2011 en menores de 1 año48.
4. Vacuna meningocócica: Se ha reportado una alta portación nasofaríngea de Neisseria meningitidis en población VIH/SIDA, cercana al 43%; con tasas de colonización rectal del 2% y uretral del 1% en hombres que tienen sexo con hombres. Se estima que estos pacientes tienen un riesgo aumentado en 10 a 60 veces de presentar EMI, independiente del serogrupo, especialmente en sujetos con LT CD4+ ≤ a 200 cel/mm3, los que tienen un alto riesgo de presentar meningitis aguda. Por otro lado, la letalidad reportada es cercana al doble de la población general, disminuyendo en los casos de pacientes con TARV49. Se recomienda el uso de vacuna conjugada tetravalente, contra serogrupos A, C, W e Y, en esquema de dos dosis, separadas por 8 semanas y revacunar al cabo de cinco años22,50. Actualmente, los serogrupos W y B predominan en casi idéntica proporción en nuestro país, siendo sus riesgos clínicos semejantes, por lo que la cobertura debiera incluir al serogrupo B. La vacuna 4CMenB en adolescentes y adultos se utiliza en esquema de 2 dosis, separadas por 2 meses, sin tope de edad. Existe otra vacuna, (rLP2086), licenciada, pero no comercializada al momento de redacción de este manuscrito, la que podría ser utilizada en 2 o 3 dosis, en jóvenes entre 10 a 25 años37. La necesidad de dosis de refuerzo de esta vacuna no está establecida, pero podría ser utilizada de forma semejante a vacunas conjugadas tetravalentes. No hay reportes de seguridad relevantes en pacientes con VIH.
5. Vacuna sarampión, rubéola y parotiditis (trivírica): Contraindicada en inmunodepresión severa, como lo es la etapa inmunológica 3. Se necesita al menos 1 dosis de la vacuna trivírica. Se puede administrar en pacientes sin síntomas de infección VIH o solo síntomas leves, con LT CD4+ >200 cel/mm338,51.
5. Vacuna hepatitis A: Vacuna inactivada, muy segura e inmunogénica, con esquema de 2 dosis para adolescentes y adultos, separadas por 6 a 12 meses. En nuestro país, durante el 2017 se presentó un brote de hepatitis A, principalmente en hombres que tenían sexo con hombres, por lo que se recomendó vacunar a varones con infección por VIH14,15,52. Existe una vacuna combinada para hepatitis A y B, sin embargo, la vacuna monovalente es preferida en algunas guías por sobre la vacuna combinada, ya que posee el doble de antígeno (1.440 vs 720 EIU). No hay reportes de seguridad relevantes en pacientes con VIH.
6. Vacuna VPH: La vacuna inactivada tetravalente está recomendada por el MINSAL desde el año 2016 a todos los adultos infectados con VIH y de edad inferior a 26 años, en esquema de tres dosis, 0, 2 y 6 meses, en forma independiente de su género y estado inmunológico. Esta vacuna es segura y bien tolerada, incorporando los serotipos 6, 11, 16 y 18 fue introducida en nuestro PNI en mujeres de 4° y 5° básico desde el 2014, con estrategia de captura hasta 7mo básico, por lo que actualmente las generaciones que egresan de 4to medio debieran estar inmunizadas53. En el caso de la vacunación programática de hombres, esta fue introducida durante el 2019 en 4to básico, por lo que los adolescentes varones desde los 10 años pueden mayoritariamente no estar vacunados. La disponibilidad de vacuna nonavalente existe en el mercado privado, en esquemas semejantes a los licenciados para vacuna tetravalente, extendiendo la protección hacia los serotipos 31, 33, 45, 52 y 58. A pesar de que el momento óptimo de vacunación es previo al inicio de actividad sexual, la mayoría de los adolescentes y adultos con VIH no han sido expuestos a todos los serotipos contenidos en la vacuna y por lo tanto se beneficiarán con ella. También se ha demostrado menores recurrencias en pacientes con VIH que han tenido displasias de alto grado asociadas a VPH18,44.
5. Vacuna varicela: Vacuna a virus vivo atenuado, orientada a prevenir varicela en individuos adolescentes o adultos jóvenes sin el antecedente de la enfermedad o seronegativos contra el VVZ, en etapas N, A y B, sin inmunosupresión grave, en esquema de 2 dosis, separadas por al menos 3 meses y con LT CD4+ >200 cel/mm319.
6. Vacuna herpes zóster: Estas vacunas están orientadas a prevenir recurrencias de VVZ. En el caso de adultos mayores de 50 años, seropositivos para VVZ, con recuento de LT CD4+ >200 cel/mm3, se podría usar la vacuna viva atenuada para prevenir herpes zoster, en 1 dosis. Existe una vacuna inactivada recombinante, con adyuvante, lo que la hace más inmunogénica, cuya utilización se prefiere por sobre la viva atenuada, pero no está disponible actualmente en Chile. No hay reportes de seguridad relevantes con estas vacunas en pacientes con linfocitos LT CD4+ >200 cel/mm354.
7. Vacuna influenza: Se recomienda utilizar formulaciones inactivadas anualmente para prevenir las complicaciones de la gripe, siendo parte de los grupos de riesgo definidos por el PNI, incluyendo a los contactos domiciliarios. Nuestro PNI usa exclusivamente formulaciones trivalentes. No existe recomendación preferente respecto de opciones vacuna tri o tetravalente. Para una mejor inmunogenicidad, se recomienda su administración con recuentos de LT CD4+ >200 cel/mm3. A pesar de la recomendación en diferentes guías internacionales, varios estudios han demostrado una subutilización de esta vacuna en población con VIH. No han sido descrito efectos adversos diferentes a la población general ni efectos negativos en recuento de linfocitos LT CD4+ ni carga viral. Los pacientes que no pueden recibir esta vacuna por anafilaxia severa al huevo o reacción adversa severa post vacuna, como el síndrome de Guillian-Barré, deberían recibir profilaxis antiviral19,22,44.
8. Vacuna de fiebre amarilla: Vacuna virus vivo atenuada, la que debe ser considerada con precaución, en pacientes menores a 60 años, asintomáticos, con LT CD4+ >350 cel/mm3 solo en caso de exposición inminente e impostergable. La guía clínica de Estados Unidos sugiere discutir el riesgo beneficio para los pacientes con LT CD4+ entre 200 y 49939,43. La vacuna debe administrarse al menos 2 semanas previo al viaje. No se recomienda su uso en casos de etapas SIDA y/o inmunosupresión severa, ni mayores de 60 años. En relación con la duración de la protección, no se ha demostrado que sea indefinida como en la población general, y se recomiendan refuerzos cada 10 años si se expone al riesgo nuevamente55. Si el riesgo de fiebre amarilla es muy bajo o solo existe un requerimiento administrativo de la vacuna, se sugiere entregar un informe médico de excepción para no vacunarse.
CONCLUSIONESLas alteraciones inmunológicas de la infección por VIH predisponen a los pacientes a infecciones inmunoprevenibles bacterianas y virales, con alto riesgo de morbi-mortalidad. La TARV no restituye la inmunidad de las vacunas administradas antes de su implementación, sin embargo, permite optimizar la respuesta inmune, sobre todo cuando son administradas, al menos 6 meses después de su inicio, con CV indetectable. Las vacunas inactivadas pueden ser utilizadas de manera segura en pacientes con VIH, tanto niños, como adolescentes y adultos. Las vacunas vivas atenuadas como rotavirus, trivírica, varicela y fiebre amarilla podrán ser administradas según su estado inmunitario, a diferencia de BCG y VPO, las que tienen contraindicación absoluta. Los hijos de madres con VIH, expuestos no infectados, deben recibir las vacunas en forma rutinaria, con excepción de BCG, que se puede administrar sólo si el recuento de LT CD4+ es normal para la edad. La correcta administración de las vacunas, considerando el estado inmune y complementado el calendario programático, según corresponda, son fundamentales para apoyar la sobrevida de los pacientes que viven con VIH, por lo que debemos conocer sus recomendaciones para asegurar la correcta adherencia a ellas y disminuir su riesgo de morbimortalidad.
Declaración de conflicto de interésDra. Cecilia Piñera: no declara conflictos de interés.
Dr. Rodolfo Villena: ha participado en proyectos de investigación en vacunas para GSK y consultorías para Pfizer y Sanofi Pasteur.
Dr. Rodrigo Blamey: Participación como speaker y en advisory board para Pfizer, MSD y.GSK, financiamiento para asistencia a congresos por Pfizer, MSD y GSK.