La degeneración macular relacionada con la edad (DMAE) es la causa más frecuente de pérdida de visión irreversible en personas mayores de 65 años. Su origen es multifactorial, involucrando el envejecimiento, así como diversos factores genéticos y ambientales tales como el tabaquismo, obesidad y la dieta. Afecta principalmente la retina externa (epitelio pigmentario retinal y fotorreceptores) de la zona macular. Se clasifica en “no neovascular” y “neovascular”.
La forma “no neovascular” se caracteriza por la presencia de drusas blandas, las cuales pueden evolucionar hacia una atrofia macular progresiva y una pérdida gradual de la agudeza visual. En la forma “neovascular”, se desarrollan vasos sanguíneos anormales, que crecen habitualmente desde la coroides, al espacio subepitelio pigmentario o subretinal con exudación de líquido y sangre con pérdida brusca de visión, conduciendo a la fibrosis y daño irreversible de la retina externa.
En el presente artículo se analiza la clasificación y estado actual de tratamiento de la degeneración macular relacionada con la edad.
Age related macular degeneration (AMD) is the most common cause of irreversible vision loss in people over 65 years of age. Its origin is multifactorial, involving aging as well as various genetic and environmental factors such as smoking, obesity and diet. It mainly affects the outer retina (retinal pigment epithelium and photoreceptors) in the macular area. It is classified into “non-neovascular” and “neovascular”.
The “non-neovascular” form is characterized by the presence of soft drusen, which can evolve towards progressive macular atrophy and a gradual loss of visual acuity. In the “neovascular” form, abnormal blood vessels develop, usually growing from the choroid, into the subretinal or subepithelial pigment space with exudation of fluid and blood with sudden loss of vision. This leads to fibrosis and irreversible damage to the outer retina.
This article analyzes the classification and current state of treatment of age-related macular degeneration.
La degeneración macular asociada o relacionada con la edad (DMAE), es una enfermedad neurodegenerativa progresiva que afecta a los fotorreceptores y epitelio pigmentario de la retina, especialmente en su zona central conocida como mácula1. En los países desarrollados, la DMAE es la principal causa de ceguera legal en pacientes sobre 65 años2. Esta enfermedad provoca una importante pérdida de la calidad de vida, dificultando principalmente la lectura, reconocimientos de rostros y capacidad para conducir vehículos3.
La DMAE se caracteriza por la presencia de depósitos, conocidos como depósitos drusenoides subretinianos y drusas blandas, mayoritariamente de naturaleza lipídica, en el espacio subretinal y subepitelio pigmentario4 (figuras 1 y 2). Estos depósitos extracelulares contienen en forma importante digestión incompleta de segmentos externos de los fotorreceptores que no han sido correctamente eliminadas. En la patogenia de la DMAE intervienen factores relacionados con el envejecimiento humano, factores genéticos y ambientales, los cuales ocasionan disfunción y atrofia del epitelio pigmentario, alterando la capa de fotorreceptores y el proceso de fototransducción. Además, se produce inflamación e isquemia microvascular a nivel de la coroides (coriocapilaris), lo que conduce a cambios anatómicos secundarios.
La DMAE se clasifica en dos grandes categorías: “no neovascular” y “neovascular”6. La forma “no neovascular” es la más común, representando el 85% de los casos4.
En la forma “no neovascular” se reconoce una fase temprana, donde se observan en el fondo del ojo, en la zona macular, algunas drusas pequeñas llamadas duras (menos de 65 micrones), que se consideran como cambios normales del envejecimiento, asociadas a drusas intermedias (65 a 124 micrones de diámetro) que se consideran el primer indicio de la enfermedad, junto con pequeños depósitos subretinales llamados drusas pseudoreticulares o depósitos drusenoides subretinianos.
La fase temprana es seguida de la fase intermedia. Esta se caracteriza por tener varias drusas de tamaño intermedio y una o más drusas grandes (125 micrones o más). Con el tiempo pueden seguir creciendo y hacerse confluentes, llegando a constituirse verdaderos desprendimientos drusenoides del epitelio pigmentario. Se agregan también acúmulos pigmentarios intra retinales, provenientes de la capa más externa de la retina, el epitelio pigmentario.
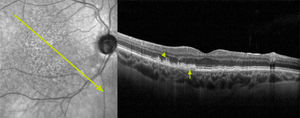
La fase intermedia es seguida de la fase avanzada, donde se comienza a evidenciar zonas de atrofia geográfica (por su forma que remeda “islas” o “continentes” en un mapa), que corresponden a áreas de ausencia de epitelio pigmentario y segmento externo de los fotorreceptores que, producto de la enfermedad, se fueron dañando progresivamente (figura 3). Estas áreas, pequeñas en un inicio, que pueden ser multifocales, se expanden progresivamente y van confluyendo, pudiendo afectar la zona extrafoveal o subfoveal con pérdida importante de la agudeza visual.
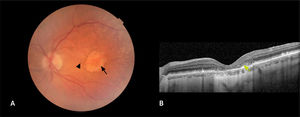
La forma “neovascular” (15%)4, se considera también una fase avanzada de la enfermedad, ya que puede producir una disminución importante de la visión. En ella se produce una proliferación de vasos sanguíneos, principalmente desde la coroides, que exudan líquido y sangre (figura 4). Esto distorsiona la arquitectura retinal, generando una deformación y disminución brusca de la visión. Esta forma, dependiendo de la ubicación de la membrana neovascular, puede clasificarse en: i) tipo 1, donde se posiciona por debajo del epitelio pigmentario (subepitelio pigmentario); ii) tipo 2 donde se encuentra por encima del epitelio pigmentario o espacio subretinal y; iii) tipo 3 cuando se inicia en el espesor de la retina neurosensioral (proliferación angiomatosa retinal). Además, existe un subtipo del tipo 1, llamada polipoidea o aneurismática por la presencia de dilataciones saculares dentro del complejo de la membrana neovascular, que se asocia a una coroides engrosada (paquicoroides). Sin un tratamiento oportuno, la neovascularización puede llevar a la formación de una cicatriz con daño irreversible de las capas externas de la retina y la agudeza visual (figura 5).
En muchos casos, ambas formas de DMAE pueden coexistir simultáneamente.
EtiologíaHoy en día se sabe que la DMAE es de origen multifactorial y uno de los factores más importantes es la susceptibilidad genética, contribuyendo en un 46 a 71% a la enfermedad. Un porcentaje de los casos, se puede explicar por un componente hereditario sobre todo cuando se presenta en la adultez intermedia y se observa un historial familiar positivo de DMAE. Con los avances en genética, a la fecha se han identificado 103 loci asociados a DMAE que explican en gran medida su patogenia. Estos loci están constituidos por genes que participan en diversos procesos celulares como factores del sistema del complemento, metabolismo de lípidos, angiogénesis, sistema inmune, movimiento celular, citoesqueleto, apoptosis y proliferación celular, entre varios otros. Determinados polimorfismos en los genes CFH (factor H del complemento) y ARMS2/HTRA1 (la proteína 2 de susceptibilidad a la maculopatía asociada a la edad y la HtrA serina peptidasa 1) son los loci más destacados que dan cuenta de una mayor susceptibilidad a desarrollar DMAE7.
Estos conocimientos dan pie a que actualmente se trabaje en medicina personalizada para orientar terapias biológicas que participen bloqueando algunos de los mecanismos etiopatogénicos involucrados en esta enfermedad.
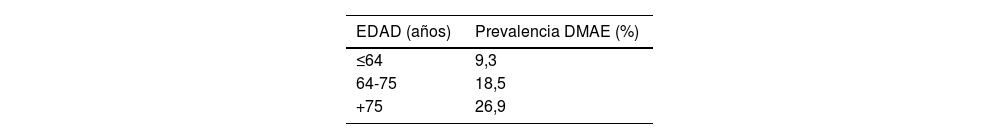
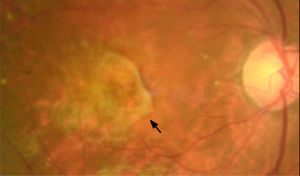
DiagnósticoGracias al progreso tecnológico, en los últimos años se han introducido nuevas herramientas de evaluación macular no invasivas que permiten obtener imágenes de alta definición del fondo de ojo de manera rápida. Estas técnicas se utilizan de forma rutinaria en la práctica clínica. De manera destacada, la tomografía óptica de coherencia de alta resolución (OCT dominio espectral y swept source) y la tomografía óptica de coherencia de alta resolución asociada a angiografía (OCT-A)7 (figura 6) han brindado un mayor conocimiento sobre la enfermedad y sus distintas etapas evolutivas.
OCT-A (angiografía de retina por tomografía de coherencia óptica) en fase a nivel del epitelio pigmentario (A) y asociado a OCT estructural (B)
Las imágenes muestran que la membrana neovascular coroidea ha penetrado por debajo del epitelio pigmentario (flecha) y edema intraretinal (punta de flecha).
Estos avances tecnológicos han permitido realizar diagnósticos y tratamientos más tempranos8, lo que se ha traducido en mejores pronósticos visuales para los pacientes, especialmente aquellos que padecen de la forma “neovascular” que es la que ocasiona un mayor deterioro visual. Además, han facilitado el diseño de estudios clínicos con una selección más precisa de pacientes en etapas más tempranas9, con el objetivo de prevenir el daño visual.
TratamientoRecomendaciones generalesLa incidencia de la DMAE aumenta con el envejecimiento10 (Tabla 1). Dada la prevalencia de la DMAE y otras enfermedades oculares como el glaucoma, se recomienda realizar exámenes oftalmológicos a los 40 años en pacientes sin síntomas visuales, y realizar exámenes anuales a partir de los 65 años, o incluso antes si hay antecedentes familiares de problemas oculares como los mencionados11.
Prevalencia de la degeneración macularpor edad (DMAE) en Europa11
| EDAD (años) | Prevalencia DMAE (%) |
|---|---|
| ≤64 | 9,3 |
| 64-75 | 18,5 |
| +75 | 26,9 |
DMAE: Degeneración macular relacionada con la edad.
Existen ciertas medidas que se aconsejan en familiares de pacientes con antecedentes de DMAE o con etapas iniciales de la enfermedad (drusas pequeñas y medianas) con el fin de prevenir la aparición o la progresión a estados más avanzados12. El factor ambiental más relevante y modificable es el tabaquismo, el cual se recomienda evitar o suspender13. El tabaco contribuye al desarrollo y progresión de la DMAE a través del aumento del estrés oxidativo y la peroxidación de los lípidos, entre otros factores13.
En cuanto a la alimentación, se aconseja seguir una dieta estilo mediterráneo, que es rica en frutas, verduras, legumbres, pescado y uso de aceite de oliva. Esta dieta se ha asociado con una menor incidencia y progresión de la enfermedad14.
La obesidad15 y el sedentarismo16 también son factores de riesgo, por lo tanto, se recomienda mantener un índice de masa corporal dentro del rango normal y realizar ejercicio físico de forma regular, ya que se ha demostrado que reduce el riesgo de progresión de la enfermedad.
Asimismo, la evidencia muestra un mayor riesgo de desarrollo de DMAE en pacientes con mayor exposición solar17, por lo que sería aconsejable protegerse de la radiación utilizando lentes de sol con bloqueo UV 100%.
DMAE intermediaEste grupo de pacientes con DMAE intermedia presenta un mayor riesgo de progresión a estadios más avanzados de la enfermedad y pérdida de la visión, por lo tanto, requieren una identificación temprana y un seguimiento más frecuente18. Según el estudio AREDS18, se observó una progresión a estados avanzados en hasta un 45% de los casos a los 5 años y un 71% a los 10 años.
Los estudios AREDS19 y AREDS 220, fueron prospectivos, aleatorizados y doble ciego, reclutando a un gran número de participantes (3640 y 4203, respectivamente). Demostraron que una combinación de vitaminas y antioxidantes (Tabla 2), consumidos diariamente por vía oral, reduce significativamente la progresión de la enfermedad en un 25% en este grupo específico de pacientes. Por lo tanto, se recomienda que todos los pacientes con DMAE intermedia, además de seguir las recomendaciones generales, reciban la prescripción de esta combinación de nutrientes20. El estudio AREDS 2 demostró que el uso de luteína y zeaxantina es capaz de reemplazar a los betacarotenos usados en el estudio AREDS 1, que se han asociado con un aumento de cáncer pulmonar en pacientes fumadores o con historia de tabaquismo en otros trabajos.
Fórmula AREDS 2. Ingesta diaria recomendada21
| Vitamina C | 500mg |
| Zinc (óxido de zinc) | 400UI |
| Cobre (óxido de cobre) | 2mg |
| Luteina | 10mg |
| Zeaxantina | 2mg |
La forma avanzada “no neovascular” de la DMAE se caracteriza por la progresiva atrofia del epitelio pigmentario de la retina y fotorreceptores en el área macular21. Esto da lugar a la formación de focos que van confluyendo, creando zonas extensas de atrofia geográfica que llegan a comprometer la zona foveal, lo que resulta en una pérdida progresiva y severa de la agudeza visual (figura 3).
Hasta hace poco no existía ningún tratamiento disponible que pudiera ayudar a estos pacientes. Sin embargo, a inicios del 2023 la Food and Drug Administration de EEUU (FDA) aprobó el uso de un inhibidor del factor C3 del complemento (inyección de pegcetacoplan) para el tratamiento de la DMAE avanzada de tipo “no neovascular”. Dicho estudio, demostró que el uso de una inyección intravítrea mensual, o al menos cada 2 meses, de un anticuerpo humanizado que bloquea el factor C3 (pegcetacoplan) reduce significativamente la velocidad de progresión de la atrofia en comparación con los pacientes no tratados, con una disminución del 22% y 19% a 2 años23. Adicionalmente, en agosto 2023, la FDA también aprobó el uso de avacincaptad pegol para el tratamiento de la atrofia geográfica24–26.
Si bien ambos tratamientos son invasivos, requieren de una administración prolongada y no están libres de complicaciones, representan el primer paso hacia una nueva línea de tratamiento que se irá desarrollando en el tiempo. Esto brinda esperanza para un gran número de pacientes que antes no tenían alternativas disponibles.
NeovascularEsta forma de DMAE se caracteriza por la aparición de neovasos, los cuales suelen originarse en la coroides y atraviesan la membrana de Bruch para crecer hacia el espacio subepiteliar pigmentario y, eventualmente, hacia el espacio subretinal27. Estos neovasos tienen endotelios capilares más permeables, lo que permite la acumulación de líquido y sangre en el espacio del subepitelio pigmentario, subretinal e intrarretinal (figura 4). Esto ocasiona una distorsión en la arquitectura retinal y afecta la función celular. Clínicamente, se manifiesta con una disminución brusca de la agudeza visual, la aparición de zonas oscuras en la visión central (escotomas centrales o paracentrales) y la distorsión de las figuras (metamorfopsia).
La introducción de los inhibidores del factor de crecimiento endotelial vascular (VEFG) en forma de inyecciones intravítreas a partir del 2004ha supuesto un avance significativo en el tratamiento de la neovascularización macular en la DMAE28. Estos inhibidores del VEGF permiten detener la progresión de la enfermedad en la mayoría de los casos, y si se administran de manera temprana, mejorar la agudeza visual al inducir la regresión de la neovascularización (figura 7). Sin embargo, es importante destacar que requieren inyecciones intravítreas frecuentes, al principio mensuales, y para posteriormente ampliar el intervalo entre las dosis según la respuesta del paciente.
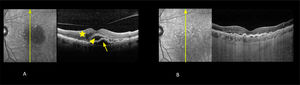
Degeneración macular asociada a la edad neovascular (DMAEn)
Fotografía infrarroja y tomografía de coherencia óptica de dominio espectral (OCT).
A Pre tratamiento. Agudeza visual de 0,5. Se observa acumulación de líquido en los espacios subepitelio pigmentario (flecha), subretinal (cabeza de flecha) e intrarretinal (estrella) al OCT.
B. Post tratamiento con aflibercept respuesta inicial después de 3 inyecciones mensuales. Agudeza visual 1,0 parcial. Se observa reabsorción casi total del líquido en los espacios subepitelio pigmentario, subretinal e intrarretinal.
Habitualmente se inicia el tratamiento con una fase de carga, donde se inyecta mensualmente en forma intravítrea el anti-VEGF por al menos 3 meses y se hace una reevaluación. Si persisten signos de actividad como hemorragias, líquido subretinal o edema retinal, se mantiene el tratamiento mensual, hasta lograr que desaparezcan los signos exudativos.
Una vez controlada la exudación, se pasa a la fase de mantención. Una de las modalidades más usadas es la de tratar y extender (T&E), donde el intervalo entre inyecciones se va extendiendo habitualmente cada 2 semanas, siempre que no haya nuevamente signos exudativos en los controles clínicos y examen de OCT macular. Progresivamente se puede, en algunos casos, extender hasta 4 meses. Otra modalidad usada es la PRN o Pro-Re-Nata (como se requiera), donde se controla mensualmente al paciente clínicamente y con OCT y solo cuando se presentan nuevos signos exudativos, se inicia nuevamente el tratamiento con una frecuencia según necesidad. Ambas presentan ventajas y desventajas, pero la primera, T&E, se asocia con mejores resultados visuales29.
En la mayoría de los casos, el tratamiento en fase de mantención no puede suspenderse por completo y debe prolongarse durante muchos años.
Existen en la actualidad múltiples terapias biológicas inhibidoras del VEGF como el bevacizumab, ranibizumab, brolucizumab y de otros factores como el aflibercept28, que también inhibe el factor de crecimiento placentario (PGF), y el faricimab30, muy reciente, que además inhibe el receptor de la angiopoyetina 2 (Tabla 3). Estas nuevas opciones terapéuticas han permitido extender, en muchos casos, el intervalo entre las inyecciones a 4 meses en la fase de mantención.
Medicamentos utilizados en forma intravítrea para el tratamiento de la degeneración macular relacionada con la edad neovascular (DMAEn)
| Medicamentos intravítreos de uso en DMAEn | Mecanismo de acción |
|---|---|
| Avastin (bevacizumab) | • Anticuerpo monclonal humanizado anti-VEGF A |
| Lucentis (Ranibizumab) | • Fragmento de anticuerpo monoclonal anti-VEGF A |
| Eylea (Aflibercept) | • Proteína de fusión recombinante anti-VEGF A,B,C y anti-PIGF |
| Beovue (Brolucizumab) | • Fragmento de anticuerpo humanizado anti-VEGF A de una cadena |
| Vabysmo (Faricimab) | • Anticuerpo biespecífico anti-VEGF A y Ang-2 |
DMAEn: degeneración macular relacionada con la edad neovascular; VEGF (factor de crecimiento vascular endotelial); PIGF (factor de crecimiento placentario); Ang-2 (angiopoyetina 2).
Las inyecciones intravítreas han tenido un impacto significativo en la mejora de las perspectivas visuales de estos pacientes. Muchos de ellos experimentan una mejoría en su visión, y la mayoría logra mantener la estabilidad de esta a largo plazo. Sin embargo, con el paso de los años, factores como la complejidad del tratamiento, el alto número de visitas e inyecciones necesarias y los costos asociados, pueden llevar a que, en la práctica clínica habitual, muchos pacientes reciban un tratamiento insuficiente, lo que deriva en resultados menos alentadores.
Recientemente, la FDA ha aprobado un nuevo dispositivo terapéutico (Susvimo®), implante recargable que se coloca intraocularmente adherido a la pared escleral. Contiene un anticuerpo bloqueador del VEGF (ranibizumab) que permite mantener niveles terapéuticos en el interior del ojo durante al menos 6 meses31. Después de ese periodo, es necesario realizar una recarga del dispositivo mediante una inyección transconjuntival. Esta modalidad de tratamiento resulta especialmente útil para aquellos pacientes que requieren inyecciones frecuentes de manera prolongada, ya sea mensuales o bimensuales, a lo largo de los años. Sin embargo, es importante tener en cuenta que este tratamiento no está exento de complicaciones, como la posibilidad de desarrollar endoftalmitis con mayor frecuencia.
Es crucial brindar tratamiento temprano y oportuno en casos de neovascularización coroidea, antes de que se produzca un daño irreversible en la retina y la pérdida de agudeza visual32. Para lograr esto, es importante educar a los pacientes de alto riesgo sobre la importancia de buscar atención médica de manera precoz y establecer canales de acceso expeditos a la atención médica. Habitualmente se aconseja hacerse un autoexamen en sus hogares con la grilla de Amsler, para evidenciar más fácilmente la aparición de metamorfopsia o escotomas.
En los últimos años, se han desarrollado nuevos sistemas de autocontrol para que los pacientes puedan monitorear su condición en casa33,34. Estos sistemas permiten detectar cambios sutiles y transmitirlos de manera electrónica, facilitando con ayuda de la inteligencia artificial, un diagnóstico y tratamiento temprano.
Rehabilitación visualLos pacientes con DMAE, cuya visión continúa disminuyendo a pesar de todos los esfuerzos, pueden beneficiarse de ayudas visuales, ya sean ópticas (como lentes de mayor poder dióptrico, lupas, magnificadores electrónicos, entre otros) o no ópticas (como filtros, tiposcopios, atriles, etc.)35. Estos pacientes deben ser referidos a unidades de rehabilitación, donde profesionales capacitados evalúan su condición y les enseñan a utilizar estos dispositivos. En muchos casos estas ayudas visuales les permiten volver a leer y llevar una vida más independiente, mejorando significativamente su calidad de vida.
FuturoConforme la población nacional36 y mundial37 continúe envejeciendo, se espera un aumento de la demanda de tratamiento para la DMAE. Este incremento de pacientes representará una carga adicional para un sistema de salud que ya se encuentra saturado. Además, los costos aumentarán a medida que se introduzcan terapias más avanzadas y sofisticadas, las cuales deben pasar por un extenso proceso de desarrollo para demostrar su eficacia y seguridad, y así obtener la aprobación necesaria para su uso clínico.
Por lo tanto, es fundamental continuar buscando soluciones que permitan administrar tratamientos continuos con la menor cantidad de procedimientos posible. En la actualidad, se están llevando a cabo estudios en fase 2 que exploran la aplicación de la terapia génica como una posible opción, tanto para las formas “neovascular” como “no neovascular” de la DMAE38,39. Esta técnica implica la inyección de vectores virales modificados a nivel intravítreo, los cuales se integran en las células de la retina y utilizan la maquinaria intracelular para producir los fármacos necesarios, cómo ejemplo un anti-VEGF. El objetivo es lograr un tratamiento a largo plazo mediante una sola inyección intraocular, lo cual sería altamente deseable en términos de comodidad para el paciente y menos carga a los sistemas de atención en salud.
La búsqueda de un tratamiento efectivo para pacientes con degeneración macular intermedia, antes que se produzca un daño funcional de la retina, es considerado como el “santo grial” en el campo de la DMAE. El objetivo es preservar la visión y evitar que la enfermedad progrese a estados más avanzados.
Consideraciones ÉticasLas imágenes incluidas en este artículo han sido anonimizadas para mantener la confidencialidad de los pacientes.
Declaración de conflictos de interesesEl autor declara no tener conflicto de intereses.
Referencias no citadas5,22.