La lesión renal aguda se define como el deterioro abrupto de la función renal excretora, a menudo observado en pacientes críticos. La incidencia de LRA en todo el mundo oscila entre 20 y 200 casos por millón de habitantes. La sepsis y el shock séptico contribuyen al 25-75% de los casos de LRA. Independientemente de la causa, la pérdida de la homeostasis de fluidos y electrolitos, junto con la acumulación de desechos nitrogenados, conduce a la uremia, hiperkalemia, la retención de agua y sodio, y acidosis metabólica. Las terapias de reemplazo renal (TRR) tienen como objetivo mitigar estos efectos y prevenir la muerte asociada a la insuficiencia renal. Existen diversas modalidades de TRR, que incluyen la hemodiálisis intermitente, la TRR continua como también diferentes técnicas para la eliminación de solutos. Ha habido significativos avances en tecnologías de membranas y adición de sustancias para mejorar la biocompatibilidad además de nuevas estrategias de anticoagulación. El objetivo de este trabajo es hacer una puesta al día de las TRR existentes y comentar recomendaciones con respecto a su dosis y momentos de inicio y cese de terapia.
Acute kidney injury (AKI) is defined as the abrupt deterioration of renal excretory function, often observed in critically ill patients. The incidence of AKI worldwide ranges between 20 and 200 cases per million population. Sepsis and septic shock contribute to 25-75% of AKI cases. Regardless of the cause, loss of fluid and electrolyte homeostasis and the accumulation of nitrogenous wastes lead to uremia, hyperkalemia, water and sodium retention, and metabolic acidosis. Renal replacement therapies (RRT) aim to mitigate these effects and prevent death associated with kidney failure. There are various modalities of RRT, including intermittent hemodialysis, continuous RRT, as well as different solute elimination techniques. There have been significant advances in membrane technologies and the addition of substances to improve biocompatibility, in addition to new anticoagulation strategies. The aim of this article is to review current RRT alternatives and comment on recommendations regarding their dosage and timing for starting and discontinuing therapy.
Se define lesión renal aguda (LRA) como el deterioro abrupto de la función renal excretora, manifestada por un aumento en la creatinina plasmática y/o reducción o cese del flujo urinario en un periodo menor a 7 días1. Puede ocurrir por alteraciones funcionales mediadas por cambios hemodinámicos o por daño estructural intrínseco de los glomérulos, túbulos, compartimiento intersticial o vascular, como resultado de la exposición a toxinas, sepsis o shock2. La incidencia estimada de LRA en el mundo es de 20 a 200 por millón de habitantes. Se manifiesta en entre un 7 a 18% de los ingresos hospitalarios y en un 50% de los pacientes ingresados en unidades de cuidados críticos3,4. Entre un 25 y un 75% de los casos de LRA están asociados a sepsis o shock séptico5. Independiente de la causa, la pérdida de la homeostasis de fluidos y electrolitos junto a la acumulación de desechos nitrogenados y otros metabolitos tiene como consecuencia las manifestaciones de la uremia, acumulación de agua y sodio, hiperkalemia y acidosis metabólica. La severidad de estas anormalidades está determinada por la magnitud y duración de la lesión inicial y el catabolismo propio de cada paciente6. El principal objetivo de las terapias de reemplazo renal (TRR) es mitigar los efectos de estas manifestaciones y prevenir la muerte asociada a falla renal.
Generalidades de terapia de reemplazo renal en el paciente críticoLa TRR más utilizada en falla renal aguda consiste en la depuración extracorpórea de la sangre del exceso de agua, sal y otros solutos a través de una membrana semipermeable impulsada por una bomba de extracción contenida en la máquina de diálisis.
La extracción de la sangre requiere de un catéter venoso central de doble lumen conectado al circuito de diálisis. La sangre extraída es impulsada al interior de un conjunto de fibras huecas compuestas por una membrana semipermeable de celulosa o polímero sintético con una superficie de intercambio de 1 a 2,5m2, compactada al interior de una carcasa denominada, en conjunto, como hemodializador o hemofiltro. La membrana semipermeable divide el dializador en dos compartimientos, el sanguíneo al interior de la fibra hueca y el del dializado o ultrafiltrado por fuera de ésta. Los mecanismos de remoción de sustancias incluyen el transporte de agua y solutos a través de la membrana por difusión y convección, además de la adsorción de moléculas de acuerdo al tipo de membrana utilizada y a la modalidad de terapia indicada.
Acceso vascular en terapias de reemplazo renal agudoLa cateterización yugular o femoral en pacientes críticos implica un procedimiento invasivo que puede contribuir a un aumento de morbilidad asociada a posibles complicaciones mecánicas, infecciosas o trombóticas7. Un estudio aleatorizado controlado demostró que la localización yugular del acceso no reduce el riesgo de complicaciones infecciosas, excepto en pacientes con índice de masa corporal (IMC) mayor a 28,4 quienes presentan mayor riesgo de colonización de dispositivos de diálisis en localización femoral8. La cateterización vía subclavia debe ser evitada por aumento del riesgo de estenosis venosa y dificultad de acceso vascular a largo plazo en caso de que la función renal no se reestablezca9.
Transporte y moléculasLas toxinas urémicas son definidas como productos del metabolismo que son acumulados cuando la capacidad excretora renal se encuentra alterada. Basado en sus características fisicoquímicas se dividen en tres grupos: moléculas solubles pequeñas (peso molecular<500Da), moléculas solubles medianas (peso molecular entre 500–12 000Da) y moléculas unidas a proteínas10.
El principio de hemodiálisis involucra el movimiento de solutos de menor tamaño (ej. urea, creatinina, electrolitos) y agua hacia el compartimiento del dializado mientras que las moléculas de mayor tamaño como células sanguíneas y proteínas son retenidas dentro del compartimiento sanguíneo. El transporte de moléculas pequeñas se produce desde el compartimiento de mayor concentración al de menor concentración por mecanismo de difusión mientras que el transporte de agua plasmática se produce por ultrafiltración como consecuencia del gradiente de presión generado sobre la membrana o mecanismo de convección11. La tasa de ultrafiltración depende de la porosidad de la membrana y la presión hidrostática generada por la sangre al interior de la fibra. El transporte de moléculas medianas disueltas en agua plasmática depende de la tasa de ultrafiltración y de las características específicas de la membrana. Se han identificado más de 25 toxinas urémicas unidas a proteínas divididas en fenoles, indoles, hipuratos, péptidos, poliaminas y productos glicosilados capaces de aumentar la susceptibilidad a infecciones y complicaciones vasculares12. Debido a su unión a proteínas plasmáticas estas moléculas son removidas con técnicas de hemoperfusión o hemodiafiltración por mecanismos de adsorción.
En el pasado, se utilizaban membranas de celulosa no modificada en técnicas de hemodiálisis. Estas son membranas homogéneas y simétricas con alta permeabilidad a moléculas pequeñas disueltas en el agua del plasma. En la actualidad se han desarrollado membranas sintéticas con mayor permeabilidad al agua, mayor resistencia, mayor tamaño y uniformidad en la distribución de los poros y mayor asimetría en su espesor. Estos cambios favorecen las propiedades de transporte convectivo, biocompatibilidad y estabilidad a lo largo de la terapia13. Los polímeros utilizados en la fabricación incluyen polisulfona, polietersulfona, poliamida, policarbonato y poliacrilonitrilo, entre otros. A pesar de estos avances, la coagulación del circuito extracorpóreo es una complicación frecuente. El uso de anticoagulantes permite mantener el circuito funcional, sin embargo, puede aumentar el riesgo de complicaciones hemorrágicas. La decisión del uso de anticoagulación va a depender de la duración de la terapia, modalidad y riesgos de cada paciente. La heparina fraccionada o no fraccionada es la estrategia farmacológica más frecuentemente utilizada. Más recientemente, la anticoagulación regional con citrato en terapias continuas permite quelar calcio al interior del circuito manteniendo estables los niveles plasmáticos de calcio ionizado del paciente14. Esta técnica ha demostrado ventajas en comparación con otros métodos de anticoagulación. El citrato es considerado más seguro que la heparina ya que tiene menos efectos adversos, como la trombocitopenia inducida por heparina, y puede reducir el riesgo de sangrado al evitar la necesidad de altas dosis de heparina. Asimismo, permite que la terapia de reemplazo renal se realice durante períodos de tiempo más prolongados sin interrupciones debidas a problemas de coagulación del filtro14. Es importante destacar que la anticoagulación regional con citrato requiere una monitorización cuidadosa de los niveles de calcio y pH sanguíneo durante el procedimiento por el riesgo asociado de alcalosis metabólica. Evidencia reciente sugiere que la anticoagulación regional con citrato tiene efectos inmunomoduladores, mitigando la respuesta inflamatoria a través de la reducción de la expresión del receptor CD11b en neutrófilos y mejoría de la fibrinolisis por reducción en los niveles del inhibidor del activador del plasminógeno tipo 1 (PAI-1)15. Algunos componentes biológicos como heparina y vitamina E se han agregado a las membranas de diálisis para incrementar su biocompatibilidad. La adición de materiales adsorbentes como carbón activado, hidroxiapatita y recientemente zeolita, permite mejorar el clearance de toxinas urémicas unidas a proteínas como p-cresol y de moléculas de mediano tamaño (ej. beta-2 microglobulina)16. Las membranas pueden ser clasificadas de acuerdo a su coeficiente de filtración de agua y de acuerdo a su eficiencia. Las membranas de bajo flujo son aquellas que tienen un coeficiente de filtración menor a 10ml/h/mmHg, mientras que las de alto flujo tienen un coeficiente de ultrafiltración mayor a 20ml/h/mmHg con un clearance convectivo de moléculas de mediano tamaño mayor a 20ml/min. Por otro lado, la eficiencia está determinada por el coeficiente de transferencia de masa de urea (KoA urea), siendo menor a 500ml/min en las membranas de baja eficiencia y mayor a 600ml/min en las de alta eficiencia de transporte.
Modalidades de terapias de reemplazo renalExisten distintas modalidades de terapias de reemplazo renal utilizadas en pacientes críticamente enfermos. La evidencia es controversial respecto a la tolerancia hemodinámica, sobrevida y recuperación de la función renal, por lo que la indicación debe ser individualizada de acuerdo a criterios clínicos y recursos disponibles.
Clasificación por tiempo de permanencia de la terapia de reemplazo renalLa hemodiálisis intermitente se caracteriza por periodos cortos de permanencia (3-6 horas), mientras que la terapia de reemplazo renal continua se indica por 24 horas y es habitualmente mantenida por varios días. Respecto a la mortalidad, el ensayo más grande realizado incluye 360 pacientes, la mayoría de ellos con compromiso hemodinámico severo. La mortalidad al día 60 no fue diferente según la técnica (32% versus 33%; p=0,98 para hemodiálisis intermitente y continua, respectivamente)17. En contraste, otro estudio que incluyó a 166 pacientes reportó una mayor mortalidad hospitalaria con hemodiálisis continua respecto a hemodiálisis intermitente (66% versus 48%; p<0,02)18. Los autores de este estudio atribuyeron este hallazgo a un desequilibrio en algunas características al inicio del estudio. Una revisión sistemática de Cochrane y varios metaanálisis concluyeron la falta de diferencia de mortalidad entre TRR continua y hemodiálisis intermitente18–21. La TRR continua tiene ventajas específicas en pacientes con edema cerebral y presión intracraneal elevada, como se ven en las lesiones cerebrales agudas o en la insuficiencia hepática. Los cambios rápidos en la osmolalidad sérica son más probables con la hemodiálisis intermitente y pueden precipitar o exacerbar el edema cerebral22. Esto se refleja en la recomendación del uso preferente de TRR continua para estos pacientes en las guías de práctica clínica1–23.
Es más probable que la hemodiálisis intermitente precipite hipotensión intradiálisis en pacientes críticamente enfermos. Se sabe que el estrés circulatorio sistémico inducido por la diálisis, precipitado por muchos factores como hipovolemia intradiálisis, hipotensión, hipoxia, cambios osmóticos, vasoplejía y arritmias cardíacas, incita y exacerba la lesión cardíaca y el daño de órganos terminales24,25. La detección clínica de estrés circulatorio sistémico inducido por diálisis en pacientes críticamente enfermos puede quedar enmascarada por el shock circulatorio y la disfunción multiorgánica concomitante. En un estudio observacional de un solo centro, entre los pacientes críticamente enfermos que recibieron terapia de reemplazo renal continua, el 50% experimentó hipotensión intradiálisis después de la transición a hemodiálisis intermitente, siendo el requerimiento de drogas el factor de riesgo más potente26.
Clasificación por técnica de remoción de solutos- -
Hemodiálisis: El principal mecanismo de remoción de solutos en hemodiálisis es la difusión de moléculas desde el compartimiento sanguíneo a la solución de dializado. Es más efectiva en la remoción de moléculas pequeñas y requiere de circulación en configuración de contracorriente de ambos compartimientos para optimizar la eficiencia del procedimiento. En general se realiza con membranas de bajo flujo, sin embargo, dializadores de alto flujo permiten optimizar el transporte convectivo durante la terapia conocida como hemodiálisis de alto flujo27.
- -
Hemofiltración: Es una terapia exclusivamente convectiva en la que se obtiene el ultrafiltrado del plasma a través de una membrana de alto flujo en ausencia de líquido de dializado. Requiere la infusión de una solución estéril dentro del compartimiento de sangre para reponer parcial o totalmente el volumen de plasma reducido y disminuir la concentración de solutos. Esta solución de sustitución puede administrarse antes de la entrada de la sangre al hemofiltro, con la consecuente disminución en la eficiencia del clearance de solutos o a la salida del recorrido de la sangre por el hemofiltro, aumentando el riesgo de coagulación al interior de las fibras por hemoconcentración28. La hemofiltración de alto volumen, definida por dosis de sustitución de 50-70ml/kg/hora de administración continua o de 100ml/kg/hora por 4-6 horas29 ha sido utilizada como estrategia de soporte en pacientes con shock séptico por la eliminación de mediadores de respuesta inflamatoria por método convectivo. Estudios aleatorizados han demostrado resultados variables respecto de la mejoría de parámetros hemodinámicos y sobrevida30,31.
- -
Hemodiafiltración: Consiste en una técnica combinada de hemodiálisis y hemofiltración en la que la remoción de solutos ocurre por mecanismos de difusión y convección. Requiere el uso de membranas de alto flujo, la administración de fluido de sustitución y liquido en el compartimiento de dializado o efluente32.
- -
Hemoperfusión: En la técnica de hemoperfusión o plasmaperfusión la sangre circula por una membrana que contiene sorbentes específicos, permitiendo la remoción de sustancias unidas a proteínas, o liposolubles como toxinas urémicas, o venenos por mecanismo de adsorción. Los sorbentes naturales como el carbón activo o la zeolita o los sorbentes sintéticos pueden estar incorporados en la estructura del poro de la membrana o pueden tener forma de gránulos, polvo o pellets con superficies de exposición extremadamente altas que varían entre 300 y 1200m2/g33,34.
Existen dispositivos diseñados para hemoperfusión y adsorción de citoquinas y endotoxinas, con o sin hemodiálisis o hemofiltración asociada. Las nanopartículas de carbón no poroso y grafeno embebidas en criogel remueven eficientemente citoquinas desde el torrente sanguíneo35. Más recientemente se han desarrollado columnas de adsorción específicas como CytoSorb®, compuesto de cuentas de copolímero de poliestireno divinilbenceno biocompatibles capaces de adsorber moléculas de peso molecular medio utilizando una combinación de exclusión de tamaño (60 kDa) e interacciones hidrofóbicas en una superficie total mayor a 45 000m2, removiendo citoquinas inflamatorias (IL-1B, IL-6, IL-8, IL-10, TNF-α, IFN-γ), proteínas (mioglobina, ferritina, hemoglobina libre), DAMPs (patrones moleculares asociados a la lesión, por sus siglas en inglés) y PAMPs (patrones moleculares asociados a microorganismos patógenos, por sus siglas en inglés) que pueden contribuir a la desregulación de la respuesta inflamatoria36,37. Un estudio multicéntrico y prospectivo en 45 pacientes con shock séptico mostró descenso significativo en los requerimientos de drogas vasoactivas (norepinefrina (51,4%), epineprina (69,4%) and vasopresina (13,%)), reducción de los niveles de IL-6 (53%) y reducción de la mortalidad predictiva por APACHE II de 56,5 a 48,8%, con énfasis en el inicio de la hemoperfusión dentro de las primeras 24 horas de evolución de shock38. Por otro lado, un incremento en el nivel de endotoxinas es observado en pacientes con sepsis y LRA, donde columnas específicas con membranas recubiertas de polimixina-B han demostrado reducción del riesgo de mortalidad, menores requerimientos de drogas vasoactivas, disminución del SOFA (Sequential Organ Failure Assessment) score y aumento de los días libres de ventilación mecánica invasiva38. Oxiris es una membrana de diálisis compuesta por AN69 (poliacrilonitrilo) recubierta de polietilenamina y heparina que permite la adsorción de citoquinas y endotoxinas, además de tener funciones de depuración convectivas por hemofiltración de moléculas de hasta 40 kDa. Un estudio no controlado muestra reducción de 37% en el SOFA score a las 48 horas de tratamiento39.
Indicaciones y momento de inicio de terapia de reemplazo renalMúltiples factores deben ser considerados en la decisión de inicio de TRR agudo en pacientes críticos. Datos observacionales muestran una fuerte correlación entre la magnitud de acumulación de fluidos y mortalidad en pacientes con LRA. Esta asociación no establece causalidad dado que los pacientes con mayor compromiso hemodinámico y riesgo de muerte requieren mayor cantidad de fluidos en fase de reanimación. La severidad de la congestión pulmonar y respuesta a diuréticos debe ser considerada como criterio de inicio de reemplazo renal en pacientes críticamente enfermos. Un estudio aleatorizado controlado mostró que pacientes postquirúrgicos con sobrecarga refractaria de volumen y edema pulmonar se benefician del inicio precoz de la TRR con reducción de la mortalidad a 90 días a 39,3% respecto del 54,7% en los pacientes que inician tratamiento en forma tardía40.
La hiperkalemia severa, definida por efectos en la conducción miocárdica o refractaria a manejo médico es indicación de inicio de TRR en pacientes con LRA. La acidosis metabólica refractaria a infusión de bicarbonato o acidosis metabólica secundaria a intoxicación por metformina es indicación de inicio de TRR en pacientes con falla renal aguda. La falla renal persistente por más de 72 horas con valores absolutos de nitrógeno ureico sobre 112mg/dl41, oliguria o complicaciones derivadas de la uremia como encefalopatía, hemorragia o pericarditis son indicaciones de inicio inmediato de TRR. Estrategias de inicio preventivas antes de la aparición de complicaciones no han mostrado beneficio en sobrevida a corto plazo42.
Dosis de terapia de reemplazo renalLa cuantificación de intensidad o dosis de tratamiento varía de acuerdo al tipo de TRR indicada. En hemodiálisis intermitente, la dosis más frecuentemente indicada es de 3 a 5 veces por semana con KT/V de urea de 1,2 por sesión, donde KT/V representa la tasa o clearance de remoción de urea durante el tiempo de terapia indicado normalizado por el volumen de distribución del paciente. Por otro lado, un flujo de 20 a 25/ml/kg de efluente es la dosis recomendada en TRR continuas1.
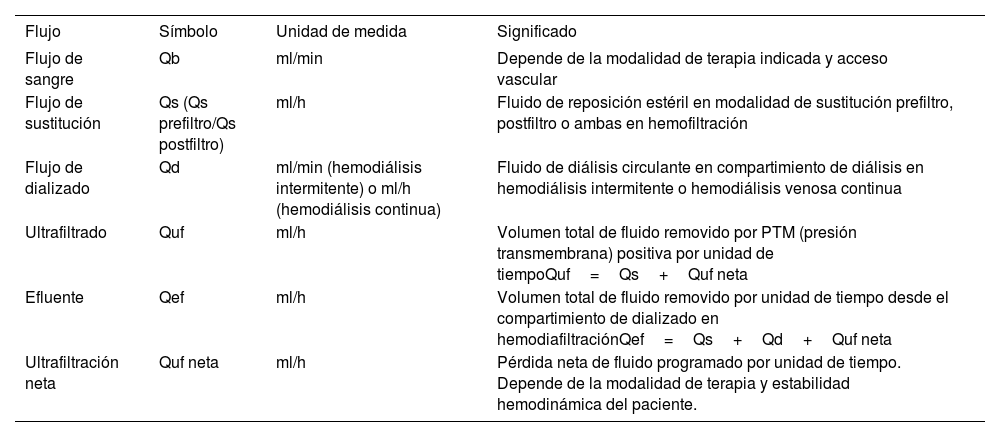
Múltiples estudios han evaluado la influencia de las dosis de tratamiento en pacientes con LRA y TRR. En el caso de TRR continua no se demuestran diferencias al comparar dosis de efluente de 20 y 35ml/kg/h con mortalidad similar a 60 días de 53,6 y 51,5% respectivamente43. Al comparar dosis de efluente de 25ml/kg/h respecto de 40ml/kg/h en pacientes críticos con indicación de hemodiafiltración veno-venosa continua se observó una mortalidad del 44,7% a 90 días en ambos grupos44. Las dosis, flujos y nomenclatura utilizada varía según la modalidad de terapia indicada (tablas 1 y 2).
Nomenclatura de uso habitual en indicación de TRR
| Flujo | Símbolo | Unidad de medida | Significado |
|---|---|---|---|
| Flujo de sangre | Qb | ml/min | Depende de la modalidad de terapia indicada y acceso vascular |
| Flujo de sustitución | Qs (Qs prefiltro/Qs postfiltro) | ml/h | Fluido de reposición estéril en modalidad de sustitución prefiltro, postfiltro o ambas en hemofiltración |
| Flujo de dializado | Qd | ml/min (hemodiálisis intermitente) o ml/h (hemodiálisis continua) | Fluido de diálisis circulante en compartimiento de diálisis en hemodiálisis intermitente o hemodiálisis venosa continua |
| Ultrafiltrado | Quf | ml/h | Volumen total de fluido removido por PTM (presión transmembrana) positiva por unidad de tiempoQuf=Qs+Quf neta |
| Efluente | Qef | ml/h | Volumen total de fluido removido por unidad de tiempo desde el compartimiento de dializado en hemodiafiltraciónQef=Qs+Qd+Quf neta |
| Ultrafiltración neta | Quf neta | ml/h | Pérdida neta de fluido programado por unidad de tiempo. Depende de la modalidad de terapia y estabilidad hemodinámica del paciente. |
Clearance de solutos en terapia de reemplazo renal (TRR) continua
| Tipo de terapia | Transporte de solutos | Qs ml/h | Qb ml/min | Quf ml/h | Qd ml/h |
|---|---|---|---|---|---|
| Hemofiltración veno-venosa continua | convección | si | 150–300 | 1 000–4 000 | 0 |
| Hemodiálisis veno-venosa continua | difusión | no | 150–300 | 0–350 | 1 000–4 000 |
| Hemodiafiltración veno-venosa continua | convección y difusión | si | 150–300 | (Quf neta) | 1 000–4 000 |
En la práctica clínica algunos criterios simples como la recuperación de la diuresis o el descenso espontaneo del nitrógeno ureico y la creatinina son utilizados con indicadores de recuperación de función renal y retiro de la TRR. No existen estudios prospectivos aleatorizados que evalúen criterios precisos para el cese de la TRR continua o intermitente y la decisión es habitualmente guiada por las características y evolución de cada paciente, la estabilidad hemodinámica, sobrecarga de fluidos, trastornos hidroelectrolíticos y débito urinario. Epidemiológicamente, los motivos más frecuentes de cese de TRR aguda son el incremento del flujo urinario (74%), normalización del pH (70%), adecuación de metas de balance hídrico (54%) y normalización de nitrógeno ureico o creatinina (39%)45. Análisis multivariados han mostrado que flujos urinarios mayores a 436ml/día sin diuréticos y mayores a 2330ml/día con diuréticos 24 horas antes del retiro de la TRR tienen la mayor sensibilidad, especificidad (80,9 y 87,9% respectivamente) y valor predictivo positivo de cese de terapia sin necesidad de reingreso a diálisis46. Por otro lado, factores de riesgo independientes para requerir TRR dentro de 30 días luego de suspender la terapia inicial son un SOFA score elevado, oliguria menor a 100ml/día, enfermedad renal crónica preexistente y edad mayor a 65 años47. Un estudio retrospectivo demostró que un clearance de creatinina de 2 horas mayor a 23ml/min medido 12 horas previo a discontinuar la TRR continua tiene un valor predictivo positivo de 88,8% de probabilidades de no requerir TRR en los siguientes 7 días y fue superior a la predicción estimada por flujo urinario48. La medición del clearance de creatinina de 6 horas mayor a 22ml/min ha mostrado un alto valor predictivo de no requerir de reemplazo renal en los siguientes 30 días43.
ConclusiónLa LRA es una entidad de alta incidencia en las unidades de cuidados críticos y representa un desafío desde su fisiopatología hasta el proceso de toma de decisiones terapéuticas. La sobrecarga de volumen es una complicación frecuente que compromete el estado hemodinámico y respiratorio del paciente crítico, resultando en un aumento de su morbimortalidad. Diversos investigadores han propuesto anticiparse a estos factores, sugiriendo la indicación precoz de la TRR, sin lograr demostrar beneficio en mortalidad excepto en pacientes críticos postoperatorios.
Asimismo, la tendencia durante las últimas décadas a aumentar la dosis de diálisis tampoco ha reportado beneficios. La anticoagulación con citrato se está consolidando como la técnica de elección a la hora de optimizar la permeabilidad del circuito, reduciendo los riesgos de sangrado y trombocitopenia asociados con el uso de la heparina clásica. Finalmente, la modalidad de inicio, uso secuencial de técnicas e interrupción de la terapia de sustitución renal depende de criterios clínicos individuales y se requiere de más evidencia para el desarrollo de recomendaciones más específicas.
FinanciaciónLa presente investigación no ha recibido financiamiento de agencias del sector público, sector comercial o entidades con o sin ánimo de lucro.
Declaración de conflicto de interésLa autora declara no tener conflictos de interés.