El shock cardiogénico (SC) es un proceso patológico multifactorial con alta morbimortalidad. Cuando ocurre en relación con el entorno perioperatorio de cirugía cardiovascular, elementos como causa de la cirugía (preoperatorio), procedimiento realizado (intraoperatorio), eventos anestésicos y fenómenos fisiopatológicos postquirúrgicos precoces y tardíos (postoperatorio) pueden afectar negativamente los resultados del paciente. En este contexto, y como consecuencia de la gran heterogeneidad de fenómenos fisiopatológicos relacionados a una causa única o múltiples del shock cardiogénico (pre, intra y postoperatorio), es imprescindible un enfoque multidisciplinario que abarque todos los aspectos de la clínica del paciente para decidir el tratamiento más adecuado para cada escenario que evalúelos riesgos de cada tratamiento y proyecte una posible evolución del cuadro. La oxigenación por membrana extracorpórea veno-arterial (ECMO-VA) entrega un soporte hemodinámico y de oxigenación más sólido que otros soportes, reemplazando parcial o totalmente los sistemas cardíaco y respiratorio del paciente. El ECMO-VA periférico puede instalarse rápidamente al lado de la cama en el caso de pacientes gravemente inestables. El ECMO-VA central tiene la ventaja única de servir como soporte estable en el caso de shock cardiogénico posterior a la cardiotomía y se puede convertir fácilmente mediante las inserciones de cánulas para el bypass cardiopulmonar, constituyendo un puente para toma de decisiones. La elección de la configuración adecuada (periférico o central) dependerá, por tanto, de la causa que generó el shock cardiogénico y lo agudo del cuadro, por lo que la estrategia más adecuada de manejo debe ser realizada por un equipo multidisciplinario a modo de velar por un diagnóstico y tratamiento más temprano y asegurar la preservación de la función miocárdica al considerar todas las posibles complicaciones derivadas de cada tipo de soporte
Cardiogenic shock (CS) is a multifactorial pathological process with high morbidity and mortality. When it occurs in relation to the perioperative environment of cardiovascular surgery, elements such as the cause of the surgery (preoperative), the procedure performed (intraoperative), anesthetic events, and early and late postoperative pathophysiological phenomena (postoperative) can negatively affect patient outcomes. In this context, and as a consequence of the great heterogeneity of pathophysiological phenomena related to a single or several causes of cardiogenic shock (pre, intra and postoperative), a multidisciplinary approach that encompasses all aspects of the patient's clinic is essential to decide the most appropriate treatment for each scenario, evaluating the risks of each treatment, as well as projecting a possible evolution of the condition. Veno-arterial extracorporeal membrane oxygenation (VA-ECMO) provides more robust hemodynamic support and oxygenation than other supports, partially or totally replacing the patient's cardiac and respiratory systems. Peripheral VA-ECMO can be quickly installed at the bedside in severely unstable patients. VA-ECMO has the unique advantage of serving as a stable support in the event of cardiogenic shock following cardiotomy and can be easily converted from cannula insertions to cardiopulmonary bypass, providing a bridge to decision making. The choice of the appropriate configuration (peripheral or central) will depend, therefore, on the cause that generated the cardiogenic shock and the acuteness of the condition, so the most appropriate management strategy must be carried out by a multidisciplinary team in order to ensure an early diagnosis and treatment and guarantee the preservation of myocardial function by considering all the possible complications derived from each type of support.
El shock cardiogénico (SC) se define como una disfunción cardíaca primaria que conduce a hipoperfusión e hipoxemia de órganos críticos. Es causado por un deterioro grave del rendimiento miocárdico que da como resultado una disminución del gasto cardíaco, hipoperfusión de órganos diana e hipoxia1,2.
Clínicamente, esto se presenta como hipotensión persistente y signos de compromiso de la perfusión de órganos diana, como extremidades frías, oliguria o estado mental alterado a pesar de la corrección de la hipovolemia subyacente3.
El infarto agudo de miocardio (IAM) es la causa más frecuente de SC, representando hasta el 70% de los casos y ocurriendo en el 5-10% de los pacientes con IAM. A pesar de los importantes avances terapéuticos, la mortalidad del SC en el contexto de un IAM se mantiene inaceptablemente alta (40-50%)4.
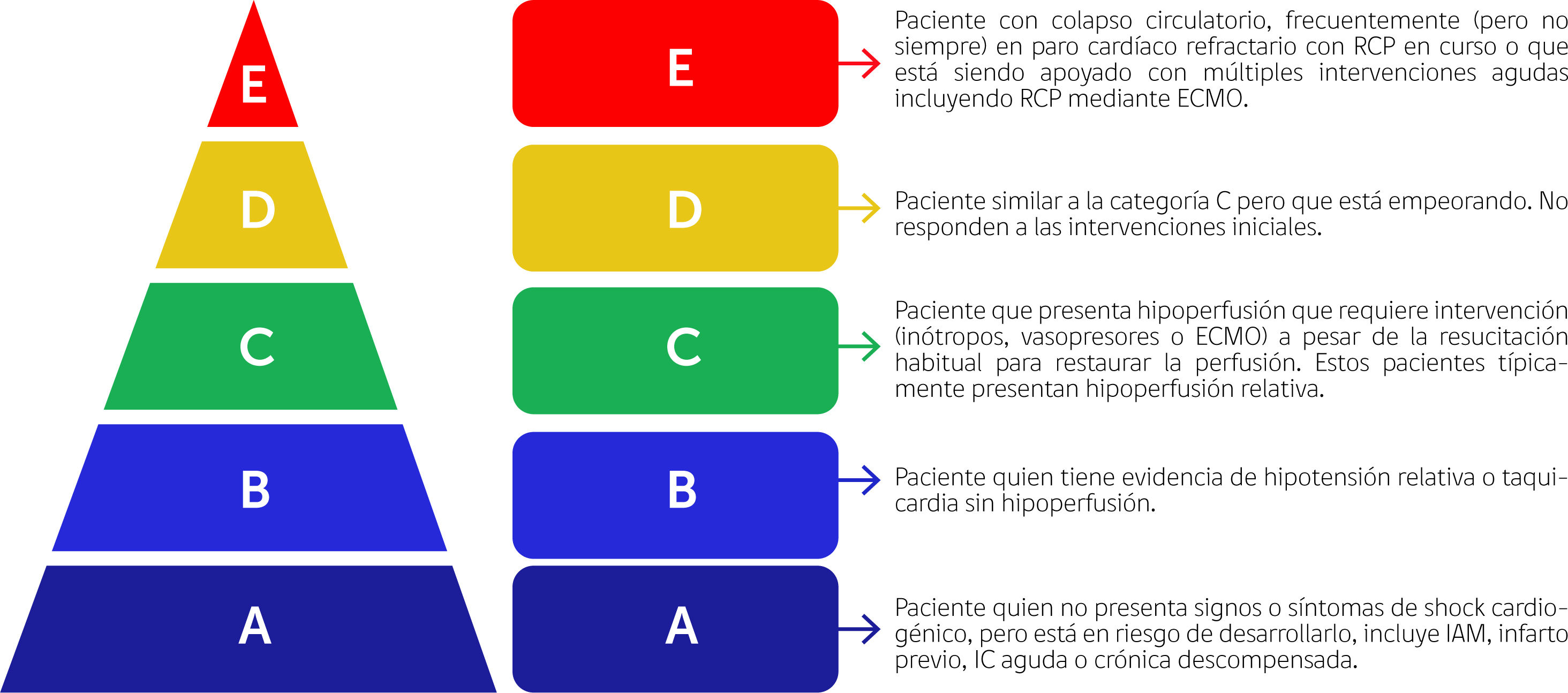
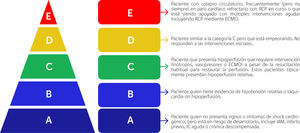
Los pacientes con SC representan una población heterogénea con pronóstico variable según la etiología, la gravedad de la enfermedad y las comorbilidades. El SC es un continuo que se extiende desde los estados previos al shock hasta los estados de shock refractario, lo que influye en las consideraciones oportunas de varias intervenciones. Reconocer este continuo facilita la unifi- cación de los criterios clínicos y hemodinámicos para definir el SC. La Sociedad de Angiografía e Intervención Cardiovascular (SCAI) propone una nueva clasificación del SC que incluye cinco estadios (A-E) de gravedad creciente según los signos clínicos, biológicos y hemodinámicos del SC5 (Fig. 1).
Cuando el shock cardiogénico ocurre en relación con el entorno perioperatorio de cirugía cardiovascular, elementos como causa de la cirugía (preoperatorio), procedimiento realizado (intraope- ratorio), eventos anestésicos y fenómenos fisiopatológicos post- quirúrgicos precoces y tardíos (postoperatorio) pueden afectar negativamente los resultados del paciente. La heterogeneidad de fenómenos fisiopatológicos relacionados a causas únicas o múlti- ples del shock cardiogénico en el entorno perioperatorio de una cirugía cardíaca requiere de un enfoque multidisciplinario que abarque todos los aspectos de la clínica del paciente para decidir el tratamiento más adecuado para cada escenario.
El objetivo de esta revisión es mostrar, en el entorno periopera- torio, cuáles son los elementos que deben ser considerados por el equipo multidisciplinario al momento elección de la configu-ración adecuada del ECMO-VA (periférico o central), basados en la causa que generó el shock cardiogénico, lo agudo del cuadro y las posibles complicaciones derivadas de cada tipo de soporte, a modo de asegurar la preservación de la función cardíaca.
2FisiopatologíaEl fenómeno principal es una reducción de la contractilidad miocárdica que da como resultado una disminución del gasto cardíaco, hipotensión, vasoconstricción sistémica e isquemia miocárdica.
Lacaracterísticadistintivaeslavasoconstricciónperiféricayeldaño de órganos diana, que se deriva de un volumen sistólico ineficaz y una compensación circulatoria insuficiente6. La vasoconstricción periférica compensatoria puede mejorar inicialmente la perfusión coronaria y periférica, sin embargo, contribuye a aumentar la poscarga cardíaca que sobrecarga el miocardio dañado. Esto da como resultado una disminución del flujo de sangre oxigenada al tejido periférico y, en última instancia, al corazón.
La inflamación sistémica provoca vasodilatación patológica, libe- rando óxido nítrico sintetasa y peroxinitrito, que tienen efectos inotrópicos cardiotóxicos7.
Debido a estos fenómenos, en el SC refractario a las catecolaminas, parece lógico considerar el uso de soporte circulatorio en lugar de un mayor soporte farmacológico. Por lo tanto, el uso de dos inótropos a dosis ascendentes indica la necesidad de soporte mecánico circula- torio. El dispositivo de elección en shock cardiogénico refractario es la oxigenación por membrana extracorpórea venoarterial.
3Shock cardiogénico en el perioperatorio e intraoperatorio de cirugía cardíacaCuando el SC tiene lugar en un entorno peri e intraoperatorio, factores como la cirugía, la anestesia y los problemas fisioló-gicos posquirúrgicos pueden tener un impacto negativo en los resultados del paciente. El más común es el infarto agudo de miocardio con disfunción del ventrículo izquierdo (VI)1, que puede presentarse como shock cardiogénico en el preopera- torio (insuficiencia mitral aguda por ruptura de cuerda tendínea, comunicación intraventricular o aneurisma apical). La disfunción miocárdica después de una intervención quirúrgica cardíaca (periodo intra o postoperatorio) ocurre en alrededor del 3 al 8% de los pacientes8–11, la que se puede atribuir a un gasto cardíaco bajo (hibernación, aturdimiento o cardioprotección inadecuada), vasodilatación sistémica, o ambos12,13.
Otras causas de disminución del gasto cardíaco (GC) en el perio- peratorio se exponen en la Tabla 1:
Causas de shock cardiogénico en el perioperatorio de cirugía cardíaca
| • Infarto agudo de miocardio |
| • Patología valvular aguda |
| −Insuficiencia mitral aguda por ruptura de cuerdas |
| −Insuficiencia aórtica aguda por una disección aórtica que incluye el anillo aórtico. |
| • Obstrucción del tracto de salida del ventrículo izquierdo |
| • Patología valvular aguda |
| • Arritmias |
| • Shock obstructivo |
| −Tromboembolismo pulmonar |
| −Taponamiento pericárdico |
| −Neumotórax a tensión |
| −Hemotórax |
| • Síndrome compartimental abdominal. |
| • Obstrucción dinámica |
| −Hipertrofia septal asimétrica fisiológica |
| −Miocardiopatía obstructiva hipertrófica14 |
Existen múltiples etiologías posibles para el SC en el periopera- torio. El más común es el infarto agudo de miocardio con disfun- ción del VI1.
Otras causas de disminución del gasto cardíaco (GC) en la Tabla 1:
Los pacientes normalmente se separan de la circulación extra- corpórea con inótropos/vasopresores o balón de contrapulsación intraaórtico (BCIA). En caso de disfunción cardíaca y/o pulmonar refractaria, asociada al impacto negativo de los agentes vaso- presores prolongados e inótropos en pacientes en SC, puede ser necesaria una asistencia circulatoria mecánica adicional, aunque actualmente no existe consenso sobre la elección del dispositivo. Dicha elección puede ser extraordinariamente compleja y debe integrar criterios fisiopatológicos específicos de cada paciente y un plan concertado a largo plazo.
4ECMO en shock cardiogénicoDurante la última década, el uso de la oxigenación por membrana extracorpórea (ECMO) ha aumentado exponencialmente, de aproximadamente 30 a 40 pacientes por año en los Estados Unidos hace 20 años, a más de 2000 por año en la actualidad, y sigue aumentando15. El ECMO-VA como terapia de rescate en pacientes con shock cardiogénico refractario permite el apoyo circulatorio mecánico como puente en los casos en los que existe una función cardíaca residual deficiente con una baja posibilidad de recuperación y una necesidad de pasar a un dispositivo más duradero o trasplante cardíaco. Si bien los datos de la Organiza- ción de Soporte Vital Extracorpóreo (ELSO) continúan mostrando una alta mortalidad en pacientes que requieren soporte ECMO, no existe una comparación directa de ECMO versus tratamiento médico en SC agudo grave, donde se pueden anticipar resultados de mortalidad mucho más altos16–18.
La elección de los candidatos adecuados y la gestión de su cuidado diario puede ser un gran desafío, y los factores pronós- ticos previamente identificados incluyen: prevención de la sobre- carga del ventrículo izquierdo, edema pulmonar, lesión pulmonar y daño miocárdico. Indicadores pronósticos adicionales son baja presión de oxígeno y baja saturación de oxígeno del circuito ECMO, edad avanzada, comorbilidades preoperatorias, el tipo de procedimiento quirúrgico y alto requerimiento de hemode- rivados19–25.
En relación con el entorno quirúrgico cardiovascular, las características únicas de cada paciente y la fisiopatología asociada a la indicación de soporte determinan que el shock cardiogénico perioperatorio requiera un enfoque de equipo multidisciplinario que permita elegir el dispositivo y estrategia de conexión más adecuada que minimice las complicaciones y proporcione una mejora en los resultados del paciente. En este contexto, ECMO-VA se considera la terapia de soporte temporal (TCS, por sus siglas en inglés) de primera línea, ya que permite una rápida mejoría en la oxigenación, es menos costoso y tiene ventajas para pacientes con insuficiencia biventricular grave o en caso de arritmia maligna, así como en la insuficiencia pulmonar asociada26–29. El ECMO-VA permite el soporte durante días o semanas como un “puente a toma de decisiones” que va desde el retiro del soporte después de la recuperación de la función cardíaca, trasplante cardíaco, soporte circulatorio mecánico (MCS, por sus siglas en inglés) a largo plazo y la desconexión en caso de que la recuperación cardíaca sea poco probable y no haya indicación para un trasplante de corazón o un dispositivo dura- dero de asistencia del ventrículo izquierdo (AVI).
Se debe considerar ECMO-VA para el shock cardiogénico dentro de las 6 horas posteriores a su ocurrencia, refractario a la terapia farmacológica y fluidos convencionales, y en pacientes con colapso cardiocirculatorio reversible o aquellos elegibles para asistencia cardiocirculatoria alternativa o trasplante, debiendo iniciarse ANTES de la falla multiorgánica y después de una evaluación ecocardiográfica exhaustiva (Tabla 2). Las etiologías que comprometan la función adecuada del ECMO (insuficiencia aórtica) deben considerarse como posibles contraindicaciones (Tabla 3). La edad, per se, no debe utilizarse como contraindica- ción absoluta. La puntuación pronóstica (SAVE score) se puede utilizar para proporcionar información sobre la toma de deci- siones antes de ECMO, aunque no se aplica a entornos posteriores a la cardiotomía30 (Tabla 4).
Indicaciones comunes de ECMO
| Enfermedades médicas |
| • Infarto agudo de miocardio |
| • Miocarditis fulminante |
| • Intoxicación con fármacos cardiotóxicos |
| • Cardiomiopatía aguda postparto |
| • Miocardiopatía isquémica o dilatada en etapa terminal |
| • Hipotermia con inestabilidad cardiocirculatoria refractaria |
| • Embolia pulmonar masiva |
| • Paro cardiorrespiratorio refractario |
| • Tormenta arrítmica |
| • Back-up para procedimientos cardiológicos intervencionales |
| Postquirúrgicas |
| • Postcardiotomía |
| • Postrasplante/asistencia ventricular izquierda |
Contraindicaciones del uso de ECMO-VA
| • Recuperación cardíaca poco probable, sin indicación para un trasplante cardíaco o un dispositivo de asistencia para ventrículo izquierdo (LVAD) |
| • Baja esperanza de vida (enfermedades de órganos periféricos en etapa terminal, tumor maligno, embolias pulmonares masivas en pacientes con cáncer, miocardiopatía crónica inducida por quimioterapia, etc.) |
| • Insuficiencia valvular aórtica grave |
| • Enfermedad vascular grave con extenso compromiso de aorta y vasos periféricos |
| • Disección aórtica aguda tipo A o B con extenso compromiso de ramas antes de la cirugía |
| • Deterioro neurológico grave |
| • Enfermedad inmunológica grave con trastornos marcado de la coagulación |
| • Cirrosis hepática (Child-Pugh clase B y C) |
The SAVE Score
| Parámetro | Score | |
|---|---|---|
| Diagnóstico | ||
| Miocarditis | 3 | |
| FV/TV refractaria | 2 | |
| Postrasplante cardíaco o pulmonar | 3 | |
| Cardiopatía congénita | −3 | |
| Otros diagnósticos | 0 | |
| Edad | ||
| • 18-38 | 7 | |
| • 39-52 | 4 | |
| • 53-62 | 3 | |
| • >63 | 0 | |
| Peso | −3 | |
| • <65 | 1 | |
| • 65-89 | 2 | |
| • >90 | 0 | |
| Falla orgánica aguda pre ECMO | ||
| Insuficiencia hepática | −3 | |
| Insuficiencia renal | −3 | |
| Disfunción sistema nervioso central | −3 | |
| Insuficiencia Renal crónica >3 meses | −6 | |
| Duración de intubación pre ECMO | ||
| • <10 | 0 | |
| • 11-29 | −2 | |
| • >30 | −4 | |
| Presión inspiratoria máxima <20cm H2O | 3 | |
| HCO3 pre ECMO<15mmol/L | −3 | |
| PAD pre ECMO >40mmHg | 3 | |
| Paro pre ECMO | −2 | |
| Valor constante para agregar a los cálculos | −6 | |
| Total | −35 a 17 | |
| Clasificación hospitalaria de supervivencia (SAVE Score) | Clase | Supervivencia |
| >5 | I | 75 |
| 1 a 5 | II | 58 |
| −4 a 0 | III | 42 |
| −9 a -5 | IV | 30 |
| <-10 | V | 18 |
FV/TV refractaria: fibrilación ventricular/taquicardia ventricular; ECMO: membrana de oxigenación extracorpórea; PAD: presión arterial diastólica; SAVE Score: SAVE (Survival after Veno-Arterial ECMO) Score.
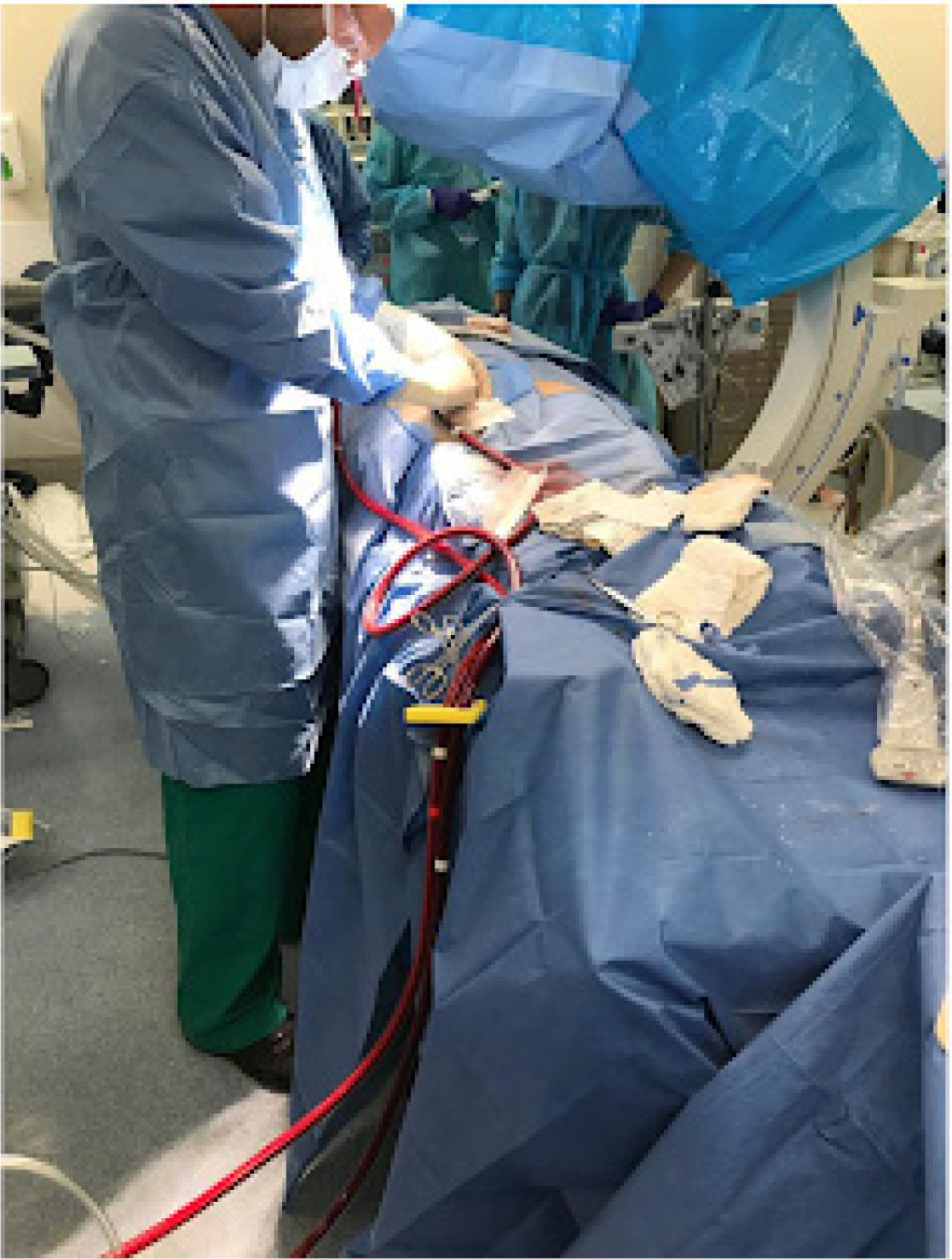
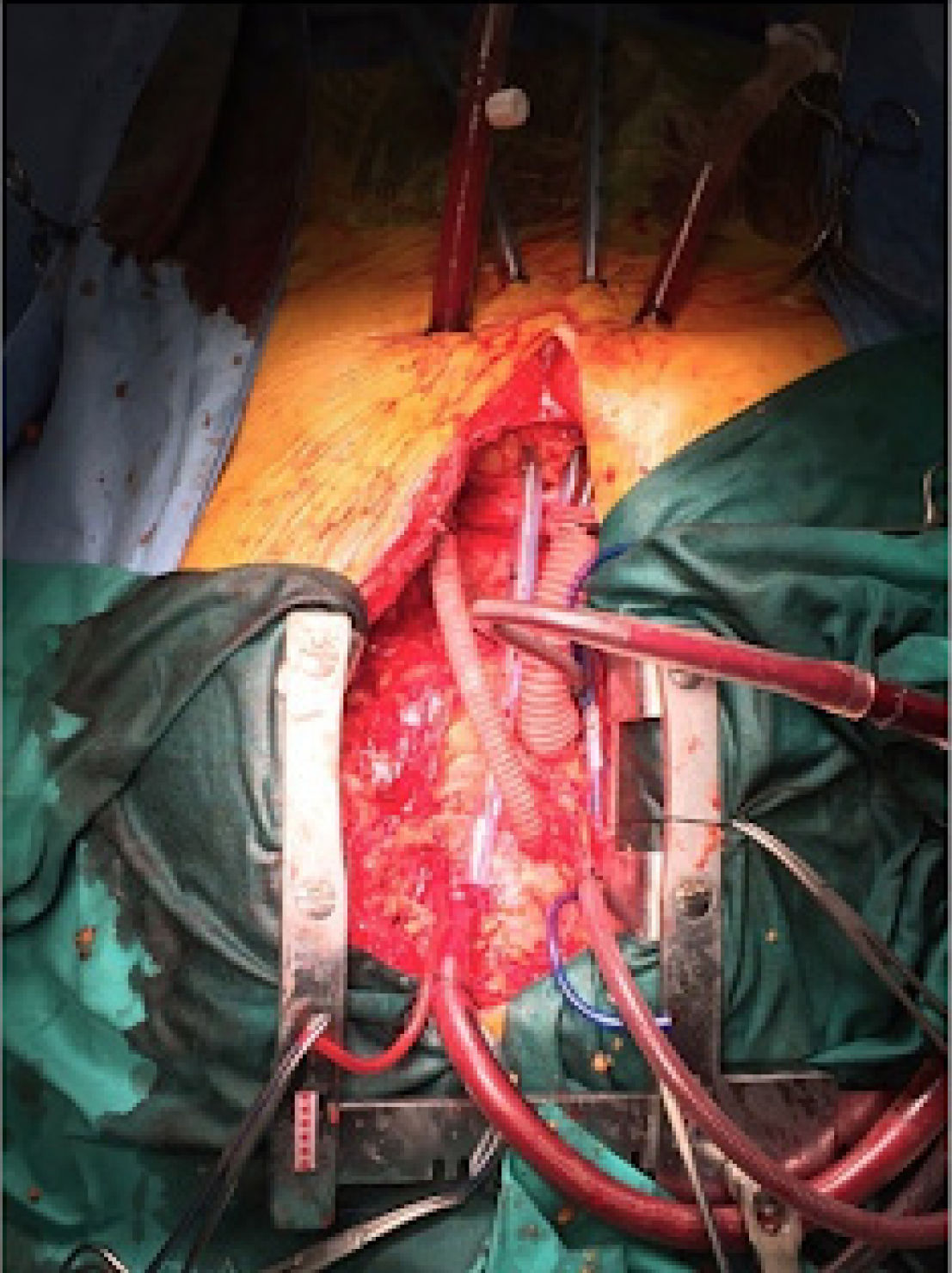
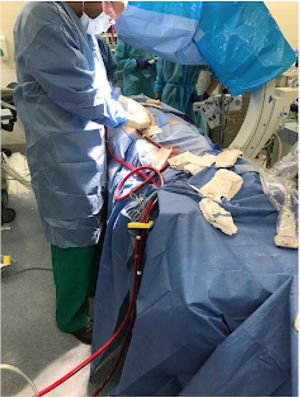
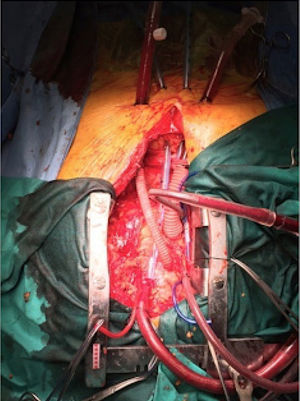
En el escenario perioperatorio, el ECMO-VA asegura el soporte hemodinámico y la oxigenación en el caso que exista una insu- ficiencia de los sistemas cardíaco y/o pulmonar del paciente. El ECMO-VA periférico tiene la ventaja que puede colocarse rápi- damente al lado de la cama en pacientes gravemente inestables (Fig. 2). El ECMO-VA central en el perioperatorio de cirugía cardíaca tiene la ventaja única de asegurar un soporte estable en el shock posterior a la cardiotomía o en aquellos pacientes que no pueden desconectarse del bypass cardiopulmonar (Fig. 3)24,31.
Sin embargo, el ECMO-VA tiene algunos inconvenientes, como la falta de descarga inherente del VI, generando presiones intra- cardíacas más elevadas y una mayor sobrecarga miocárdica, así como un eventual edema pulmonar secundario al aumento de la poscarga, generando daño a otro sistema de órganos y aumentando aún más el riesgo de mortalidad. Por lo tanto, al momento de elegir la estrategia adecuada de conexión, se requiere una evaluación multidisciplinaria y considerar los siguientes puntos32:
- •
Factores hemodinámicos básicos que fundamentan el desa- rrollo del shock cardiogénico
- •
En que pacientes considerar conexión a ECMO-VA y que configuración de conexión tiene más beneficios
- •
Estrategia de canulación
- •
Complicaciones hemodinámicas y fisiológicas asociadas al tipo de canulación
- •
Asegurar perfusión de extremidad en caso de canulación periférica
- •
Evaluar alternativas al uso de ECMO-VA
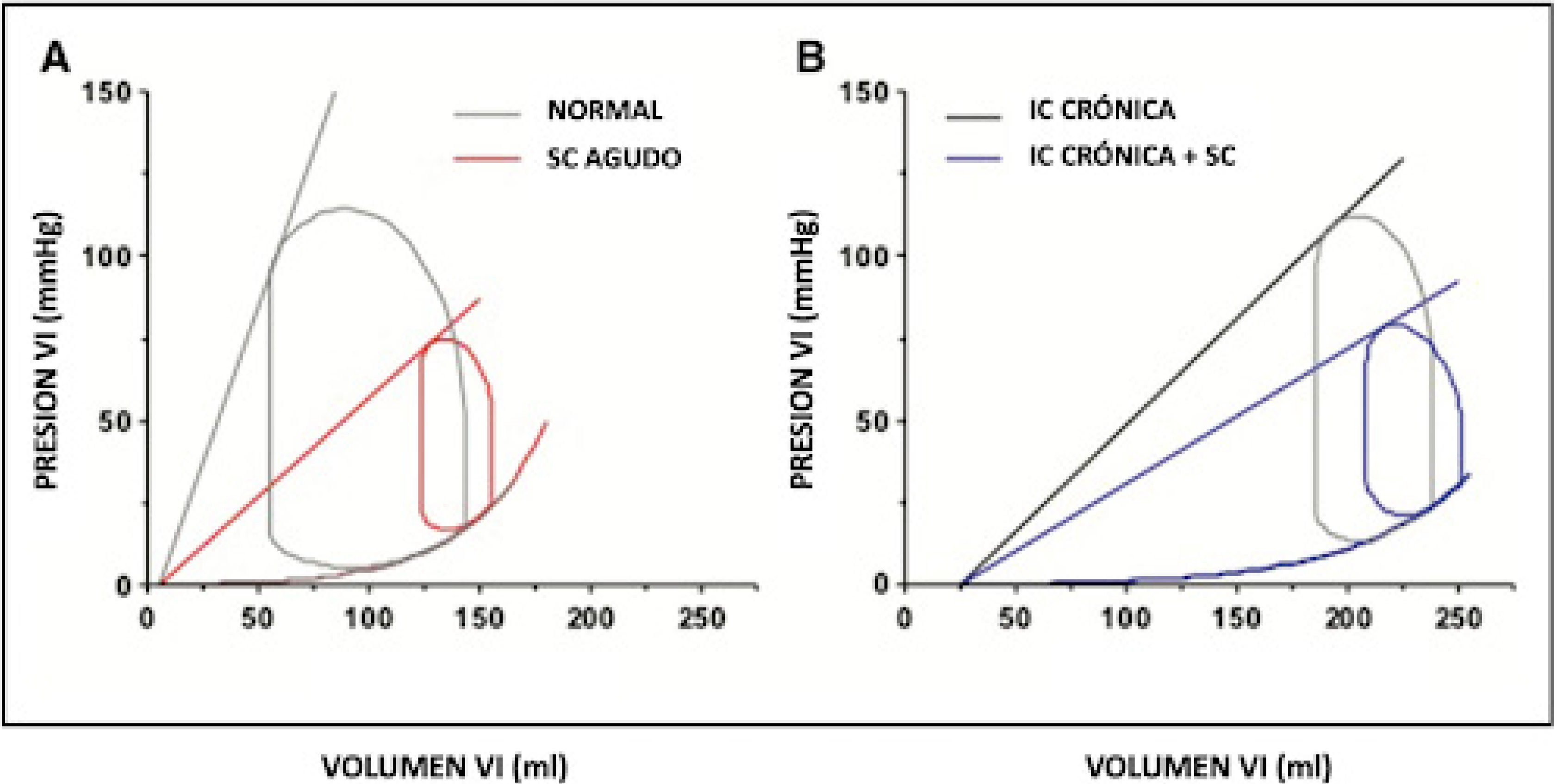
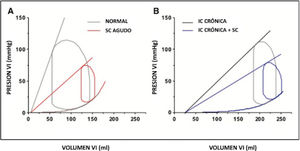
El shock cardiogénico agudo puede deberse a una rápida dismi- nución de la contractilidad ventricular en un individuo previa- mente normal, como puede ocurrir con un infarto de miocardio o una miocarditis aguda, o como consecuencia de una descom- pensación aguda de una insuficiencia cardíaca grave crónica. En ambos casos, el factor común es una reducción primaria de la contractilidad ventricular la que inicia el shock cardiogénico, generando reflejos secundarios en la frecuencia cardíaca, resis- tencia periférica y venoconstricción (Fig. 4).
Estos efectos primarios y secundarios conspiran para aumentar la presión diastólica final del VI y las presiones venosas pulmonares; las presiones venosas centrales también pueden aumentar, incluso en ausencia de disfunción significativa del ventrículo derecho debido a la redistribución del volumen del compartimento peri- férico al central. Sin embargo, aunque las presiones arteriales, las presiones de enclavamiento y los gastos cardíacos pueden ser simi- lares en estos 2 escenarios, las diferencias importantes incluyen las fracciones de eyección inicial y final y el grado de dilatación compensatoria del VI. Es importante tener en cuenta estas dife- rencias, particularmente cuando se trata de considerar los tamaños ventriculares y la necesidad de desencadenar la introducción de una estrategia de descarga del VI durante ECMO. La comprensión de esta representación de presión-volumen del shock cardiogénico proporciona una base sólida para comprender el impacto de ECMO en cada paciente.
5.2Selección de pacientes y elección de la configuración5.2.1Selección de pacientesComo ya se señaló, no existen pautas claras basadas en la evidencia respaldadas por la sociedad (SCAI) para el uso de ECMO-VA o en la selección de pacientes con mayor probabilidad de beneficiarse. Los factores de riesgo asociados con peores resultados a largo plazo después de ECMO-VA incluyen el aumento de la edad y comorbilidades, como cardiopatía isquémica, diabetes mellitus, enfermedad renal crónica y enfermedad pulmonar obstructiva crónica. El grado de alteración ácido-base y la gravedad de la disfunción hepática/renal en el momento del inicio de ECMO son fuertes predictores de supervivencia a largo plazo33.
A la luz de la alta mortalidad hospitalaria, los costos y los problemas éticos, la selección adecuada de pacientes para ECMO-VA requiere una cuidadosa consideración de todos los factores antes mencionados.
5.2.2Configuración del ECMO-VAEn todos estos entornos, el objetivo es (principalmente) asumir la responsabilidad de proporcionar sangre oxigenada a la circulación sistémica. Sin embargo, comprender la hemodi- namia del ECMO es importante para apreciar la necesidad de una monitorización adecuada del paciente para garantizar que el VI y los pulmones no se sobrecarguen de líquido y, cuando esté presente, se realice la intervención adecuada (detallada a continuación). En este sentido, un principio importante es que, si bien ECMO puede descargar las venas centrales, la aurícula y el ventrículo derechos, no descarga intrínsecamente el VI, parti- cularmente cuando la función contráctil del VI está gravemente comprometida.
De hecho, ECMO en un corazón poco contráctil puede aumentar significativamente la presión diastólica final del VI y la tensión de la pared, lo que da como resultado un mayor consumo de oxígeno del miocardio y una mayor susceptibilidad a la necrosis mediada por isquemia.
En pacientes con una lesión cardíaca aguda profunda pero poten- cialmente reversible, como miocarditis e isquemia miocárdica, el ECMO-VA puede proporcionar un puente hacia la recuperación. En pacientes con insuficiencia cardíaca crónica aguda descom- pensada o infarto de miocardio masivo, el ECMO-VA se puede utilizar como terapia de puente al destino, como un dispositivo de asistencia ventricular duradero y trasplante cardíaco.
En muchos casos, se deben considerar estrategias alternativas, como dispositivos de asistencia ventricular temporal percutá- neos o implantados quirúrgicamente (como un puente hacia la estabilidad que conduce a un soporte o recuperación duraderos), para reducir muchas de las complicaciones de ECMO, como la respuesta inflamatoria sistémica, daño a las plaquetas y riesgos de sangrado, daño vascular, isquemia de las extremidades y acci- dente cerebrovascular34,35.
Además, estas estrategias pueden prevenir el desarrollo de edema pulmonar, aumento del estrés de la pared miocárdica y la posi- bilidad de hipoxemia cerebral. Se debe considerar que, hasta la fecha, ECMO es único entre las estrategias de soporte circulatorio mecánico agudo, ya que proporciona intercambio de oxígeno y dióxido de carbono para reemplazar a los pulmones si es nece- sario. En consecuencia, ECMO puede ser útil para pacientes con enfermedad pulmonar subyacente36,37.
5.3Estrategia de canulaciónLa mayor parte de la literatura relacionada con ECMO no delimita entre canulación central y periférica.
El ECMO-VA periférico se establece por vía percutánea o por acceso quirúrgico vascular con canulación doble de una vena y una arteria periféricas. La inserción percutánea se realiza mediante una técnica de Seldinger modificada y se asocia a un menor riesgo de hemorragia e infección, así como a una instala- ción más rápida. Sin embargo, la enfermedad vascular periférica, estenosis o trombos a menudo limitan el abordaje percutáneo38. Las cánulas venosas drenan la sangre de la vena cava superior, aurícula derecha y vena cava inferior, a menudo a través de la vena femoral, vena yugular interna derecha o vena subclavia. Una vez que la sangre se drena del sistema venoso, pasa a través de la bomba y el circuito de intercambio de gases y regresa al sistema arterial con el flujo arterial retrógrado resultante. La arteria femoral se cánula con mayor frecuencia debido a su tamaño y facilidad de acceso a través de una técnica percutánea. con el extremo de la cánula terminando en la arteria femoral común, la arteria femoral común, arteria ilíaca o aorta abdominal distal. Las cánulas más pequeñas proporcionaron un flujo menor pero también tasas de complicaciones arteriales más bajas39.
La principal ventaja del ECMO-VA periférico es la facilidad y rapidez de implementar esta forma de soporte cardiopulmonar fuera del quirófano, por lo que es más utilizado en caso de PCR refractario o shock cardiogénico por otras causas como trom- boembolismo pulmonar (TEP) o IAM, mostrando una sobrevida del 40% en estos casos40,41.
Se puede realizar canulación arterial periférica por acceso axilar innominada o subclavia, con el objeto de obtener algunos bene- ficios de la canulación central sin realizar esternotomía, como la mayor movilidad, disminución del riesgo de hipoxemia cerebral y trombosis de la raíz aórtica, aunque requieren técnica quirúrgica con instalación de un injerto de dacrón lateral y no eliminan la potencial distensión del VI42.
Las estrategias de canulación central para ECMO-VA más comunes utilizan la canulación venosa bicava o de la aurícula derecha y el retorno arterial aórtico directo. Estas cánulas se fijan y se conectan rápidamente a un circuito ECMO con rápida restitución del flujo. Cuando se utiliza una estrategia de este tipo, el circuito suele planificarse para el cierre del tórax. En situaciones en las que existe una baja posibilidad de recuperación y una necesidad de pasar a un dispositivo más duradero o reemplazo cardíaco, las configuraciones únicas, como una canulación apical del VI o una canulación arterial pulmonar, pueden potencialmente cambiarse a un dispositivo de flujo continuo o pulsátil extracorpóreo.
5.4Complicaciones hemodinámicas y fisiológicas asociadas al tipo de canulación5.4.1Distensión VICon el uso de cánulas grandes y bombas modernas, el soporte de flujo ECMO-VA puede ser alto, aunque los flujos suelen ser de 3 a 4 L/min. Al drenar sangre directamente del sistema venoso sistémico, ECMO-VA disminuye la precarga ventricular derecha y la conges- tión venosa periférica. Esta disminución de la precarga del VD no se trasmite al VI y, por tanto, no disminuye la congestión pulmonar, debido a que el flujo del ECMO aumenta la presión arterial y la poscarga del VI, disminuyendo el vaciamiento del VI y a pesar de flujos más altos de la bomba, no disminuye el retorno de sangre a este que se mantiene en continuo por flujo residual desde cavi- dades derechas, drenaje desde sistema Tebesiano, reflujo aórtico si existiera y flujo sanguíneo bronquial a la aurícula izquierda.
Por lo tanto, para que se pueda vaciar el VI, la sangre debe pasar por la válvula aórtica, por lo que el ventrículo debe ser capaz de generar suficiente presión para superar la que es generada por el flujo retrógrado del ECMO-VA. En consecuencia, se debe establecer una condición de equilibrio mediante el ajuste de la presión de llenado del VI de modo que a la presión arterial esta- blecida durante ECMO, el flujo de salida del VI sea igual al flujo que regresa al VI desde todas las fuentes43,44.
A medida que se incrementa el flujo del ECMO, se disminuye la presión auricular, sin embargo, el aumento de la presión aortica genera en el ventrículo izquierdo un aumento de los volúmenes, disminución del volumen sistólico, aumento de la presión tele- diastólica, telesistólica, de la aurícula izquierda y de la arteria pulmonar, induciendo o empeorando un edema pulmonar preexistente. Este aumento de la presión arterial por el incre- mento del flujo del ECMO disminuye la presión arterial pulsátil, lo que indica disminuciones progresivas en el volumen sistólico del VI y apertura más breve de la válvula aórtica, generando estasis de sangre dentro del ventrículo izquierdo, con el riesgo de trombosis ventricular, aórtica y pulmonar, lo que puede provocar accidente cerebrovascular, embolia periférica y embolia pulmonar45.
Además, la distensión del VI en el contexto de una poscarga aumentada y presiones de llenado diastólicas del VI elevadas reduce el gradiente de perfusión transcoronario y puede alterar la perfusión coronaria (en particular, la perfusión subendocárdica), creando o empeorando así la isquemia miocárdica46.
La distensión del VI es la causa principal de la mala recuperación del VI y de la incapacidad para desconectar la ECMO VA, por lo cual es primordial reconocerla precozmente (Tabla 5).
Reconocimiento de la distensión del VI y el edema pulmonar
| Trazado de presión arterial | Presencia y el grado de apertura de la válvula aórtica |
| Seguimiento ecocardiográfico | Visualización del grado y la duración de la apertura de la válvula aórtica (modoM).Evaluación de cambios en la dimensión del VI *,** |
| Oximetría tisular cerebral | Detección de perfusión de la circulación superior con sangre desoxigenada debido al empeoramiento del edema pulmonar. |
| Radiografía de tórax | Empeoramiento en caso de aumento del edema pulmonar, que puede significar un empeoramiento de la PCWP*** |
| Catéter de arteria pulmonar | La PCWP constituye el mejor índice para seguir las presiones de llenado del VI47 |
* Atención a la no linealidad de la relación presión-volumen al final de la diástole del VI y a las restricciones pericárdicas que pueden limitar el cambio de la dimensión del VI a pesar de los cambios marcados en la presión al final de la diástole del VI.
** Considerar que determinadas condiciones premórbidas cardíacas que causan insuficiencia aguda pueden modificar el tamaño del VI medido durante el soporte con ECMO, por lo que puede ser engañoso como índice de distensión ventricular, presión diastólica final del VI y PCWP.
*** Puede ser un hallazgo tardío y es inespecífico. PCWP: pulmonary capillary wedge pressure
VI: ventrículo izquierdo
Drenaje del Ventrículo Izquierdo durante conexión a ECMO
| • Drenaje del VI de forma percutánea a través de la colocación transeptal de una cánula a la aurícula izquierda conectada al circuito venoso de ECMO VA51. |
| • Drenaje del VI quirúrgico a través de una cánula colocada quirúrgicamente a través de una minitoracotomía a través del vértice del VI hacia el VI conectada al circuito venoso de ECMO VA*52. |
| • Drenaje transaórtico del VI con catéter percutáneo pigtail instalado por vía percutánea y con guía ecográfica conectado al circuito venoso de ECMO VA53. |
| Dispositivo de asistencia ventricular transaórtico percutáneo microaxial (Impella)**54,55. |
* Tiene como ventaja eliminar el riesgo de estasis sanguíneo en el VI, sin embargo, la ausencia de apertura aórtica puede aumentar el riesgo de estasis en la aorta proximal
**Proporciona soporte de flujo anterógrado adicional hacia la raíz aórtica, disminuyendo el diámetro telediastólico del VI, el edema pulmonar y puede permitir el inicio del destete de ECMO.
No hay estudios que comparen la efectividad de las diferentes estrategias de descarga del VI, por lo que la práctica clínica gene- ralmente se guía por la experiencia y los conocimientos locales, por lo que una mayor comprensión de los principios hemodiná- micos que caracterizan de manera única el estado fisiológico de un paciente determinado puede ayudar en la toma de decisiones. La distensión del VI, el edema pulmonar y estasis sanguínea dentro del VI y raíz aórtica son eventos altamente interrelacionados.
Las estrategias para prevenir deben considerarse en las primeras etapas del tratamiento ECMO, no solo para evitar elevaciones de la presión capilar pulmonar (PCP), sino también para descargar proactivamente el VI, implementando un dispositivo de descarga al momento de conexión del ECMO:
5.4.3Reducción del flujo de ECMOCuanto mayor sea el flujo de ECMO, mayor será el grado de carga del VI. Por lo tanto, la reducción del flujo de ECMO puede reducir la carga del VI y aumentar el grado de apertura de la válvula aórtica. Sin embargo, la disminución del flujo de ECMO, también lo hace el grado de soporte cardiopulmonar, lo que puede no ser posible dependiendo de las necesidades de presión arterial y gasto cardíaco del paciente. Por lo tanto, si bien esta estrategia limitará el grado de carga, es posible que no descargue el ventrí- culo ni descongestione los pulmones en relación con el estado inicial del paciente48.
5.4.4InótroposEl uso de inótropos tiene como rol fundamental superar la presión de poscarga generada por el flujo del ECMO al optimizar la contractibilidad de un VI con disfunción contráctil significa- tiva, mejorando la apertura de la válvula aórtica. Sin embargo, esta descarga es limitada debido al aumento significativo del consumo de oxígeno miocárdico por la mayor contractilidad miocárdica, el aumento del trabajo total del VI y aumento de la frecuencia cardíaca, perjudiciales en el contexto de isquemia e infarto de miocardio.
5.4.5VasodilatadoresEl uso de vasodilatadores reduce la resistencia vascular sistémica, disminuyendo la presión arterial y permitiendo una mayor eyec- ción del VI y apertura de la válvula aórtica, pero puede propor- cionar un grado limitado de descarga del VI y su uso estará limitado en el caso que la presión arterial sistémica en el soporte sea insuficiente.
5.4.6Balón de contrapulsación intraaórtico (BCIA)El BCIA reduce la presión arterial durante la sístole y puede mejorar la apertura de la válvula aórtica y aumentar la eyección del VI49. Sin embargo, en un metaanálisis, no se identificó ningún beneficio de supervivencia con el uso de BCIA como estrategia de descarga durante ECMO35.
5.4.7Septostomía auricularLa septostomía auricular, que permite la derivación de izquierda a derecha, fue una de las primeras estrategias invasivas utilizadas para descomprimir el VI durante ECMO50.
Sin embargo, la descompresión por este mecanismo puede ir acompañada de una disminución de la apertura de la válvula aórtica y estasis sanguíneo en VI por disminución de la eyección del VI.
5.4.8Drenaje del VI (Venting)Similar en concepto a la septostomía auricular, la descompre- sión del VI también se puede lograr de forma percutánea a través de la introducción de diferentes elementos, entre los cuales se encuentran:
6ConclusionesCuando el shock cardiogénico se produce en el entorno perio- peratorio de la cirugía cardiovascular, factores fisiopatológicos pre, intra o postquirúrgicos únicos o en conjunto, pueden tener un impacto negativo en los resultados del paciente. Los estudios muestran que entre un 2% y 6% de los pacientes que se someten a una cirugía cardíaca desarrollan un shock postcardiotomía. Esto no considera aquellos pacientes con indicación quirúrgica de una causa que genera shock cardiogénico, y que requieren cirugía de urgencia o estabilidad prequirúrgica, ya sea farmacológica o mediante soporte extracorpóreo. Este último se debe considerar en pacientes con shock cardiogénico refractario a terapia médica con una causa potencialmente reversible o corregible quirúrgica- mente y debe iniciarse antes de la falla multiorgánica y después de una evaluación ecocardiográfica exhaustiva.
Teniendo en cuenta las altas tasas de morbimortalidad y el impacto general en los pacientes, el shock cardiogénico en el entorno perioperatorio requiere un enfoque de equipo multi-disciplinario que permita elegir el dispositivo y estrategia de conexión más adecuada que minimice las complicaciones, como la distensión del VI, Síndrome de Arlequín e isquemia vascular periférica, y entregue los mejores resultados de acuerdo con la estrategia de rehabilitación elegida.
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses.