La sospecha de Síndrome de Ovario Poliquístico es un motivo de consulta frecuente durante la adolescencia, esto probablemente está dado por la sobreposición de las características fisiológicas de este período con los criterios diagnósticos tradicionalmente usados para definir este síndrome, tales como ciclos menstruales irregulares, hiperandrogenismo y morfología ecográfica de ovario poliquístico. Es por esto que parece importante discutir si los criterios diagnósticos de Síndrome de Ovario Poliquístico aplicados en mujeres adultas pueden extrapolarse a los primeros años postmenarquia. En este artículo se discute el diagnóstico de Síndrome de Ovario Poliquístico en la adolescencia, sus controversias y su manejo.
The suspicion of polycystic ovary syndrome is a common complaint during adolescence, and is probably given by the overlap of physiological characteristics of this period of life with the diagnostic criteria traditionally used to define this syndrome, such as irregular menstrual cycles, hyperandrogenism and polycystic ovarian morphology. This is why it seems important to discuss whether these diagnostic criteria for polycystic ovary syndrome in adults can be extrapolated to the early years postmenarche. This article will discuss the diagnosis of polycystic ovary syndrome in adolescence, their controversies and their management.
El Síndrome de Ovario Poliquístico (SOP) es un trastorno endocrino metabólico que afecta entre el 5 y 7% de las mujeres en edad reproductiva. Es frecuente que su diagnóstico se realice en la adolescencia tardía, pero su sospecha puede comenzar en los primeros años de edad reproductiva. La prevalencia de este trastorno en la adolescencia se desconoce, pues sus síntomas y signos suelen sobreponerse a los cambios fisiológicos que caracterizan a esta edad 1,2. En el presente artículo se revisa la definición de SOP, las dificultades para el diagnóstico durante la adolescencia, los factores predisponentes y se realiza una aproximación inicial al enfoque diagnóstico y terapéutico.
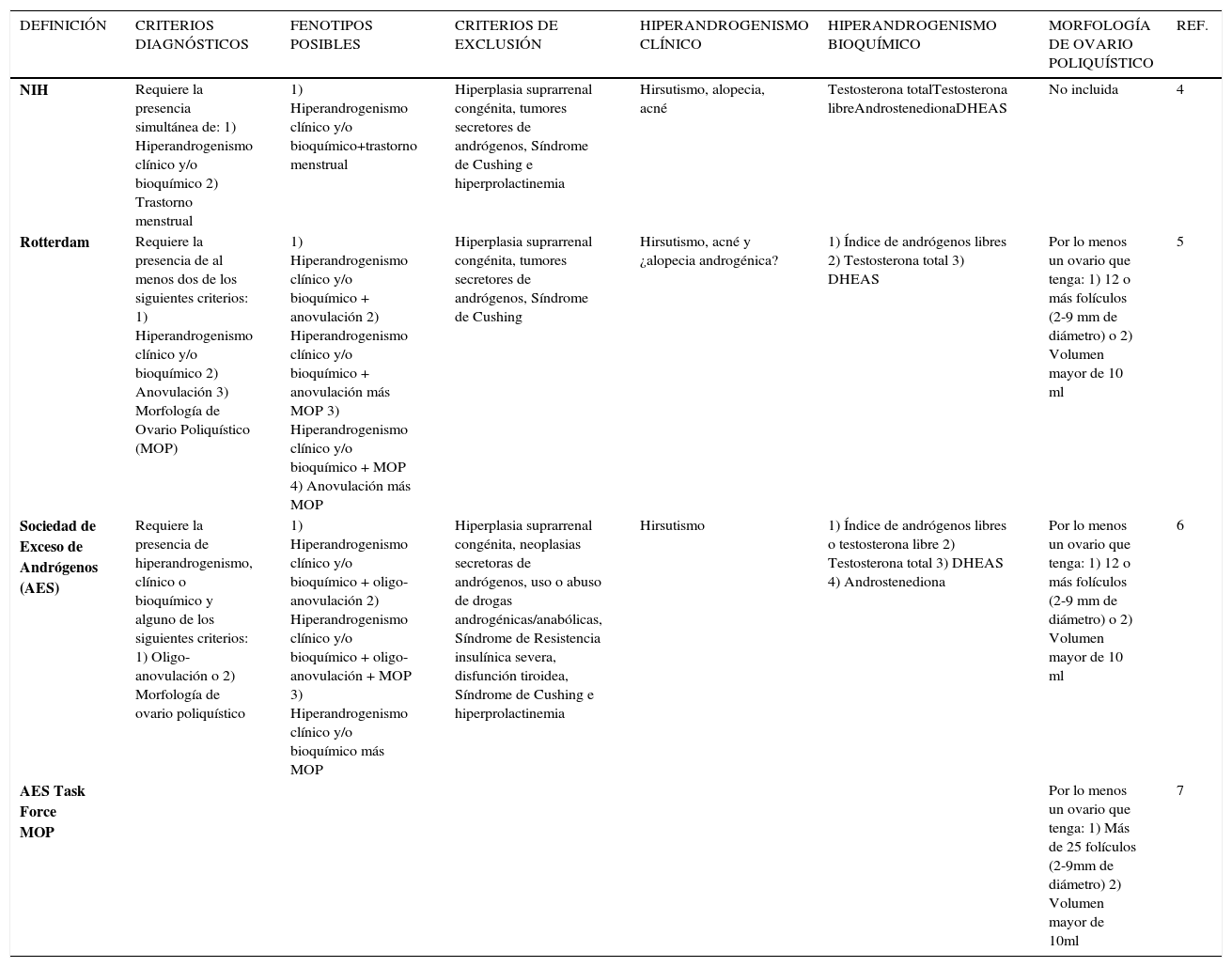
DEFINICIÓNEn 1935 Irvin Stein y Michael Leventhal describieron por primera vez este síndrome en siete mujeres adultas con amenorrea, hirsutismo, obesidad y con hallazgo de degeneración quística ovárica bilateral al momento de la cirugía 3. Posteriormente, se describieron distintas manifestaciones asociadas a este síndrome, lo cual llevó a grupos de expertos a intentar establecer una definición del fenotipo y que fuera práctica desde el punto de vista clínico. Es así que la definición del SOP en la mujer adulta se basa en las clasificaciones diagnósticas derivadas de los consensos, conocidos como NIH, Rotterdam y de la Sociedad de Exceso de Andrógenos 4–7. Fue este último consenso que determinó una definición basada en la evidencia científica. Estas clasificaciones postulan a la disfunción ovulatoria, el hiperandrogenismo clínico y/o bioquímico y el aspecto ecográfico de los ovarios (Morfología de Ovario Poliquístico, MOP) como elementos diagnósticos para definir esta entidad, dando origen a numerosos fenotipos (tabla 1) 8,9.
CRITERIOS DE DIAGNÓSTICO DE SOP, SEGÚN LAS DIFERENTES CLASIFICACIONES PUBLICADAS
| DEFINICIÓN | CRITERIOS DIAGNÓSTICOS | FENOTIPOS POSIBLES | CRITERIOS DE EXCLUSIÓN | HIPERANDROGENISMO CLÍNICO | HIPERANDROGENISMO BIOQUÍMICO | MORFOLOGÍA DE OVARIO POLIQUÍSTICO | REF. |
|---|---|---|---|---|---|---|---|
| NIH | Requiere la presencia simultánea de: 1) Hiperandrogenismo clínico y/o bioquímico 2) Trastorno menstrual | 1) Hiperandrogenismo clínico y/o bioquímico+trastorno menstrual | Hiperplasia suprarrenal congénita, tumores secretores de andrógenos, Síndrome de Cushing e hiperprolactinemia | Hirsutismo, alopecia, acné | Testosterona totalTestosterona libreAndrostenedionaDHEAS | No incluida | 4 |
| Rotterdam | Requiere la presencia de al menos dos de los siguientes criterios: 1) Hiperandrogenismo clínico y/o bioquímico 2) Anovulación 3) Morfología de Ovario Poliquístico (MOP) | 1) Hiperandrogenismo clínico y/o bioquímico + anovulación 2) Hiperandrogenismo clínico y/o bioquímico + anovulación más MOP 3) Hiperandrogenismo clínico y/o bioquímico + MOP 4) Anovulación más MOP | Hiperplasia suprarrenal congénita, tumores secretores de andrógenos, Síndrome de Cushing | Hirsutismo, acné y ¿alopecia androgénica? | 1) Índice de andrógenos libres 2) Testosterona total 3) DHEAS | Por lo menos un ovario que tenga: 1) 12 o más folículos (2-9 mm de diámetro) o 2) Volumen mayor de 10 ml | 5 |
| Sociedad de Exceso de Andrógenos (AES) | Requiere la presencia de hiperandrogenismo, clínico o bioquímico y alguno de los siguientes criterios: 1) Oligo-anovulación o 2) Morfología de ovario poliquístico | 1) Hiperandrogenismo clínico y/o bioquímico + oligo-anovulación 2) Hiperandrogenismo clínico y/o bioquímico + oligo-anovulación + MOP 3) Hiperandrogenismo clínico y/o bioquímico más MOP | Hiperplasia suprarrenal congénita, neoplasias secretoras de andrógenos, uso o abuso de drogas androgénicas/anabólicas, Síndrome de Resistencia insulínica severa, disfunción tiroidea, Síndrome de Cushing e hiperprolactinemia | Hirsutismo | 1) Índice de andrógenos libres o testosterona libre 2) Testosterona total 3) DHEAS 4) Androstenediona | Por lo menos un ovario que tenga: 1) 12 o más folículos (2-9 mm de diámetro) o 2) Volumen mayor de 10 ml | 6 |
| AES Task Force MOP | Por lo menos un ovario que tenga: 1) Más de 25 folículos (2-9mm de diámetro) 2) Volumen mayor de 10ml | 7 |
Modificada de Ethel Codner and Héctor F. Escobar-Morreale. Hyperandrogenism and Polycystic Ovary Syndrome in Women with Type 1 Diabetes Mellitus. J Clin Endocrinol Metab, 2007; 92: 1209 –1216; y de Merino P., Schulin-Zeuthen C. and Codner E.: [Current diagnosis of polycystic ovary syndrome: expanding the phenotype but generating new questions]. Rev Med Chil 2009; 137: 1071-80.
El mayor riesgo metabólico y cardiovascular a largo plazo, característico de este síndrome, se ha documentado en aquellas pacientes con exceso de andrógenos, por lo tanto, el diagnóstico de SOP requeriría la presencia de hiperandrogenismo, como lo determinó la Sociedad de Exceso de Andrógenos en 2006.
MANIFESTACIONES CLÍNICAS EN LA PACIENTE ADOLESCENTELa disfunción ovulatoria, el hiperandrogenismo clínico y/o bioquímico y el aspecto ecográfico de los ovarios (MOP) son criterios postulados como manifestaciones del SOP en base a estudios realizados en mujeres adultas. Durante la adolescencia, estas características descritas se pueden sobreponer a los cambios fisiológicos relacionados al proceso de maduración del eje hipotálamo-hipófisis-ovario, lo que genera mucha controversia acerca de su utilidad en el diagnóstico de SOP en la paciente durante sus primeros años postmenarquia.
A continuación se analiza cada uno de estos tres pilares diagnósticos, discutiendo su validez como criterios diagnósticos en la adolescente.
1. Disfunción ovulatoria
La disfunción ovulatoria en mujeres adultas es definida por ciclos de más de 35 días y anovulación determinada por medición de progesterona entre los días 20 y 24 10.
Esta definición no es aplicable al grupo de las adolescentes, ya que dentro de los primeros cinco años postmenarquia hay una variabilidad mayor en la ciclicidad menstrual. Durante este período, los ciclos menstruales pueden durar entre 21 y 45 días 11,12. Posteriormente se van haciendo cada vez más regulares, reflejando una mayor tasa de ciclos ovulatorios. Un estudio en adolescentes chilenas describió un ciclo promedio de 45,4±24,8 días de duración con un 25% de ciclos ovulatorios en el primer año postmenarquia. Al tercer y cuarto año postmenarquia, la duración del ciclo fue de 32,6 ± 5,1 y 32,2 ± 4,7 días, respectivamente, con tasas ovulatorias de 37 y 45%, respectivamente 13. Por la gran variabilidad en la longitud de los ciclos y la anovulación fisiológica en los primeros años de edad ginecológica, no se sugiere medir progesterona en fase lútea en adolescentes.
Por lo tanto, se sugiere sospechar disfunción ovulatoria en las adolescentes cuando presenta ciclos persistentemente más largos que 45 días dentro de los primeros cinco años postmenarquia.
2.- Hiperandrogenismo (HA)
El hiperandrogenismo corresponde a las manifestaciones clínicas por exceso de andrógenos, lo que puede deberse a mayores niveles circulantes de andrógenos (hiperandrogenemia) o a una mayor sensibilidad de los receptores androgénicos a niveles normales de estas hormonas en sangre. El HA es el signo cardinal en el SOP.
El signo más específico de HA clínico es el hirsutismo, el cual es definido como la presencia de pelo terminal en zonas dependientes de andrógenos (labio superior, mentón, espalda alta y baja, cara anterior del tórax, abdomen alto y bajo, brazos y muslos), con un puntaje de Ferriman-Gallwey sobre percentil 95 para la población en estudio 14. Esto corresponde a un puntaje mayor o igual a ocho en la población europea; sobre seis en mujeres chilenas 15; y mayor a tres en pacientes chinas 16. Es importante realizar la distinción con hipertricosis, que es frecuente en niñas y adolescentes y se diferencia por el tipo de pelo y su distribución anatómica 17. La hipertricosis que corresponde a un vello largo y fino, no se considera una manifestación de exceso de andrógenos.
El acné, signo muy frecuente en adolescentes y a menudo transitorio, no debería ser considerado como HA, a excepción del acné severo y/o persistente, comedones en niñas prepúberes, falta de respuesta a tratamientos sistémicos y reaparición posterior a uso de retinoides 18.
La alopecia androgénica no es considerada como un criterio diagnóstico de HA por el último consenso. Sólo un 5% de las mujeres con hiperandrogenismo presenta alopecia 19 y es un signo clínico infrecuente en este grupo de mujeres jóvenes y adolescentes. Cuando no se asocia a hirsutismo o acné es un signo inespecífico y puede tener otras etiologías, siendo la alopecia areata la causa más frecuente en población pediátrica 20.
El problema en definir HA bioquímico en la adolescencia es que en la pubertad los niveles de andrógenos aumentan respecto al período prepuberal en forma fisiológica. Existe un aumento en la producción de andrógenos adrenales, una disminución en la SHBG aumentando el índice de andrógenos libres, entre otros. Además, no existen valores de corte para definir hiperandrogenismo de laboratorio en adolescentes, por lo que se utilizan los de mujeres adultas 21.
Se sugiere sospechar HA en adolescentes con hirsutismo progresivo. En acné severo se sugiere estudiar exceso de andrógenos y de las otras manifestaciones del SOP y no considerarlo como un hallazgo específico único.
3.- Morfología de Ovario Poliquístico (MOP)
MOP se define como la presencia de 12 o más folículos de 2 a 9mm de diámetro (folículos antrales) y/o un volumen ovárico mayor a 10ml en uno o ambos ovarios. No se considera el aspecto subjetivo de ovarios poliquísticos, la distribución folicular y tampoco el aspecto del estroma. Recientes estudios cuestionan la presencia de más de 12 folículos como patológicos, sugiriendo aumentar el recuento a 25 folículos antrales por ovario al hacer la ecografía con los nuevos equipos disponibles, cuya resolución sea mayor o igual a 8MHz. Esta nueva sugerencia de la Sociedad de Exceso de Andrógenos sugiere mantener el criterio de volumen ovárico mayor o igual en 10ml como criterio de MOP 7.
La controversia de extrapolar este criterio a adolescentes, es que la sensibilidad y especificidad de estos puntos de corte para volumen y recuento folicular como diagnóstico de SOP fueron definidos en mujeres adultas y con ecografía por vía transvaginal 22. Es importante recordar que en adolescentes no hay series grandes que definan el volumen ovárico y recuento folicular normal por vía transabdominal, que es la vía de elección para este grupo de pacientes, lo que adicionalmente puede dificultar la visualización y conteo de los folículos. La prevalencia de MOP en adultas con SOP es de un 90-100%, pero en adolescentes se ha discutido que se trate de un hallazgo fisiológico. Con los Criterios de Rotterdam para definir MOP, se realizó un longitudinal en adolescentes sanas entre dos y cinco años postmenarquia, el cual mostró que este patrón ecográfico está presente entre un 33-40% de las adolescentes a los dos, tres y cuatro años postmenarquia. En las pacientes que se siguieron hasta los cinco años de edad ginecológica, MOP había desaparecido 23.
Numerosos estudios han evaluado la utilidad de la hormona antimülleriana (AMH) como marcador de MOP en pacientes adultas con SOP. Se ha buscado correlacionar los niveles de esta hormona producida por las células de la granulosa con el numero de folículos antrales pequeños (2 a 5mm) 24,25. En Chile, un estudio en adolescentes sanas con ciclos menstruales regulares y sin hiperandrogenismo, las adolescentes con MOP presentaron niveles más elevados de AMH respecto a niñas sin este patrón ecográfico 26.
Por lo tanto, una ecografía alterada aislada, sin otros elementos clínicos, no debiera ser empleada como diagnóstico de SOP en la adolescencia. Los ovarios “multiquísticos” o “multifoliculares”, definidos por la presencia de más de seis folículos entre 4-10mm y estroma normal, pueden corresponder a un hallazgo frecuente durante la pubertad, motivo por el que este término no debe ser confundido con MOP.
FACTORES PREDISPONENTESSe ha propuesto que SOP podría comenzar en la vida intrauterina 27. Estudios chilenos en hijas de mujeres con este síndrome han mostrado niveles de AMH elevados y un perfil metabólico adverso similar al que se ve en SOP en estas niñas, sugiriendo un rol de la exposición prenatal a andrógenos 28–30.
Otros factores predisponentes de SOP son obesidad e insulinorresistencia 31. El bajo peso al nacer y el uso de ciertos fármacos predispone, pero no determina, el desarrrollo de este síndrome.
Estudios que evalúan la asociación entre obesidad e hiperandrogenismo en la infancia y pubertad, muestran que el Índice de Masa Corporal se relaciona directamente con mayores niveles de testosterona total y libre y menores niveles de SHBG 32. Un estudio en adolescentes obesas, el grupo con síndrome metabólico tiene niveles mayores de testosterona y DHEAS comparado con aquellas sin síndrome metabólico 33.
La insulinorresistencia ha sido implicada en la fisiopatología de SOP, ya que se ha relacionado con un aumento en la secreción de andrógenos por las células de la teca y una menor producción hepática de su hormona transportadora (SHBG). La evaluación de IR mediante medición de insulina y HOMA, no forman parte de los criterios diagnósticos de SOP, ni en la mujer adulta ni en las adolescentes. Además, en la adolescencia, existe un grado de IR fisiológica con niveles de insulinemia más altos que los descritos en las adultas 31.
ENFOQUE DE LA PACIENTE ADOLESCENTE CON SOSPECHA DE SOPEl diagnóstico de SOP en la adolescencia debería realizase basándose en los criterios clásicos de alteraciones menstruales e hiperandrogenismo 1,2,34. Es importante además evaluar los aspectos metabólicos que a menudo lo acompañan para un manejo adecuado de esta entidad. Debe realizarse una anamnesis que incluya los antecedentes médicos personales, antecedentes del desarrollo puberal (telarquia, pubarquia, menarquia), antecedentes perinatales (peso de nacimiento, edad gestacional), historia menstrual actual (calendario menstrual), ingesta de medicamentos, antecedentes familiares y hábitos de vida (alimentación y actividad física).
El examen físico debe incluir antropometría, la distribución de la grasa corporal, la medición de presión arterial. Se deben buscar signos de HA, evaluando la Escala de Ferriman para consignar hirsutismo; evaluar el grado de acné, la presencia de acantosis o estrías. En el examen abdominal, se debe evaluar la presencia de tumores palpables abdominales o pelvianos y en la inspección genital, hay que buscar signos de virilización como clitoromegalia.
En el estudio de laboratorio se debe medir testosterona total, SHBG, androstenediona, DHEAS, 17-hidroxiprogesterona, prolactina, TSH y perfil lipídico. La medición de cortisol libre urinario se sugiere en los casos de sospecha clínica de Síndrome de Cushing. Los exámenes hormonales se deben realizar en fase folicular precoz (días 3 a 5 del ciclo), en ayunas y antes de las 9 am. No se recomienda la medición de testosterona libre en estas pacientes, dado que las técnicas que se utilizan en el laboratorio clínico habitual tienen alta variabilidad y no son confiables.
La ecografía ginecológica debe realizarse en fase folicular precoz. La vía de elección es abdominal en las niñas sin actividad sexual y transvaginal en las adolescentes que ya han iniciado relaciones sexuales.
El estudio estará enfocado a confirmar el hiperandrogenismo, evaluar presencia de complicaciones metabólicas y descartar otras fuentes productoras de andrógenos, como tumores virilizantes ováricos o suprarrenales y otras endocrinopatías como hiperplasia suprarrenal congénita, Síndrome de Cushing, acromegalia, HAIR-AN o trastornos tiroideos.
Se sugiere que sólo en los casos de disfunción menstrual asociada a hiperandrogenismo, sospechar SOP. En las pacientes con alteraciones menstruales sin manifestaciones de exceso de andrógenos, se debe realizar un estudio destinado a descartar otras causas frecuentes de alteraciones menstruales en la adolescencia, como son las causas centrales que incluyen amenorrea hipotalámica asociada a trastornos de alimentación, deportes de alto rendimiento, o alteraciones funcionales por inmadurez del eje, agravados por el stress o gonadales no SOP, tales como falla ovárica prematura de origen autoinmune o secundario a tratamientos oncológicos, entre otros.
CONCLUSIÓNEs importante no asignar precozmente el diagnóstico de SOP en la paciente adolescente, ya que puede llevar a tratamientos innecesarios y preocupación excesiva acerca de las consecuencias que este trastorno puede determinar en la vida adulta. Sin embargo, debe realizarse un seguimiento acucioso los primeros cinco años postmenarquia, ya que la evolución de los síntomas y signos confirmará el diagnóstico.
Las autoras declaran no tener conflictos de interés, en relación a este artículo.