La radioterapia es un tratamiento efectivo en el manejo del cáncer. Es responsable de mejorar significativamente el control locorregional, la supervivencia global y la calidad de vida en múltiples tumores. Históricamente, sin embargo, sus complicaciones agudas y crónicas han reducido estos beneficios. La incorporación de la computación a la radioterapia ha permitido el desarrollo de diversas técnicas de tratamiento, incluyendo la radioterapia conformada 3D (3D-CRT) y la intensidad modulada (IMRT). Éstas permiten aumentar la dosis tumoral protegiendo los tejidos sanos, con un potencial aumento en el control del tumor y reducción de las complicaciones agudas y crónicas asociadas. Múltiples estudios prospectivos y retrospectivos han evaluado los beneficios de la IMRT en distintos tumores primarios. Hasta ahora sus principales indicaciones son cáncer de próstata y de cabeza y cuello. En otras localizaciones se han obtenido mejorías dosimétricas significativas. Se requiere mayor seguimiento para conocer los resultados clínicos tardíos de esta tecnología.
Radiation therapy is an effective treatment in cancer management. It is responsible for significant improvements in local/regional control, overall and cause-specific survival and better quality of life in many tumors. Nevertheless, in the past, acute and chronic radiation toxicity has reduced this benefits. The introduction of computer technologies to radiotherapy has allowed the development of various planning and treatment techniques, including 3D conformal radiotherapy (3D-CRT) and intensity modulation (IMRT), permiting to escalate tumor doses while protecting healthy tissues. This can improve tumor control and reduce acute and late complication rates associated with radiotherapy. Multiple prospective and retrospective studies have evaluated the benefits of IMRT in different primary tumors. Their main indications are head and neck and prostate cancer. In other locations, a significant dosimetric improvements of IMRT have been found, but longer follow-up is required to identify long term effects.
La radioterapia (RT) es un tratamiento esencial en el manejo actual del cáncer. Usada en forma exclusiva o complementaria a la cirugía y/o a las terapias sistémicas, su impacto en el control locorregional y subsecuentemente en la supervivencia global y por causa específica en muchos tumores primarios ha sido ampliamente demostrada en múltiples estudios aleatorizados y metanálisis. Históricamente, sin embargo, el uso de radioterapia ha implicado un riesgo real de efectos secundarios agudos y crónicos que potencialmente pueden, en casos seleccionados, traducirse en morbi-mortalidad importante y/o reducir la calidad de vida de los pacientes (1). Esto ha determinado la constante búsqueda de alternativas, incluyendo técnicas y métodos más seguros de irradiación.
Desde la radioterapia 2d a la IMRTDurante la mayor parte del siglo XX la radioterapia era por lo general bastante simple, utilizando uno a cuatro campos de tratamiento, que podían ser laterales, antero-posteriores o bien "cajas" de cuatro campos. La simulación, cuando se efectuaba, consistía en dibujar los campos de tratamiento en una radiografía convencional o en un simulador, utilizando referencias óseas. La dosimetría se hacía en forma manual dibujando las curvas de isodosis del equipo sobre el contorno del paciente en un solo plano central bidimensional (2D), con poca consideración de la inhomogeneidad que se podía producir en el resto del volumen.
La incorporación a la medicina de las tecnologías de la información durante el último cuarto de siglo impulsó el desarrollo de nuevas formas de radioterapia, permitiendo por una parte, una mejor definición espacial de las zonas comprometidas por tumor que requieren tratamiento y de los órganos normales que necesitan ser protegidos y por otra, la creación de herramientas que hacen posible entregar dosis diferentes a estos tejidos.
El principio de esta nueva metodología es la radioterapia conformada tridimensional (3D-CRT). En ésta, el diseño del plan de tratamiento se efectúa delimitando, en cortes tomográficos axiales seriados, los volúmenes correspondientes a los blancos tumorales y a los órganos normales, estableciendo los objetivos de dosis total y dosis por fracción en tumor y definiendo el número y características de los campos de tratamiento que permitan excluir a los tejidos normales de las zonas de alta dosis.
La radioterapia de intensidad modulada es una forma avanzada de 3D-CRT. Constituye uno de los avances técnicos más importantes de los últimos años, representando un cambio radical en la planificación y administración del tratamiento. Al igual que la 3D-CRT, la IMRT requiere de una planificación 3D con la delimitación en cortes axiales de los volúmenes de interés. Sin embargo en la IMRT, además de definir el objetivo de dosis total necesarias en el volumen tumoral, el médico establece las restricciones de dosis necesarias para proteger los distintos tejidos normales involucrados. De acuerdo a estas indicaciones, el computador elabora, en base a un algoritmo de cálculo por ensayo y error, un plan de irradiación que satisface los perfiles de dosis requeridos. Este proceso de optimización es conocido como planificación inversa.
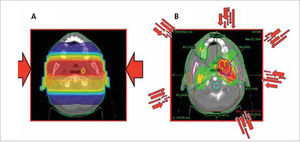
La radioterapia con intensidad modulada, como la 3D-CRT, utiliza múltiples haces de radiación conformada que confluyen sobre el objetivo tumoral desde varios ángulos de entrada. Pero a diferencia de ella, cada campo de tratamiento está formado por la suma de varios segmentos, de modo que se generan diferentes niveles de intensidad de dosis en los distintos puntos de cada campo (Figura 1). Este efecto se logra con un colimador de multiláminas, dispositivo diseñado para dar forma al haz de radiación mediante múltiples bloques motorizados. (Figura 2). Las dosis entregadas por la sumatoria de los campos crea en el paciente un volumen de tratamiento en el que los órganos y tejidos normales quedan ubicados en zonas restringidas y el tejido tumoral en las zonas de mayor exposición.
El uso de la radioterapia de intensidad modulada se ha popularizado durante los últimos 15 años adoptándose con rapidez en múltiples centros de todo el mundo a causa principalmente de sus características dosimétricas, a pesar de una comprensión a veces incompleta de sus ventajas, limitaciones e implicancias radiobiológicas y de la evidencia incipiente de sus potenciales beneficios clínicos finales.
La IMRT tiene varias ventajas dosimétricas evidentes sobre la radioterapia convencional 2D y conformada 3D. Permite reducir significativamente la cantidad de tejidos normales sometidos a altas dosis de radiación, con la potencial reducción del riesgo de complicaciones agudas y crónicas. Es capaz de producir distribuciones de dosis mucho más homogéneas y conformadas a la anatomía de los volúmenes involucrados, (Figura 3) reduciendo la zonas de penumbra en los límites del volumen blanco. Estos factores permiten el escalamiento de la dosis en el tejido tumoral y la reducción simultánea de la dosis en órganos normales, con el consiguiente aumento del rango terapéutico. Finalmente, el plan de tratamiento puede ser diseñado considerando diferentes dosis/fracción para distintos volúmenes, permitiendo lograr diferentes condiciones radiobiológicas para tejidos normales y tumorales que pueden mejorar aún más la respuesta del tumor y la preservación funcional.
A. Dosimetría de un paciente de cáncer de amígdala con planificación 2-D convencional usando campos paralelos opuestos y boost convencional. B: El mismo paciente con un plan de intensidad modulada en que múltiples haces de diferentes intensidades inciden desde distintos ángulos para esculpir una distribución de dosis con protección del cerebro, tronco encefálico, mandíbulas, mucosa oral y glándulas parótidas.
El alto grado de precisión que puede lograrse con el uso la de radioterapia de intensidad modulada es el resultado de una cadena de procedimientos optimizados que se inician con la localización del tumor en el cuerpo del paciente a través de los estudios de imágenes diagnósticas, CT, MRI, PET entre otros, y se completa con la entrega de una dosis de radiación en un curso de 30 a 40 fracciones de terapia. Entre ellos están la correcta delimitación de los volúmenes blanco y de los órganos a riesgo, la simulación de la terapia, el cálculo de las dosis, el proceso de optimización, inversa o no inversa, el correcto posicionamiento del paciente en la mesa de terapia y la verificación con imágenes previas a cada fracción de tratamiento. Cada uno de estos eslabones debe ser realizado bajo un estricto control de calidad que descarte cualquier posibilidad de error. Es necesario considerar que los tumores no son estáticos, pudiendo presentar movilidad, reducción de tamaño por respuesta al tratamiento, deformaciones y eventualmente aumento de volumen a lo largo de la terapia. También los pacientes pueden presentar cambios, debido a edema, variaciones en el peso corporal, movimientos de vísceras o diferencias en el volumen de su contenido, además de los movimientos producidos por la respiración. Estos cambios determinan el riesgo de que los tejidos normales que conforman los volúmenes de restricción puedan quedar posicionados en áreas de alta dosis durante la irradiación y que el blanco tumoral pueda salir de ella, determinando aumento en las complicaciones y mayor posibilidad de falla en el control tumoral. Estas múltiples incertezas, que constituyen las principales limitaciones de la IMRT, han conducido al desarrollado de métodos adicionales de control de calidad que aseguren su correcta realización. Estos incluyen la radioterapia guiada por imágenes (IGRT), el control respiratorio y la radioterapia 4-D. Otras limitaciones de la IMRT que deben ser consideradas son la posible inclusión de volúmenes importantes de tejidos sanos en zonas expuestas a dosis bajas de radiación, determinada por el uso de múltiples campos de tratamiento y la mayor exposición corporal total por aumento de la duración de cada fracción. Las consecuencias de éstas, que podrían tener importancia especialmente en pacientes pediátricos sometidos a IMRT, no han sido establecidas hasta ahora.
En los últimos años se han publicado numerosos estudios que comprueban las ventajas dosimétricas de la IMRT. La pregunta clave, sin embargo, es ¿cuáles son las ventajas clínicamente relevantes que la IMRT tiene sobre las otras técnicas convencionales? Esto ha sido parcialmente respondido por estudios clínicos directos e indirectos que han determinado la correlación existente entre las dosis recibidas por cada órgano y su función posterior, produciendo valiosa información sobre la relaciones dosis-volumen y toxicidad para diferentes tejidos, que en la actualidad se utiliza en la planificación de la IMRT.
Cáncer de cabeza y cuelloLa radioterapia constituye una importante modalidad terapéutica en el manejo del cáncer de cabeza y cuello. Puede ser exclusiva, adyuvante, asociada o no a quimioterapia o a terapia biológica concurrente.
La necesidad de entregar una dosis alta de radiación para lograr el control local y regional, y la estrecha vecindad de múltiples órganos críticos con distinta sensibilidad incluyendo parótidas, oído medio e interno, articulación témporo-maxilar, glándulas salivales, lóbulos temporales, órbitas, cristalinos, vías ópticas, médula espinal, y tronco cerebral, que determinan un riesgo considerable de efectos secundarios no deseados agudos a largo plazo, convierten al territorio de la cabeza y el cuello en una zona ideal para la utilización de radioterapia con intensidad modulada. La mejor conformación obtenida por la IMRT puede permitir un aumento del control local y regional mediante el escalamiento de la dosis en tumor primario y los ganglios linfáticos regionales, diminuyendo el riesgo de toxicidad aguda y crónica al aplicar restricciones de dosis en órganos sanos adyacentes al blanco. Debido a que muchos de los órganos de la cabeza y cuello tienen movilidad limitada o ausente, es posible tener blancos fijos con inmovilización convencional usando referencias óseas para la localización diaria de los campos de tratamiento.
Las imágenes obtenidas durante la planificación del tratamiento no representan necesariamente la anatomía del paciente y del tumor durante el curso del resto del tratamiento. Debe evaluarse la respuesta tumoral y la eventual incursión de tejidos normales dentro del volumen de tratamiento por el reposicionamiento espacial del tumor y de los órganos críticos. Por esta razón puede ser necesaria la re-planificación periódica durante el período de tratamiento, incorporando los cambios observados de forma que el tumor y los tejidos sanos continúen correspondiendo a los volúmenes blanco y de restricción de dosis respectivamente.
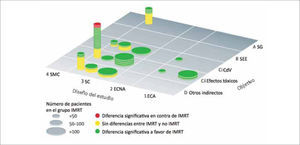
Recientes estudios han demostrado que con la IMRT se logra buen control loco-regional con una significativa reducción de los efectos secundarios y mejor calidad de vida de los pacientes irradiados por distintos primarios de cabeza y cuello (2-7). En estudios aleatorizados, la xerostomía, prevalente en 75-80% de los pacientes irradiados con técnica 2D se redujo a menos de 40% al usar IMRT (8-9) y las alteraciones en la audiometría cayeron de 30% con 2D a sólo 8% con IMRT (10). En la actualidad la utilización de la IMRT se ha incrementado en todos los cánceres de cabeza y cuello, (Figura 4) y en las guías clínicas NCCN está considerada como terapia de elección para el carcinoma de nasofaringe, orofaringe y senos paranasales.
Sin embargo aún persisten preguntas no respondidas y los datos disponibles sobre resultados a largo plazo son limitados.
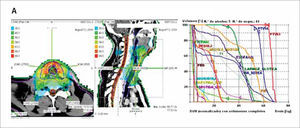
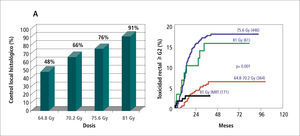
Cáncer prostáticoVarias series han demostrado que existe una relación directa entre la dosis de radiación utilizada y el control local y bioquímico y la supervivencia por cáncer de próstata (11-13). También está demostrada la relación de la dosis y la incidencia de efectos laterales no deseados, en especial toxicidad rectal y vesical (14, 15). La introducción de la 3D-CRT y posteriormente de la IMRT han logrado ajustar los volúmenes de radiación a la anatomía individual de cada paciente, permitiendo el escalamiento de dosis sobre un blanco bien conformado con reducción de las dosis recibidas por recto y vejiga, lo que mejora el control local de la enfermedad y disminuye el riesgo de complicaciones agudas y crónicas (Figura 5) (16). El logro de este objetivo está condicionado a que el volumen blanco y los volúmenes de restricción sean adecuadamente localizados en cada fracción a lo largo de todo el período de terapia.
Incidencia de biopsias prostáticas negativas post tratamiento según dosis en un grupo de 252 pacientes. B Probabilidad de toxicidad rectal ? G2 según dosis y técnica de radioterapia. A 81 Gy la IMRT se asoció a la menor incidencia de toxicidad rectal tardía.
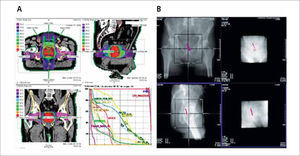
Considerando que existe variabilidad en el posicionamiento diario en la mesa de tratamiento y en la ubicación de la próstata dentro de la pelvis, se hace indispensable el uso de métodos adicionales de localización, distinto a las referencias óseas, para reducir la incerteza de posición. Entre los métodos descritos está la radioterapia guiada por imágenes (IGRT) mediante ecografía, imágenes portales con fiduciarios implantados en próstata, método utilizado en nuestra unidad, (Figura 6) (17, 18) y CT incorporado (cone-beam) (19). Más recientemente se ha comenzado a utilizar un sistema de semillas magnéticas (“transponders”) capaces de retransmitir su posición a un sistema de detección en tiempo real, permitiendo identificar y eventualmente corregir los movimientos del blanco antes y durante la aplicación del tratamiento (20, 21).
Aún no existe evidencia definitiva de la ventaja clínica de la IMRT en el cáncer prostático. Es difícil establecer una comparación confiable entre los estudios publicados ya que éstos tiene diferencias en técnicas de radiación, fraccionamientos, definición de volumen blanco, márgenes de seguridad, restricciones de dosis y órganos en riesgo. En algunos, se considera como volumen blanco la pelvis completa (22). En otros, sólo la próstata con o sin las vesículas seminales. En la mayoría de los estudios comparativos se utilizan controles históricos, lo que resulta especialmente inadecuado al considerar el progreso experimentado por los procedimientos diagnósticos y la mayor estandarización de la histología (23) que han producido una migración de estado, o fenómeno de Will Rogers (24, 25). Finalmente, la adopción de la radioterapia guiada por imágenes para el posicionamiento de los pacientes y la observación más cuidadosa de las relaciones dosisvolumen-toxicidad y dosis-respuesta puede haber contribuido a la reducción de los efectos tóxicos en los estudios de IMRT. Existe, sin embargo, cierto consenso en que la IMRT, por sí sola o como parte de las técnicas optimizadas de radioterapia, permite el escalamiento de dosis reduciendo la incidencia de efectos tóxicos gastrointestinales y genitourinarios y el impacto en la función sexual. Por esta razón, la IMRT ha sido incluida en las guías NCCN de práctica clínica como estándar de tratamiento, considerando el uso de IGRT si se indica escalamiento de dosis.
Cáncer de mamaLa cirugía conservadora asociada a radioterapia de la mama con fotones (RT) es el tratamiento estándar del cáncer de mama temprano (26-28). La radioterapia reduce en 70% el riesgo de recidiva local en pacientes sometidas a cirugía conservadora independientemente de la edad, del estadio clínico y del compromiso regional, mejorando la supervivencia global y reduciendo la mortalidad por cáncer de mama (29).
La técnica convencional de irradiación de la mama utilizaba dos haces de radiación tangenciales opuestos, que incluían toda la glándula permitiendo una buena cobertura del tejido mamario. El uso de filtros de cuña lograba mejorar la homogeneidad de la dosis en la mama. Sin embargo, esta corrección se obtenía sólo en el plano central, persistiendo, en especial en las mamas de mayor volumen (30, 31) una importante inhomogeneidad, con áreas que recibían dosis superiores al 10% sobre la dosis indicada, lo que se asociaba con la aparición de toxicidad aguda y de pobres resultados cosméticos por fibrosis y secuelas cutáneas tardías (32). La IMRT, en cambio, a través de campos segmentados, (Figura 7) efectúa las correcciones en múltiples planos, impidiendo la creación de puntos con dosis excesivas y previniendo sus complicaciones.
A: Segmentos laterales y B: segmentos mediales conformados con colimador de multiláminas utilizados para obtener volúmenes de radiación homogéneos en IMRT mamaria.
Diversos autores han explorado la utilidad de la radioterapia con intensidad modulada en cáncer de mama, (33) considerándose que su uso es factible, aceptable y seguro, aunque el seguimiento es aún insuficiente (34). Sus potenciales beneficios incluyen mayor homogeneidad de la dosis en la mama, (35) menor toxicidad cutánea aguda, mejor cobertura de los ganglios linfáticos mamarios internos, reducción de la dosis en pulmón ipsilateral y miocardio y del volumen cardiaco comprometido (36). Entre sus posibles desventajas se incluyen la eventual irradiación con dosis bajas de mayor volumen mamario y pulmonar contralateral, habitualmente excluido en radioterapia 2-D y 3-D, mayor tiempo de exposición, mayor dosis corporal total, y las incertezas producidas por el movimiento de órganos generado por la respiración (37).
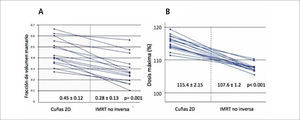
En dos ensayos aleatorios publicados se evidencia una mejoría en la homogeneidad de las dosis con una reducción de las complicaciones agudas cutáneas (38) y de la fibrosis tardía (39). Un tercer estudio reportó mejoría en la dosimetría lograda y subsecuentemente menor aparición de telangectasias (40, 41). Estos efectos parecen ser clínicamente más importantes en pacientes seleccionadas con mamas de gran volumen, en las que existe mayor riesgo de inhomogeneidad de dosis con las técnicas convencionales. En la unidad de trabajo del autor, se ha optado por una técnica simplificada de intensidad modulada que consiste en emplear campos tangenciales bisegmentados con uso de filtros de cuña y planificación no inversa, con lo que se logra un aumento significativo de la homogeneidad de la dosis en la mama, con una significativa reducción de los puntos de máxima dosis y de la fracción de tejido mamario incluido en zonas de alta dosis (Figura 8), lo que clínicamente se ha traducido en mínima toxicidad cutánea aguda. Esta técnica es costo efectiva y no requiere mayor tiempo de planificación ni de tratamiento.
El rol de la IMRT en el cáncer de mama y la tecnología asociada a su uso está en rápida evolución (42). Están pendientes los resultados clínicos a largo plazo, las técnicas óptimas a utilizar y la selección de pacientes que presentan mayor beneficio. Se concluye que la radioterapia con intensidad modulada permite reducir la toxicidad mediante una mejoría en la homogeneidad de las dosis y que la decisión de utilizar IMRT debe considerar la dosimetría obtenida en cada paciente de acuerdo a sus características anatómicas individuales (43).
Cáncer analEl uso de IMRT en cáncer anal ha permitido mayor precisión y mejor protección de los tejidos vecinos normales, como piel perineal, genitales externos y vejiga, lo que se traduce en la reducción de la toxicidad aguda (44) y de las eventuales interrupciones por mala tolerancia al tratamiento que pudiesen comprometer el control tumoral (45). También podría añadir una ventaja adicional al reducir el volumen de médula ósea pelviana irradiado, mejorando la tolerancia hematológica al tratamiento combinado y permitiendo el uso de dosis adecuadas de quimioterapia (46). La IMRT está considerada entre las recomendaciones de tratamiento en la guías clínicas NCCN para cáncer anal.
Tumores CerebralesNo existe evidencia que el uso de la intensidad modulada en tumores cerebrales se asocie a mejoría significativa en control tumoral o supervivencia. En un estudio retrospectivo japonés el uso de IMRT en astrocitomas se asoció a mejor sobrevida libre de enfermedad que con RT convencional (47). La IMRT puede mejorar la conformalidad del volumen blanco y reducir los efectos secundarios al proteger estructuras críticas como oído interno, nervios ópticos, quiasma o tronco cerebral, sin aumentar la dosis integral ni el volumen de dosis baja en pacientes con gliomas (48).
ReirradiaciónLa IMRT puede ser utilizada en pacientes que requieren un segundo curso de radioterapia en tejidos previamente irradiados. Territorios como columna, asiento frecuente de metástasis óseas, pueden ser reirradiados aplicando restricciones de dosis en médula, sin presentar toxicidad secundaria significativa. También está descrita la reirradiación de la rinofaringe y otras localizaciones en cabeza y cuello en caso de recidivas y segundos primarios, con un razonable control tumoral y riesgo aceptable de complicaciones (49, 50).
SíntesisExiste evidencia en ensayos aleatorios que la IMRT produce una reducción clínicamente importante de la toxicidad aguda secundaria a la radioterapia y mejoría en la calidad de vida (51). Aunque es probable que la toxicidad crónica también se reduzca, aún se requiere mayor seguimiento y mejor evidencia. No hay hasta ahora datos que permitan afirmar que el aumento en la exposición de los tejidos normales a dosis bajas de radiación durante el tratamiento pueda asociarse a un aumento del riesgo de complicaciones tardías. Aunque existe una ventaja en el control de tumores de próstata y cabeza y cuello, la potencial mejoría en la supervivencia global en la mayoría de los tumores necesita ser demostrada en ensayos clínicos aleatorios controlados.
El autor declara no tener conflictos de interés, en relación a este artículo.