Durante años se ha usado una nomenclatura imprecisa para designar a las “Anomalías Vasculares de la Infancia”. Esto ha contribuido a diagnósticos erróneos y como consecuencia, a tratamientos inadecuados. La clasificación actual las separa en dos grandes grupos: las malformaciones vasculares y un gran grupo de tumores vasculares, que incluyen principalmente a los clásicos hemangiomas de la infancia y a “nuevos tumores vasculares” que tienen una evolución distinta. Recientemente nuevos hallazgos asociados a las anomalías vasculares de la infancia ha obligado a establecer cambios en el diagnóstico y manejo de estas lesiones con un fuerte énfasis en el manejo multidisciplinario. En el presente artículo se analizan los hemangiomas de la infancia con sus características clínicas, asociaciones con otras patologías y evolución. Se plantean alternativas de estudio y tratamiento.
For years, a confusing nomenclature has been used in the classification of "Children’s Vascular Anomalies." This has contributed to misdiagnosis and consequently inappropriate treatments. The current classification divides them in two groups: vascular malformations and a large group of vascular tumors, including mainly children’s classic infantile hemangiomas and "new vascular tumors" that have a different behavior. In recent years new findings associated with vascular anomalies have led to changes in diagnosis and management, focusing in a personalized and multidisciplinary approach. This article discusses infantile hemangiomas in terms of their clinical picture, associated diseases and evolution. Study and treatment modalities are analyzed.
Hasta hace pocos años las lesiones vasculares infantiles se conocían genéricamente como angiomas (planos cavernosos), sin establecer diferencias en su apariencia clínica, evolución, pronóstico y asociaciones con otras patologías. Esto ha generado confusiones que dificultan el adecuado manejo y tratamiento de este tipo de lesiones. En 1982, Mulliken y Glowacki propusieron por vez primera una separación entre los tumores y las malformaciones vasculares basada en su presentación clínica, sus rasgos histopatológicos y su comportamiento biológico (1).
Es fundamental tener conocimiento de la clasificación actual de las distintas lesiones vasculares que, si bien, pueden tener características clínicas similares, tienen distinta evolución, pronóstico y tratamiento. En este sentido, la International Society for the Study of Vascular Anomalies (ISVA) el año 1996 establece una nueva clasificación de las anomalías vasculares, que en sus fundamentos es respetada hasta el día de hoy (2) (Tabla 1). Se añade la descripción de nuevos tumores vasculares diferentes de los clásicos hemangiomas de la infancia (HI), como son los hemangiomas congénitos (HC) y los hemangioendoteliomas, que tienen un comportamiento biológico distinto.
Clasificación de las anomalías vasculares de la infancia (issva 1996)
| Tumores Vasculares | Hemangiomas de la Infancia (HI) |
| Hemangiomas Congénitos (RICH y NICH) | |
| Hemangioendoteliomas | |
| Angioma en Penacho (AP) (Tufted angioma) | |
| Angiosarcoma | |
| Misceláneos | |
| Tumores Vasculares Adquiridos | |
| Malfomaciones Vasculares | |
| 1. Flujo lento | Capilares (MC) |
| Linfáticas (ML) | |
| Venosas (MV) | |
| 2. Flujo rápido | Arterial (MC) Fístula arteriovenosa (FAV) Malformación arteriovenosa (MAV) |
| 3. Combinadas | MCV, MCL, MLV, MCLV, MAV-ML, MC-MAV |
HI: Hemangiomas Infantiles; RICH: Rapidly Involuting Congenital Hemangioma; NICH: Noninvoluting congenital hemangioma; F: Fístula M: Malformación; C: Capilar; V: Venosa; L: Linfática; A-V: Arteriovenosa.
La descripción de estos nuevos tumores vasculares y la detección de alteraciones asociadas a diversos hemangiomas en los últimos años han obligado a establecer cambios en el diagnóstico, manejo y tratamiento de los tumores vasculares.
Esta clasificación universalmente aceptada por los médicos especialistas en lesiones vasculares es muy útil, pero no está siendo aplicada ampliamente, por lo que aún en la literatura médica continúa utilizándose erróneamente la palabra hemangioma para nombrar lesiones vasculares congénitas, incluidas muchas malformaciones. Siguen usándose adjetivos como capilar, cavernoso, angioma en fresa, angioma plano que aumentan la confusión.
Los tumores vasculares corresponden a lesiones proliferativas, en cambio, las malformaciones vasculares corresponden a errores en la morfogénesis de los vasos (sin hiperproliferación endotelial) producidas en las primeras semanas de gestación por una alteración en los mecanismos reguladores de la vasculogénesis. El sufijo “oma” significa proliferación de un tumor, por lo tanto el uso de palabras que lo contengan como angioma, hemangioma o linfangioma son incorrectos cuando se usan para denominar malformaciones vasculares.
El comportamiento biológico de las malformaciones vasculares es distinto al de los HI. Las malformaciones están presentes desde el nacimiento, aunque pueden hacerse evidentes más tarde en la vida. A diferencia de los hemangiomas infantiles (HI), las malformaciones vasculares no crecen por proliferación endotelial durante el primer año de vida y tampoco involucionan espontáneamente durante la infancia. Habitualmente se mantienen estables durante la infancia, crecen lentamente a lo largo de la vida o en forma rápida en períodos de estimulación hormonal (pubertad, embarazo y parto) o frente a estímulos traumáticos o infecciones.
Tumores vasculares de la infanciaLos tumores vasculares corresponden a un grupo de tumores que incluye principalmente al Hemangioma de la Infancia (HI), que tiene un comportamiento biológico bien definido de crecimiento en el primer año de vida y posterior involución espontánea. El resto lo conforman otros tumores vasculares, mucho menos frecuentes, que tienen un comportamiento y pronóstico distinto. Este grupo está constituido por los hemangiomas congénitos (HC) rápidamente involutivos (RICH: rapidly involuting congenital hemangioma), los HC no involutivos (NICH: non involuting congenital hemangioma), el hemangioendotelioma kaposiforme (HEK), el Angioma en Penacho (AP) o Tufted angioma, entre otros (Tabla 1).
Hemangiomas de la infanciaEl (HI) es una proliferación benigna de células endoteliales. Constituye el tumor benigno más frecuentes en lactantes. El diagnóstico es principalmente clínico (38, 39, 40, 41).
En la mayoría de los casos los HI aparecen en las primeras semanas de vida aunque pueden estar presentes al momento de nacer, en forma de lesión precursora. Son más frecuentes en raza blanca y en sexo femenino con una proporción de 2-5:1 (38). La incidencia es de 1-2,6% en recién nacidos y de 10-12% en lactantes al primer año de vida (38-41).
El año 2000, North descubrió que la isoforma 1 de la proteína transportadora de glucosa GLUT-1, expresada en endotelios que tienen función de barrera como la placenta, los eritrocitos, la retina y el tejido nervioso, también está presente en las células endoteliales de los HI (42). Esta positividad es independiente del estadio evolutivo del hemangioma (37, 43). En consecuencia, el GLUT-1 constituye actual-mente una herramienta esencial en el estudio histopatológico como un marcador inmunohistoquímico capaz de diferenciar los HI del resto de anomalías vasculares (tumores y malformaciones).
La etiopatogenia aun no está clara y continúa en investigación. Se han planteado distintas teorías. Una de ellas postula un origen trofoblástico basado en la similitud que presentan las células placentarias y la de los HI ya que comparten marcadores moleculares como Glut-1, antígeno Lewis Y, merosina y receptor Fc gamma II (42). Por otra parte la incidencia de HI es mayor en hijos de mujeres a las que se les realizó biopsia de vellosidades coriónicas (44). Otras teorías postulan un origen en células precursoras del endotelio que son capaces de originar vasos sanguíneos (vasculogénesis) y otras plantean el desarrollo de nuevos vasos a partir de los existentes (angiogénesis) (4, 5).
Características clínicas de los hemangiomas de la infanciaLos HI se caracterizan por estar ausentes o muy poco desarrollados al momento de nacer (lesión precursora), presentar un crecimiento postnatal considerable durante los primeros meses de vida, seguido de un período de lenta involución espontánea, que comienza habitualmente alrededor del primer año de vida. La involución espontánea de los HI (sin tratamiento) es de aproximadamente un 30% a los 3 años y de un 50% a los 5 años (38, 39). Habitualmente a los 7 a 10 años han involucionado por completo (41).
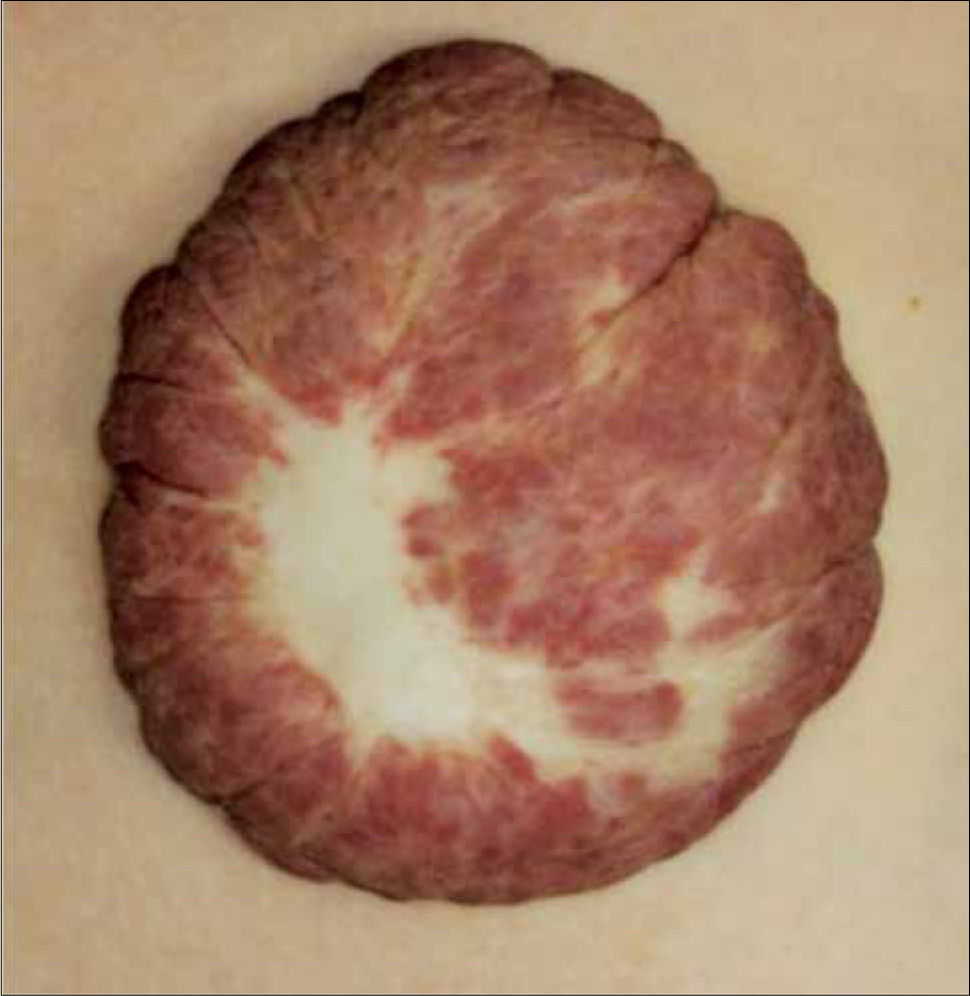
Los HI se localizan más frecuentemente en la cabeza y en el cuello (80%), seguido del tronco y de las extremidades, aunque pueden situarse en cualquier parte del cuerpo. Pueden presentarse en piel o mucosas y su apariencia clínica está determinada por la profundidad, localización y etapa clínica de la lesión. Dependiendo del tipo clínico de hemangioma y del tamaño alcanzado durante el período de crecimiento, cuando involucionan pueden desaparecer por completo o dejar cambios residuales (telangiectasias, cicatrices atróficas, piel redundante, hipo o hiperpigmentación y lesiones fibroad¡posas).
Clasificación de los hemangiomas de la infanciaSegún la ubicación de las células endoteliales en la piel los HI se pueden clasificar en:
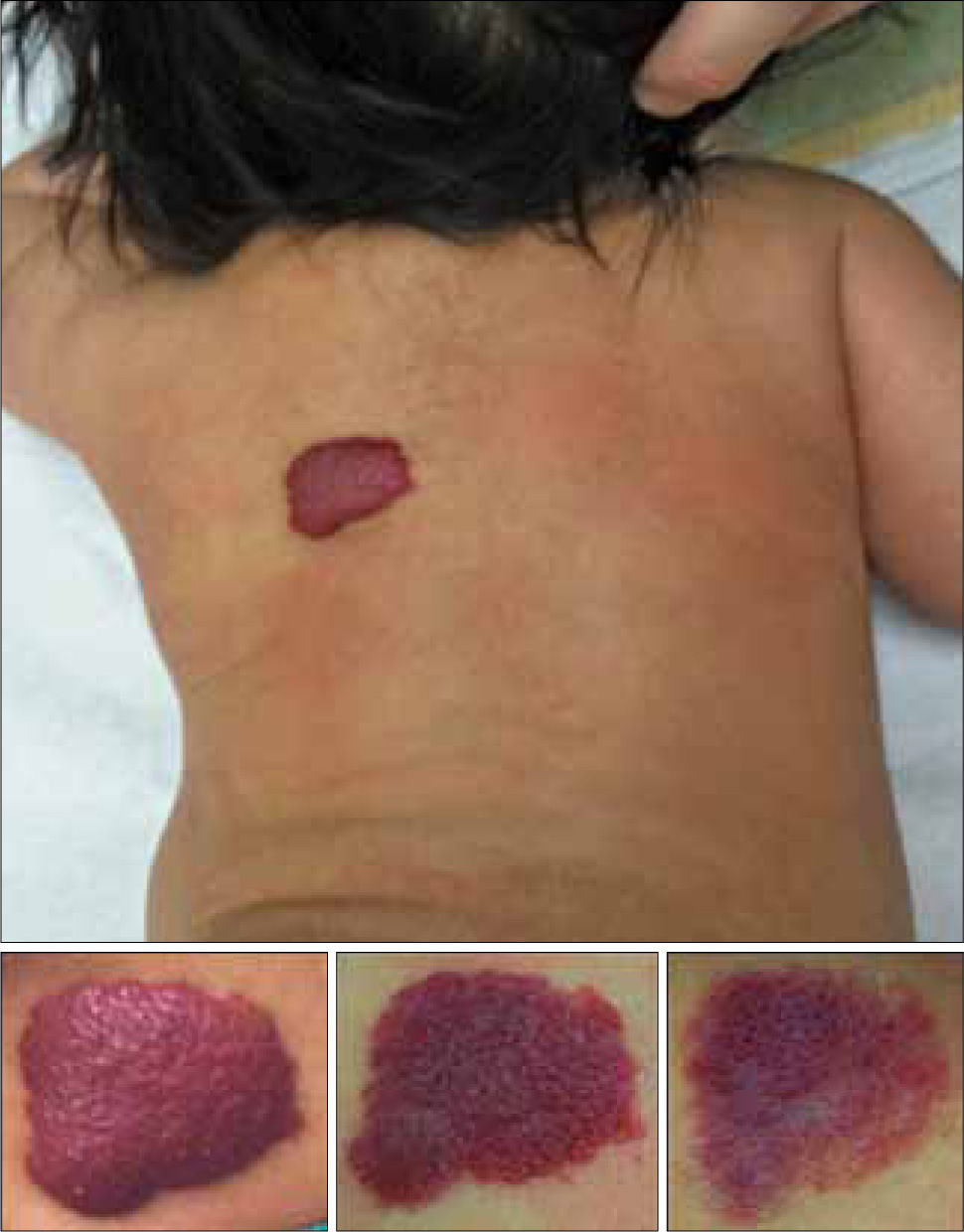
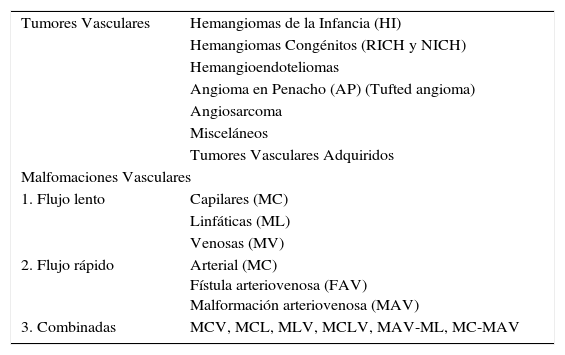
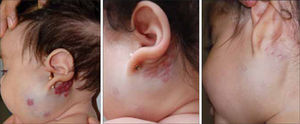
• HI Superficiales: corresponden a los HI más frecuentes (50-60%) (38). Se localizan en la dermis superficial. Clínicamente la lesiones en la fase proliferativa son de color rojo brillante con pequeñas lobulaciones en la superficie (aspecto de fresa) y en la fase involutiva cambia de rojo intenso a púrpura gris y se produce un “aplanamiento” de la superficie (41) (fig.1 y 3). Estas lesiones involucionan habitualmente en forma completa.
• HI Profundos: se localizan en la dermis profunda y/o en el tejido celular subcutáneo. En general no son aparentes al momento de nacer y suele diagnosticarse en las primeras semanas de vida. Clínicamente se manifiestan por un aumento de volumen azul-violáceo, con aumento de temperatura local, con poca o ninguna alteración de piel. Estas lesiones generalmente dejan secuelas fibroadiposas.
• HI Mixtos: contienen ambos componentes. En la fase proliferativa se manifiestan por una placa vascular superficial bien delimitada sobre el componente profundo, de límites menos netos (fig. 2 y 3).
Por otra parte, los HI se pueden clasificar según su distribución en:
• HI focales: lesiones puntuales, redondeadas, conformando nódulos o placas.
• HI segmentarios: son hemangiomas que abarcan un segmento corporal, son más extensos y presentan con mayor frecuencia a complicaciones, tales como ulceraciones, malformaciones asociadas y compromiso de riesgo vital (4, 9-11).
Esta segunda clasificación es más funcional y permite de mejor manera tomar decisiones de manejo.
Complicaciones de los hemangiomas de la infanciaLa mayoría de los HI son pequeños y no requieren tratamiento (41). Sin embargo algunos HI pueden ser problemáticos por su ubicación, tamaño, distribución y porque pueden afectar estructuras vecinas durante la fase proliferativa. Por otra parte algunos HI en ubicaciones particulares se asocian a anomalías sistémicas, que deben ser estudiadas. Se estima que un 1-10% de los HI están asociados a una importante morbilidad, principalmente en forma de malformaciones concomitantes y presencia de hemangiomas viscerales (14). El reconocimiento precoz de los hemangiomas de alto riesgo y un oportuno abordaje terapéutico, implicará una disminución en la morbilidad futura.
Un manejo adecuado de los HI requiere en primer lugar establecer un buen diagnóstico, es decir, tener claro que la anomalía vascular en evaluación constituye un HI y no otro tipo de tumor ni una malformación vascular. En segundo lugar se debe establecer si se trata de un HI preocupante con riesgo de complicaciones por ubicación, número, tamaño, distribución, patrón de crecimiento, riesgo de asociación con otras patologías, ulceración etc. (Tabla 2). En estos casos se debe realizar un estudio adecuado complementario con exámenes (principalmente de imágenes) que permitan delimitar la lesión, determinación de otras patologías asociadas y prevenir las complicaciones con un manejo terapéutico precoz y multidisciplinario.
Complicaciones de hemangiomas en la infancia
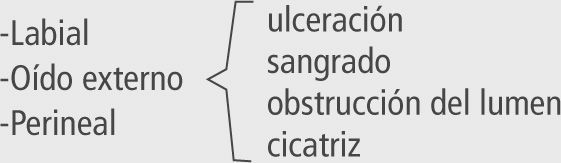
| Ulceración | La más frecuente (5-13% de los casos). Ocurre en fase proliferativa. Más frecuente en HI labiales y perineales. Doloroso. Riesgo de sobreinfección y de cicatrices. Induce involución. |
| Sangrado | Espontáneo o por traumatismo. Generalmente leve y controlable con compresión. Más frecuente en HI labiales y perineales. |
| Por gran tamaño | Deformaciones y repercusiones funcionales y estéticas. Insuficiencia cardiaca congestiva con gasto cardíaco aumentado (HI viscerales). Alta mortalidad. |
| Hemagiomatosis Neonatal |
|
| Localizaciones especiales |
|
Los HI que tienen mayor riesgo de complicaciones y asociación con otras patologías se resumen en la Tabla 2.
En este sentido es importante destacar los siguientes HI:
• HI perioculares: pueden interferir en el desarrollo normal de la visión y generar ambliopía provocada tanto por la compresión extrínseca del globo ocular, que genera vicios de refracción, como por el bloqueo del paso de la luz a través de la pupila, que produce privación del estímulo visual y estrabismo secundario. Cuando se extienden al espacio retrobulbar pueden causar un daño directo del nervio óptico y si se extienden al área intraorbitaria tienen mayor riesgo de ambliopía que los que se mantienen en área exclusivamente palpebral. Se recomienda durante la fase de proliferación una evaluación clínica mensual por un oftalmólogo pediátrico, ya que incluso HI pequeños pueden producir alteraciones de la visión. En lesiones de gran tamaño se recomienda estudiar con resonancia nuclear magnética para determinar la extensión retrobulbar de la lesión (6, 7, 12).
• HI ubicados en labios y áreas intertriginosas: tienen mayor riesgo de ulceración y sangramiento (39). Es importante advertir a los padres para un adecuado tratamiento con medidas generales.
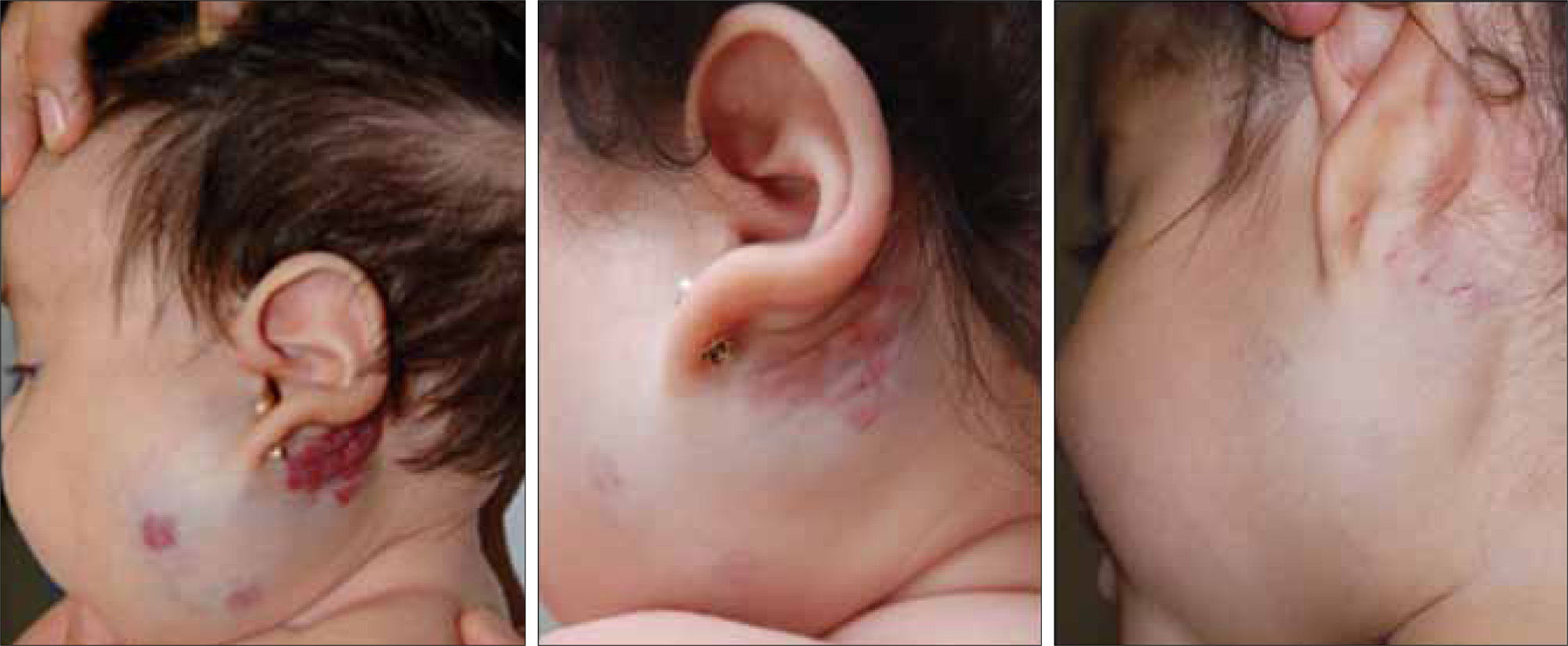
• HI que afectan el conducto auditivo: pueden provocar su oclusión parcial o total y dificultar la audición u originar otitis a repetición, por lo tanto requiere una evaluación periódica por el otorrino (12).
• HI segmentarios en el área de la barba y el cuello: pueden estar asociados a hemangiomas subglóticos que dificultan la respiración por obstrucción de la vía aérea. Hay que sospecharlo en caso de estridor, especialmente durante la alimentación o el llanto, tos persistente o afonía. La visualización directa de la vía aérea mediante laringoscopía, es absolutamente necesaria en casos sintomáticos y recomendable en casos asintomáticos, especialmente si consultan en los primeros 3 meses de vida (12, 13). Los recién nacidos asintomáticos con hemangiomas extensos en estas zonas deben ser rigurosamente controlados clínicamente dentro de los primeros seis meses de vida, ya que un 60% de ellos desarrollará tumores sintomáticos de la vía aérea, con importante riesgo vital (13-15).
• HI segmentarios faciales: pueden asociarse a alteraciones estructurales y de la vasculatura denominados con el acrónimo PHACES (Posterior fossa defects, Hemangiomas, Arterial anomalies, Cardiac defects and Coarctation of the aorta, Eye anomalies, Sternal clefting or Supraumbilical abdominal raphe). Se presenta con mayor frecuencia en niñas. Ante la sospecha se requiere evaluación oftalmológica, cardiológica, neurológica y estudio complementario con ecocardiografía y angio-resonancia nuclear magnética cerebral.
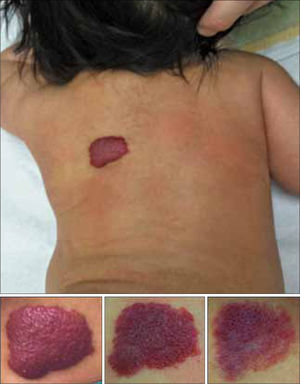
• HI parotídeos: generalmente afectan a la glándula en su totalidad, tienden a involucionar lentamente, tienen una menor respuesta a tratamiento médico y son difíciles de abordar quirúrgicamente debido al riesgo de dañar el nervio facial. En forma infrecuente estos tumores pueden deformar en su crecimiento el hueso mandibular u obstruir el conducto auditivo externo, con la consiguiente sordera de conducción (15, 16) (fig. 2).
• HI lumbosacros y zona perianal: pueden asociarse a disrafismo espinal (ej. médula anclada, lipomeningocele) u otras malformaciones congénitas ocultas (ano imperforado con formación de fístulas rectales, alteraciones del hueso sacro, malformaciones genitales, anomalías renales y lipomeningomielocele) (17, 18). Los más preocupantes son aquellos que ocupan la línea media y los HI segmentarios (mayor riesgo que los focales). Se ha descrito el Síndrome SACRAL por la asociación de un HI localizado en área lumbosacra con anomalías anogenitales; renales y urológicas; anomalías cutáneas y disrrafismo espinal (41, 45) y el Síndrome de PELVIS: por la asociación de hemangioma extenso en área perineal con malformaciones en genitales externos, lipomielomeningocele; anormalidades vesicorectales y ano imperforado (41, 46).
El estudio se puede realizar con una ecografía de la médula lumbosacra, antes de los 3-6 meses de edad ya que a esta edad se pueden detectar alteraciones subyacentes y permite determinar la altura del cono medular y su adherencia o no a estructuras anómalas. Posteriormente se produce el proceso de osificación que limita la visualización, por lo que se requiere Resonancia Magnética (RM) que es la técnica de elección para visualizar alteraciones subyacentes después de los 6 meses. Algunos recomiendan realizarla de forma sistemática y otros únicamente si la ecografía es anormal o hay signos clínicos (12, 19). Obviamente en estos casos debe evaluarse además la zona genital para descartar lesiones asociadas.
• HI múltiples: habitualmente los HI se presentan como una lesión cutánea única, pero en un 10-25% de los casos las lesiones son múltiples. La presencia de seis o más HI cutáneos es muy infrecuente y ocurre en aproximadamente el 3% de los niños con HI (21). En estos casos el compromiso puede ser exclusivamente cutáneo, cuadro conocido con el nombre de Hemangiomatosis Neonatal Benigna (HNB) o puede asociarse a la presencia de hemangiomas viscerales cuadro que se denomina: Hemangiomatosis Neonatal Difusa (HND) (9, 12, 20). El hígado es la localización extracutánea más frecuente, aunque cualquier órgano puede verse comprometido (cerebro, aparato gastrointestinal, ojos, bazo, pulmón y riñón) (40). Cuando existen más de cinco HI cutáneos existe una mayor probabilidad de Hemangioma hepático (20, 32). El estudio inicial debe incluir ecografía hepática e imágenes de cualquier otro órgano sintomático (12, 15, 20). Cuando se detecta un Hemangioma hepático debe realizarse también evaluación de función tiroidea ya que ha encontrado una asociación entre hemangiomas hepáticos difusos e hipotiroidismo de muy difícil manejo con alto impacto en la morbimortalidad del paciente (23, 24, 32). El compromiso hepático puede complicarse con hepatomegalia congestiva y con insuficiencia cardíaca con alto riesgo de mortalidad (41). El tratamiento debe ser precoz.
Este cuadro se debe distinguir de otros cuadros de anomalías vasculares múltiples, como la Linfangioendoteliomatosis Multifocal Congénita con Trombocitopenia (MLT) (34, 33) o el síndrome de Blue Rubber Bleb Nevus, cuadros que a simple vista pueden ser similares, pero que presentan mayor compromiso gastrointestinal y trastornos de la coagulación. Estos últimos tienen menor sobrevida y peor respuesta a tratamientos.
HI de consideración estética (32):
- -
HI faciales: especialmente en área central (punta nasal y labio) por el riesgo de provocar deformación permanente.
- -
HI con telangiectasias extensas especialmente en zonas expuestas (cara y manos)
- -
HI en área perineal.
- -
HI con gran compromiso subcutáneo por la deformación secundaria. Un tratamiento precoz puede evitar secuelas complejas.
- -
HI de gran tamaño: pueden producir insuficiencia cardiaca y daño por compresión de estructuras vecinas.
La ecografía es una técnica no invasiva relativamente barata de mucha ayuda en el enfoque inicial del paciente. Resulta especialmente útil en niños al no requerir de excesiva cooperación por parte del paciente, por lo que no es necesario el uso de sedación. La información obtenida es dependiente del equipo y del operador. Se requiere un radiólogo experimentado.
La ecografía de la lesión misma con doppler color, permite determinar su origen vascular y evaluar las características del flujo sanguíneo dentro de ella, aunque no permite valorar con extrema precisión la extensión de ésta. Está especialmente indicado en:
- •
HI profundos (subcutáneos) por el diagnóstico diferencial con otros tumores vascularizados y otras anomalías arterio-venosas (12, 30).
- •
Estudio de localización y evolución de HI viscerales (hepáticos) (4).
- •
Seguimiento evolutivo HI complicados, para valorar su involución.
- •
En el Sd de PHACE es útil para evaluar la anomalías arterial a nivel cervical y la Ecocardiografia para descartar coartación aortica (30).
- •
La ecografía también es útil para descartar anomalías asociadas, como disrafia espinal oculta (en menores de 6 meses) malformaciones genitourinarias (en HI lumbosacros), malformaciones cerebrales (ecografía cerebral en menores de 9 meses con HI segmentario de cara).
Es la técnica de elección para lesiones de partes blandas, entre ellas, las anomalías vasculares. Es un examen que requiere sedación en los pacientes pediátricos, se utilizan compuestos de gadolinio como medio de contraste que son bastante seguros, en comparación con los medios de contraste yodados que se utilizan en los procedimientos que hacen uso de radiaciones ionizantes como la TC. Además de proporcionar información anatómica, también es capaz de aportar datos hemodinámicos del flujo sanguíneo (36).
La RM permite diferenciar HI de malformaciones vasculares. Puede determinar con exactitud la extensión de la lesión vascular, especialmente en el área periocular o en la región del cuello. Tiene indicación en evaluación de HI lumbosacros, en los casos de hallazgos patológicos en la ecografía de columna o en niños mayores de 6 meses para descartar disrafismo oculto o extensión intraespinal o en HI perineales extensos, para descartar anomalías urogenitales. Debe realizarse ante la sospecha de un Síndrome de PELVIS o SACRAL (30). Está indicada en HI segmentarios de cabeza (Sd. PHACES) y cuello para descartar asociaciones con malformaciones estructurales y vasculares cerebrales y evaluación de la vía aérea (4, 30). Se utiliza en el estudio de HI viscerales (sistema nervioso central, vías respiratorias, hepáticas y digestivo).
Es recomendable su uso en tumores vasculares de presentación atípica, especialmente si se sospecha de un HEK y en algunas lesiones con alto flujo, en que persisten dudas en la ecografía del diagnóstico diferencial con un RICH o una malformación arteriovenosa.
C. Tomografía Computada (TC)Es útil para determinar la extensión de las lesiones de mayor tamaño y para evaluar la posible repercusión ósea, aunque la RM resulta de mayor ayuda para valorar los tejidos blandos (12). Es difícil diferenciar con esta técnica un hemangioma de una malformación vascular. Es un examen que emite radiación ionizante y requieren sedación en los pacientes pediátricos.
D. BiopsiaEl estudio histológico es la prueba diagnóstica definitiva. Permite diferenciar tumores de malformaciones vasculares y distinguir entre los distintos tumores vasculares y diferenciarlos de otros con aspecto vascular pero de otro origen histológico (rabdomiosarcoma, miofibroma, fibrosarcoma congénito).
El marcador inmunohistoquímico GLUT-1 permite diferenciar los HI del resto de los tumores vasculares (HC, HEK; AP) ya que solo es positivo en los primero. Este patrón de positividad se mantiene en todas las fases del HI, incluida la involutiva. El AP y el HEK tienen un patrón histológico característico con GLUT-1 negativo (42, 43).
Se debe considerar tomar biopsia frente a lesiones vasculares cuyo diagnóstico clínico en los primeros meses de vida no pueda establecerse clínicamente con seguridad y se plantee la necesidad de tratamiento activo a corto plazo (4).
E. Otros estudiosHemograma y estudio de coagulación para valorar anemia aguda o crónica por hemorragia de las lesiones cutáneas o viscerales o trombocitopenia asociada (4).
Dímero D en sospecha de trastorno de la coagulación asociado (está aumentado).
Pruebas tiroideas: en hemangiomas hepáticos y hemangiomas de gran tamaño ya que pueden asociarse a hipotiroidismo (15).
Estudios asociados a la evaluación multidisciplinaria en cada caso por ejemplo estudio por método endoscópico (en estudio de hemangiomas laríngeos y en HI sangrantes en el tracto digestivo).
Tratamiento de los hemangiomas de la infanciaEl 90% de los hemangiomas no necesita tratamiento ya que van a involucionar en forma espontánea.
La decisión de inicio de tratamiento debe considerar la edad del paciente y ser enfocada a cada caso en particular, sin embargo su indicación es clara en HI complicados o con alto riesgo de serlo: compromiso vital, distribución segmentaria, repercusión funcional, deformidad significativa y ulceración.
En general las indicaciones de tratamiento se pueden resumir de la siguiente manera:
- a)
HI que implican riesgo vital: HI localizados en la vía aérea; HI que provocan insuficiencia cardíaca; los asociados a hipotiroidismo severo (HI hepático) y los que comprimen estructuras del sistema nervioso central.
- b)
HI con repercusión funcional: como los ubicados en la órbita (ambliopía); oído (pérdida de la audición); nariz (respiración) y área perineal.
- c)
HI que se complican con dolor y ulceración extensa.
- d)
HI con riesgo secuelas estéticas importante con alto impacto psicológico como los faciales (segmentarios y en área central) y en la mama en el caso de las mujeres (32).
El tratamiento implica un enfoque multidisciplinario y precoz. Sin embargo no existe un protocolo claro y definido de esquema terapéutico, de hecho, la FDA (Food and Drug Administration) no ha aprobado ningún tratamiento sistémico para los HI. Por tanto existe un riesgo significativo con las terapias actuales disponibles (31).
A. Corticoides orales: Por años ha sido el pilar de tratamiento en HI complicados (2-5 mg/Kg de prednisona /día). Con alto riesgo de efectos colaterales generalmente transitorios (insomnio, facies cushingoide, irritabilidad, reflujo gastroesofágico, acné, retardo de crecimiento y osteoporosis) y en ocasiones muy significativos como la miocardiopatía hipertrófica e insuficiencia suprarrenal (32). Estos actúan solo en fase proliferativa (24).
B. Propanolol: El año 2008, Léaute´-Labrèze y su grupo publican una serie de 11 pacientes con HI tratados con propranolol a una dosis de 2 mg/kg/día con una excelente respuesta (25). Estudios posteriores en distintas partes del mundo han obtenido resultados similares. La ventaja de este tipo de fármaco es que no sólo actúa en la etapa proliferativa, sino también en la etapa de involución y su perfil de seguridad es mucho mejor que el de los esteroides orales (24). Se ha observado que tiene efecto inhibiendo el crecimiento del tumor y adelantando y acelerando el proceso de involución (24). Esto ha marcado un “antes y un después” en el tratamiento de los HI. Significa un cambio importante en el pronóstico de estas lesiones, disminución de complicaciones y disminución de problemas secundarios al tratamiento con esteroides orales. Además se disminuye la necesidad de requerir tratamiento quirúrgico y se mejoran las condiciones en caso de ser requerido. Estas características han llevado a considerar al Propranolol como la terapia de primera línea en HI. Pero hay que tener en cuenta que faltan estudios randomizados para evaluar el perfil de seguridad de estos fármacos, especialmente en niños sanos, sin cardiopatía.
Aún no está del todo claro el mecanismo de acción de este fármaco en los HI. Se plantea que actuaría a través de tres mecanismos principales: un mecanismo inicial atribuible a la vasoconstricción debido a la menor liberación de óxido nítrico. Un efecto en la etapa intermedia que se debería a la inhibición de la síntesis de factores proangiogénicos, evitando el crecimiento tumoral y por último efectos a largo plazo producidos por la inducción de apoptosis en las células endoteliales, que lleva a adelantar la regresión del tumor (26).
El propranol es un bloqueador no selectivo de receptores beta adrenérgicos y está aprobado para niños menores de un año en otras patologías. Se usa en dosis de 2mg/kg/día dividido en 3 dosis (fig. 2). Los efectos secundarios más frecuentes del propranolol son: bradicardia, hipotensión, broncoespasmo, hipoglicemia, vasoconstricción periférica, trastornos gastrointestinales, cambios de comportamiento y alteraciones del sueño, erupción cutánea, sudoración profusa, y diarrea (8). El más grave es la hipoglicemia.
Si bien no hay un protocolo claro de la administración de este fármaco la mayoría de los reportes sugiere una evaluación cardiológica con electrocardiograma basal e incluso algunos inician el medicamento con el paciente hospitalizado durante 24 a 48 horas, especialmente en niños menores de 3 meses, para monitorizar la presión arterial, frecuencia cardiaca y glicemia. Con una dosis inicial de 0.5-1 mg / kg y según tolerancia se aumenta hasta una dosis de 2-3 mg / kg dividida en tres dosis al día. No está claro la duración del tratamiento pero la mayoría lo mantiene durante el primer año de vida (fase proliferativa) (3).
C. Interferón alfa-2a y 2b: Está indicado en IH complicados que no responden glucocorticoides. La dosis varía de 1 a 3.000.000 unidades/m2/día, administrada mediante inyección subcutánea (41, 32). La duración del tratamiento puede variar de 6 a 12 meses. Los primeros signos de regresión aparecen entre la segunda semana y tres meses de tratamiento (32). Se asocia frecuentemente a efectos secundarios importantes: neurotoxicidad (agitación, irritabilidad, convulsiones, diplejía espástica); toxicidad hepática y hematológica; hipotiroidismo y habitualmente produce fiebre y dolores musculares, especialmente al principio del tratamiento (41, 32).
D. Vincristina: También es una terapia de segunda línea y se reserva para los casos graves que no responden a terapias convencionales. Se administra por vía endovenosa de 0,05mg / kg ó 1mg / m2 por al menos 15 semanas. Tiene una alta tasa de respuesta de regresión del HI pero con alto riesgo de efectos adversos: fatiga, alopecia, estreñimiento, dolor abdominal; neuropatía periférica; toxicidad hematológica y secreción inadecuada de hormona antidiurética (41).
E Otros: Recientemente se han publicado algunos casos de HI pequeños y focales tratados en forma tópica con Timolol al 0,5% con buenos resultados (27, 29). Otros tratamientos generalmente complementarios son: láser decolorante pulsado y cirugía (HI muy grandes, disfunción severa, obstrucción, lesiones residuales).
La autora declara no tener conflictos de interés, en relación a este artículo.