La monitorización terapéutica de fármacos (MTF) es una herramienta con demostrada efectividad para mejorar los resultados clínicos de los pacientes, minimizando la toxicidad y maximizando la efectividad de los tratamientos. Además de usarla en aquellos fármacos con estrecho margen terapéutico o con perfil de efectos adversos dosis-dependientes, podría favorecer en la individualización de los tratamientos. Reconociendo en qué etapa de la farmacocinética (ADME: absorción, distribución, metabolismo, excreción) el paciente tiene alternaciones y cuáles son los parámetros farmacocionéticos individuales (volumen de distribución, clearance, vida media, área bajo la curva, etc.), sería posible interpretar las concentraciones plasmáticas medidas para conseguir la respuesta terapéutica esperada con una dosis específica. El presente artículo revisa los aspectos necesarios a considerar antes de utilizar la MTF en nuestros centros.
Therapeutic drug monitoring (TDM) is a tool with proven effectiveness to improve clinical outcomes for patients, minimizing toxicity and maximizing the effectiveness of treatments. Besides their use in those drugs with narrow therapeutic profile or dose-related adverse effects, TDM might help to obtain treatment individualization. Recognizing changes in both step of patient's pharmacokinetics (ADME: absorption, distribution, metabolism, excretion) and individual pharmacokinetic parameter (volume of distribution, clearance, half-life, area under the curve, etc.) could be possible to interpret the plasma concentrations measured to achieve an expected therapeutic response with a specific dose. This article reviews some necessary aspects to consider before to use the MTF in our hospitals.
La monitorización terapéutica de fármacos (MTF) también conocida ampliamente como TDM por su nombre en inglés de Therapeutic Drug Monitoring, es una práctica que en el último tiempo ha tenido fuerte alza en los tratamientos farmacológicos. Su implementación ha permitido optimizar el uso de medicamentos y mejorar la terapia de los pacientes, por lo que se justifica invertir en ella1.
Según la International Association of Therapeutic Drug Monitoring and Clinical Toxicology (IATDMCT), la MTF es una especialidad clínica multidisciplinaria destinada a mejorar la atención al paciente mediante el ajuste individual de dosis de aquellos medicamentos en los que se ha mostrado evidencia o experiencia de mejorar el resultado clínico en poblaciones generales o especiales. Puede basarse en farmacogenética a priori, información demográfica y clínica, y/o en medición a posteriori de las concentraciones en sangre de los fármacos y/o biomarcadores (monitoreo farmacocinético y/o farmacodinámico, respectivamente).2
En términos sencillos, consiste en medir la concentración de un fármaco en alguna matriz biológica, normalmente sangre, a un tiempo determinado y evaluar el cumplimiento de un rango terapéutico definido. Sirve para relacionar la dosis administrada con el efecto terapéutico esperado3–5. Debido a que es casi imposible medir la concentración del fármaco en el sitio de acción, se estima que la concentración en plasma puede relacionarse con un efecto farmacológico. Se considera que la sangre es un reflejo de lo que ocurre en los tejidos. Por lo tanto, sin necesariamente tener la misma concentración, si se observan cambios de concentración en la sangre, podría también haberla en el sitio de acción. Este supuesto farmacológico asume la relación dosis –tiempo- efecto, por lo que variaciones en la dosis significan cambios en la concentración plasmática y con ello conseguir una respuesta, la que podría ser sub-terapéutica, terapéutica o tóxica según el rango de concentración establecido al momento de la monitorización6,7.
Si bien podría pensarse que todos los medicamentos en uso deberían monitorizarse, en la práctica no es así. Cuando sea posible contar con un parámetro de seguimiento para el fármaco, no es necesario monitorizar con niveles plasmáticos3. Por tal razón, no todos los fármacos son candidatos de medición de niveles. Los principales criterios para que el uso de un fármaco se pueda monitorizar con la medición de niveles sanguíneos son:
- -
Buena correlación entre el efecto farmacológico o tóxico y las concentraciones medidas.
- -
Estrecho margen terapéutico. Concentraciones tóxicas y concentraciones. Terapéuticas muy cercanas.
- -
Alta variabilidad inter e intraindividual farmacocinética.
- -
Efecto farmacológico difícil de medir.
- -
Metodología analítica disponible. Rápida obtención del resultado.
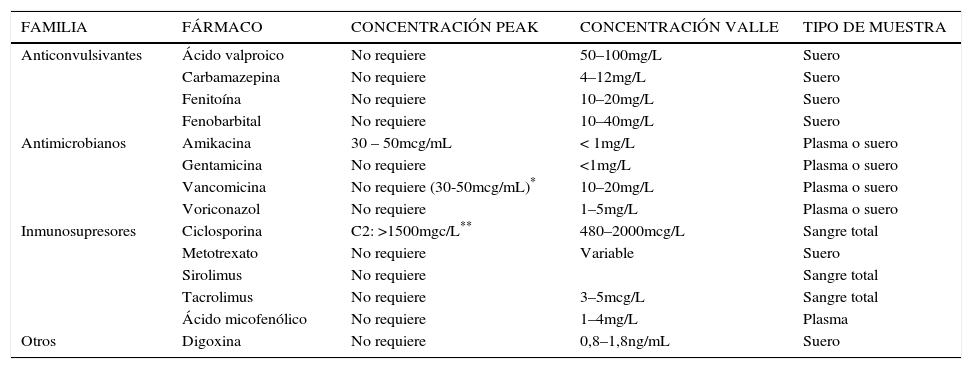
En la Tabla 1 se muestran los fármacos que normalmente se monitorizan en nuestro país.
EJEMPLOS DE ALGUNOS FÁRMACOS FRECUENTEMENTE MONITORIZADOS EN CHILE Y SUS RANGOS DE CONCENTRACIONES ESPERADAS
| FAMILIA | FÁRMACO | CONCENTRACIÓN PEAK | CONCENTRACIÓN VALLE | TIPO DE MUESTRA |
|---|---|---|---|---|
| Anticonvulsivantes | Ácido valproico | No requiere | 50–100mg/L | Suero |
| Carbamazepina | No requiere | 4–12mg/L | Suero | |
| Fenitoína | No requiere | 10–20mg/L | Suero | |
| Fenobarbital | No requiere | 10–40mg/L | Suero | |
| Antimicrobianos | Amikacina | 30 – 50mcg/mL | < 1mg/L | Plasma o suero |
| Gentamicina | No requiere | <1mg/L | Plasma o suero | |
| Vancomicina | No requiere (30-50mcg/mL)* | 10–20mg/L | Plasma o suero | |
| Voriconazol | No requiere | 1–5mg/L | Plasma o suero | |
| Inmunosupresores | Ciclosporina | C2: >1500mgc/L** | 480–2000mcg/L | Sangre total |
| Metotrexato | No requiere | Variable | Suero | |
| Sirolimus | No requiere | Sangre total | ||
| Tacrolimus | No requiere | 3–5mcg/L | Sangre total | |
| Ácido micofenólico | No requiere | 1–4mg/L | Plasma | |
| Otros | Digoxina | No requiere | 0,8–1,8ng/mL | Suero |
Los fármacos anticonvulsivamentes son el grupo farmacológico clásico para ejemplificar la MTF. Debido a que son fármacos con alto metabolismo hepático, con interacciones en la absorción y en el metabolismo a nivel de citocromo P450; alta unión a proteínas plasmáticas, frecuentes efectos adversos y dificultad de adherencia al tratamiento, desde hace muchos años que se han incorporado las mediciones de niveles plasmáticos para optimizar su uso en los pacientes. En la actualidad, se siguen monitorizando con dosificación personalizada, ya que se interpreta que el nivel obtenido debe siempre relacionarse con el objetivo terapéutico3,8,9. Sin embargo, para los nuevos anticonvulsivamentes aún no ha sido claramente definida la utilidad de medir niveles plasmáticos.
La monitorización de inmunosupresores es también una práctica realizada tanto para evitar toxicidad, así como también obtener mejor respuesta y evaluar la adherencia a los tratamientos por parte de los pacientes. La falta de adherencia a la terapia es un problema grave ya que conduce al empeoramiento de la enfermedad, aumento de los costos en la atención médica e incluso a la muerte. Por lo tanto, en casos de trasplante de un órgano el grado de inmunosupresión lograda con los medicamentos debe garantizar la menor tasa de rechazo10.
Los antibióticos β-lactámicos son un ejemplo de implementación de monitorización fuera de los conceptos clásicos. No son considerados candidatos de MFT ya que no tienen estrecho margen terapéutico y la mayoría de los eventos adversos no son dosis dependiente. Por otro lado, existe variada información que muestra las ventajas de optimizar la exposición del β-lactámico si se realizan modificaciones en las velocidades, frecuencias y dosis administradas, además del cumplimiento de ciertas concentraciones plasmáticas.
De esta forma, el cumplimiento del objetivo farmacocinético-farmacodinámico (FC/FD) tiempo-dependiente, parece obligar el control de niveles para que los pacientes logren concentraciones plasmáticas más constantes de al menos 5 veces la CIM del patógeno para ese antibiótico11.
La metodología analítica para su determinación aún no ha sido implementada en nuestro país, pero existen grupos de investigación que se encuentran en su desarrollo (Proyecto U-Redes UR-004/2015 de la Universidad de Chile).
En algunos países, los métodos analíticos por HPLC ha permitido desde la investigación, incorporar en forma rutinaria la monitorización de niveles plasmáticos de β-lactámicos, generando evidencia para modificar las formas de administración12. Gracias a ello, el aumento de la frecuencia en la posología o la proposición de emplear infusiones prolongadas o continuas sea hecho una realidad, sobre todo en el paciente crítico13,14.
Para los antifúngicos existe suficiente información que también recomienda incorporar la MTF como práctica clínica rutinaria. Este grupo de fármacos deberían igualmente cumplir condiciones FC/FD que de no medirse niveles plasmáticos resultaría muy difícil alcanzar, sobre todo porque se ha observado que las dosis normalmente empleadas sería insuficiente en ciertos pacientes lo que impacta directamente en el control de la infección así como también, reducir eventos adversos asociados a altas dosis15.
Habitualmente se realiza monitorización de aminoglicósidos y vancomicina y los niveles plasmáticos solicitados han sido constantemente revisados para ser útiles no solo en reducir oto y nefro toxicidad. En general, implementar monitorización de antimicrobianos sería la estrategia más óptima para realizar un uso racional y efectivo para el control de la infección en los pacientes16. Al día de hoy, la morbimortalidad por sepsis sigue siendo alta a nivel mundial, sobre todo en Unidades de Cuidados Intensivos por lo que es fundamental el uso de antimicrobianos con dosis correctas para obtener concentraciones adecuada desde el comienzo de la terapia.
Sin embargo, usar la MTF solamente para conseguir un nivel dentro del rango terapéutico es una simplificación muy frecuente y, además, errónea.
En primer lugar, si sabemos que el rango o índice terapéutico es un intervalo de concentración plasmática deseable, definida en las fases de desarrollo de un medicamento para establecer la dosis con la que se tiene la mayor respuesta farmacológica y la mínima toxicidad,6 comprenderíamos que algunos pacientes se escapan de ese comportamiento poblacional5. Por lo tanto, no es correcto ajustar la dosis del paciente sólo para alcanzar el rango de concentración sin comprender cuál es la concentración que el paciente requiere y la dosis para alcanzarla. Para poner en práctica una MTF y maximizar la eficacia minimizando la toxicidad, es imprescindible conocer los conceptos de farmacocinética detrás del uso de medicamentos.
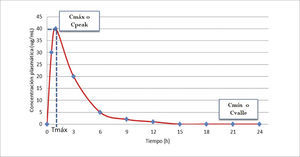
FARMACOCINÉTICALa farmacocinética es el estudio de la evolución temporal de las concentraciones de un fármaco y/o metabolitos en un organismo (fluidos, tejidos, compartimentos extracorporales) y de las relaciones matemáticas necesarias que permitan interpretar los datos a través de modelos definidos4,7,17,18. Es el estudio del proceso ADME (absorción, distribución, metabolismo y excreción) que sufre un fármaco una vez administrado a un individuo. Si pudiéramos construir un gráfico de concentración plasmática del fármaco versus tiempo, podríamos estudiar el comportamiento farmacocinético, identificando cada etapa del ADME.
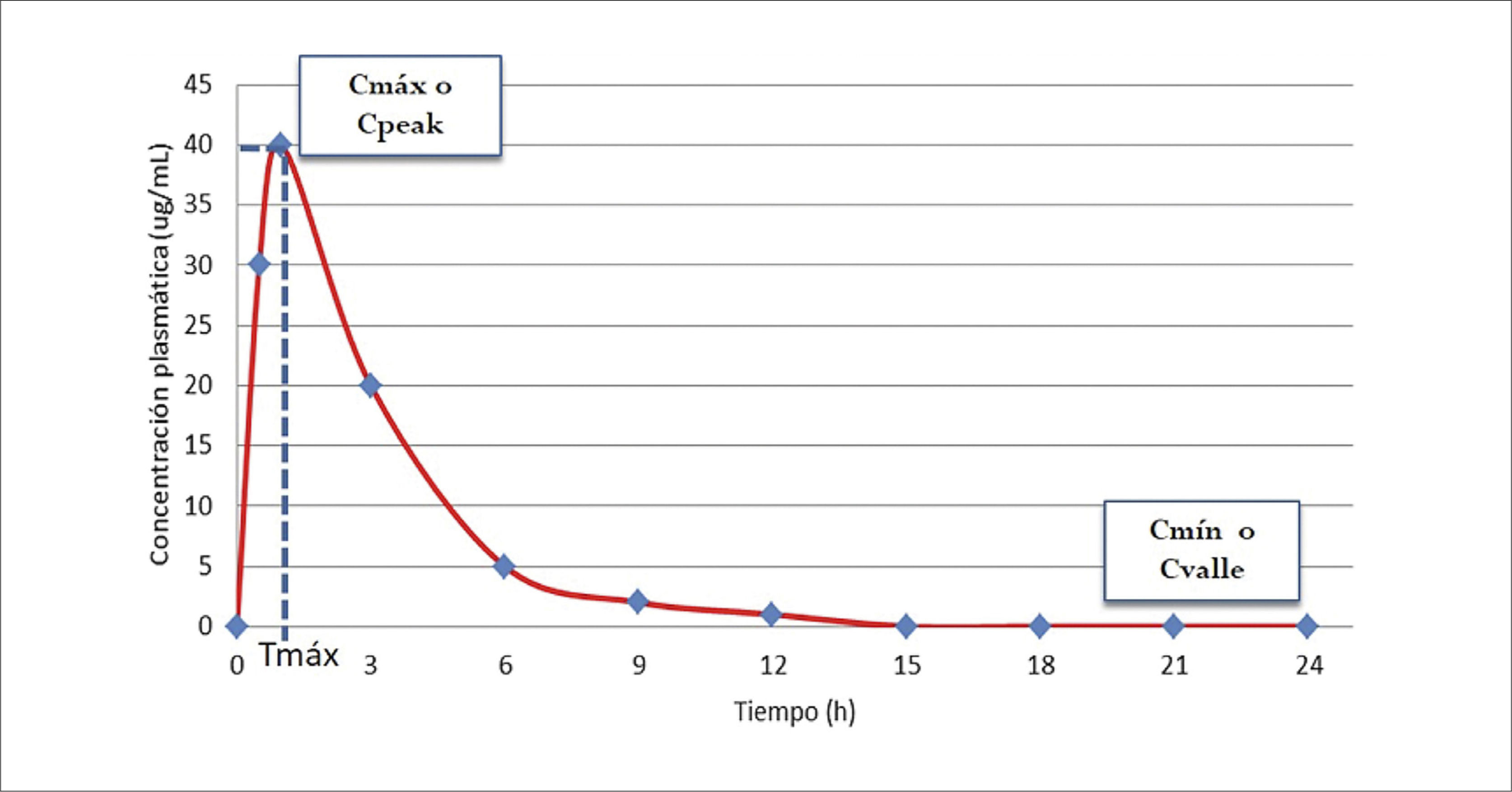
Como resultado de estas etapas, se generan concentraciones del fármaco en la sangre, las que van cambiando en el tiempo. En la Figura 1 se puede observar que desde que se administra el medicamento, y a medida que se absorbe, el fármaco va apareciendo en la sangre hasta alcanzar una concentración máxima (Cmáx) a un tiempo determinado (Tmáx). Si el medicamento se administra directamente a la sangre, no habría absorción por lo que el fármaco tendría 100% de biodisponibilidad (BD). Luego, a medida que se distribuye por la sangre a todos los tejidos del organismo, puede pasar por órganos que lo metabolicen a sustancias activas o inactivas. Si se suma a eso procesos de eliminación desde el organismo, con el paso del tiempo va desapareciendo el fármaco de la sangre hasta ser indetectable.
GRÁFICO DE CONCENTRACIÓN PLASMÁTICA VERSUS TIEMPO DE UN FÁRMACO CUALQUIERA
Cmáx o C peak: concentración plasmática máxima o concentración plasmática peak. Máxima concentración conseguida con la dosis administrada.
Tmáx: Tiempo para alcanzar la concentración plasmática máxima.
Cmín o Cvalle: concentración plasmática mínima o concentración plasmática valle. Concentración residual antes de la administración de la siguiente dosis.
Se sabe que, en ciertos pacientes, alguna etapa del ADME está seriamente alterada, lo que generará, por consiguiente, distintas concentraciones plasmáticas a las esperadas.
Por ejemplo, en los neonatos, ancianos o pacientes con daño renal, la etapa de excreción de fármacos está disminuida, requiriendo dosis menores19–21. Por otro lado, en pacientes críticos se observa un aumento en el volumen de distribución por lo que requerirían dosis más altas de las usuales22,23, así también los pacientes obesos24. Estos cambios en poblaciones especiales se deben estudiar en forma particular y establecer en ellos las dosis necesarias. Aquí la MTF juega un rol protagónico del que se puede generar nueva información para un correcto uso del medicamento5.
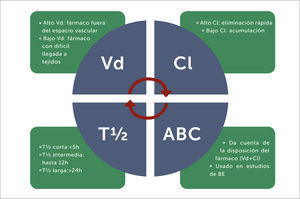
Para estudiar la farmacocinética en un paciente, se deberían conocer los parámetros farmacocinéticos que explican el ADME de ese fármaco (Figura 2). Los parámetros más importantes son:
- -
El volumen de distribución aparente (Vd).
- -
Aclaramiento o clearance (Cl).
- -
Área bajo la curva de la gráfica concentración plasmática–Tiempo en 24 horas (ABC24).
- -
Constante de velocidad de eliminación (ke).
- -
Tiempo de vida media de eliminación (más conocido como vida media, T ½).
- -
Principalmente 4,7,17,18.
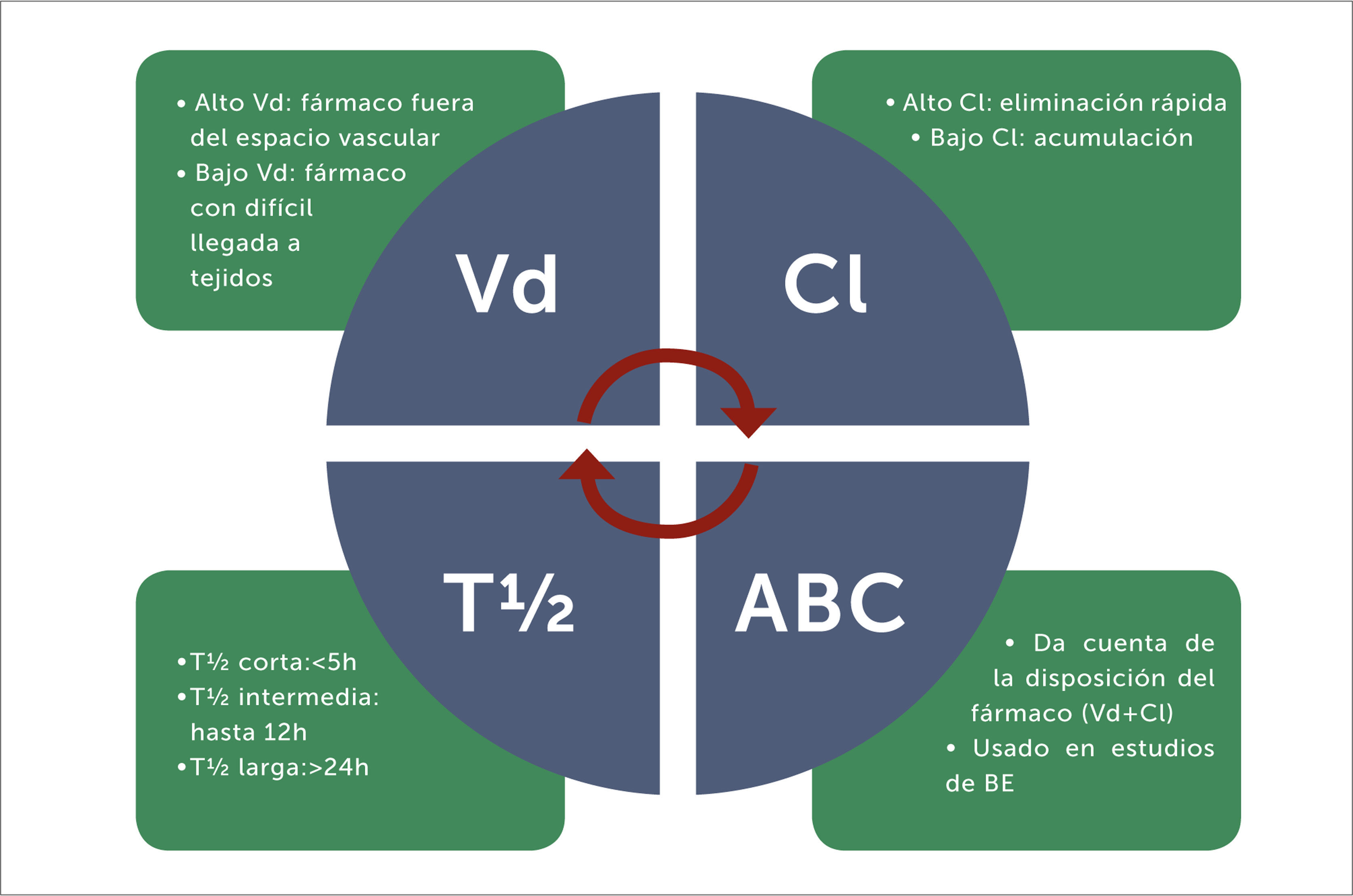
Parámetros farmacocinéticos comúnmente empleados para estudiar el comportamiento de un fármaco
Vd: volumen aparente de distribución (expresado en L o L/Kg).
Cl: clearance o aclaramiento (expresado en L/h o mL/min).
T ½: tiempo de vida media de eliminación (expresado en h).
ABC: área bajo la curva de concentración plasmática del fármaco versus tiempo en 24h.
BE: bioequivalencia.
De la monografía de cada medicamento podríamos conocer los valores promedio de cada parámetro, que derivan de la dosis empleada y la forma de administración autorizadas para su uso. Sin embargo, al individualizar la terapia, es preciso estimar cuál o cuáles parámetros son los distintos junto a la magnitud del cambio, y cómo la dosis o la forma de administración se deberían modificar para alcanzar la concentración esperada18.
Volúmen de distribución (Vd)
Cplasma: concentración plasmática del fármaco.
La relación entre la dosis (mcg, mg, g) y el volumen en que se encuentra (mL, L) genera una concentración (mcg/L, mg/L, etc). Así se estima el volumen de distribución aparente.
Por lo tanto, el Vd, como parámetro farmacocinético, sólo da cuenta de cómo se relaciona la dosis administrada con la concentración alcanzada. Tiene un valor mínimo, relacionado con la volemia del paciente, muchas veces observado en fármacos hidrofílicos como aminoglicósidos o β-lactámicos, pero no tiene un valor máximo llegando, por ejemplo, a valores virtuales muy altos como por ejemplo, Vd=600 L para digoxina. Por tanto, un gran Vd nos orienta a que ese fármaco genera bajas concentraciones plasmáticas ya que se distribuye bien fuera del espacio vascular, normalmente con buena penetración a tejidos25
Tiempo medio (T½), es un parámetro farmacocinético del que muchas veces se habla. Es el tiempo (normalmente en horas) para que la concentración del fármaco se reduzca a la mitad. La utilidad de conocerlo permite saber cuándo se alcanza el estado estacionario del fármaco (aquel momento en que, pese a las sucesivas dosis, la concentración plasmática sigue aumentando y siempre se mueve en un rango), así como también, predecir cuándo se eliminaría el fármaco del organismo4,7. Para ambos escenarios, 5 o 6 veces la vida media del fármaco será el tiempo necesario para conseguir cualquiera de las dos situaciones. (Nota: con este criterio, el estado estacionario se alcanza si la frecuencia de administración es igual al T½. Ejemplo: en niños, vancomicina tiene T½ = 6h, y la posología es 15mg/kg cada 6h. El tiempo para alcanzar el estado estacionario será 5*6h = 30h. Por otro lado, fármacos con corta vida (ejemplo 1h), cuya frecuencia de administración es cada 12 horas, no alcanzarían nunca el estado estacionario. En ese caso, a las 5*1h=5h ya no quedaría una concentración detectable en sangre).
Por último, la excreción del fármaco frecuentemente se relaciona con la función renal del paciente. Muchos fármacos se eliminan por filtración glomerular por lo tanto, aquellas fórmulas basadas en el clearance de creatinina plasmática para estimar la velocidad de filtración glomerular, como la fórmula de Cockroft-Gault, Modification of Diet in Renal Disease (MDRD), o Schwartz (usada en pediatría) ayudarían a evaluar la necesidad de ajustar la dosis.26
Con los datos de concentración plasmática versus tiempo de una dosis (Figura 1), la farmacocinética se puede estudiar utilizando modelos que simplifican los datos. De allí provienen fórmulas matemáticas con las que se pueden calcular posteriormente los parámetros farmacocinéticos4.
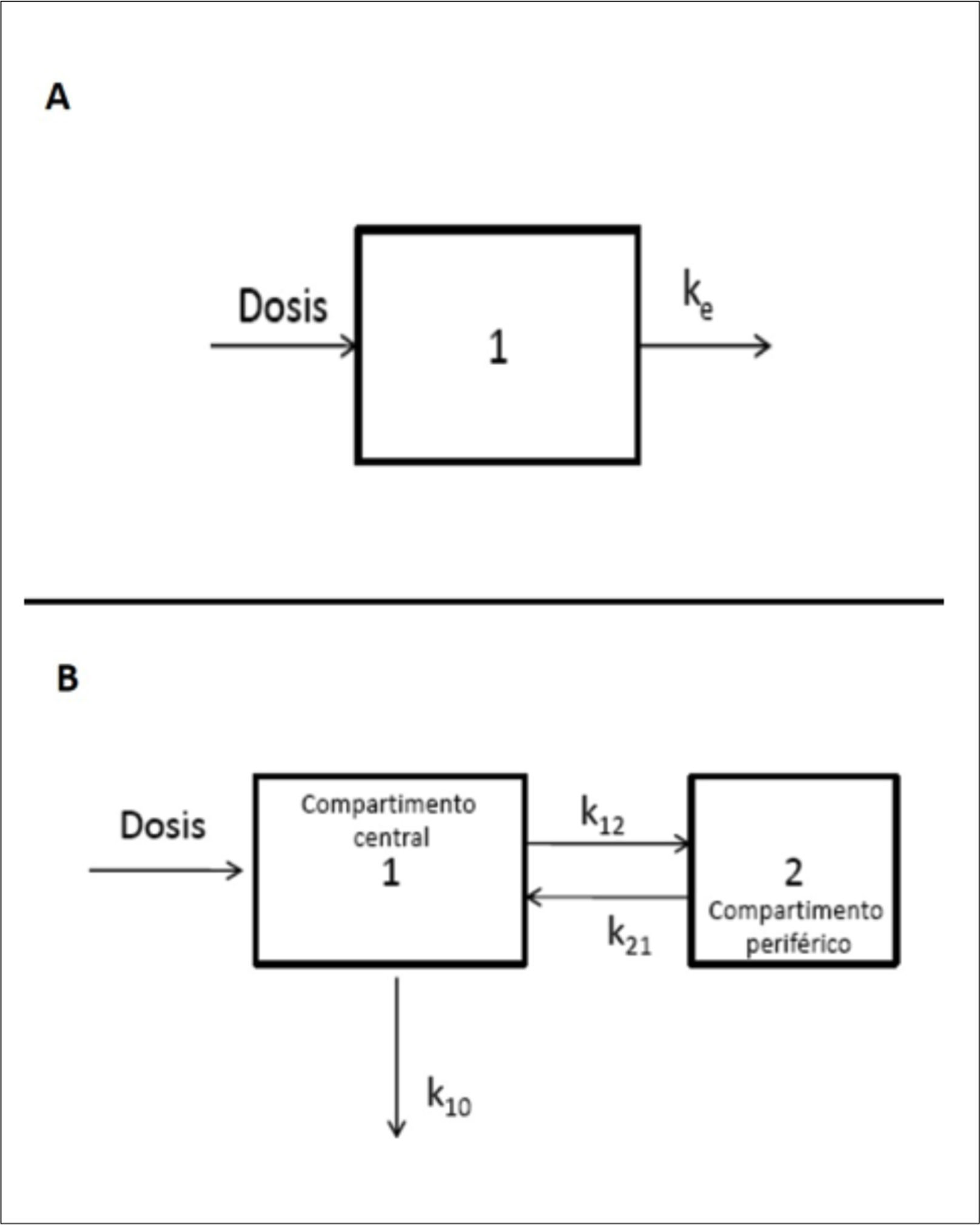
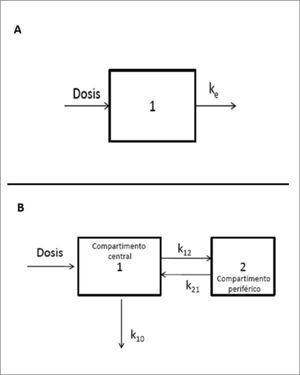
Normalmente se emplean modelos compartimentales para favorecer la comprensión de los cambios en el ADME. En la Figura 3 se esquematizan los modelos más frecuentes.
ESQUEMA DE MODELOS COMPARTIMENTALES
A: modelo de 1 compartimento. La dosis se distribuye rápidamente en el compartimento central (1), alcanzando el equilibrio de distribución inmediatamente.
B: modelo de 2 compartimentos. La dosis se distribuye primero en el compartimento central (1) y luego en el compartimento periférico (2). La distribución no es instantánea, demora un tiempo hasta alcanzar el equilibrio.
Así, el comportamiento de muchos fármacos se puede ajustar a modelos de 1 compartimento, en el que la dosis administrada alcanza rápidamente el equilibrio de distribución, tan rápida que es imposible caracterizarla. Ejemplos clásicos de este comportamiento son los fármacos hidrofílicos, como β-lactámicos o aminoglicósidos. En cambio, otros fármacos pueden caracterizarse por modelos de 2 compartimentos. En ellos, el equilibrio de distribución es más lento, y se requiere esperar alcanzarlo antes para interpretar las variaciones cinéticas. La mayoría de los fármacos liposolubles tendrían este modelo. Incluso de más de 2 compartimentos4,7,17.
Es posible estudiar el comportamiento de un fármaco de 2 compartimentos con el modelo de 1 compartimento por la simplicidad en el manejo de los datos, pero es necesario considerar la imprecisión de ese ajuste.
Por último, es importante conocer el tipo de cinética involucrada. Algunos fármacos tienen una velocidad de eliminación lineal (también llamada cinética orden 1), y otros, una velocidad no lineal (cinética de orden cero)4,7,17.
Cuando la cinética es lineal, la concentración plasmática cambiaría linealmente con la dosis; la eliminación es constante y es una fracción del fármaco por unidad de tiempo. Así, el ABC, Cl, Vd, y t½ se mantienen constantes, por lo que cambios en la dosis no deberían generar cambios en esos parámetros.
En el caso que la cinética es no - lineal, existe una variación que no es proporcional a la dosis administrada. En esos fármacos, los parámetros farmacocinéticos son fluctuantes dependiendo de la concentración plasmática que tenga el paciente. Existen procesos saturables. Los anticonvulsivantes tienen este comportamiento y es por eso que se justifica la MTF.
MÉTODOS ANALÍTICOSLa medición de concentraciones plasmáticas se ha realizado desde que se cuenta con las técnicas analíticas para determinar el fármaco en la matriz en cuestión.
A medida que la tecnología se ha hecho más cercana, con resultados más rápidos y con menores costos, ha sido posible extender la monitorización hacia otros fármacos.
Nuevas metodologías analíticas desarrolladas para determinar y cuantificar el fármaco en la matriz de estudio deben validarse cumpliendo una serie de requisitos para que el resultado informado sea el correcto27–29.
La MTF se ha realizado durante mucho tiempo usando inmunoensayos por su rapidez en la obtención del resultado y facilidad en la manipulación de la muestra. Sin embargo, se sabe que pueden tener interferencias en la medición pudiendo sobre -o sub- estimar la concentración debido a interferencias inespecíficas con otros compuestos, metabolitos o efecto matriz28. Cuando se piensa desarrollar nuevos métodos, normalmente utiliza cromatografía líquida (High performance liquid chromatography, HPLC) ya que tienen mayor sensibilidad y especificidad, no requieren grandes volúmenes de muestra (podrían ser <500 uL comparado con 2000 o más uL de los inmunoensayos) y podrían medirse más de un fármaco a la vez en la misma muestra30. Incluso sólo gotas de sangre podrían ser útiles para MTF mediante los micrométodos como dried blood spots, sobre todo en pacientes en extraer mucha sangre podría ser más cuestionado9,31 o la obtención de muestra menos invasiva como saliva32.
La desventaja principal es el alto precio del equipo y la necesidad de contar con un profesional especialista, tanto en la manipulación del equipo, así como también en desarrollar y validar los mejores métodos para realizar el análisis. Sin embargo, para incorporar nuevos fármacos a la monitorización, resulta necesario contar con estas técnicas ya que se abre un abanico de opciones tanto en investigación como en monitorización rutinaria1,3,9,30,32.
CONSIDERACIONES PRE ANALÍTICAS PARA EL ANÁLISIS DE LA MUESTRAEs importante controlar el proceso de recolección de la muestra, la manipulación, transporte y la preparación, así como también, la estabilidad del analito en la matriz bajo distintas condiciones de almacenamiento. Esta fase pre-analítica es crítica, pero no siempre recibe suficiente atención ya que depende de muchas personas en cada etapa.
En los fluidos biológicos, las concentraciones que generan los fármacos son muy bajos (mg/L, ng/mL) y la muestra utilizada es escasa (0.5 a 2ml). Por lo tanto, además de la exigencia de sensibilidad y especificidad del método de medición, se quiere mantener la integridad de la muestra en todo momento27,29.
La mayoría de los análisis se realizan en sangre del paciente debido a la buena correlación entre la concentración y el efecto terapéutico. Para ello se utiliza plasma o suero. En algunos casos la muestra es sangre total cuando el fármaco tiene alta penetración al glóbulo rojo, como es el caso de la ciclosporina. Otras matrices (orina, saliva, líquido cefalorraquídeo), también podrían utilizarse, pero el procesamiento de la muestra podría ser más complejo así como también su obtención, por lo que extracción de sangre es la más empleada3.
¿QUÉ NIVEL SE UTILIZA?Idealmente el nivel debería tomarse una vez alcanzado el estado estacionario. Por ello, en fármacos con T½ larga no es conveniente tomar un nivel con las primeras dosis. Algunos fármacos requieren control del nivel plasmático máximo alcanzado. Otros, del nivel valle. En la tabla 1 se muestran algunos ejemplos.
La muestra debe ser tomada a un tiempo correcto respecto a la dosis que se quiere monitorizar3. Para monitorizar un nivel peak la muestra debe tomarse 0.5 -1h después de alcanzado el equilibrio de distribución. Por ello vale la pena saber si el fármaco es de 1 o 2 compartimentos. No debe tomarse justo después de terminada la infusión en caso de administración endovenosa.
Por otro lado, para monitorizar un nivel valle, la muestra debe tomarse justo antes de la siguiente dosis o 30 minutos antes como máximo (Figura 1).
Es imperativo que la muestra sea correctamente rotulada y en lo posible con la hora exacta a la que fue extraída. El equipo de enfermería debe estar al tanto de la importancia de esta etapa para la correcta interpretación del resultado. Cuando existan dudas del resultado obtenido, evaluar la necesidad de repetir el examen.
INTERPRETACIÓN DEL RESULTADOPara utilizar un valor de concentración plasmática en el seguimiento farmacoterapéutico, se requiere un estudio no sólo del nivel obtenido, sino también de las condiciones en las que ocurrió esa determinación y de las condiciones fisiopatológicas del paciente. Es fundamental conocer el rango terapéutico, pero también cuáles serían las concentraciones fuera de ese rango que se pueden aceptar. Por lo tanto, antes de proponer ajuste de dosis, se debe definir cuál es la concentración deseada para el paciente.
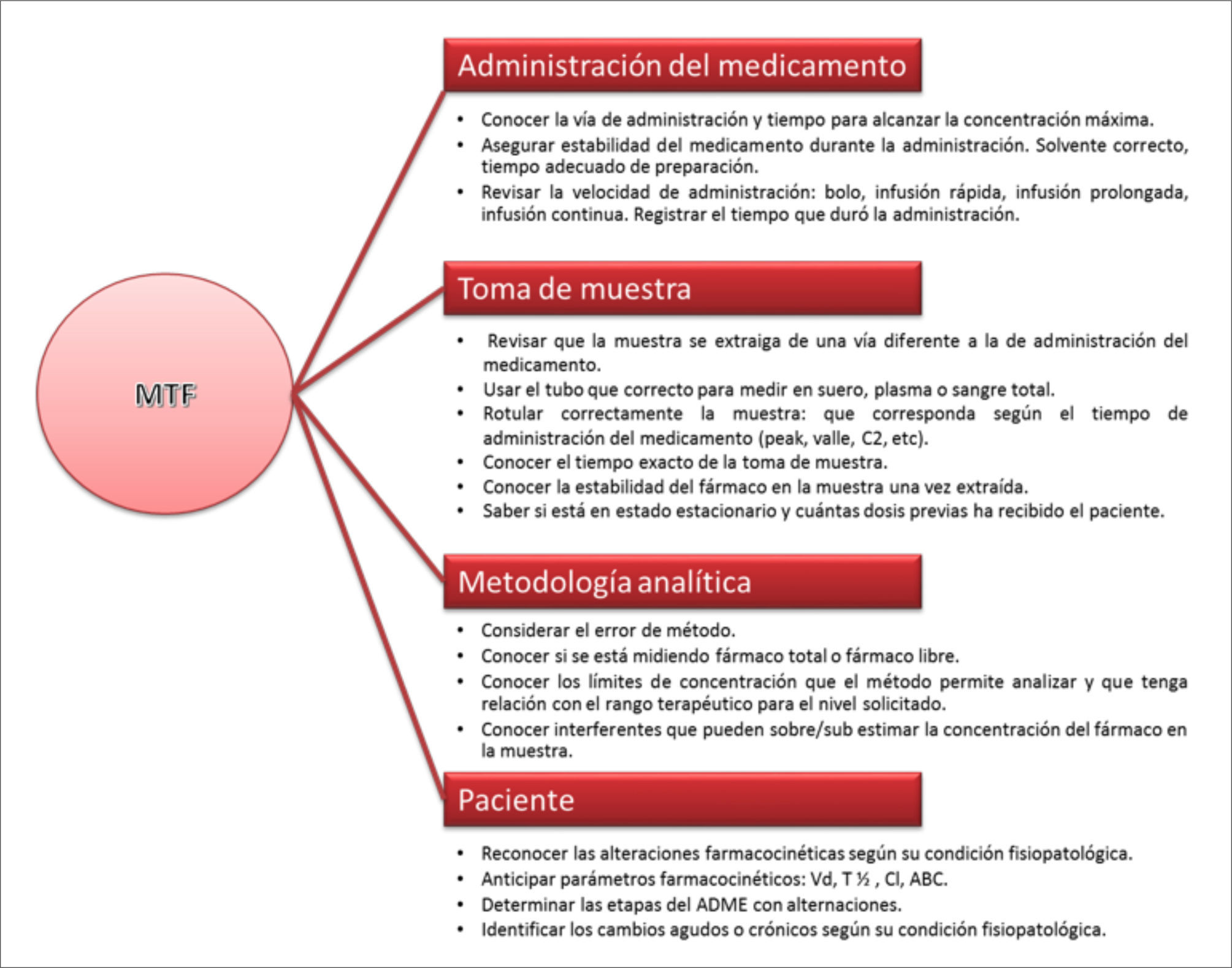
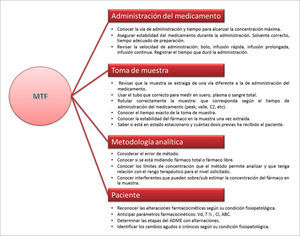
En la Figura 4 se muestran los principales puntos que deben revisarse antes de tomar una decisión con el resultado.
PUNTOS CRÍTICOS A CONSIDERAR PARA REALIZAR MONITORIZACIÓN TERAPÉUTICA DE FÁRMACOS (MTF)
C2: concentración plasmática medida 2 horas después de la administración del medicamento.
Vd: volumen aparente de distribución (expresado en L o L/Kg).
Cl: clearance o aclaramiento (expresado en L/h o mL/min).
T½: tiempo de vida media de eliminación (expresado en h).
ABC: área bajo la curva de concentración plasmática del fármaco versus tiempo en 24h.
ADME: absorción, distribución, metabolismo y excreción.
Ref. 3.
Para realizar los ajustes en la dosis, se deben conocer los datos del paciente (edad, peso ideal, peso real, sexo, talla o superficie corporal, enfermedad de base, estado clínico), los datos del medicamento (dosis, forma de administración, vía de administración, cantidad de dosis previas al nivel, tiempo de uso, etc.) y datos de la toma de muestra (hora de administración del medicamento, hora de toma de muestra, cumplimiento de protocolo, entre otros puntos)3.
Es posible emplear ecuaciones matemáticas previamente desarrolladas para ese fármaco en pacientes similares, o guiar el ajuste con modelos poblacionales que algunos programas farmacocinéticos computacionales contienen. En la literatura existe variada información al respecto. Lo importante es evaluar la idoneidad para su uso en el paciente.
Por cualquiera de los dos métodos, se deberían calcular en el paciente los parámetros farmacocinéticos antes mencionados. Así, un nivel alto podría explicarse porque la dosis es muy alta, o el paciente tiene procesos de eliminación ineficientes. En contraparte, que la concentración sea baja, podría deberse a dosis insuficiente porque el volumen de distribución está aumentado, o las vías de eliminación están favorecidas.
¿CUÁNDO SOLICITAR MEDICIÓN DE NIVELES PLASMÁTICOS?No es necesario realizar mediciones de niveles plasmáticos sistemáticamente, ni a todos los fármacos. Se debe identificar el momento en que esto realmente aporta a una mejor titulación o ajuste del tratamiento para el paciente. Recordemos que la mayoría de las veces, los recursos económicos son escasos. Se debe seleccionar aquel nivel que entregue la mayor información tanto para efectividad, así como también seguridad del tratamiento (Tabla 1).
Por tal razón, los cuatro momentos claves para monitorizar niveles son:
- 1.
Cuando la respuesta al tratamiento no es la esperada (por falta de efecto o sospecha de toxicidad).
- 2.
Ante cambios durante el tratamiento. Considerar cambios fisiopatológicos notorios que indican cambios importantes en el ADME (ejemplo: insuficiencia renal o hepática, inflamación sistémica, desnutrición, amputaciones, entre otros).
- 3.
Cambios en terapia por incorporación o retiro de fármacos que tengan interacción con el fármaco de interés. Cambios de dosis.
- 4.
Evaluar cumplimiento/adherencia del paciente al tratamiento. Ya sea para evitar toxicidad o conseguir la mayor respuesta del tratamiento.
La monitorización terapéutica de fármacos requiere conocer y manejar varios aspectos que en forma simultánea le dan sustento. Es más complejo de lo que se cree, ya que involucra la participación de varias especialidades. Extender su utilización a más fármacos siempre necesitará evaluación del real aporte a la terapia de los pacientes. Es necesario conocer los conceptos de farmacocinética para una correcta interpretación de los resultados y adaptar los esquemas farmacológicos a los requerimientos de los pacientes.
El autor declara no tener conflictos de interés, en relación a este artículo.