El trasplante de órganos es un procedimiento vital para el reemplazo de órganos en falla irreversible. En Chile, el promedio de donantes es muy inferior a países en que el proceso de donación está consolidado. Al considerar la escasez de órganos disponibles para trasplante parece fundamental entregar las herramientas que permitan la pesquisa precoz y el manejo adecuado y oportuno del potencial donante (PD). El PD es aquel paciente con una puntuación en la escala de Glasgow (GCS) igual o menor a 7, daño neurológico severo identificado como fuera de alcance neuro-quirúrgico, que se encuentra en soporte ventilatorio y hemodinámico y en el cual ya se ha diagnosticado adecuadamente la muerte encefálica. El manejo guiado por metas de este paciente permite optimizar la posibilidad de donación, aumentar el número de órganos donados y la función de los mismos en el receptor. De esta manera, el adecuado manejo de cada sistema del PD incluye, entre otros, el soporte hemodinámico que asegure la perfusión tisular y evite la sobre-volemización, así como la selección adecuada del soporte vasoactivo, la implementación de una ventilación mecánica protectora y tratamiento oportuno de las injurias respiratorias, el control de la temperatura y del medio interno (glicemia, electrolitos y eventualmente el reemplazo hormonal). La donación implica educar al equipo de salud, al receptor, pero particularmente a toda la sociedad potencial donante en el hecho que la muerte del encéfalo y del tronco cerebral es irreversible, y que lleva inevitablemente al cese de las funciones orgánicas restantes.
Organ transplantation is a vital procedure for the replacement of organs in irreversible failure. In Chile, the average number of donors is much lower than in countries where the donation process is consolidated. When considering the shortage of organs available for transplantation, it seems essential to provide the tools that allow early screening and the appropriate management of the potential donor (PD). The PD is that patient with a score on the Glasgow coma scale (GCS) equal to or less than 7, with severe neurological damage, and in whom encephalic death has already been adequately diagnosed. Goal oriented management of the PD is associated with an increase number of organs donated and a better function in the recipient. In this way, the proper management of each PD system includes, among others, the hemodynamic support that ensures tissue perfusion and avoids positive fluid balances, as well as the adequate selection of vasoactive support, the implementation of protective mechanical ventilation and early treatment of lung infections or injuries, and control of temperature and internal homeostasis (glycemia, electrolytes and eventually hormone replacement). Donation involves education of health teams involved, to the recipient, but particularly the entire potential donor society in the fact that brain and brainstem death is irreversible, and that inevitably leads to the cessation of the remaining organic functions.
El trasplante de órganos es un procedimiento vital para el reemplazo de órganos en falla irreversible. En Chile, el promedio de donadores de órganos al año varía entre 6 a 10 por millón de habitante, muy por debajo al de otros países (ej. España 43 a 46 por millón de habitantes). Considerando la escasez de órganos disponibles para trasplante parece fundamental entregar las herramientas para la pesquisa precoz y el manejo adecuado y oportuno del potencial donante en las unidades de cuidados intensivos (UCI)1.
2Definiciones- a.
Posible donante: Corresponde a todo paciente que presente una puntuación en la escala de Glasgow (GCS) igual o menor a 7, daño neurológico severo identificado como fuera de alcance neuro-quirúrgico. Estos pacientes pueden estar en soporte ventilatorio y hemodinámico.
- b.
Potencial donante (PD): Corresponde a todos los posibles donantes que han sido certificados en muerte encefálica (ME) y que al menos un órgano se encuentra en condiciones clínicas de ser trasplantado.
- c.
Donante efectivo: Es todo aquel potencial donante, del que efectivamente se extrae al menos un órgano para trasplante.
Pesquisa del PD y consideraciones iniciales
Reanimación
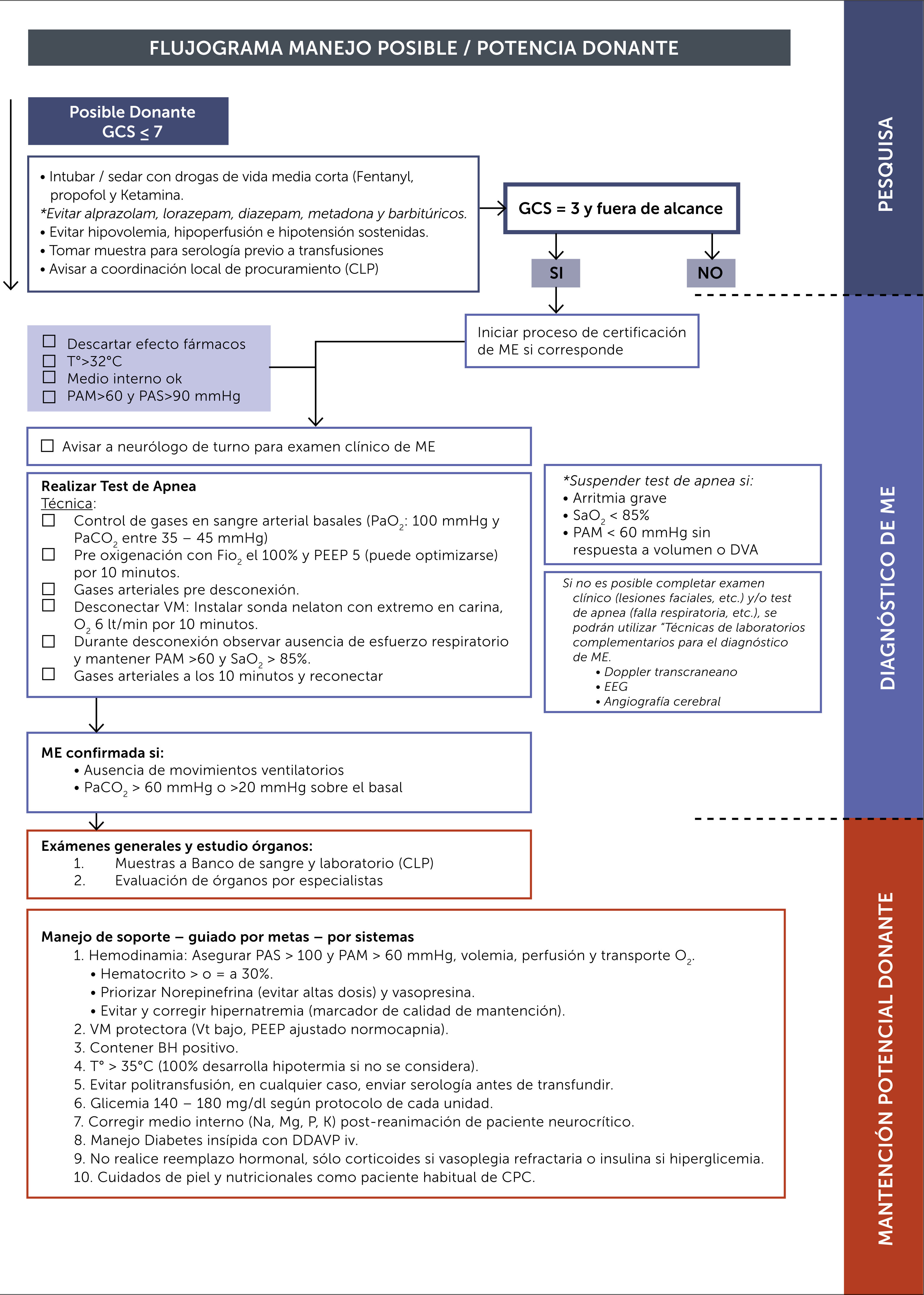
En todo paciente que cumpla las características de posible donante, independiente de su pronóstico vital, deben tomarse las medidas para preservar el óptimo funcionamiento fisiológico para permitir una posible donación si correspondiese. Es decir, en el paciente deben optimizarse todas las maniobras de reanimación tendientes a evitar la hipovolemia, hipoperfusión y la hipotensión sostenidas.
2.1Intubación / sedaciónDeben tomarse las medidas de intubación y/o sedación favoreciendo la utilización de drogas de vida media corta como el fentanilo, propofol y ketamina, evitando aquellas de vida media larga como el lorazepam, diazepam, metadona y barbitúricos. El tiempo que debe transcurrir antes de considerar que no existe influencia de depresores del SNC dependen del grado de lipofilicidad de la droga, el tiempo de vida media de eliminación y la presencia de factores que retarden el metabolismo y eliminación, como la hipotermia, insuficiencia renal, insuficiencia hepática e interaciones con otros fármacos. La Academia Americana de Neurología recomienda esperar 5 vidas medias del fármaco (descartada la influencia de los factores antes mencionados) o, de estar disponible, tener niveles plasmáticos bajo el rango terapéutico2.
2.2Serologías y politransfusiónDebe guardarse muestra de sangre para los estudios serológicos necesarios, particularmente aquellos pacientes en los cuales sea necesario transfundir más de un 50% de la volemia, en quienes la serología se diluye y se vuelve inválida.
2.3NotificaciónTodo paciente detectado como posible donante debe ser notificado de manera inmediata a la coordinación local de procuramiento (CLP), independiente de la historia clínica del PD, la etapa en que se encuentre de la certificación de la ME y la voluntad de donación.
Diagnóstico de muerte encefálica
En Chile, para el diagnóstico de ME se requiere que se cumplan con todos los elementos expresados a continuación3:
1. La abolición total e irreversible de todas las funciones encefálicas.
- a.
Estar en coma y sin ventilación espontánea.
- b.
No presentar reflejos de decorticación, descerebración, ni presentar convulsiones.
- c.
No presentar reflejos fotomotores, corneales, oculocefá- licos, oculovestibulares, faríngeos, ni traqueales.
2. Tener la certeza diagnóstica de la causa del mal, realizando un diagnóstico positivo de daño encefálico estructural, según parámetros clínicos corroborados por las pruebas o exámenes calificados.
3. La certificación unánime de a lo menos dos médicos cirujanos, uno de los cuales deberá desempeñarse en el campo de la neurología o neurocirugía. Estos médicos no podrán formar parte del equipo que haya de realizar el trasplante.
Para la certificación de ME es necesario que se cumplan los siguientes prerrequisitos:
1. Ausencia de fármacos depresores del Sistema Nervioso Central (SNC). La presencia de depresores del SNC se puede excluir según historia y screening toxicológico. Una adecuada evaluación debe considerar el tipo de fármaco, dosis, tiempo y duración de la terapia utilizada, como también su farmacocinética y farmacodinamia. La insuficiencia renal, hepática e hipotermia pueden retrasar el metabolismo y eliminación, por lo que se recomienda:
- -
Aplazar la evaluación, durante al menos 24 horas una vez alcanzada la normotermia, para permitir que cualquier residuo sea metabolizado.
- -
Medir niveles de droga en sangre para certificar se encuentran por debajo de su rango terapéutico y de no ser posible una directriz razonable es calcular 5 veces la semivida de eliminación y esperar esas horas antes del examen clínico (asumiendo función hepática y renal normales).
2. Ausencia de hipotermia grave, es decir, temperatura corporal central igual o mayor a 32°C.
3. Ausencia de alteraciones metabólicas y endocrinas severas.
4. Ausencia de inestabilidad hemodinámica significativa, es decir, que tenga presión arterial sistólica mayor o igual a 90mmHg y una presión arterial media mayor o igual a 60mmHg.
5. Asistencia por ventilación mecánica invasiva con oxigenación adecuada sin bloqueo neuromuscular.
La ley chilena además exige la realización del test de apnea para la certificación de ME. Si no se pueden satisfacer los prerrequisitos necesarios para el test por riesgo de hipoxia tisular, el test está contraindicado. En estos casos la ley chilena contempla la realización de exámenes complementarios.
Test de apnea
La resolución exenta N° 604 del Ministerio de Salud, del 10 de mayo de 2016 establece la forma de realizar el test de apnea3 (Tabla 1).
Protocolo Test de apnea
| 1° Verificar estabilidad hemodinámica del posible donante. PAM mayor o igual 60mmHg. |
| 2° Control de gases en sangre arterial basales, que evidencien una correcta oxigenación (PaO2: 100mmHg y PaCO2 entre 35 – 45mmHg). |
| 3° Pre oxigenación con Fio2 el 100% y PEEP de 5 por 10 minutos. |
| 4° Control de primera muestra de gases en sangre arterial para el test de apnea. |
| 5° Suspender ventilación mecánica, desconectar del ventilador y administrar oxigeno (6 lt/min) por 10 minutos a través de sonda nelaton, cuyo extremo debe estar al nivel de la carina. |
| 6° Durante los 10 minutos de desconexión observar estabilidad en frecuencia cardiaca, presión arterial y saturación de oxígeno. |
| 7° Observar ausencia de esfuerzo respiratorio durante periodo de desconexión. |
| 8° Luego de los 10 minutos, controla la segunda muestra de gases en sangre arterial y reconectar al paciente a ventilación mecánica. |
| • El test de apnea se debe suspender si: |
| - Se presenta una caída de la presión sistólica que no se logre corregir con cargas de volumen, y/o dosis adicionales de vasopresores y/o presente signos de hipoperfusión. |
| - El oxímetro de pulso indique una caída de la saturación bajo 85%. |
| -Se presenten arritmias cardiacas graves con compromiso hemodinámico. |
Se considerará un test de apnea (+), consistente con el diagnóstico de ME si durante el período de observación:
- a)
No se observan movimientos respiratorios y se alcanza un valor de PaCO2≥60mm Hg al término de la observación.
- b)
No se observan movimientos respiratorios y se observa un incremento de PaCO2 de 20mm Hg, con un valor basal de PaCO2 de al menos 35mmHg.
Si durante el test de apnea, el paciente no presentó movimientos respiratorios, pero no alcanzó los valores requeridos, el test de apnea se puede repetir después del intervalo de una hora, prolongando el período de desconexión a tiempo de 15 minutos.
Es importante enfatizar que la ley no exige a priori ningún método complementario para el diagnóstico de muerte. Estos se exigen sólo en caso de no poder cumplirse con las condiciones para el diagnóstico clínico de ME (por ejemplo, incapacidad de realizar un examen neurológico completo por trauma facial grave), no contar con los prerrequisitos para el test de apnea (por ejemplo, neumonía grave con alteración severa del intercambio gaseoso o EPOC con hipercapnia crónica) o que éste deba suspenderse por inestabilidad respiratoria o hemodinámica.
2.4Exámenes complementariosLa resolución exenta N° 48 del Ministerio de Salud, del 28 de enero de 20005 establece como métodos complementarios el electroencefalograma, la cintigrafía de perfusión encefálica y la angiografía cerebral. En la resolución exenta N° 36 del Ministerio de Salud, del 25 de enero de 20135 se agrega como técnica complementaria el Doppler Transcraneano (DTC).
Doppler Transcraneano: El paciente que desarrolla muerte encefálica en un altísimo porcentaje de los casos se debe a Hipertensión Intracraneana (HIC) grave y evolutiva, disminución de la presión de perfusión cerebral e isquemia global, siendo el paro circulatorio cerebral la última etapa en la evolución de la hipertensión intracraneal progresiva, etiopatogenia más frecuente de la muerte encefálica6.
El patrón sonográfico normal de las arterias de la base del cerebro es de flujo continuo. Si la presión intracraneal (PIC) comienza a ascender, se opone una resistencia al Flujo Sanguíneo Cerebral (FSC). Inicialmente se enlentece más el diástole, con una respuesta cardiogénica que aumenta la velocidad sistólica. Al aumentar más la PIC, disminuyen todas las velocidades, pero siempre en mayor grado la velocidad diastólica, llegando a tener velocidad de flujo cero en diástole, lo que se conoce como “pico sistólico”. Cuando la PIC sigue en ascenso y alcanza la presión arterial diastólica, el flujo se hace reverberante, es decir, avanza muy lentamente en la etapa sistólica y retrocede en la etapa diastólica. Cuando la PIC alcanza la Presión Arterial Media (PAM) se ven las espigas sistólicas y cuando llega a la presión arterial sistólica no se visualiza movimiento de la sangre en los vasos.
En diversas publicaciones se ha establecido la alta sensibilidad y especificidad del DTC en el diagnóstico del paro circulatorio cerebral comparado con angiografía convencional y angio-tomografía7. En nuestro medio, Brunser y cols.8 publicó un estudio de validación de DTC en la determinación de paro circulatorio intracraneal, informando una sensibilidad de 100%, especificidad de 96%, VPP 96 y VPN 100. Un reciente metaanálisis determino que el DTC comparado con la evaluación clínica tiene una sensibilidad de 90% y especificidad de 98%9. El DTC tiene la ventaja adicional que se puede realizar al lado de la cama del paciente, no es invasivo, es de bajo costo y es un examen concluyente.
La ley establece, entre otras, las siguientes condiciones para el uso del DTC en el diagnóstico de ME:
- a.
Al momento de realizar el examen, el paciente debe tener una presión arterial media superior a 60mmHg.
- b.
El uso del DTC no es válido en el diagnóstico de ME en pacientes con craniectomía descompresiva, TEC abierto o drenaje de LCR abierto. c) En caso de que el patrón sonográfico al DTC sea de ausencia de señal de flujo en las arterias exploradas, es necesario que se cuente con un examen previo de DTC con flujo que documentó la factibilidad técnica de pesquisar flujo en dichas arterias. La ausencia total de señal de flujo sin un examen previo no será considerado concluyente para el diagnóstico de muerte encefálica.
Electroencefalograma: Es concordante con el diagnóstico de muerte encefálica la presencia de “inactividad electroencefalográfica”, definida como ausencia de actividad electroencefalográfica con una amplitud mayor a 2mV.
Cintigrafía de perfusión encefálica: En este examen, la “ausencia de perfusión cerebral efectiva”, apoya el diagnóstico de muerte encefálica. Esto se demuestra con la ausencia de perfusión a través de las arterias cerebral anterior y media en el primer paso del trazador, habiéndose documentado el tránsito a través de las arterias carótidas comunes y ramas de las carótidas externas.
Angiografía cerebral: Debe documentarse la “ausencia de flujo sanguíneo cerebral”, definida como la ausencia de opacificación significativa de la porción intracraneal de ambas arterias carótidas internas y sus ramas, y del sistema vertebro-basilar, con presencia de opacificación de las arterias carótidas externas.
La ley chilena no se pronuncia acerca de cuál método complementario utilizar, por lo que es deber del clínico decidir a qué método recurrir, según la situación clínica específica. En general, se prefiere utilizar métodos de perfusión cerebral por sobre el electroencefalograma, debido a que estos métodos presentan menos artefactos en este contexto de pacientes10–12.
3Consideraciones finales sobre el diagnóstico de ME (Anexos Ley 19.451)• Artículo 20°: En los casos de ME, el certificado médico de defunción se emitirá con la fecha y hora de la certificación de la ME.
• Artículo 21°: Cuando la muerte hubiese dado lugar a una investigación penal, será necesaria la autorización del fiscal competente para destinar el cadáver a las finalidades previstas en la ley y en este reglamento. Para adoptar su decisión, el fiscal competente deberá consultar al médico del Servicio Médico Legal o al facultativo que éste designe. Dicho profesional deberá constituirse en el establecimiento donde se encuentra el eventual donante e informará al fiscal si la extracción de los órganos pudiere afectar la realización de exámenes médicos necesarios para el éxito de la investigación. La autorización podrá ser solicitada por el medio de comunicación que resulte más expedito. Deberá dejarse constancia escrita de la autorización otorgada, la que se comunicará al facultativo que la solicita de la forma que resulte más adecuada a la premura del procedimiento médico.
Solicitud de testimonio de última voluntad
El dialogo con la familia y la obtención del consentimiento debe ser conducido por personal entrenado en la solicitud de donación de acuerdo con la legislación vigente y a los deseos del paciente. No deben ser las personas a cargo del manejo directo del potencial donante, como tampoco los cirujanos a cargo del procuramiento y trasplante.
Estudios específicos
Es de responsabilidad del CLP y coordinador central que se encuentre de turno valorar la existencia de criterios absolutos de exclusión del posible donante detectado, así como de asegurar que se tomen oportunamente todas las muestras y estudios necesarios para favorecer el proceso de donación.
Entre estos estudios están: Grupo ABO, Rh, serologías para VIH, VHB, VHC, HTLV I y II, Chagas y RPR. Además de ecografía abdominal con Doppler, radiografía de tórax y ecocardiograma transtorácico.
Manejo protocolizado del PD
Cuidados generales del potencial donante
El cuidado del donante debe ser guiado por objetivos terapéuticos para cada sistema. Este manejo ordenado por metas aumenta el número de órganos trasplantados y está asociado con un aumento en la sobrevida del órgano trasplantado13–16. Es clave el manejo coordinado y capacitado de todo el equipo de salud que concurre al manejo de estos pacientes, sin duda, no basta que cada unidad desarrolle un protocolo escrito para la pesquisa y manejo del PD, sino que deben existir capacitaciones regulares para lograr los objetivos propuestos.
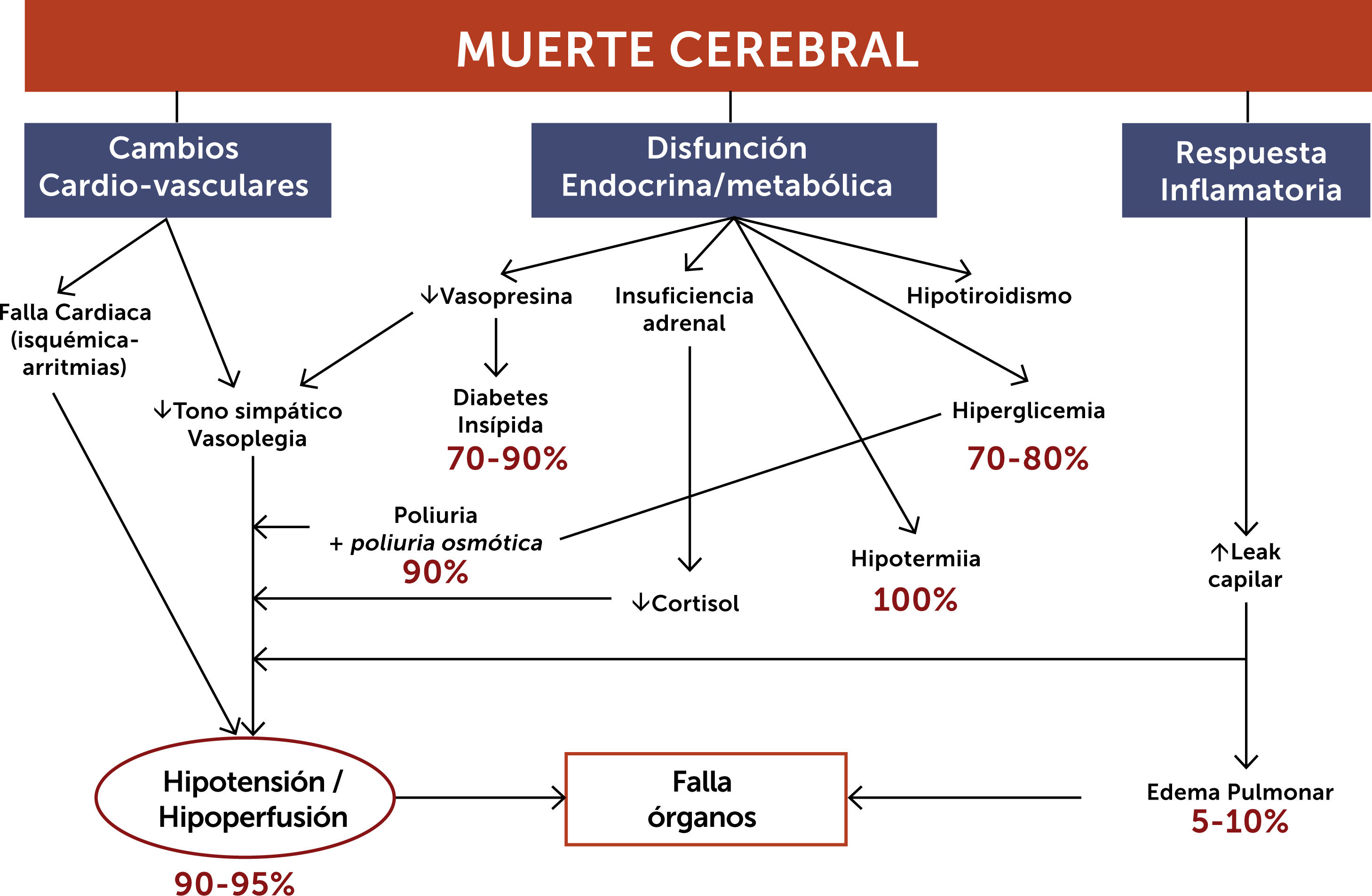
En el PD ocurren progresivamente una serie de fenómenos fisiopatológicos que alteran significativamente al sistema cardiovascular, generan disfunción metabólica y endocrina y se asocian a un progresivo estado inflamatorio similar al del shock distributivo. Por lo anterior el equipo multidisciplinario que enfrenta a estos pacientes debe estar capacitado para afrontar y manejar estos cambios y para actuar ágilmente en el proceso de donación (Figura 1).
3.1Manejo hemodinámicoAl igual que el paciente séptico hospitalizado en UCI, el PD presenta habitualmente periodos de hipoperfusión, hipotensión y/o progresión de disfunciones orgánicas incompatibles con la donación. A modo de ejemplo, en pacientes en ME se presentan episodios de hipotensión hasta en el 80% de los casos. La ME suele ir precedida de un periodo de duración variable de HIC, durante ese periodo ocurre una intensa estimulación simpática con marcada vasoconstricción, aumento de la resistencia vascular sistémica y taquicardia. Posterior a esta descarga catecolaminérgica acontece una pérdida del tono vasomotor con vasodilatación periférica, lo que puede llevar a hipotensión, hipoperfusión e isquemia si no es adecuadamente manejada, lo que se asocia a un menor número y función de órganos trasplantados. El objetivo del manejo protocolizado del PD y del cuidado de los potenciales órganos a donar pretende restaurar la perfusión tisular en forma precoz, racional y sin generar daño asociado14 (Figura 2).
3.2Volemia y perfusiónEn primer lugar, aparece entonces como fundamental asegurar la volemia del PD, considerando que éste está expuesto a varios factores de riesgo para hipovolemia, como son las eventuales pérdidas por el cuadro que originó la muerte cerebral, la poliuria osmótica como consecuencia de un eventual manejo previo de HIC y/o hiperglicemia y/o poliuria por diabetes insípida (DI) y/o falta de aporte de fluidos por “estar fuera de alcance terapéutico”, eventual hipertermia, entre otros. La corrección de la volemia en el PD debe realizarse de la misma forma que se enfrentaría a un paciente séptico hipotenso y/o hipoperfundido, es decir, asegurando el transporte de oxígeno y la presión de perfusión tisular, sin generar sobrecarga de volumen.
Como recomendaciones generales, es necesario lograr una adecuada oxigenación y concentración de hemoglobina, así como un gasto cardíaco óptimo, privilegiando la evaluación de precarga utilizando parámetros dinámicos sobre estáticos, y monitorizando al paciente para asegurar que las medidas implementadas logren restaurar en forma precoz la perfusión tisular.
Si bien aún existen numerosas guías que priorizan el aporte de volumen generoso para asegurar la perfusión tisular, es claro también que el edema intersticial secundario al balance hídrico persistentemente positivo se asocia sostenidamente a disfunción de injerto en todos los estudios, y las estrategias más “restrictivas” de fluidos, se han asociado a mejor disponibilidad y función de órganos post trasplante. Aun así, la hipovolemia es muy frecuente al momento de la muerte cerebral y debe ser corregida a la brevedad15,17.
La hipernatremia es un marcador de mala calidad en la reanimación en el PD. Su presencia se asocia a manejo previo con soluciones hipertónicas y/o a poliuria osmótica y/o a DI, pero también al uso excesivo de solución fisiológica 0.9%. La reanimación adecuada debiese tender a normalizar el sodio plasmático y refleja la calidad de la misma. La hipernatremia se asocia a pérdida de donantes, órganos y menor función de los mismos17.
Una vez asegurada la perfusión tisular y la presión de perfusión, con el menor volumen posible, debe mantenerse la normo volemia con balances hídricos tendientes a la neutralidad, principalmente para permitir la donación de pulmón. En general las guías recomiendan mantener, si es posible, una diuresis cercana a 1ml/kg/h 14.
3.3Uso y selección de vasopresoresEn caso de persistir el PD hipotenso con precarga optimizada, e incluso durante la optimización de la misma, deben iniciarse drogas vasopresoras. Los objetivos de presión arterial más recomendados en el PD son una presión arterial sistólica (PAS) >100 y PAM >6018, teniendo en cuenta los efectos secundarios y reacciones adversas que se puedan presentar.
En el pasado la dopamina era la droga de primera línea para el manejo ante el colapso cardiovascular del donante, pero estudios recientes no lograron demostrar su beneficio en la circulación renal o hepato-esplacnica, asociado a su mayor riesgo de arritmias con respecto a la noradrenalina (NA) como se observó en pacientes sépticos19–21. La NA es considerada actualmente como la primera elección en el manejo del PD para el manejo de la hipotensión refractaria a volumen, sin embargo deben tenerse en cuenta ciertas consideraciones.
En primer lugar, en el PD se observó que la NA en dosis elevadas aumenta la permeabilidad capilar pulmonar, genera vasoconstricción mesentérica y coronaria, además del posible deterioro de la función cardiaca durante el post-trasplante, por lo tanto, parece necesario usar esta droga con precaución y en la menor dosis posible22–24.
Por otro lado, de acuerdo a la fisiopatología del PD, sus niveles de vasopresina plasmáticos caen a las pocas horas luego de la confirmación de la ME, por lo que su déficit parece asociarse con hipotensión refractaria a volumen y a dosis altas de noradrenalina. Además, la vasopresina tiene un rol conocido para el tratamiento de la diabetes insípida. Por lo anterior, vasopresina ha sido considerada como una droga recomendada como coadyuvante, e incluso como droga de primera línea por algunos autores. Plurad y cols. destacan en su trabajo retrospectivo que los pacientes bajo infusión de vasopresina tuvieron una tasa de recuperación de órganos elevada con respecto a lo sucedió con noradrenalina y adrenalina. Este estudio tiene la limitación de no conocer el estado hemodinámico basal con el que se inició la infusión de vasopresina25. Otro estudio, también retrospectivo, demostró que la vasopresina tiene mayor efecto en la tasa de donación de pulmón y mejoría en la función pulmonar del donante, pero en el grupo con vasopresina también se observó mayor cantidad de pacientes con requerimiento de noradrenalina y adrenalina26. Las guías o recomendaciones de diferentes autores y sociedades son variadas en este tópico, lo que se refleja en los principales estudios prospectivos y randomizados como CORTICOME y MonITOR sobre donación. En el primero, el vasoactivo de elección fue noradrenalina, y en el segundo no se estandarizó el uso de vasoactivos ya que los autores consideraban que no existía evidencia a favor de ninguna de estas drogas27,28.
Tanto las catecolaminas como la vasopresina tienen beneficios potenciales, así como también reacciones adversas, es por esto que nuestra recomendación es iniciar con NA, pero evitar dosis altas (>0.3 ug/kg/min), privilegiar combinación de drogas si es necesario, considerando vasopresina como coadyuvante, particularmente si se sospecha DI. Sea cual sea la elección del vasoactivo es importante mantener la menor dosis posible asociándola con otro fármaco en caso de mayor deterioro hemodinámico y, como se señaló, optimizar el aporte de fluidos según el estado de la precarga del paciente.
Arritmias
Las arritmias son frecuentes y multifactoriales en el PD, ya sea por hipovolemia, hipotensión, hipotermia, alteraciones acido-básicas, alteraciones metabólicas e hidroelectrolíticas, contusión miocárdica, etc. Debe mantenerse una conducta proactiva en la monitorización y manejo de las causas subyacentes según corresponda. En caso de paro cardiorrespiratorio, se pueden efectuar maniobras de reanimación avanzadas de resucitación cardiopulmonar si se considerase apropiado, sin embargo, en Chile la ley no permite hasta la fecha la donación a corazón parado, por lo que las maniobras debiesen lograr retomar la circulñación espontánea o bien certificar la muerte cardiopulmonar del paciente sin donación efectiva. Los tiempos durante los cuales debiesen extenderse las maniobras de reanimación son controversiales, ya que la mayor parte de la evidencia original sugiere que los tiempos de RCP prolongados no empeoran el pronóstico de los órganos donados29,30.
4Manejo ventilatorioEl PD plantea desafíos múltiples en el manejo de su función respiratoria. Tradicionalmente, los criterios para donación pulmonar han sido bastante estrictos (edad <55 años, radiografía normal, PaO2>300mmHg, ausencia de historia de aspiración, sepsis, secresión purulenta y de patología pulmonar crónica). Sin embargo, cada paciente debe ser discutido por el equipo de procuramiento de manera de considerar alternativas para intentar utilizar el pulmon donante14.
En primer lugar el manejo ventilatorio en VM, al igual que en cualquier paciente de UCI, debe ser protector, de manera de evitar injurias secundarias y de preservar una adecuada función pulmonar para el donante de pulmón. La VM protectora, mandatoria en todo paciente PD, consiste en volumen corriente bajo (6ml/kg peso ideal), presión de distensión menor a 15cmH2O (P. plateau – PEEP), PEEP adecuado para mantener un reclutamiento alveolar suficiente, siendo en la mayoría de los pacientes entre 8 y 12cmH2O, frecuencias respiratorias para PaCO2 entre 35 y 45mmHg y la menor FiO2 posible para una SaO2>94%31. Sin duda debe cumplirse además con todas las medidas de prevención de neumonía asociada a ventilación mecánica.
Los donantes que no cumplen los críterios de donación pulmonar deben ceñirse a un protocolo dirigido a recuperar la función pulmonar y/o a tratar prontamente cualquier noxa que impida la donación. Entre las alternativas de manejo y recuperación están la búsqueda de balances hídricos neutros y normovolemia, kinesioterapia respiratoria, broncoscopía con limpieza de secreciones, antibióticos precoces y maniobras de reclutamiento si corresponde. Adicionalmente, en algunos centros es posible la realización de perfusión pulmonar ex vivo para ganar tiempo de recuperación14.
5Manejo de temperaturaLa regulación de la temperatura en humanos es controlada por el hipotálamo, donde las neuronas alteran su velocidad de disparo dependiendo de la temperatura del ambiente circundante. Como resultado de la respuesta hipotalámica frente a una caída de T° corporal, se producen calofríos, vasoconstricción y piloerección con el fin de conservar y producir calor corporal. La ME lleva a una desconexión del eje hipotálamo-hipófisis y la pérdida de regulación de la temperatura, generando una hipotermia progresiva con tendencia a igualar la temperatura ambiental32.
La hipotermia en el PD es común y para garantizar la viabilidad de los órganos a trasplantar, la temperatura recomendada tradicionalmente debe ser >35°C central. Los métodos normalmente empleados para tratar la hipotermia en el paciente de UCI suelen ser insuficientes en el PD. Las mantas comunes ayudan a conservar el calor, pero generalmente no son efectivas para recalentar cuando no hay calofríos y otros mecanismos de producción de calor normalmente presentes en pacientes sin ME.
En primer lugar, siempre hay que considerar que la mejor manera, y la más simple, de mantener la temperatura corporal es evitar el desarrollo de hipotermia. Esto mediante la implementación de medidas como son el aumentar la temperatura ambiental, el uso precoz de frazadas térmicas y temperar el aire inspirado en el ventilador mecánico, así como el uso de sueros tibios.
La práctica convencional para tratar la hipotermia en el PD se basa en el recalentamiento activo, es decir, el uso de dispositivos que aplican calor directamente a la piel. Debido a la pérdida del tono vascular y ausencia de vasoconstricción periférica del PD, la conductividad térmica de la piel es alta, lo que la convierte en una opción terapéutica atractiva. Una primera alternativa es el uso de mantas con aire caliente, pero que pudiesen no ser suficientes en pacientes PD, ya que sólo cubren el 50% de la superficie corporal en un paciente además sometido a múltiples procedimientos y a necesidad de retirar la manta para examinarlo frecuentemente. En general la prevención de la hipotermia, sumado al manejo con frazadas térmicas permite el control adecuado de la T°, sin embargo, excepcionalmente pudiese ser necesario el uso de parches de hidrogel asociados a una bomba de circulación de agua a temperatura controlada y con posibilidad de feed-back desde un termómetro central esofágico o vesical (Arctic Sun®).
6Terapia transfusionalEn general el equipo al cuidado del PD debe saber que estos pacientes presentan un riesgo aumentado de anemia y de coagulopatía intravascular diseminada (CID), ambas de origen multifactorial por acidosis, hipotermia, pérdidas asociadas a la causa de ME, reposición de volumen, entre otros. Los objetivos en el manejo del donante incluyen valores de hematocrito cercanos a 30%, recuento de plaquetas >80.000 e INR <2.
En el paciente PD debe tenerse presente, antes o después del diagnóstico de ME, que la politransfusión contraindica la donación de órganos si las muestras de serología necesarias para donar no son tomadas con anterioridad, ya que la politransfusión puede negativizar los estudios serológicos pertinentes.
7HiperglicemiaEl PD tiene un riesgo elevado de hiperglicemia, la que se relaciona a resistencia periférica a la insulina, pérdida de la regulación hormonal, infusiones de soluciones glucosadas para el manejo de hipernatremia, entre otros. La American Diabetes Association sugiere glicemias entre 140 y 180mg/dl23 para todo paciente de UCI, incluido el PD, sin embargo, no existe evidencia clara entre control, glicemico y número o función de órganos donados. Un reciente estudio mostró que el lograr glicemias <180mg/dl con administración continua de insulina en forma protocolizada se asocia con un mayor número de órganos donados y mejor funcionamiento de los mismos33. La recomendación actual es manejar al PD como cualquier paciente de UCI de acuerdo al protocolo de cada unidad intentando glicemias < a 180mg/dl.
8Manejo hidroelectrolítico y diabetes insípida (DI)La alteración en los niveles de electrolitos, principalmente hipernatremia, hipokalemia, hipomagnesemia e hipofosfemia ocurren secundariamente a poliuria, la cual puede tener en estos pacientes, como se señaló anteriormente, múltiples causas, entre estas: diabetes insípida (DI), diuresis osmótica, y/o por excesiva reposición de líquidos14. Las alteraciones electrolíticas reflejan también un cuidado poco prolijo del paciente y se asocian, particularmente la hipernatremia, a malos resultados clínicos de donación, en cuanto a número y función de órganos trasplantados.
La DI se presenta hasta en un 80% de los PD, y se genera por ausencia de producción de vasopresina (DI central), hormona encargada de retener agua y en menor medida sodio, a nivel renal. La ausencia de vasopresina se asocia a poliuria de baja osmolaridad y aumento de la osmolaridad plasmática, secundaria a hipernatremia progresiva. Dejada a evolución espontánea, la DI lleva a marcada hipernatremia y deshidratación, con mal resultado de donación en cuanto a N° y función. Las metas numéricas para electrolitos, osmolaridad y volemia en el PD, son equivalentes a las de un paciente sin ME, es decir, la meta es lograr valores normales en cada uno de los indicadores medidos.
El diagnóstico de DI se realiza en base a la diuresis horaria. Un débito urinario mayor o igual a 2.5 a 3 cc/kg/h sostenido por más de dos horas es compatible con el diagnóstico de DI. No es necesario para su diagnóstico, pero suele ir acompañado de alteraciones electrolíticas secundarias a la depleción de volumen, como hipernatremia, hipokalemia, hipomagnesemia, hipofosfemia e hipocalcemia, así como osmolaridad plasmática aumentada y orina inadecuadamente diluida (Densidad <1.005, osmolaridad urinaria <200 mOsm/Kg H2O). Otras causas de poliuria, descritas anteriormente, deben ser consideradas.
El tratamiento de la DI se basa en el reemplazo hormonal. Este puede hacerse mediante el uso de vasopresina en infusión continua, o bien mediante el uso en bolos sc, ev o por via nasal de 1-deamino-8-D-arginina-vasopresina (DDAVP - desmopresina), análogo de la vasopresina, con un efecto casi puro antidiurético y despreciable actividad vasopresora. Como se señaló anteriormente, el uso de vasopresina en infusión continua es especialmente atractivo en este grupo de pacientes porque puede proveer estabilidad hemodinámica como vasopresor, tratar la DI y funcionar como terapia hormonal15.
9Reposición hormonalEn una lógica de reposición de hormonas perdidas por disfunción hipotalámica, la administración, aislada o en conjunto, de hormona tiroidea, corticoides, vasopresina e insulina, se ha asociado a mejores resultados cardiovasculares. De hecho, entre los predictores independientes para procurar más de 4 órganos se encuentran la edad, creatinina plasmática, hormona tiroidea y el cumplir las metas protocolizadas de manejo en donantes34. Es en este contexto que debemos estudiar y considerar particularmente el reemplazo de hormona tiroidea.
El daño al eje hipotálamo-hipofisiario propio del PD provocaría una endocrinopatía caracterizada por ausencia de hormonas tiroideas y adrenales, que contribuirían a la inestabilidad del donante. Se han observado alteraciones similares a las de un eutiroideo enfermo o síndrome de T3 baja: TSH normal, con descenso de los niveles de triyodotironina (T3) total y libre, con T4 normal o baja y la rT3 normal o alta35. La reducción de T3 se ha asociado a una disminución de la contractilidad cardiaca, con eventuales efectos hemodinámicos en algunos pacientes. Por lo anterior, se ha sugerido la corrección de estas alteraciones con administración de hormonas tiroideas, especialmente en el manejo de donantes cardiacos36.
En el trabajo original al respecto, en el cual se suplementaba corticoesteroides, hormona tiroidea e insulina, se observó mayor estabilidad hemodinámica, disminución de requerimientos de drogas vasoactivas y mejoría en la función cardiaca en los donantes37. Trabajos posteriores han demostrado la utilidad, tanto en la estabilidad hemodinámica del paciente como en la donación final, del reemplazo con corticoesteroides, vasopresina, además de reemplazo con T3 o T4. Sin embargo, no hay evidencia de alto nivel que apoye el reemplazo hormonal tiroideo rutinario38.
En el caso de falla hemodinámica, sí existe algo más de evidencia que apoya el uso -como rescate- de terapia de reemplazo hormonal tiroidea. Dichos estudios tienen varias falencias en diseño, pero los resultados suelen ser consistentes: hay un aumento en la donación cardiaca efectiva luego de la suplementación de dichas hormonas. Un estudio retrospectivo que analizó el uso de hormona tiroidea en 66629 donantes durante el periodo 2000–2009, mostró que dicha terapia aumentó en forma independiente el número de procuramiento efectivo de corazones, pulmones, riñones, páncreas e intestinos, pero no de hígado39.
A modo pragmático, se recomienda el uso de hormona tiroidea en pacientes con muerte encefálica e inestabilidad hemodinámica que no ha respondido a terapia habitual. Si el paciente tiene PAM≤60mmHg, con requerimientos de drogas vasoactivas, diuresis insuficiente (≤1cc/Kg/min) y fracción de eyección <45%, habiendo optimizado su precarga, se recomienda iniciar reemplazo tiroideo38. Las dosis habituales son T3 0.4 ug en bolo y luego 3ug/hora en infusión continua, o bien T4 20ug en bolo e infusión continua de 20ug/hora. Lamentablemente, en Chile aún no hay disponibilidad de hormona tiroidea ev, y faltan estudios que apoyen la suplementación enteral de dicho fármaco.
10Tegumentario y NutriciónEl cuidado de los tejidos expuestos, en especial las córneas, es un proceso que debe considerarse el cuidado del PD. Para su correcto cuidado hay que evitar lesiones y sequedad de las corneas, mantener los párpados cerrados, aplicar colirios o soluciones lubricantes como lágrimas artificiales, e idealmente, uso de colirios antibióticos cada 2 a 4 horas41.
La recomendación habitual sugiere mantener la nutrición enteral (NE) para aumentar las reservas de glucógeno en beneficio del potencial trasplante hepático, aunque no existen estudios para apoyar esta recomendación teórica, en beneficio del potencial trasplante de hígado y el trofismo intestinal26. Por otro lado, la eventual pérdida del tono vagal asociada a la ME, sería una contraindicación al alterar el tránsito intestinal y la absorción de nutrientes42. En general, se recomienda mantener la NE si el paciente se encuentra con estabilidad hemodinámica y perfusional, en caso contrario debe suspenderse para privilegiar la reanimación del paciente.
Donante marginal o con criterio expandido
En términos generales, un órgano ideal proviene de un donante fallecido por muerte cerebral de origen traumática, menor de 40 años, sin comorbilidad43. El término donante con criterio expandido (DCE) fue introducido por Kaufmman en 1997, para definir el uso de órganos provenientes de donantes que no cumplían todos los criterios para ser un donante óptimo44. En este sentido, un órgano con criterio de donación expandido connota un órgano cuya calidad es menor, lo que se traduce en un mayor riesgo de desenlaces negativos asociados al trasplante43. En el contexto del trasplante renal, un DCE es definido en la literatura como un donante con muerte cerebral, mayor de 60 años, o entre 50 y 59 con al menos dos de los siguientes criterios: Creatinina en suero >1.5mg/dl, un accidente cerebro vascular como causa de su muerte, o historia de hipertensión arterial45. Recibir un injerto a partir de una DCE está asociado a un RR de1.7 de falla de órgano al ser comparado con órganos obtenidos de donantes habituales44. ¿Cómo se justifica entonces realizar un trasplante utilizando un injerto con conocido riesgo aumentado de fracaso? El uso de estos órganos se justifica cuando son utilizados en pacientes cuyo riesgo de presentar desenlaces negativos en la lista de espera es muy alto en el corto plazo, lo que compensa el mayor riesgo asociado al uso de ellos. A modo de ejemplo, en el contexto del trasplante renal, la sobrevida del injerto proveniente de DCE es claramente inferior al del proveniente de un donante clásico, sin embargo, es capaz de aumentar la sobrevida a 5 años, en comparación a permanecer en lista de espera en diálisis46,47. En contexto de trasplante hepático las cifras también son favorables: las sobrevidas a uno y 5 años para aquellos que recibieron órganos provenientes de donantes mayores de 75 años son 78 y 59% respectivamente, lo que es superior a permanecer en lista de espera48,49. De esta manera, en un plan de uso de DCE es clave aparejar bien el binomio donante y receptor50. Un ejemplo de grupos donde el uso de donantes con criterio expandido está bien consolidado son los programas llamados “viejo por viejo”, donde adultos mayores reciben órganos provenientes de otros adultos mayores46,48. A modo de ejemplo, el Eurotransplant Senior (ESP), es un programa bien establecido de asignación por edades que existe en Europa desde 1999, donde los donantes fallecidos mayores de 65 años se asignan a receptores no sensibilizados mayores de 65 años. La asignación se realiza utilizando sólo la coincidencia de grupo ABO. Fritsche et al. reportó que esta política permitió expandir el pool de donantes sin afectar significativamente la supervivencia del receptor ni del injerto51. En esta misma línea de lograr el binomio correcto entre donante y receptor, está bien documentado que pacientes con falla hepática secundaria a VHC tienen desenlaces muy malos cuando reciben órganos provenientes de donantes de edad avanzada, por lo que habitualmente son excluidos de los programas de DCE, pues tienen mejor sobrevida al permanecer en lista de espera y esperar un órgano convencional43.
El uso de órganos provenientes de DCE, se ha constituido como una alternativa para expandir el pool de donantes49. En países como España los programas de prevención de muertes por accidentes han logrado su objetivo de disminuir las muertes traumáticas, sin embargo, el pool de donantes se mantiene en aumento, lo que se logra en parte a expensas de un alto uso de DCE. En dicho país, cerca del 50% de los órganos utilizados provienen de donantes con criterio extendido. En este escenario, el uso órganos con criterio expandido continua en aumento en el mundo.
En Chile, el porcentaje de trasplantes renales cuyo injerto proviene de DCE casi se ha triplicado entre 2010 y 2016, pasando de un 12% a un 32% del total de trasplantes realizados (ISP-MINSAL 2016). En nuestro país se ha protocolizado el uso de riñones obtenidos a partir de DCE en la “Guía sobre asignación de riñones para trasplante renal con donante cadáver” del Ministerio de Salud (MINSAL, 2014). En ella, se define como DCE a aquellos donantes mayores de 60 y menores de 70 años, sin patología agregada y con función renal óptima, o a aquellos donantes mayores de 55 años con patología agregada ya sea hipertensión arterial, diabetes mellitus o accidente cerebrovascular isquémico (siendo suficiente tener una de ellas). En esta guía se establece que quienes ingresen a la lista de espera para recibir riñones provenientes de DCE deben ser mayores de 55 años de edad, o ser diabético mayor de 40 años. Los pacientes que ingresen a esta lista deben ser informados de los riesgos y beneficios de ser trasplantados con uno de estos órganos y deben permanecer en la lista regular.
Sobre los aspectos Éticos asociados a la donación
El trasplante de órganos es una herramienta terapéutica probada para la falla de órgano terminal, y ha mostrado una relación costo-beneficio favorable respecto a otras modalidades de terapia. Existen principios rectores respecto al trasplante de células, tejidos y órganos humanos enunciados por la Organización Mundial de la Salud (OMS)52 Sin embargo, en nuestro país existe una paradójica realidad que muestra un discurso mayoritario a favor de la donación, sin reflejarse esto en un aumento significativo del número efectivo de donantes. Esta realidad se puede atribuir a múltiples causas, pero muy en el fondo parece tener que ver con la reflexión última, humana y profunda, de nuestros conceptos de la vida y de la muerte dentro de una sociedad pobremente preparada para esta discusión, donde los trasplantes vienen a representar una ruptura del orden natural de las cosas y parecen ir en un sentido contrario a la integridad corporal de la persona humana53. Entender que la muerte a nivel celular es un proceso gradual, irreversible y asincrónico respecto de cada órgano, quizá no es fácil para quien no tiene conocimientos de biología básicos. Que la expresión de la vida humana en cada persona, con todas sus características particulares (capacidad de relación, conciencia, voluntad y memoria) radica en el Sistema Nervioso Central, puede ser pobremente comprendido por algunas personas. Que la muerte del encéfalo y del tronco cerebral es irreversible, y que lleva inevitablemente al cese de las funciones orgánicas restantes, puede ser objetado por alguien que desconozca la fisiología humana. Que “la muerte de una persona es algo que no está en la mera detención de sus funciones cardiorrespiratorias” puede no ser aceptado culturalmente54.
Por ello, parece relevante la educación de todos los implicados durante el proceso de donación. Eso incluye, por una parte, la educación de los pacientes crónicos enlistados y su familia, antes, durante y luego del trasplante, lo que permitirá mejorar los resultados del trasplante, la sobrevida, la calidad de vida del paciente y su reinserción social, escolar y/o laboral. Para ello existen programas que focalizan su quehacer en este proceso. Sin embargo, no parece haber suficiente atención ni una organización que sustente la misma educación para la familia del paciente PD. Usualmente los familiares de los donantes son expuestos a una situación de crisis y derivado de ella, pueden generarse conflictos de diversa magnitud. Muchas veces esta situación ocurre en horarios no hábiles y expone a la familia a un diálogo con personal que posee pobre o nula capacitación respecto al proceso de donación. En otros momentos, la obligación recae en los coordinadores locales, que no necesariamente cuentan con las herramientas necesarias, humanas y/o técnicas, para llevar a cabo tamaña acción. La literatura sugiere incorporar acciones de intervención psicológica en este proceso tanto para la familia del donante como la del receptor, sin embargo, la realidad en Chile dista de este escenario.
En resumen, las dificultades generadas en el complejo proceso de donación y trasplante de órganos parecen verse beneficiadas, como la mayor parte de las acciones en salud, con una buena y estrecha relación médico/profesional de la salud con paciente/familiares, para lo que se requiere una óptima entrega de información (que incluya al menos, un lenguaje y un lugar adecuados) intentando generar una toma de decisiones lo mejor informada posible55. Entre los elementos que pueden considerarse esenciales por parte del entrevistador para esta interacción deben considerarse, entre otros:• Actitud empática y acompañamiento durante el proceso.• Interacciones verbales (lenguaje ajustado al contexto, con oraciones parafraseadas para mejorar la comprensión) y no verbales (establecimiento de contacto visual y mantención de escucha activa).• Ambiente adecuado y favorable para la conversación (ausencia de factores distractores).
El contacto inicial con los familiares durante la solicitud de donación es una de las fases claves del proceso de obtención de órganos para trasplante. Parece relevante, por lo tanto, trabajar hacia una profesionalización de la educación en el manejo de la familia del potencial donante, lo que pudiera incidir en un aumento real de la donación de órganos en Chile. Hasta que eso no ocurra, tendremos que continuar esperando la buena acogida y disposición de la familia a nuestra solicitud de donación.
11Declaración Conflicto de InterésLos autores no presentan conflictos de interés.
[Manejo protocolizado del potencial donante adulto en UCI - Tomás Regueira y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 171-183]
[Manejo protocolizado del potencial donante adulto en UCI - Tomás Regueira y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 171-183]
[Manejo protocolizado del potencial donante adulto en UCI - Tomás Regueira y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 171-183]
[Manejo protocolizado del potencial donante adulto en UCI - Tomás Regueira y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 171-183]
[Manejo protocolizado del potencial donante adulto en UCI - Tomás Regueira y cols.]
[REV. MED. CLIN. CONDES - 2019; 30(2) 171-183]
Referencias no citadas4,40.
e-ISSN: 2531-0186/ ISSN: 0716-8640/© 2019 Revista Médica Clínica Las Condes. Este es un artículo Open Access bajo la licencia CC BY-NC-ND(http://creativecommons.org/licenses/by-nc-nd/4.0/). [REV. MED. CLIN. CONDES - 2019; 30(2) 171-183] Revista Médica Clínica Las Condes https://www.journals.elsevier.com/revista-medica-clinica-las-condes https://doi.org/ 10.1016/j.rmclc.2019.03.006.