Las malformaciones broncopulmonares fetales (MPF), cuya incidencia se estima en 1/15000 recién nacidos vivos, son un grupo de malformaciones que incluye: quiste broncogénico, enfisema lobar congénito, atresia bronquial, malformación adenomatoidea quística (MAQ) y secuestro broncopulmonar (SBP). El objeto del presente estudio son la MAQ, el SBP y la forma híbrida de ambas, el secuestro-MAQ. La principal controversia reside en el manejo clínico prenatal y posnatal. Este estudio expone una serie de casos de MPF estudiados en la Unidad de Medicina Fetal del Hospital Virgen de las Nieves de Granada entre 2009 y 2017. El protocolo de seguimiento consiste en una ecografía cada 3-4 semanas. De 20 casos incluidos en el estudio el diagnóstico fue MAQ en 13 de los casos (65%), SBP en 5 (25%) y secuestro-MAQ en dos (10%). El diagnóstico de la MPF actualmente es mayor gracias a los avances en el diagnóstico prenatal. La necesidad de cirugía prenatal depende del pronóstico y las complicaciones asociadas. Concluimos que las MPF son subsidiarias de manejo expectante mientras no asocien complicaciones y no aumenten de tamaño. Factores concomitantes como el desplazamiento mediastínico y el hidrops fetal asocian mayor morbimortalidad y requieren un seguimiento más estrecho e, incluso, manejo intervencionista.
Fetal bronchopulmonary malformations (FBM), which incidence is estimated at 1/15000 livebirths, are a large group of malformations that includes: bronchogenic cyst, congenital lobar emphysema, bronchial atresia, congenital cystic adenomatoid malformation (CCAM) and bronchopulmonary sequestration (BPS). The object of this research are CCAM, BPS and the hybrid form of both. The main controversy lies in clinical management in prenatal and postnatal life. This study exposes a serie of cases of FBM whose surveillance has taken place in the Fetal Medicine Unit of the Virgen de las Nieves Hospital in Granada, between 2009 and 2017. The follow-up protocol consists on an ultrasound every 3-4 weeks. Of the 20 cases included in the study,13 cases had the diagnosis of CCAM in (65%), five BPS (25%) and two sequestration-CCAM (10%). Currently, FBM are more frequently diagnosed thanks to advances in imaging techniques and in prenatal diagnosis. The need for prenatal surgery depends on the prognosis and associated complications. In this study, we conclude that congenital bronchopulmonary malformations are subsidiaries of expectant management while their size don’t increase and until complications appear. Concomitant factors such as mediastinal displacement and hydrops associate greater morbidity and mortality and require closer monitoring and even interventionist management.Malformaciones broncopulmonares: Evolución durante la gestación y resultados perinatales
Las malformaciones congénitas broncopulmonares comprenden un amplio espectro de lesiones que incluye la malformación congénita de la vía aérea (MCVA), el secuestro broncopulmonar (SBP), formas híbridas de éstas y más raramente, el quiste broncogénico, el enfisema lobar congénito o la atresia bronquial. Constituyen un hallazgo relativamente raro, con una frecuencia aproximada de 1 de cada 15000 recién nacidos vivos, aunque se considera que su diagnóstico está aumentando principalmente debido a la mejora en la tecnología ecográfica y al amplio uso de la ecografía obstétrica1.
Habitualmente, un diagnóstico ecográfico detallado y el empleo en casos seleccionados de la resonancia magnética (RM) nos permite caracterizar las diferentes anomalías a la vez que el diagnóstico de formas híbridas de éstas. Sin embargo, el diagnóstico definitivo de una formación quística continúa basándose en el examen anatomopatológico2.
Tanto las malformaciones congénitas de la vía aérea como el secuestro pulmonar son de especial interés dada la controversia en relación con su manejo postnatal. El hecho de que dichas lesiones se detectan cada vez más frecuentemente en la vida prenatal y la posibilidad de empleo en su manejo de la RM fetal nos hace replantearnos la posibilidad de una actitud expectante o intervencionista, aunque esto depende en la mayoría de los casos del tamaño de la malformación, de los factores pronósticos asociados y de la presencia o no de sintomatología.
Los recién nacidos afectos de estas malformaciones pulmonares son asintomáticos en más del 90% de los casos y podrían beneficiarse de un manejo expectante sin tener que exponerlos a las posibles complicaciones de una intervención, aunque, por otro lado, el retraso de la cirugía hasta la aparición de síntomas puede resultar en un procedimiento más complicado y empeorar los resultados3,4. También hay que tener en cuenta que existen complicaciones o signos prenatales que nos pueden ayudar a predecir aquellos pacientes que nacerán con sintomatología y, por tanto, ayudarnos a un manejo postnatal adecuado.
El objetivo del presente estudio fue describir la evolución durante la gestación y los resultados perinatales de un grupo de fetos con diagnóstico prenatal de malformación congénita de la vía aérea, secuestro pulmonar o lesiones híbridas.
2MATERIAL Y MÉTODOSSe trata de un estudio descriptivo, retrospectivo, de una serie de casos de 20 fetos con diagnóstico de masa pulmonar en la Unidad de Medicina Fetal del Hospital Virgen de las Nieves de Granada entre los años 2009 y 2017. Dicha serie incluye trece casos de malformación congénita de la vía aérea o malformación adenomatoidea quística (MAQ), cinco casos de secuestro broncopulmonar y dos casos de complejo MAQ-secuestro.
El protocolo estándar de seguimiento consiste en una revisión ecográfica cada 3-4 semanas, desde el diagnóstico, en función del tamaño y evolución de la lesión, derivando a la paciente a su centro de origen en los casos en los que la lesión se estabiliza, se reduce o desaparece. Los datos del seguimiento prenatal se recogieron en el sistema Astraia (Astraia Software GmbH, Occamstr. Munich, Germany): edad gestacional en el momento diagnóstico, localización de la lesión, tamaño de la lesión, presencia o no de desplazamiento mediastínico, polihidramnios, presencia o evolución a hidrops, evolución intraútero y necesidad de intervención intraútero.
En los casos con recién nacido vivo se obtuvieron los datos del parto y seguimiento postnatal de cada centro en el que tuvo lugar el mismo: edad gestacional y peso al nacimiento, puntuación en el test de Apgar, presencia de síntomas respiratorios al nacimiento, pruebas diagnósticas posnatales realizadas, necesidad de intervención y evolución postnatal.
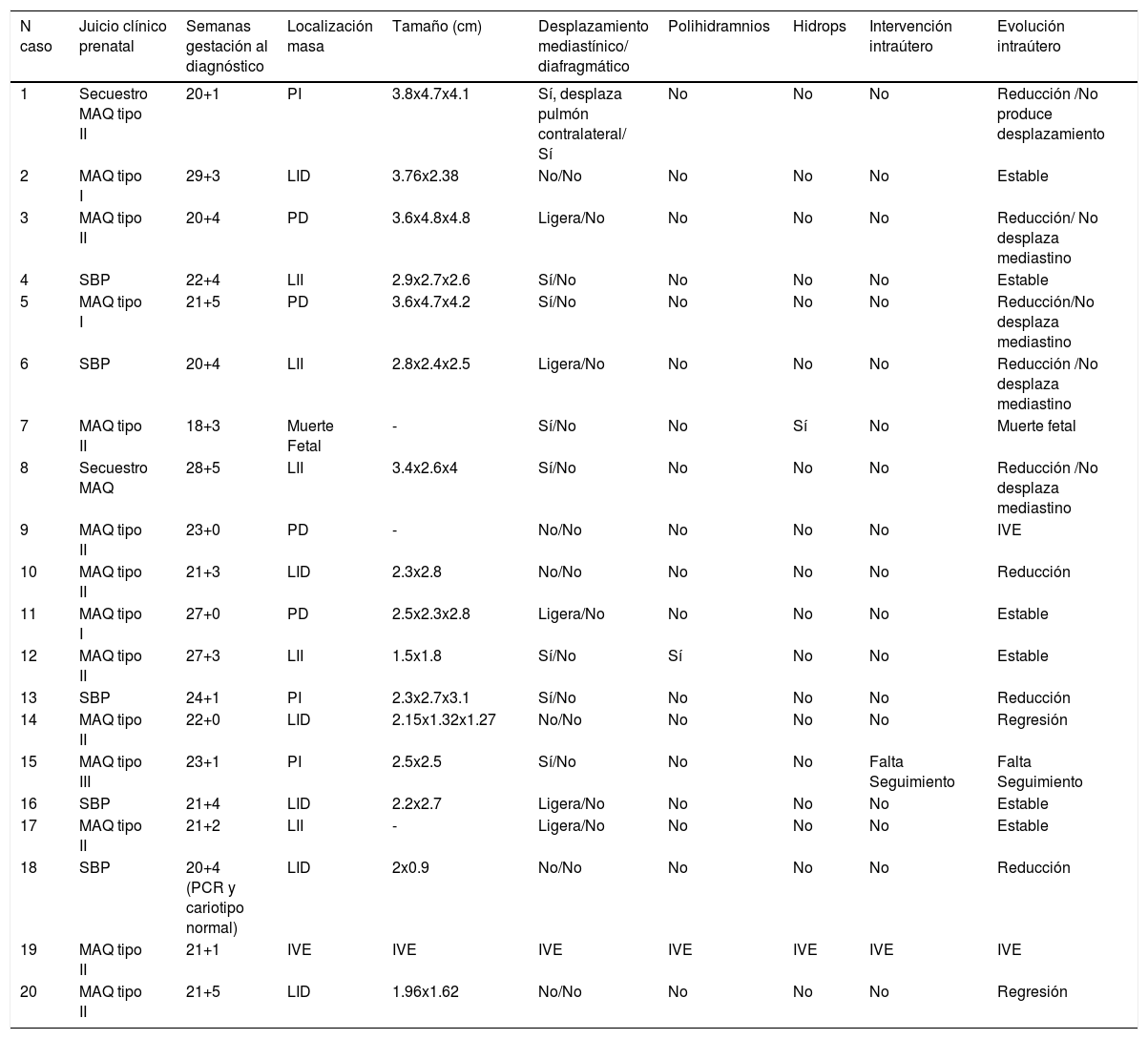
3RESULTADOSDe los 20 fetos incluidos en el estudio, el diagnóstico en 13 casos fue de MAQ (65%), 5 de SBP (25%) y dos casos de secuestro-MAQ (10%). La edad gestacional en el momento diagnóstico está comprendida entre las 18 y las 29 semanas de gestación, siendo la media 21 semanas. En dos casos la gestación finalizó mediante interrupción voluntaria del embarazo a petición de los padres, con fetos cuyo estudio anatomopatológico ratificó el diagnóstico y no reveló otras anomalías morfológicas. En uno de estos casos se realizó amniocentesis genética por solicitud de los progenitores, con resultado de cariotipo normal. Otro caso finalizó como muerte intraútero en semana gestacional 19+1 de un feto hidrópico desde el momento del diagnóstico de la malformación en semana 18.
En 9 casos (45%) la lesión se encontraba en el pulmón izquierdo (dos de secuestro-MAQ, 3 de SBP y 4 de MAQ) y 11 casos (55%) en el derecho (dos de SBP y 9 de MAQ).
En ambos casos de secuestro-MAQ se identificó desplazamiento mediastínico, en uno de ellos además había desplazamiento diafragmático en el momento del diagnóstico. En 8 de los casos de MAQ y en 4 de los casos de SBP también hubo desplazamiento mediastínico. Sólo tuvo lugar un hidrops cuya gestación terminó en muerte fetal, y un caso de polihidramnios; ambos dentro del grupo de MAQ.
La evolución intraútero fue favorable con desaparición del desplazamiento mediastínico y el diafragmático en los casos donde los había; y reducción de tamaño de la lesión en 9 casos (45%, 3 de SBP, dos de secuestro-MAQ y 4 de MAQ). La lesión desapareció en dos casos de MAQ en la semana 34 y 37 de gestación, cuyo diagnóstico fue en la semana 22 y 21; con un tamaño de 2,1 x 1.3cm y 1.9 x 1.6cm respectivamente. En el resto de los casos la lesión permaneció estable durante toda la gestación (tabla 1).
Evolución prenatal
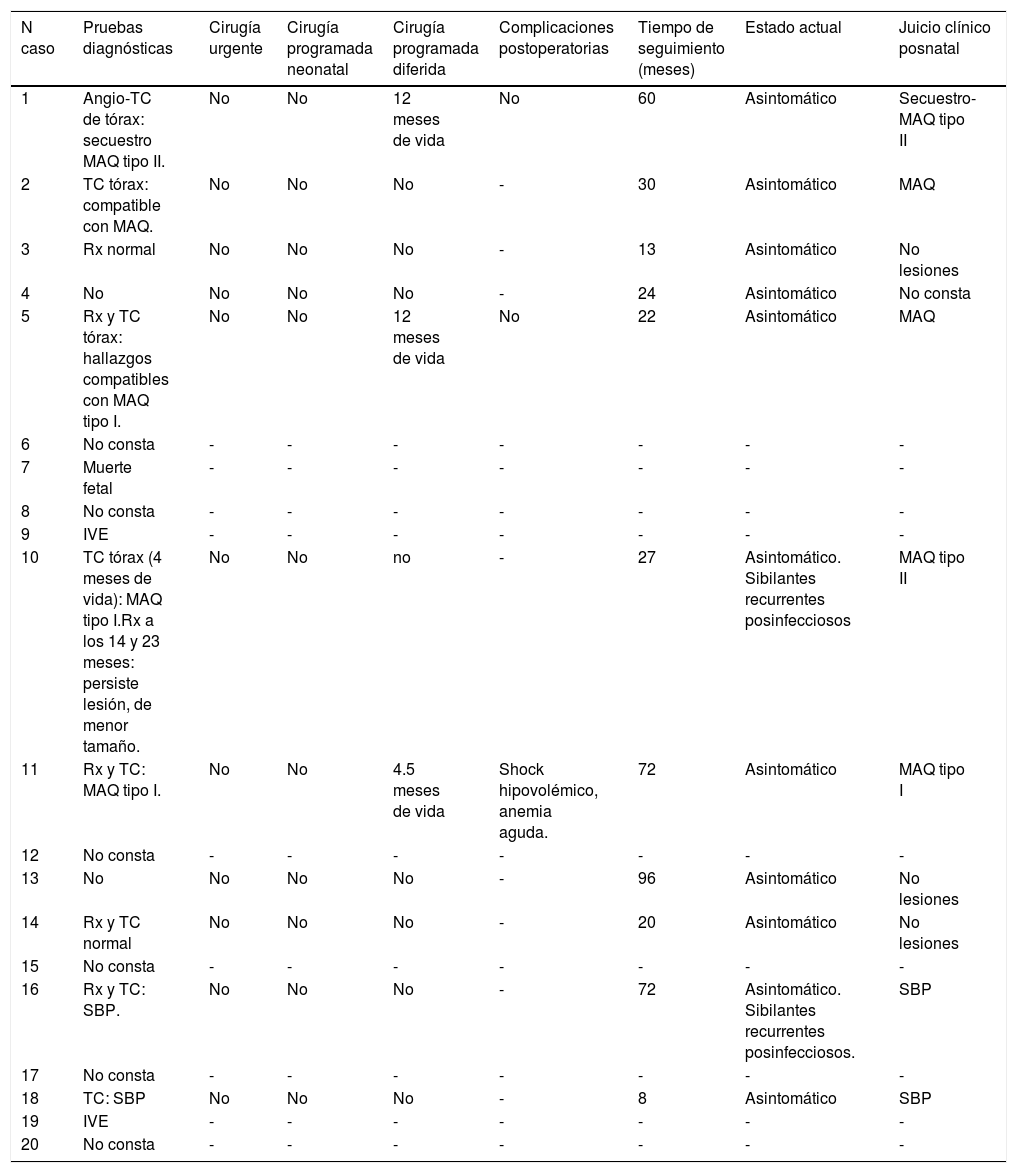
| N caso | Pruebas diagnósticas | Cirugía urgente | Cirugía programada neonatal | Cirugía programada diferida | Complicaciones postoperatorias | Tiempo de seguimiento (meses) | Estado actual | Juicio clínico posnatal |
|---|---|---|---|---|---|---|---|---|
| 1 | Angio-TC de tórax: secuestro MAQ tipo II. | No | No | 12 meses de vida | No | 60 | Asintomático | Secuestro-MAQ tipo II |
| 2 | TC tórax: compatible con MAQ. | No | No | No | - | 30 | Asintomático | MAQ |
| 3 | Rx normal | No | No | No | - | 13 | Asintomático | No lesiones |
| 4 | No | No | No | No | - | 24 | Asintomático | No consta |
| 5 | Rx y TC tórax: hallazgos compatibles con MAQ tipo I. | No | No | 12 meses de vida | No | 22 | Asintomático | MAQ |
| 6 | No consta | - | - | - | - | - | - | - |
| 7 | Muerte fetal | - | - | - | - | - | - | - |
| 8 | No consta | - | - | - | - | - | - | - |
| 9 | IVE | - | - | - | - | - | - | - |
| 10 | TC tórax (4 meses de vida): MAQ tipo I.Rx a los 14 y 23 meses: persiste lesión, de menor tamaño. | No | No | no | - | 27 | Asintomático. Sibilantes recurrentes posinfecciosos | MAQ tipo II |
| 11 | Rx y TC: MAQ tipo I. | No | No | 4.5 meses de vida | Shock hipovolémico, anemia aguda. | 72 | Asintomático | MAQ tipo I |
| 12 | No consta | - | - | - | - | - | - | - |
| 13 | No | No | No | No | - | 96 | Asintomático | No lesiones |
| 14 | Rx y TC normal | No | No | No | - | 20 | Asintomático | No lesiones |
| 15 | No consta | - | - | - | - | - | - | - |
| 16 | Rx y TC: SBP. | No | No | No | - | 72 | Asintomático. Sibilantes recurrentes posinfecciosos. | SBP |
| 17 | No consta | - | - | - | - | - | - | - |
| 18 | TC: SBP | No | No | No | - | 8 | Asintomático | SBP |
| 19 | IVE | - | - | - | - | - | - | - |
| 20 | No consta | - | - | - | - | - | - | - |
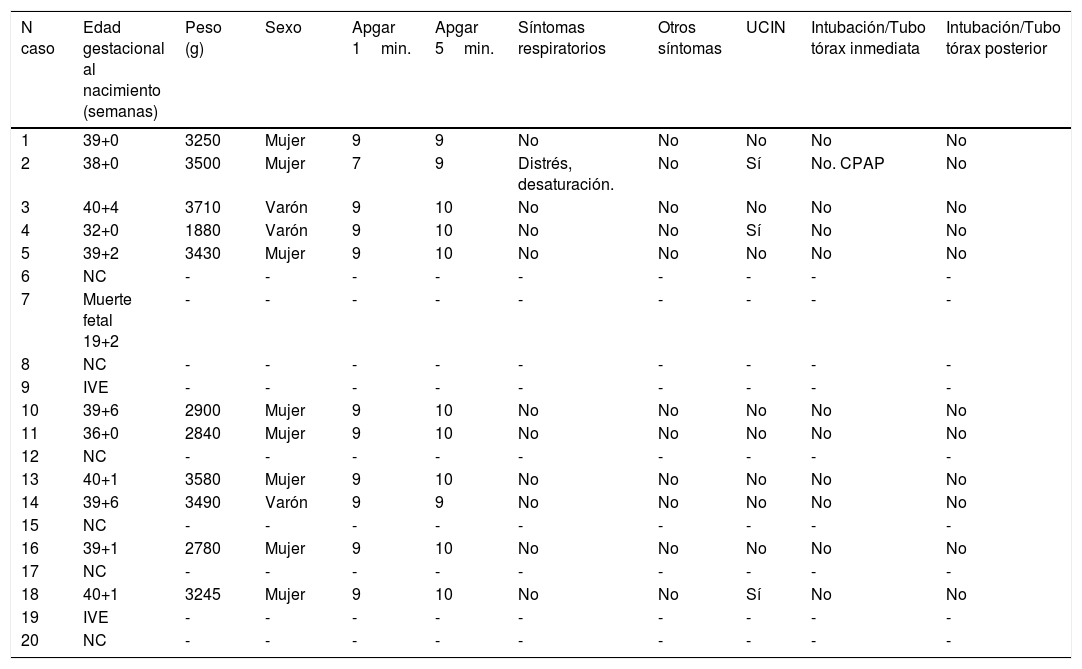
Los partos tuvieron lugar a término, entre semana 38 y 40 de gestación, a excepción de dos gestaciones que finalizaron de forma espontánea en semana 32 y semana 36. Sólo uno de los recién nacidos presentó distrés respiratorio al nacimiento (9%), precisando presión positiva continua en la vía respiratoria (CPAP). El resultado medio del test de Apgar en el primer minuto fue de 8 (rango 7-9) y de 9 (rango 9-10) en el quinto minuto. Tres de los recién nacidos precisaron estabilización en UCI neonatal, sin intubación traqueal inmediata ni posterior en ningún caso. El peso neonatal medio fue 3145g (rango 1880-3710g) (tabla 2).
Evolución perinatal
| N caso | Juicio clínico prenatal | Semanas gestación al diagnóstico | Localización masa | Tamaño (cm) | Desplazamiento mediastínico/ diafragmático | Polihidramnios | Hidrops | Intervención intraútero | Evolución intraútero |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Secuestro MAQ tipo II | 20+1 | PI | 3.8x4.7x4.1 | Sí, desplaza pulmón contralateral/ Sí | No | No | No | Reducción /No produce desplazamiento |
| 2 | MAQ tipo I | 29+3 | LID | 3.76x2.38 | No/No | No | No | No | Estable |
| 3 | MAQ tipo II | 20+4 | PD | 3.6x4.8x4.8 | Ligera/No | No | No | No | Reducción/ No desplaza mediastino |
| 4 | SBP | 22+4 | LII | 2.9x2.7x2.6 | Sí/No | No | No | No | Estable |
| 5 | MAQ tipo I | 21+5 | PD | 3.6x4.7x4.2 | Sí/No | No | No | No | Reducción/No desplaza mediastino |
| 6 | SBP | 20+4 | LII | 2.8x2.4x2.5 | Ligera/No | No | No | No | Reducción /No desplaza mediastino |
| 7 | MAQ tipo II | 18+3 | Muerte Fetal | - | Sí/No | No | Sí | No | Muerte fetal |
| 8 | Secuestro MAQ | 28+5 | LII | 3.4x2.6x4 | Sí/No | No | No | No | Reducción /No desplaza mediastino |
| 9 | MAQ tipo II | 23+0 | PD | - | No/No | No | No | No | IVE |
| 10 | MAQ tipo II | 21+3 | LID | 2.3x2.8 | No/No | No | No | No | Reducción |
| 11 | MAQ tipo I | 27+0 | PD | 2.5x2.3x2.8 | Ligera/No | No | No | No | Estable |
| 12 | MAQ tipo II | 27+3 | LII | 1.5x1.8 | Sí/No | Sí | No | No | Estable |
| 13 | SBP | 24+1 | PI | 2.3x2.7x3.1 | Sí/No | No | No | No | Reducción |
| 14 | MAQ tipo II | 22+0 | LID | 2.15x1.32x1.27 | No/No | No | No | No | Regresión |
| 15 | MAQ tipo III | 23+1 | PI | 2.5x2.5 | Sí/No | No | No | Falta Seguimiento | Falta Seguimiento |
| 16 | SBP | 21+4 | LID | 2.2x2.7 | Ligera/No | No | No | No | Estable |
| 17 | MAQ tipo II | 21+2 | LII | - | Ligera/No | No | No | No | Estable |
| 18 | SBP | 20+4 (PCR y cariotipo normal) | LID | 2x0.9 | No/No | No | No | No | Reducción |
| 19 | MAQ tipo II | 21+1 | IVE | IVE | IVE | IVE | IVE | IVE | IVE |
| 20 | MAQ tipo II | 21+5 | LID | 1.96x1.62 | No/No | No | No | No | Regresión |
MAQ: malformación adenomatoidea quística. SBP: secuestro broncopulmonar. LID: lóbulo inferior derecho. LII: lóbulo inferior izquierdo.
PD: pulmón derecho. PI: pulmón izquierdo. IVE: interrupción voluntaria del embarazo.
No fue posible obtener datos de seguimiento perinatal y posnatal en 6 de los casos, oscilando el tiempo de seguimiento en el resto entre los 8 y los 96 meses. De los 11 casos de los que se obtuvo el seguimiento tras nacimiento, el diagnóstico prenatal se confirmó en 8 de los casos mediante pruebas de imagen: secuestro-MAQ en un caso, SBP en dos casos y MAQ en 5 casos. La radiografía de tórax posnatal fue informada como normal en 4 de los casos (36%), en un caso se identificó desplazamiento mediastínico con condensación basal. En los 8 casos en los que se realizó tomografía computerizada de tórax, la lesión se confirmó en 7 (un secuestro-MAQ, un SBP, 5 MAQ) y en un caso fue normal (tabla 3).
Evolución posnatal
| N caso | Edad gestacional al nacimiento (semanas) | Peso (g) | Sexo | Apgar 1min. | Apgar 5min. | Síntomas respiratorios | Otros síntomas | UCIN | Intubación/Tubo tórax inmediata | Intubación/Tubo tórax posterior |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 39+0 | 3250 | Mujer | 9 | 9 | No | No | No | No | No |
| 2 | 38+0 | 3500 | Mujer | 7 | 9 | Distrés, desaturación. | No | Sí | No. CPAP | No |
| 3 | 40+4 | 3710 | Varón | 9 | 10 | No | No | No | No | No |
| 4 | 32+0 | 1880 | Varón | 9 | 10 | No | No | Sí | No | No |
| 5 | 39+2 | 3430 | Mujer | 9 | 10 | No | No | No | No | No |
| 6 | NC | - | - | - | - | - | - | - | - | - |
| 7 | Muerte fetal 19+2 | - | - | - | - | - | - | - | - | - |
| 8 | NC | - | - | - | - | - | - | - | - | - |
| 9 | IVE | - | - | - | - | - | - | - | - | - |
| 10 | 39+6 | 2900 | Mujer | 9 | 10 | No | No | No | No | No |
| 11 | 36+0 | 2840 | Mujer | 9 | 10 | No | No | No | No | No |
| 12 | NC | - | - | - | - | - | - | - | - | - |
| 13 | 40+1 | 3580 | Mujer | 9 | 10 | No | No | No | No | No |
| 14 | 39+6 | 3490 | Varón | 9 | 9 | No | No | No | No | No |
| 15 | NC | - | - | - | - | - | - | - | - | - |
| 16 | 39+1 | 2780 | Mujer | 9 | 10 | No | No | No | No | No |
| 17 | NC | - | - | - | - | - | - | - | - | - |
| 18 | 40+1 | 3245 | Mujer | 9 | 10 | No | No | Sí | No | No |
| 19 | IVE | - | - | - | - | - | - | - | - | - |
| 20 | NC | - | - | - | - | - | - | - | - | - |
UCIN: Unidad cuidados intensivos neonatal. NC: No consta, pérdida de seguimiento por parto en otro centro. IVE: Interrupción voluntaria del embarazo.
TC: Tomografía computarizada. Rx: Radiografía de tórax. IVE: Interrupción voluntaria del embarazo
No fue necesaria cirugía urgente en ningún caso, aunque sí diferida para extirpación de la lesión en 3 casos: al año de vida en dos de los casos (secuestro-MAQ y MAQ) y a los 4.5 meses en otro (MAQ). Todos los niños se mantuvieron asintomáticos durante su seguimiento, con sibilantes recurrentes tras una infección en dos casos (18%) que no supusieron limitación en la calidad de vida.
4DISCUSIÓNLas malformaciones congénitas broncopulmonares constituyen un grupo de anomalías moderadamente frecuente dentro de las patologías referidas para estudio a una Unidad de Medicina Fetal. De forma similar a las frecuencias comunicadas en la bibliografía, en el presente estudio la patología más frecuente fue la MAQ, seguida del SBP y el complejo MAQ-Secuestro1.
El diagnóstico de sospecha se establece mediante un cuidadoso examen ecográfico con la valoración de las características propias de cada entidad (presencia de micro o macroquistes, identificación de vaso nutricio, etc.) y en algunos casos seleccionados mediante el empleo de la RM. No obstante, el diagnóstico definitivo requiere un estudio anatomopatológico2 y, por tanto, de una cirugía que en la mayoría de los casos no es necesaria. De hecho, en los resultados presentados la confirmación histológica sólo fue posible en dos de los tres casos en los que se llevó a cabo una intervención quirúrgica postnatal: dos casos de MAQ y un caso de complejo MAQ-Secuestro. Dicha valoración anatomopatológica puede modificar el diagnóstico de sospecha en un porcentaje no despreciable de casos puesto que hasta en el 50% de los casos de SBP con resección quirúrgica postnatal puede identificarse componente histológico de MAQ5–7.
Respecto al con el tratamiento prenatal, una de las alternativas de tratamiento médico es la administración de corticoides sistémicos. El empleo de betametasona podría producir una disminución de la cantidad de líquido intralesional mediante el aumento de su reabsorción. El máximo beneficio sería durante el segundo trimestre de la gestación, tanto para la disminución del tamaño de la lesión como para la reversión del hidrops fetal y mejoría de la supervivencia8–12. No obstante, la evidencia al respecto es muy escasa sobre todo en las lesiones microquísticas.
Los tratamientos quirúrgicos prenatales disponibles en la actualidad son la punción y drenaje aspirativo de los quistes o del quiste predominante, shunt tóraco-amniótico, esclerosis de los quistes o del vaso nutricio (en caso de SBP y formas híbridas) y cirugía fetal abierta. La necesidad de cirugía durante el embarazo viene determinada por casos de mal pronóstico y las complicaciones asociadas como el desplazamiento mediastínico severo y/o disfunción cardiaca e hidrops fetal1. Para establecer una indicación de cirugía intrauterina se requiere cariotipo normal, ausencia de otras malformaciones fetales y una edad gestacional menor de 32 semanas.
En la presente serie de casos la tendencia más frecuente fue la evolución favorable (58.8% reducción de tamaño o regresión de la lesión, 35.2% lesión estable) pudiendo así evitar la necesidad de intervención prenatal. En el único caso donde se dio una evolución desfavorable, el pronóstico ya estaba muy comprometido en el momento diagnóstico, a una edad gestacional muy temprana (semana 18 de gestación) y con una forma de MAQ macroquística que presenta mal pronóstico por la posible evolución a derrame pleural e hidrops, en la que la cirugía fetal muy probablemente no habría sido capaz de mejorar el pronóstico. Por lo tanto, en este estudio se pone de manifiesto que las malformaciones pulmonares congénitas son subsidiarias de un manejo prenatal expectante de forma segura mientras no asocien complicaciones y se mantengan estables o se reduzca su tamaño.
Con respecto a la evolución tras el nacimiento, hay algunas mediciones que permiten una estimación del riesgo de distrés respiratorio neonatal como es la determinación del volumen de la malformación en relación con el volumen pulmonar total. Los resultados parecen ser más fiables si las medidas se realizan mediante resonancia magnética y durante el tercer trimestre13–15.
El manejo posnatal de los pacientes asintomáticos presenta controversia dado que el pronóstico aún no es bien conocido. Dicho manejo depende de distintos factores a tener en cuenta como son la necesidad de evitar complicaciones y síntomas relacionados con la lesión y la posibilidad de regresión de la malformación. La evidencia actual no es capaz de definir en qué casos se puede esperar la desaparición completa de las lesiones aunque si hay datos que hablan de la posibilidad de mejoría, sobre todo en el caso de lesiones microquísticas12,16.
La mayoría de las series de casos publicadas se centran en resultados de la cirugía electiva. El setenta por ciento de los centros de todo el mundo aboga por la resección profiláctica de las lesiones, sin tener en cuenta el tamaño o los síntomas17. El riesgo de infecciones respiratorias, neumotórax y malignización es lo que justifica la resección quirúrgica en el primer año de vida. Aunque no existen indicaciones absolutas para intervención quirúrgica, si existen recomendaciones para la resección de la lesión en los pacientes asintomáticos con quistes bilaterales y/o multifocales o historia familiar de condiciones asociadas a tumores como el blastoma pleuropulmonar18,19.
En la serie de casos presentada en este estudio, la evolución fue favorable en la práctica totalidad de los casos y posteriormente todos los niños de los que se obtuvieron datos se mantuvieron asintomáticos durante su seguimiento, siendo necesaria la cirugía en menos de un tercio de los casos (27.2%).
Tampoco existe consenso acerca de cuánto tiempo se debe mantener actitud expectante en pacientes asintomáticos. Se debe tener en cuenta la necesidad de evitar complicaciones y síntomas relacionados con la lesión, la posibilidad de regresión de la malformación, la morbilidad asociada al uso repetido de técnicas de imagen con radiación durante el seguimiento y su posible relación con la malignización de las lesiones. El riesgo de malignización de las lesiones se desconoce, aunque en algunos estudios se estima en un 4-9% para MAQ, siendo mayor en casos con lesiones bilaterales, donde se presupone una predisposición genética tanto para la aparición de la lesión como para la malignización de la misma20–23. Además, hay estudios que sugieren que la resección quirúrgica no elimina el riesgo de desarrollo de tumores malignos como el blastoma pleuropulmonar24. En este estudio, aquellos pacientes con tratamiento expectante durante el seguimiento posnatal (tiempo máximo 96 meses), no se dieron casos de malignización ni complicaciones de la lesión.
Finalmente, podemos concluir que, aunque hay casos que requieren tratamiento prenatal y que pueden presentar un mal desarrollo, las malformaciones congénitas broncopulmonares constituyen una entidad que, en términos generales, presenta un buen pronóstico y que suele presentar una mejoría a lo largo de la gestación, particularmente en el tercer trimestre. No obstante, hay que realizar un estrecho seguimiento de dichas pacientes por la posibilidad de aparición de complicaciones prenatales y en el intento de establecer una probabilidad de distrés respiratorio al nacimiento.
5Declaración Conflicto de InterésLos autores declaran no tener conflictos de interés
A María Paz Carrillo Badillo y Alberto Puertas Prieto por su estímulo y apoyo para la investigación, y por su labor docente en el Servicio de Obstetricia y Ginecología de Hospital Universitario Virgen de Las Nieves de Granada.