Las infecciones virales continúan siendo frecuentes en la práctica clínica. Los avances en el manejo de pacientes críticos, de inmunosuprimidos y la posibilidad de ofrecer un tratamiento antiviral oportuno han exigido que el diagnóstico virológico sea hoy un servicio central dentro de los laboratorios clínicos. Un correcto y completo diagnóstico virológico permite además monitorizar pacientes con infecciones crónicas, detectar seroconversión o susceptibilidad de la población vacunada y caracterizar eventuales epidemias causadas por estos agentes. En el siguiente artículo se revisan los conceptos en los que se basan las técnicas utilizadas para el diagnóstico virológico y se entrega un resumen de los exámenes de laboratorio a solicitar ante las infecciones más frecuentes.
Viral infections remain a frequent cause of medical consultation. Advances in support and treatment of critically ill and immunocompromised patients, and the introduction of antiviral drugs have resulted that viral diagnosis is now an important function in clinical laboratories. A complete and precise viral diagnostic also allows monitoring chronic infections, to detect serologic response or susceptibility on vaccinated population and to characterize the course of viral outbreaks. In this article, we review the basic concepts behind the most frequently used virology techniques and summarized the laboratory tests that can be performed according to the most frequent infections.
Las patologías producidas por agentes virales son de alta frecuencia tanto en la consulta pediátrica como de adultos. En la mayoría de los casos, el diagnóstico etiológico se sospecha basado en los síntomas y signos del paciente y no se requiere confirmación por laboratorio. Sin embargo, en la actualidad también nos vemos enfrentados a la complejidad de pacientes graves en unidades de cuidados intensivos, a pacientes oncológicos, trasplantados e inmunosuprimidos, quienes presentan cada vez mejores expectativas de éxito en sus tratamientos. En ellos, el oportuno y correcto diagnóstico etiológico y la monitorización de las infecciones virales -entre otras- se hacen necesarios, especialmente en los casos para los que disponemos de tratamiento antiviral específico.
Por otra parte, las nuevas técnicas diagnósticas, especialmente basadas en biología molecular, nos han llevado al descubrimiento y reconocimiento de nuevos virus involucrados en patologías. Existe la capacidad de caracterizar a los agentes que aparecen en cuadros frecuentes (como cuadros respiratorios, diarreas, fiebre) y se ha podido reconocer cómo los virus son capaces de transmitirse y diseminarse a través de la población. El concepto de epidemiología molecular, en la que se caracteriza molecularmente a los agentes que circulan en determinados brotes epidémicos, epidemias o pandemias, nos invita a vigilar constantemente a los agentes que afectan a nuestra población. El laboratorio de virología juega entonces un rol fundamental en este desarrollo.
TOMA DE MUESTRA PARA EL DIAGNÓSTICO VIROLÓGICOLa probabilidad de obtener un buen rendimiento diagnóstico depende de la calidad de la muestra recibida en el laboratorio. Para obtener muestras de alta calidad debemos conocer, por ejemplo, el sitio o lesión donde se sospecha esté el agente, de manera de pedir la secreción o el tejido donde el virus (o parte de éste) esté presente. Es importante también estimar el período en que se encuentra la infección, tanto para solicitar la muestra en el momento de mayor replicación viral, como para estimar en los casos en los que necesitemos evaluar la respuesta inmune del hospedero. Por otro lado, son determinantes la cantidad y calidad de la muestra, además de las condiciones en la que es mantenida y el tiempo en la que es transportada al laboratorio (Tabla 1).
Tipos de muestras e instrucciones para correcta obtención y transporte para diagnóstico viral
| Tipo de muestra | Material de recolección | Instrucciones y precauciones |
|---|---|---|
| Hisopado o cepillado (células epiteliales) | • Tórula o cepillo flexible• Medio de transporte viral• Unidad refrigerante | Se recogen células epiteliales (piel o mucosas) donde está ocurriendo la replicación activa del virus.Tórula o cepillo de preferencia de dacron o plástico.En caso de necesitar aislamiento viral, la muestra debe enviarse en medio de transporte viral.Mientras se espera traslado a laboratorio conservar a 4°C (no congelar). |
| Sangre | • Tubo sin anticoagulante (tapa roja) para pruebas en SUERO.• Tubo con anticoagulante (tapa lila) para pruebas en sangre total, leucocitos o plasma. | Los volúmenes requeridos dependerán de las técnicas. Técnicas moleculares requieren menor volumen.Se recomienda en general entre 5 y 10ml en adultos.Evitar hemólisis.Mantener a 4° en caso de que el transporte al laboratorio tome más de un día (no congelar). |
| Fluidos o secreciones | • Trócar para punción (LCR) o sonda fina (aspirado nasofaríngeo o traqueal)• Medio de transporte viral• Unidad refrigerante | En caso de muestras respiratorias, deben ser puestas en medio de transporte viral. LCR, orina o leche materna no necesitan medio de transporte.Mientras se espera traslado a laboratorio conservar a 4°C (no congelar). |
| Deposiciones | • Frasco estéril o limpio• Unidad refrigerante | Se recomiendan al menos 4 gr. de deposiciones.Mientras se espera traslado a laboratorio conservar a 4°C(no congelar). |
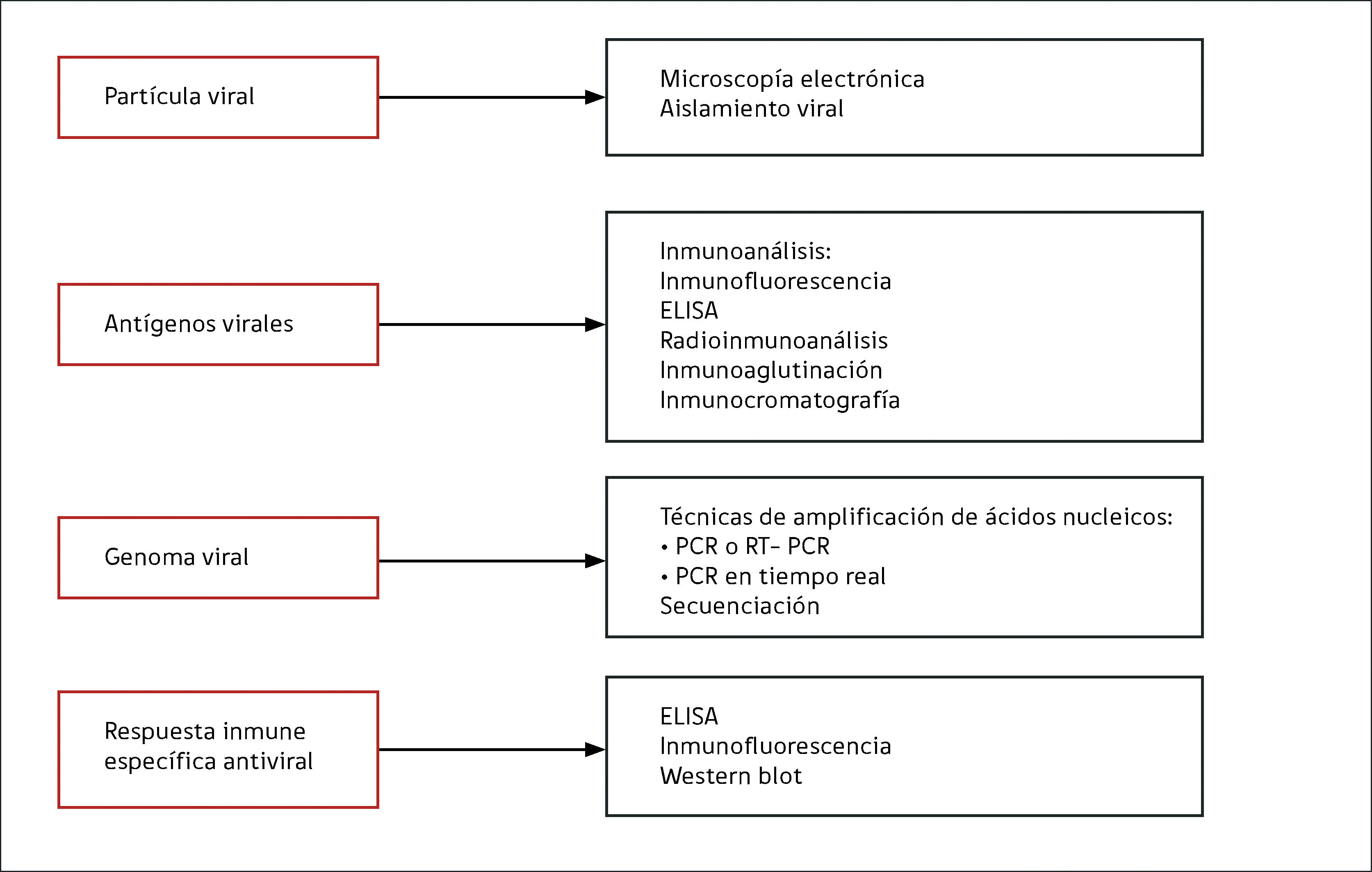
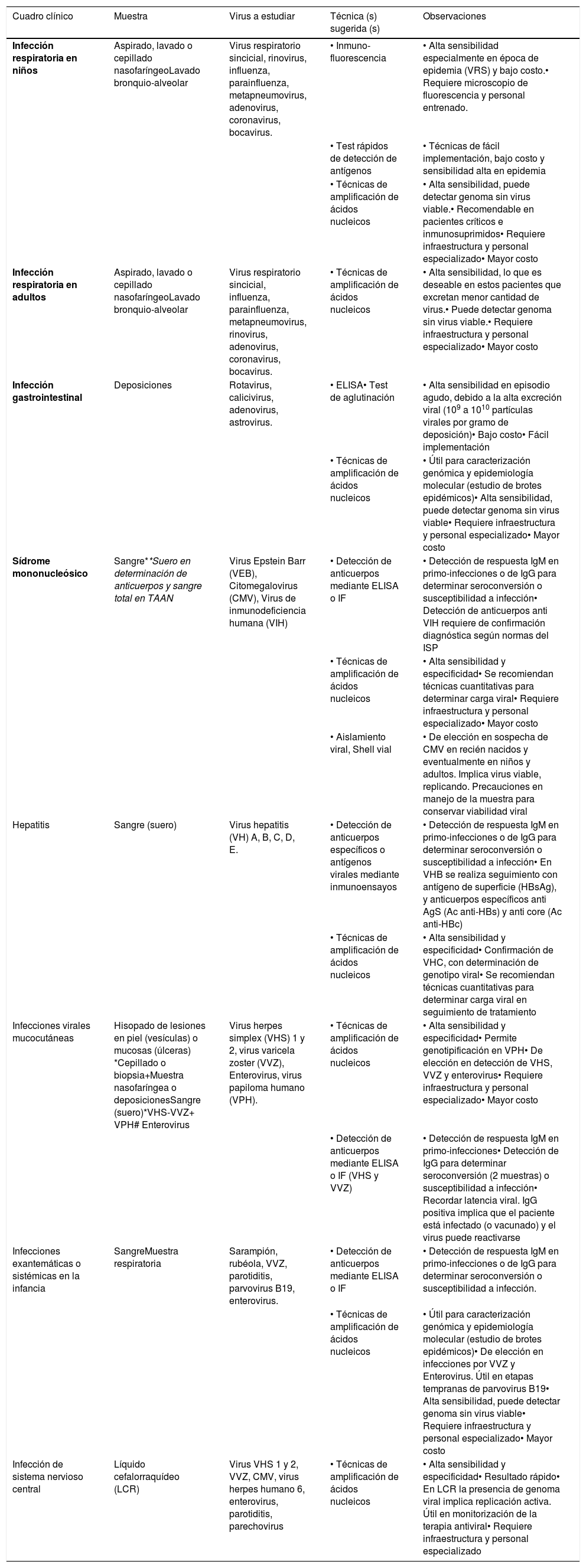
Ante la necesidad de solicitar exámenes de diagnóstico virológico debemos recordar que los virus son organizaciones macromoleculares que constan esencialmente de genoma (ácidos nucleicos de tipo ARN o ADN) y proteínas. Algunos de ellos presentarán además lípidos en su manto e hidratos de carbono unidos a las proteínas virales. Tal como se muestra en la Figura 1, existen técnicas de laboratorio específicas para la detección de la partícula viral completa, los antígenos virales (proteínas) y del genoma viral. Además, podemos detectar y caracterizar la respuesta inmune antiviral específica.
En cuanto a la detección de la partícula viral completa, las técnicas de aislamiento viral o microscopia electrónica sólo están disponibles en laboratorios especializados en virología y se encuentran generalmente reservadas para fines de investigación. Estas técnicas clásicas han sido reemplazadas en la práctica clínica por técnicas moleculares o inmunoensayos que requieren menor infraestructura e implican un menor tiempo en la entrega de resultados.
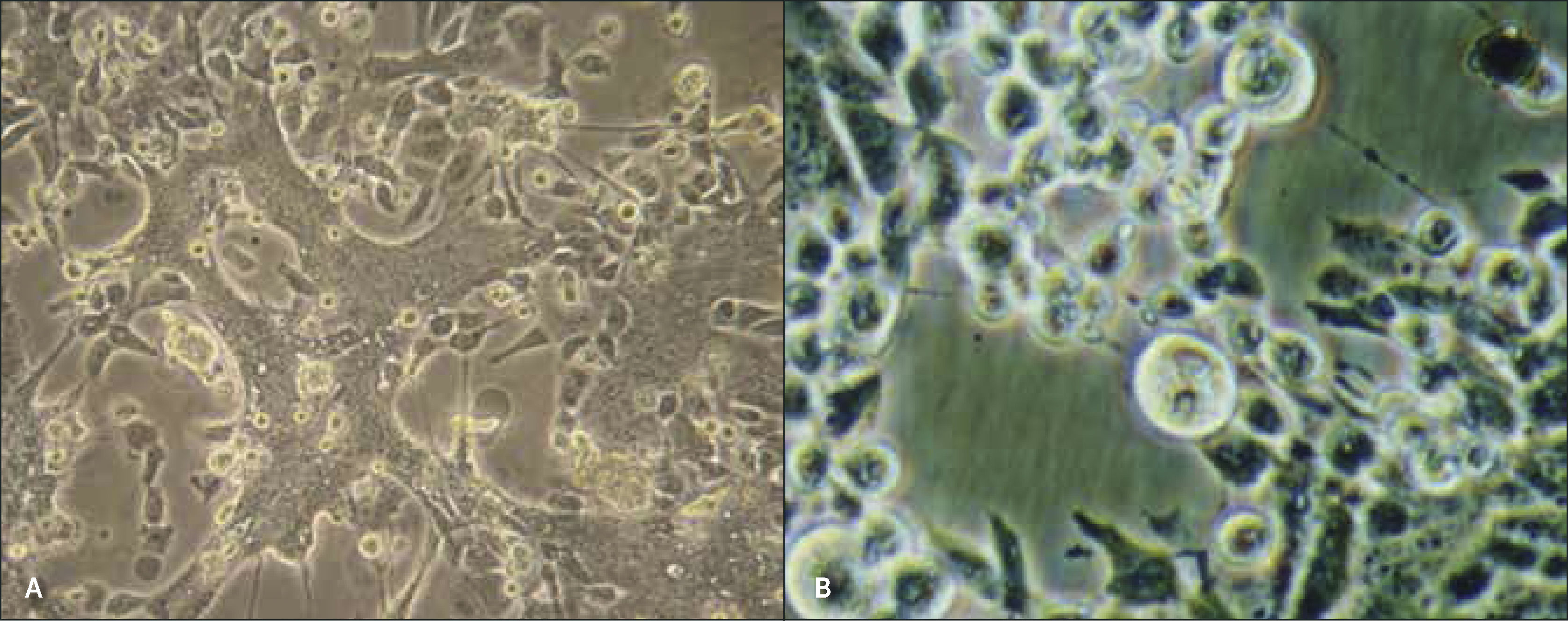
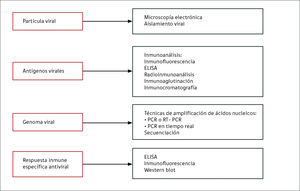
La característica de los virus de ser parásitos intracelulares implica que para el aislamiento viral se deban utilizar líneascultivos celulares, los cuales son “infectados” por el virus viable presente en la muestra y tras lo cual se observan los cambios morfológicos de las células hospederas o efectos citopáticos, como consecuencia de una replicación viral efectiva (Figura 2). Todo aislamiento viral debe ser confirmado mediante técnicas de inmunodiagnóstico (inmunofluorescencia) o moleculares específicas, debido a que ningún efecto citopático es patognomónico de un virus en particular. Una de las mayores ventajas del aislamiento viral es la posibilidad de obtener altas concentraciones de virus completo, para posteriores estudios de caracterización genómica y antigénica, de sensibilidad antiviral y para conservación en biorepositorios.
Técnica de aislamiento viral
A. Células Hep-2 infectadas por virus respiratorio sincicial. Se observa formación de sincicios producto de la fusión de membranas secundaria a la presencia de la proteína viral de fusión (F) tras la replicación viral efectiva. B. Células Vero infectadas por virus herpes simplex tipo 2. Se observa efecto citopático característico, con focos de lisis celular y megacariocitos (células “abalonadas”). Gentileza de Dra. María José Martínez.
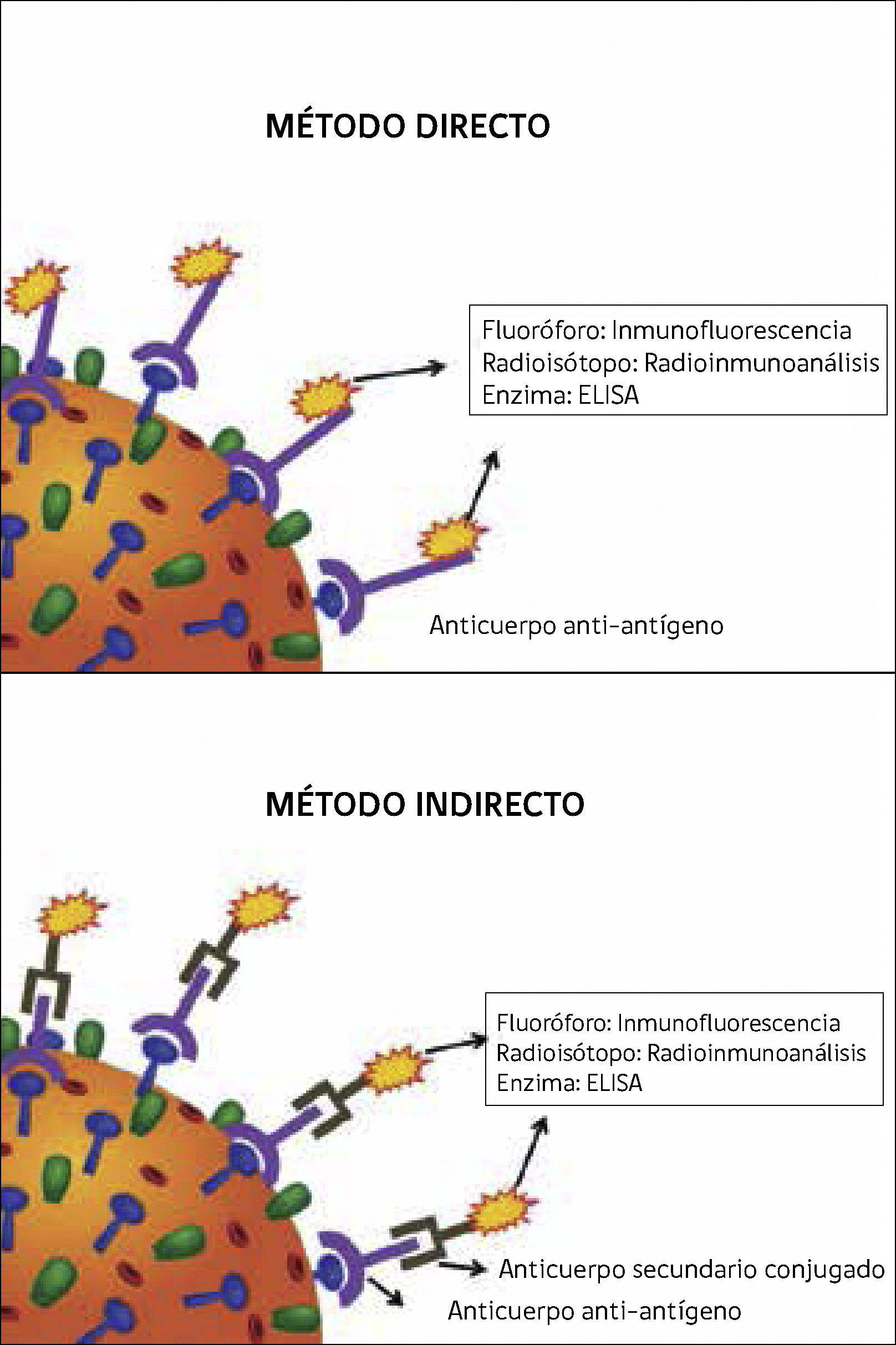
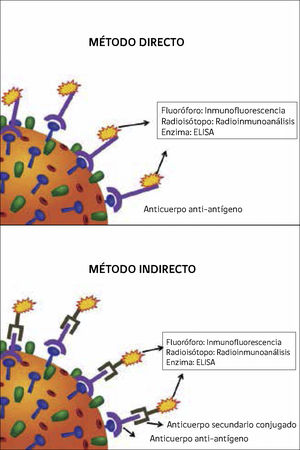
Para detectar antígenos virales disponemos de múltiples técnicas de inmunoanálisis, las cuales se basan en la especificidad de la reacción antígeno-anticuerpo. En todas estas técnicas es necesario conocer el antígeno a detectar, de manera de definir el anticuerpo específico para dicho fin. La detección puede realizarse mediante métodos directos o indirectos. Como se muestra en la Figura 3, en el método directo, el anticuerpo específico contra el antígeno a detectar está acoplado a un marcador. En el método indirecto, el anticuerpo anti-antígeno no posee marcador, y la formación del complejo antígeno-anticuerpo se evidencia mediante un segundo anticuerpo marcado, llamado anticuerpo secundario conjugado. De esta forma, la denominación de las técnicas de inmunoanálisis se basa en el tipo de marcador utilizado para evidenciar la unión del anticuerpo con el antígeno:
- •
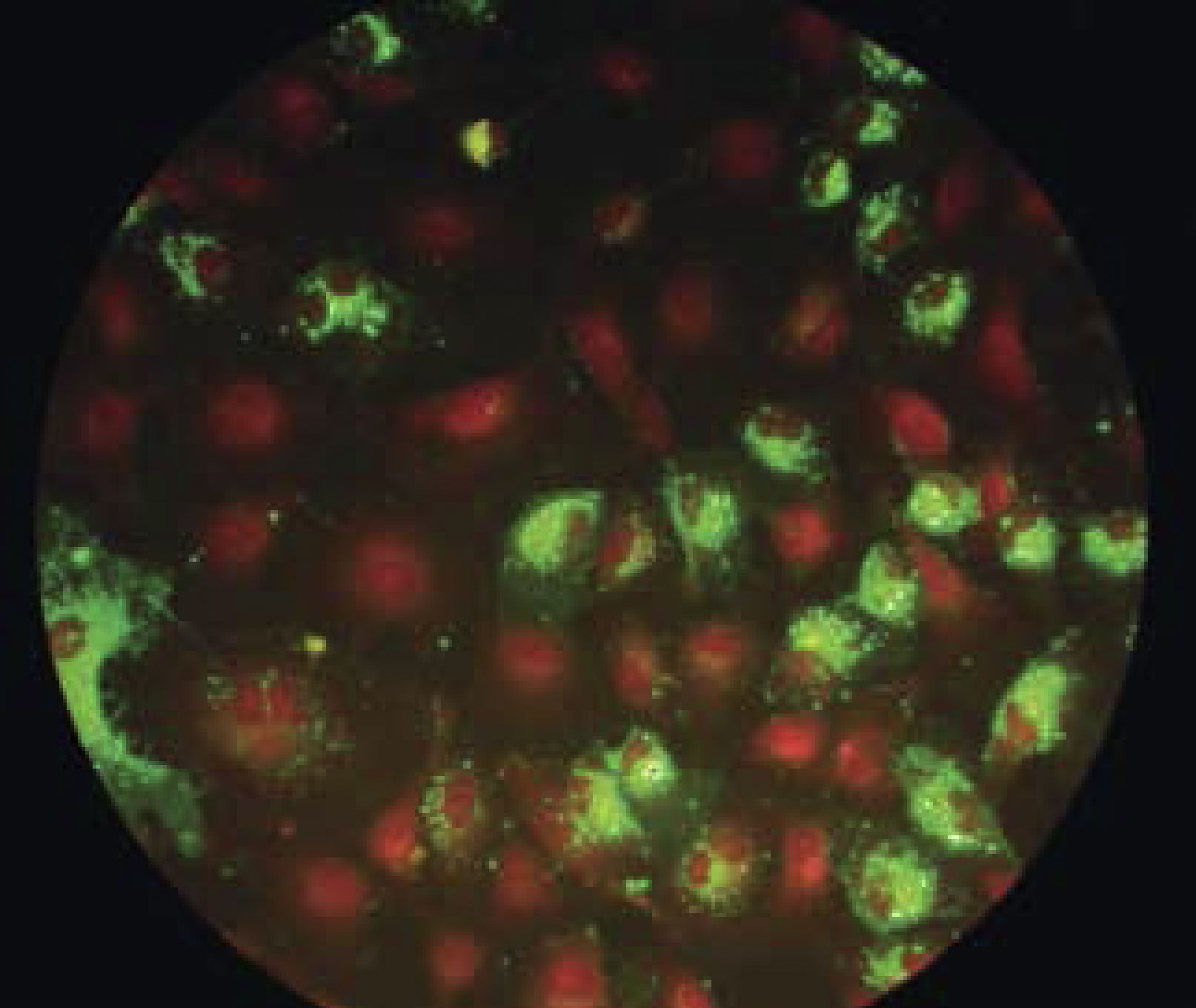
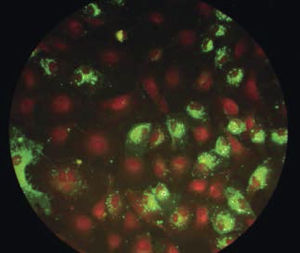
Inmunoflorescencia: el anticuerpo está unido a una molécula que emite fluorescencia (Figura 4).
Figura 4.Inmunofluorescencia indirecta
Monocapa de células HEp-2 infectadas con virus respiratorio sincicial. Se evidencia la presencia de la proteína F viral en membranas y citoplasma de las células infectadas, gracias a la marcación con anticuerpo secundario conjugado con molécula fluorescente. Foto gentileza de Dr. Luis Fidel Avendaño.
- •
Radioinmunoanálisis: el marcador en este caso es un isótopo radioactivo.
- •
ELISA (ensayo inmuno enzimático): el anticuerpo está acoplado a una enzima que al reaccionar con un sustrato produce un producto coloreado visible.
Otras técnicas de inmunoanálisis se basan en la simple aglutinación que ocurre al unirse el antígeno con el anticuerpo, formándose grandes complejos que sedimentan. Esta sedimentación es fácilmente visible, por lo que la técnica es rápida y sencilla. Por otro lado, la técnica rápida de inmunocromatografía (inicialmente utilizada para test de embarazos) se basa en la detección del complejo antígeno-anticuerpo sobre una membrana de nitrocelulosa. La muestra se hace migrar por capilaridad sobre esta membrana, la que tiene los anticuerpos antivirales específicos fijados y que evidenciarán la unión del antígeno mediante una banda de color oscuro. Ambas pruebas requieren mínima infraestructura y pueden estar disponibles en cualquier centro de salud.
La detección de genoma viral en la actualidad es la técnica de elección en la mayoría de las infecciones virales que requieren de diagnóstico virológico certero y rápido. Se basa en la identificación de secuencias específicas de ADN o ARN viral y puede ser virtualmente utilizada para cualquier virus. Más aún, la masificación y perfeccionamiento de estas técnicas de amplificación de ácidos nucleicos (TAAN) nos ha llevado al descubrimiento de nuevos virus desde la detección de su genoma.
Los análisis pueden ser específicos para un virus o bien para un grupo de ellos. Entre sus principales ventajas están el poder detectar virus que no pueden ser aislados en cultivos celulares, o en aquellas infecciones en las que la carga antigénica es muy baja como para ser detectada por inmunoanálisis. Además, debido a la estabilidad del ADN, la detección de virus con este tipo de genoma es posible a pesar de que las condiciones de la muestra no sean las óptimas. La desventaja principal es la posibilidad de contaminación y falsos positivos.
La técnica prototipo de las TAAN es la PCR, o reacción en cadena de la polimerasa, en la que se amplifican segmentos de ADN utilizando partidores específicos y una ADN polimerasa termoestable (Taq polimerasa). Cabe mencionar que en los casos en que se deba detectar ARN viral, la amplificación debe estar precedida por un paso de transcripción reversa, donde el ARN es copiado a un “ADN copia (ADNc)”. Este ADNc será el templado que se utilizará en el posterior proceso de amplificación por la polimerasa.
Los productos de amplificación podrán ser visualizados mediante distintos métodos: electroforesis en el caso de PCR convencional; mediante sondas fluorescentes que permiten la detección en la medida que ocurre la amplificación (PCR en tiempo real), o mediante la hibridación en plataformas que permiten la detección de múltiples virus a la vez (Ej: Pneumovir®, Filmarray ®). Para mayor detalle acerca de estas técnicas de biología molecular referirse al artículo de “Biología molecular aplicada al diagnóstico clínico”.
Además de su importante rol en el diagnóstico virológico, la amplificación del genoma viral ha permitido caracterizar las secuencias nucleotídicas de los agentes detectados mediante técnicas de secuenciación nucleotídica que se han perfeccionado enormemente en el último tiempo. Esta valiosa herramienta nos entrega información que permite clasificar a los virus (genotipificación), conocer su distribución y transmisión en las poblaciones, y detectar mutaciones asociadas a resistencia a drogas antivirales o a manifestaciones clínicas inusuales. Es uno de los pilares de diagnóstico, estudio y caracterización viral durante brotes epidémicos como los ocurridos con influenza pandémica el 2009, MERS 2012 y ébola 2014. Las autoridades de salud se basan en estas técnicas para rastrear virus emergentes. Por otro lado, la caracterización genética nos acerca a los cambios que pueden ocurrir en las proteínas virales que influyen en la patogénesis y nos orienta hacia los mecanismos que tienen los virus para escapar de la respuesta inmune del hospedero (presión inmunológica), siendo ampliamente utilizada en investigación. Las técnicas de secuenciación han avanzado enormemente en los últimos años, siendo la “secuenciación de nueva generación (NGS)” una promesa para avanzar en el conocimiento de la patogenia viral y para descubrir y rastrear nuevos o desconocidos virus.
Por último, a pesar que actualmente no representa uno de los pilares del diagnóstico virológico, la detección y caracterización de la respuesta inmune antiviral continúa siendo necesaria para determinar infección aguda en algunas infecciones virales, para caracterizar la susceptibilidad de los individuos a potenciales infecciones (pre-trasplante, pacientes oncológicos), en la vigilancia de la seroconversión en individuos vacunados y en población general y en la caracterización de los perfiles de respuesta a infecciones crónicas como en la infección por virus hepatitis B. Las técnicas de inmunoanálisis utilizadas en estos casos son de tipo indirecto, dado que se marcará la unión antígeno-anticuerpo específico (el que está presente o no en el suero del paciente) mediante la unión de un segundo anticuerpo que evidenciará la formación del complejo. Los ensayos más utilizados son inmunofluorescencia, ELISA y Western blot.
Laboratorio virológico según tipos de infecciones frecuentes en la práctica clínica
En la mayoría de los casos en los que se sospecha una infección viral, el diagnóstico etiológico se hará basándose en una completa historia clínica y un detallado examen físico. Cuadros como el resfrío común, gripe, bronquiolitis, varicela, herpes zoster, diarrea viral entre otros, serán generalmente diagnosticados al reconocer los síntomas y signos característicos. A continuación se entrega una tabla resumen donde se detallan las técnicas de laboratorio, las muestras a solicitar y algunas características de los exámenes de diagnóstico viral sugeridos ante tipos de infecciones frecuentes en la práctica clínica (Tabla 2).
Recomendaciones de muestras y exámenes a solicitar según cuadros infecciosos frecuentes en la práctica clínica
| Cuadro clínico | Muestra | Virus a estudiar | Técnica (s) sugerida (s) | Observaciones |
|---|---|---|---|---|
| Infección respiratoria en niños | Aspirado, lavado o cepillado nasofaríngeoLavado bronquio-alveolar | Virus respiratorio sincicial, rinovirus, influenza, parainfluenza, metapneumovirus, adenovirus, coronavirus, bocavirus. | • Inmuno-fluorescencia | • Alta sensibilidad especialmente en época de epidemia (VRS) y bajo costo.• Requiere microscopio de fluorescencia y personal entrenado. |
| • Test rápidos de detección de antígenos | • Técnicas de fácil implementación, bajo costo y sensibilidad alta en epidemia | |||
| • Técnicas de amplificación de ácidos nucleicos | • Alta sensibilidad, puede detectar genoma sin virus viable.• Recomendable en pacientes críticos e inmunosuprimidos• Requiere infraestructura y personal especializado• Mayor costo | |||
| Infección respiratoria en adultos | Aspirado, lavado o cepillado nasofaríngeoLavado bronquio-alveolar | Virus respiratorio sincicial, influenza, parainfluenza, metapneumovirus, rinovirus, adenovirus, coronavirus, bocavirus. | • Técnicas de amplificación de ácidos nucleicos | • Alta sensibilidad, lo que es deseable en estos pacientes que excretan menor cantidad de virus.• Puede detectar genoma sin virus viable.• Requiere infraestructura y personal especializado• Mayor costo |
| Infección gastrointestinal | Deposiciones | Rotavirus, calicivirus, adenovirus, astrovirus. | • ELISA• Test de aglutinación | • Alta sensibilidad en episodio agudo, debido a la alta excreción viral (109 a 1010 partículas virales por gramo de deposición)• Bajo costo• Fácil implementación |
| • Técnicas de amplificación de ácidos nucleicos | • Útil para caracterización genómica y epidemiología molecular (estudio de brotes epidémicos)• Alta sensibilidad, puede detectar genoma sin virus viable• Requiere infraestructura y personal especializado• Mayor costo | |||
| Sídrome mononucleósico | Sangre**Suero en determinación de anticuerpos y sangre total en TAAN | Virus Epstein Barr (VEB), Citomegalovirus (CMV), Virus de inmunodeficiencia humana (VIH) | • Detección de anticuerpos mediante ELISA o IF | • Detección de respuesta IgM en primo-infecciones o de IgG para determinar seroconversión o susceptibilidad a infección• Detección de anticuerpos anti VIH requiere de confirmación diagnóstica según normas del ISP |
| • Técnicas de amplificación de ácidos nucleicos | • Alta sensibilidad y especificidad• Se recomiendan técnicas cuantitativas para determinar carga viral• Requiere infraestructura y personal especializado• Mayor costo | |||
| • Aislamiento viral, Shell vial | • De elección en sospecha de CMV en recién nacidos y eventualmente en niños y adultos. Implica virus viable, replicando. Precauciones en manejo de la muestra para conservar viabilidad viral | |||
| Hepatitis | Sangre (suero) | Virus hepatitis (VH) A, B, C, D, E. | • Detección de anticuerpos específicos o antígenos virales mediante inmunoensayos | • Detección de respuesta IgM en primo-infecciones o de IgG para determinar seroconversión o susceptibilidad a infección• En VHB se realiza seguimiento con antígeno de superficie (HBsAg), y anticuerpos específicos anti AgS (Ac anti-HBs) y anti core (Ac anti-HBc) |
| • Técnicas de amplificación de ácidos nucleicos | • Alta sensibilidad y especificidad• Confirmación de VHC, con determinación de genotipo viral• Se recomiendan técnicas cuantitativas para determinar carga viral en seguimiento de tratamiento | |||
| Infecciones virales mucocutáneas | Hisopado de lesiones en piel (vesículas) o mucosas (úlceras) *Cepillado o biopsia+Muestra nasofaríngea o deposicionesSangre (suero)*VHS-VVZ+ VPH# Enterovirus | Virus herpes simplex (VHS) 1 y 2, virus varicela zoster (VVZ), Enterovirus, virus papiloma humano (VPH). | • Técnicas de amplificación de ácidos nucleicos | • Alta sensibilidad y especificidad• Permite genotipificación en VPH• De elección en detección de VHS, VVZ y enterovirus• Requiere infraestructura y personal especializado• Mayor costo |
| • Detección de anticuerpos mediante ELISA o IF (VHS y VVZ) | • Detección de respuesta IgM en primo-infecciones• Detección de IgG para determinar seroconversión (2 muestras) o susceptibilidad a infección• Recordar latencia viral. IgG positiva implica que el paciente está infectado (o vacunado) y el virus puede reactivarse | |||
| Infecciones exantemáticas o sistémicas en la infancia | SangreMuestra respiratoria | Sarampión, rubéola, VVZ, parotiditis, parvovirus B19, enterovirus. | • Detección de anticuerpos mediante ELISA o IF | • Detección de respuesta IgM en primo-infecciones o de IgG para determinar seroconversión o susceptibilidad a infección. |
| • Técnicas de amplificación de ácidos nucleicos | • Útil para caracterización genómica y epidemiología molecular (estudio de brotes epidémicos)• De elección en infecciones por VVZ y Enterovirus. Útil en etapas tempranas de parvovirus B19• Alta sensibilidad, puede detectar genoma sin virus viable• Requiere infraestructura y personal especializado• Mayor costo | |||
| Infección de sistema nervioso central | Líquido cefalorraquídeo (LCR) | Virus VHS 1 y 2, VVZ, CMV, virus herpes humano 6, enterovirus, parotiditis, parechovirus | • Técnicas de amplificación de ácidos nucleicos | • Alta sensibilidad y especificidad• Resultado rápido• En LCR la presencia de genoma viral implica replicación activa. Útil en monitorización de la terapia antiviral• Requiere infraestructura y personal especializado |
Se agradece al Dr. Luis Fidel Avendaño y a la Dra. María José Martínez por permitir el uso de fotografías de su propiedad en esta publicación.
La autora declara no tener conflictos de interés, en relación a este artículo.