El estudio de enfermedades inmunológicas resulta complejo y requiere exámenes específicos. Para dirigir el estudio de laboratorio resulta práctico dividir estas patologías en cuatro grandes grupos: inmunodeficiencias, enfermedades autoinmunes, enfermedades alérgicas y enfermedades oncológicas.
Entre las inmunodeficiencias destacan: los déficit de anticuerpos que es posible evaluar inicialmente con recuento de IgA, IgG, IgM y la infección por VIH cuya evaluación inmunológica se realiza con cuantificación de subpoblaciones linfocitarias (CD4+/CD8+). En la aproximación diagnóstica de enfermedades autoinmunes se sugiere comenzar con anticuerpos anti-nucleares (ANA) y de acuerdo al cuadro clínico solicitar exámenes específicos como anticuerpos anti-antígenos nucleares extractables (ENA), anticuerpos anti-dsDNA, factor reumatoide, etc. En el caso de enfermedades alérgicas, el estudio se realiza de acuerdo a la anamnesis y temporalidad de la exposición alergénica, siendo útil el estudio con prick test e IgE alérgeno específica. Finalmente en las discrasias de células plasmáticas, el estudio con electroforesis, inmunofijación y cadenas livianas libres en suero constituyen una buena aproximación diagnóstica.
La gran diversidad de patologías que afectan al sistema inmune hace necesario un estudio de laboratorio muy dirigido y especifico, el cual debe interpretarse en el contexto clínico del paciente, siendo de gran relevancia una adecuada y detallada historia clínica.
The study of immune diseases it is complex and requires specific analyses. To conduct laboratory studies it is more pragmatic to divide immune diseases into four big groups: immunodeficiencies, autoimmune diseases, allergic diseases and oncologic diseases.
Among the immunodeficiencies highlight; the antibody deficit, which at first approach it is possible to be evaluated through IgA, IgG and IgM counts; and the HIV infection, whose immunological evaluation is performed by quantifying lymphocytes subpopulations (CD4+/CD8+). For the autoimmune diseases diagnostic it is suggested to start with Antinuclear Antibodies (ANA) and, based on patient́s clinical picture, other specific analyses such as Extractable Nuclear Antigen Antibodies (ENA), antibodies to ds-DNA, Rheumatoid Factor, etc. Allergic diseases related to the evaluation are performed based on patient's history and allergen exposition timing and the study prick test and specific IgE useful. Finally, about the plasmatic cells dyscrasia, a correct diagnostic approach includes the use of electrophoresis, immunofixation and free light chains on serum.
The enormous diversity of pathologies affecting the immune system makes necessary a very specific and directed-towards study. This study must be interpreted in the clinical context of the patient and being of great relevance and adequate and detailed clinical history.
El estudio de enfermedades cuya alteración primaria está en el sistema inmunológico representa un desafío importante para el médico, pues muchas veces requiere de exámenes complementarios específicos y de elevado costo.
En este sentido, resulta práctico dividir las enfermedades de origen inmunológico en cuatro grandes grupos: inmunodeficiencias, enfermedades autoinmunes, enfermedades alérgicas y enfermedades oncológicas y de esta forma dirigir el estudio de laboratorio desde un enfoque clínico apropiado.
A continuación se describen los principales estudios de laboratorio utilizados en la práctica clínica habitual, considerando los cuatro grandes grupos mencionados.
APROXIMACIÓN DE LABORATORIO EN EL ESTUDIO DE INMUNODEFICIENCIASLas inmunodeficiencias corresponden a alteraciones del sistema inmune en las cuales puede existir un defecto primario de origen genético o bien un defecto secundario dado por diversos factores ambientales como infecciones virales, enfermedades metabólicas, situaciones de estrés, etc.1,2.
El estudio de laboratorio asociado a estas patologías consiste en la medición cuantitativa y en algunas ocasiones funcional de distintos componentes del sistema inmune. A continuación se describen los de uso más frecuente.
Recuento de inmunoglobulinas séricas (IgG, IgA, IgM)El estudio de laboratorio de las inmunodeficiencias asociadas a anticuerpos puede comenzar con el recuento de inmunoglobulinas séricas, siendo posible medir IgA, IgM e IgG séricas de forma rutinaria en muchos laboratorios.
Actualmente existen varias técnicas que permiten la medición de estas proteínas plasmáticas, siendo la nefelometría la más recomendada.
La nefelometría mide la dispersión de la luz, a medida que un analito está en mayor concentración, la dispersión será mayor, permitiendo, a través de un cálculo de álgebra analítica, determinar la concentración de la sustancia3.
Al momento de solicitar el recuento de inmunoglobulinas, es necesario recordar que los anticuerpos se distribuyen en los líquidos biológicos por todo el cuerpo, por tanto las formas secretadas que se encuentran en el plasma sólo corresponden a una fracción del total, a pesar de esto, diversos estudios han reflejado que se correlacionan de forma adecuada con la producción total de inmunoglobulinas del ser humano. Un adulto sano de 70kg produce aproximadamente 2 a 3 grs. de anticuerpos todos los días, en plasma la IgG se encuentra en mayor concentración y corresponde a la más importante en la respuesta a infecciones, le sigue IgA la cual tiene rol crucial en la inmunidad de mucosas y finalmente IgM con la menor concentración plasmática, pero es la primera en elevarse en infecciones agudas4.
De esta forma, en la evaluación de inmunodeficiencias asociadas a anticuerpos la evidencia avala la medición de inmunoglobulinas en plasma como el examen más adecuado al momento de sospechar déficit de anticuerpos, siendo de utilidad diagnóstica en patologías como agamaglobulinemia ligada a X (De Brutton), inmunodeficiencia común variable, déficit de IgA, entre otras1,4.
Por otra parte, es posible medir subclases de IgG, anticuerpos específicos en respuesta a vacunas, tales como los anticuerpos anti-Pneumococo, sin embargo se solicitan en casos especiales y con una fuerte sospecha diagnóstica por lo que no están considerados en la evaluación inicial.
Además es posible medir niveles de IgE total, la cual revisaremos en detalle en otro acápite de esta revisión, sin embargo vale la pena mencionar que existen inmunodeficiencias asociadas a elevación de esta inmunoglobulina, los llamados síndromes Hiper-IgE asociados a infecciones bacterianas recurrentes y dermatitis.
Existen exámenes de laboratorio que permiten medir IgA secretora en mucosa oral. Sin embargo, éstos no tienen buen rendimiento ni adecuada correlación con inmunodeficiencias. Tabla 1.
Rangos de normalidad para inmunoglobulinas séricas en mayores de 18 años
| Inmunoglobulina | Rango de normalidad |
|---|---|
| IgG | 580 a 1540 mg/dl |
| IgA | 64 a 297 mg/dl |
| IgM | 75 a 230 mg/dl |
Nota: Los rangos de normalidad son aproximados y dependen de varios factores como edad, sexo y raza.
Adaptado de: Spickett G. Immunoglobulins (total serum). Oxford Handbook of Clinical Immunolgy and Allergy, third edition, Oxford, 2013 pag: 459.
Para evaluar las inmunodeficiencias asociadas a un déficit de la inmunidad celular es posible cuantificar las distintas poblaciones de linfocitos, así como las subpoblaciones de linfocitos T mediante el uso de la citometría de flujo.
La citometría de flujo es una técnica de análisis celular multi-paramétrico en la que -mediante tamaño celular y complejidad interna de la célula- es posible distinguir distintos tipos celulares, por ejemplo, linfocitos, polimorfonucleares y monocitos. Además, mediante anticuerpos marcados con fluorocromos dirigidos contra distintos clúster de diferenciación (CD) de la superficie celular es posible diferenciar distintas subpoblaciones linfocitarias, siendo las más utilizadas en la evaluación de inmunodeficiencias los linfocitos B (CD19+), linfocitos T citotóxicos (CD8+), linfocitos T Helper (CD4+) y linfocitos natural killer (CD16+/CD56+)5.
El estudio de las distintas poblaciones linfocitarias por citometría de flujo, está recomendado para el estudio de inmunodeficiencias primarias combinadas severas en recién nacidos y lactantes pequeños, evaluación de linfocitos T CD4+ en el diagnóstico y seguimiento de pacientes VIH+, linfopenia T CD4+ idiopática, entre otras5.
Mención especial requiere la evaluación inmunológica en personas viviendo con VIH, pues una de las características más relevantes en la patogenia de la infección es la depleción de los linfocitos T CD4+ durante el avance de la enfermedad y el aumento de los linfocitos T CD8+ en respuesta a la infección viral.
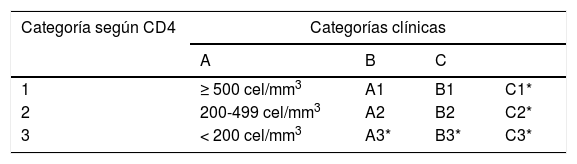
La medición de subpoblaciones de linfocitos T Helper CD4+ y Linfocitos T citotóxicos CD8+, permite al momento del diagnóstico clasificar al enfermo en tres estadios lo que tiene relevancia clínica y pronóstica, pues a medida que disminuyen los Linfocitos T CD4+, aumenta el riesgo de infecciones oportunistas, siendo el riesgo mayor con linfocitos T CD4+ menores a 200 cel/ml. Por otra parte, se produce un aumento en el número de linfocitos T citotóxicos CD8+, lo que produce una inversión en el índice CD4+/CD8+, que normalmente es 2 a 1. En el seguimiento también es relevante las subpoblaciones linfocitarias T CD4+ y CD8+ pues con la terapia antirretroviral altamente efectiva los linfocitos T CD4+ comienzan a subir y el número de linfocitos T CD8+ tiende a normalizarse, esto se traduce en la restauración del sistema inmunológico y en la disminución del riesgo de infecciones6. Tabla 2.
Clasificación CDC para pacientes VIH
| Categoría según CD4 | Categorías clínicas | |||
|---|---|---|---|---|
| A | B | C | ||
| 1 | ≥ 500 cel/mm3 | A1 | B1 | C1* |
| 2 | 200-499 cel/mm3 | A2 | B2 | C2* |
| 3 | < 200 cel/mm3 | A3* | B3* | C3* |
*= SIDA.
Adaptado de: CDC. 1993 Revised classification system for HIV infection and expanded surveillance case definition for AIDS among adolescents and adults. MMWR 1992; 41(no. RR-17).
Las enfermedades autoinmunes constituyen un grupo heterogéneo de patologías, con manifestaciones clínicas diversas. En este contexto el estudio de laboratorio constituye un complemento importante después de haber realizado una completa anamnesis y examen físico.
Anticuerpos anti núcleo-citoplasmáticos (ANA)Son auto-anticuerpos dirigidos contra componentes nucleares: dsDNA, histonas y ribonucleoproteínas. Son muy sensibles en la pesquisa de patologías autoinmunes, pero poco específicos; encontrándose positivos en distintas enfermedades e incluso, en pacientes sanos8,9.
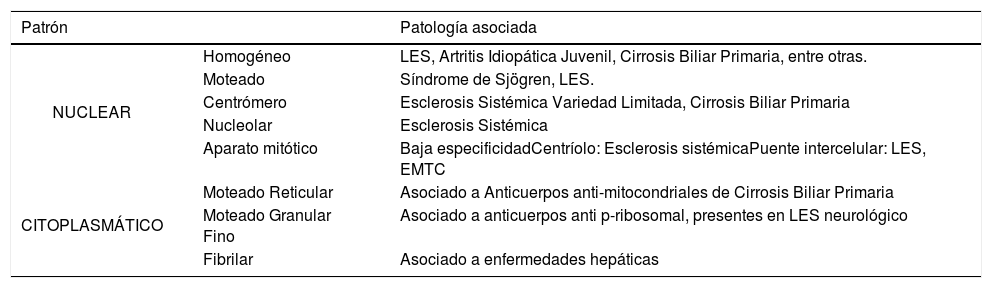
La técnica de elección para su estudio es la inmunofluorescencia indirecta (IFI) en células HEP-2, observándose distintos patrones de tinción fluorescente. Estos patrones orientan a la estructura celular afectada y a distintas patologías autoinmunes. Del mismo modo, se efectúa una dilución seriada de la muestra (titulación), con el fin de determinar de forma indirecta la cantidad de auto-anticuerpo presente. El informe del examen se realiza describiendo el título y patrón de fluorescencia observado y su ubicación nuclear y/o citoplasmática8. Tabla 3.
PATRONES DE INMUNOFLUORESCENCIA INDIRECTA EN ANA
| Patrón | Patología asociada | |
|---|---|---|
| NUCLEAR | Homogéneo | LES, Artritis Idiopática Juvenil, Cirrosis Biliar Primaria, entre otras. |
| Moteado | Síndrome de Sjögren, LES. | |
| Centrómero | Esclerosis Sistémica Variedad Limitada, Cirrosis Biliar Primaria | |
| Nucleolar | Esclerosis Sistémica | |
| Aparato mitótico | Baja especificidadCentríolo: Esclerosis sistémicaPuente intercelular: LES, EMTC | |
| CITOPLASMÁTICO | Moteado Reticular | Asociado a Anticuerpos anti-mitocondriales de Cirrosis Biliar Primaria |
| Moteado Granular Fino | Asociado a anticuerpos anti p-ribosomal, presentes en LES neurológico | |
| Fibrilar | Asociado a enfermedades hepáticas | |
Adaptado de Consenso de patrones ANA para el laboratorio de Inmunología, ISP Chile, Noviembre 2012.
En población sana hasta un 33% de las personas puede resultar con un ANA positivo a una dilución de 1/40, por tanto es considerada la dilución de trabajo inicial. Sin embargo, estudios han demostrado que una dilución ≥ 1/160 se observa sólo en 5% de la población sana, por lo tanto este título tiene mayor relevancia clínica en el diagnóstico de una patología autoinmune9,10.
Otra característica importante de los ANA, es que pueden detectarse años antes de las manifestaciones clínicas de un lupus eritematoso sistémico (1 a 2.5 años).11
Además, si bien son criterio diagnóstico de LES, Hepatitis Autoinmune y enfermedad mixta del tejido conectivo, su título no se asocia a gravedad de la enfermedad y no se aconseja su uso en el seguimiento. Tabla 4.
Utilidad de ANA en diversas patologías
| Condiciones asociadas a ANA positivo |
|---|
| Muy útil en el diagnóstico de:- LES- Esclerosis sistémica |
| Algo útil en el dignóstico de:- Síndrome de Sjögren- Polimiositis-dermatomiositis |
| Muy útil para el diagnóstico y pronóstico de:- Artritis idiopática juvenil- Fenómeno de Raynaud |
| Parte crítica para el diagnóstico de:- Lupus asociado a drogas- Enfermedad mixta del tejido conectivo- Hepatitis autoinmune |
| No es útil ni se ha probado su valor para el diagnóstico, monitorización o pronóstico de:- Artritis reumatoide- Esclerosis Múltiple- Enfermedad tiroidea- Enfermedades infecciosas- Púrpura trombocitopénico autoinmune- Fibromialgia. |
Adaptado de: Solomon et al. “Evidence Based Guidelines for de use of Immunologic tests: Antinuclear Antibody Testing”, Arthritis & Rheumatism, Vol. 47, N0. 4, August 15, 2002, Pp 434-444.
La medición de estos auto-anticuerpos se utiliza en la evaluación y manejo de pacientes con lupus eritematoso sistémico (LES). Están dirigidos contra el DNA de doble hebra (nativo), el cual está presente en el núcleo celular. Su presencia se puede sospechar al tener ANA positivo patrón nuclear homogéneo y su detección en forma dirigida se puede realizar por varias técnicas8,12.
Radioinmunoensayo (Farr): estándar de oro, permite detectar anticuerpos de alta afinidad mediante radioactividad. Tiene una alta sensibilidad y especificidad, pero es un método caro y potencialmente peligroso para el operador.
En la actualidad las dos técnicas más utilizadas son: Inmunofluorescencia indirecta (IFI) en Crithidia lucilae y ELISA (Enzyme-linked immunosorbent assay).
La IFI en Crithidia lucilae, hemoflagelado unicelular, muestra tinción del quinetoplasto que corresponde a una estructura celular que sólo contiene dsDNA. Esta técnica es comparable en sensibilidad y especificidad al ensayo de Farr8,12.
La medición por ELISA se informa según UI/ml y los valores de corte dependen de los reactivos utilizados en cada laboratorio. En pacientes con LES se encuentra positivo en 70 a 80% de los casos y sus niveles se correlacionan muy bien con enfermedad renal activa y bastante bien con actividad de la enfermedad en forma general.
En relación a la sensibilidad y especificidad de cada ensayo es importante mencionar que la IFI en Crithidia lucilae y el ensayo Farr son altamente específicos (98-99%), en cambio la técnica de ELISA es menos especifica (70%), por lo tanto se recomienda que al momento del diagnóstico de LES el resultado de Anti-dsDNA por ELISA sea confirmado por IFI o Farr. Posteriormente, el seguimiento de la enfermedad se puede realizar solo con Anti-dsDNA por ELISA8,13.
Anticuerpos contra antígenos extractables del núcleo (ENA)Son auto-anticuerpos contra proteínas no histonas, asociados a RNA; generalmente en el núcleo. Debido a la localización de estos antígenos, suelen relacionarse a distintos patrones de ANA en inmunofluorescencia. El nombre ENA, deriva de que estos antígenos pueden extraerse con soluciones salinas de baja fuerza iónica. El examen se divide en dos: screening (tamizaje) y profile (perfil); ambos se realizan mediante técnica de ELISA8,13.
Otras técnicas disponibles son inmunoblot, blot en línea y citometría de flujo.
En la técnica de tamizaje se realiza una detección general de estos auto-anticuerpos, el punto de corte depende del laboratorio, y el resultado se informa en UI/ml, pero sin especificar qué auto-anticuerpo está positivo.
En cambio en el perfil ENA se detecta la presencia y se mide la concentración de cada auto-anticuerpo. En el laboratorio clínico, usualmente se examina: Anti-SM, Anti-RNP, Anti- SSA (Ro), Anti-SSB (La), Anti Scl-70, anti Jo-1. El punto de corte depende de los reactivos utilizados. La positividad de cualquiera de estos anticuerpos, orienta a distintas patologías autoinmunes, teniendo valor diagnóstico y pronóstico.
Anti SM (sn-RNP, spliceosoma): Este anticuerpo da un patrón nuclear moteado (a veces homogéneo) en los ANA. Su principal asociación clínica es con LES, pues está presente en 15 a 30% de los casos, con especificidad cercana a 100%. Se asocia a mayor actividad y severidad de la afectación renal, pero no desaparece cuando el paciente entra en remisión. Puede preceder la aparición de los síntomas de LES 6 meses a 1 año. El 80% de las ocasiones, se encuentra asociado al anticuerpo anti RNP (ribonucleoprotreínas), ya que ambos comparten epítopos8,11,13,14.
Anti-RNP o Anti-SM-RNP (Anti-ribonucleoproteína): Este anticuerpo da un patrón moteado en los ANA y su principal epítopo reconocido es U1. Se encuentra en casi 100% de los pacientes con enfermedad mixta del tejido conectivo. También puede estar presente en un 25-47% de los pacientes con LES, en un 24% de los pacientes con polimiositis o esclerodermia, en un 2-4% de los pacientes con esclerosis sistémica y en un porcentaje menor en aquellos con fenómeno de raynaud13,14.
Anti-SSA (Ro): Puede dar un patrón nuclear moteado fino en los ANA, pero en caso de ausencia de positividad ANA, no se puede descartar su presencia. Este anticuerpo se dirige contra dos proteínas distintas: Ro52 y Ro60. En un 50% de los casos se encuentra asociado a Anti-SSB (La). Su importancia radica en la alta asociación con síndrome de Sjögren, ya que está presente desde un 60 a 97% según la cohorte estudiada, además puede aparecer cuatro años antes de los síntomas del sindrome de Sjögren.
Por otro lado, se observa en LES en un 25-30% de los casos; el clínico debe saber que este auto-anticuerpo se asocia, junto a anti SSB (La) a la aparición del “lupus neonatal”, que se produce por traspaso de anticuerpos de la madre al feto durante el embarazo. El principal compromiso observado en estos niños, es el cardíaco, específicamente el bloqueo auriculo- ventricular completo, por un daño directo de los auto-anticuerpos sobre las vías de conducción cardiaca fetales, principalmente entre las 18-26 semanas. El riesgo de que el primer hijo de una madre portadora presente este cuadro es de 2-3%. Pero una vez ocurrido el primer caso, el riesgo asciende hasta un 16%. Debido a que la mayor parte de las madres Ro (+) son asintomáticas, en el caso de bloqueo AV neonatal, miocarditis, alargamiento QT o LES neonatal, se sugiere realizar un perfil ENA a la madre11,13.
Anti-SSB (La): Auto-anticuerpo contra RNA polimerasa III, coexiste con Anti-Ro; por lo que se considera que La es un epítopo por expansión. Este anticuerpo se encuentra presente en un 75-90% de los casos de lupus neonatal. Se observa en el síndrome de Sjögren en un 75-90% y se correlaciona con mayor compromiso extraglandular, principalmente renal, pulmonar y hepático. Además está presente en un 6-35% de los pacientes con LES, asociándose al sindrome de Sjögren secundario. Precede de 2,5 a 3,2 años a los síntomas de LES y al igual que anti-Ro, precede cuatro años a los síntomas clínicos del sindrome de Sjögren11,13.
Anti-SCL70: Este auto-anticuerpo está dirigido contra la topoisomerasa I del ADN. Su importancia radica en su alta asociación (70%) con esclerosis sistémica variedad difusa y al 36% de los casos de esclerosis sistémica variedad limitada; con una especificidad cercana al 100%13–15. Se ha observado que, desde la aparición del fenómeno de Raynaud hasta el diagnóstico de esclerosis sistémica transcurren en promedio 2,4 años. La presencia de este anticuerpo se asocia a mayor riesgo de enfermedad pulmonar intersticial, afectación articular y muscular, crisis renal hipertensiva y proteinuria15. Debido a esto, es un marcador de mal pronóstico y menor supervivencia. Los títulos suelen asociarse a la actividad de la enfermedad, pero no se recomienda su uso para seguimiento. Generalmente se considera que es mutuamente excluyente con el anticuerpo anti centrómero, también presente en ES; pero en un estudio de 2002, de 5423 pacientes con esclerosis sistémica, 30 tenían ambos anticuerpos (0.52%), lo que asoció a presentación difusa con mayor afectación cutánea y visceral16,17.
Anti Jo-1: A diferencia de los otros anticuerpos descritos, éste se encuentra dirigido contra la histidil-tRNA sintetasa y se asocia a un patrón citoplasmático granular fino en ANA. Su presencia se observa en un síndrome denominado “Síndrome anti-sintetasa” en que coexisten: miositis, enfermedad pulmonar intersticial, artritis/artralgias, fenómeno de raynaud y lesiones cutáneas hiperqueratósicas, escamosas y fisurada en manos, denominadas “mano de mecánico”. Presente en un 90% de los pacientes con enfermedad pulmonar intersticial, a un 20% de las polimiositis/dermatomiosistis; además que es un factor predictor de mala respuesta al tratamiento y alta mortalidad13,14. Tabla 5.
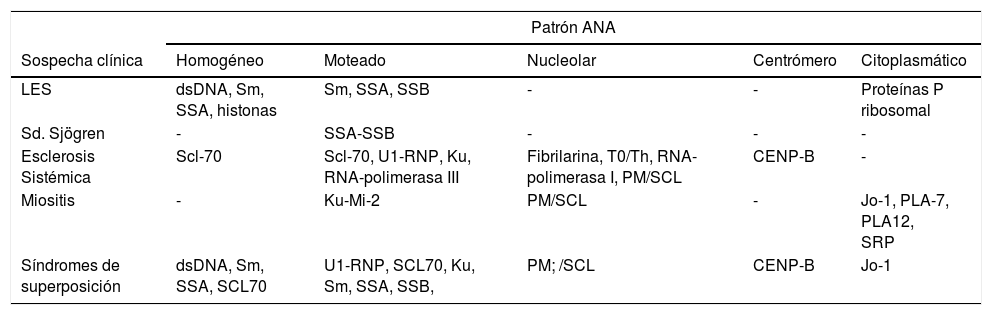
Relación entre los patrones de ANA en IFI y los auto- anticuerpos ENA observados en distintas patologías
| Patrón ANA | |||||
|---|---|---|---|---|---|
| Sospecha clínica | Homogéneo | Moteado | Nucleolar | Centrómero | Citoplasmático |
| LES | dsDNA, Sm, SSA, histonas | Sm, SSA, SSB | - | - | Proteínas P ribosomal |
| Sd. Sjögren | - | SSA-SSB | - | - | - |
| Esclerosis Sistémica | Scl-70 | Scl-70, U1-RNP, Ku, RNA-polimerasa III | Fibrilarina, T0/Th, RNA-polimerasa I, PM/SCL | CENP-B | - |
| Miositis | - | Ku-Mi-2 | PM/SCL | - | Jo-1, PLA-7, PLA12, SRP |
| Síndromes de superposición | dsDNA, Sm, SSA, SCL70 | U1-RNP, SCL70, Ku, Sm, SSA, SSB, | PM; /SCL | CENP-B | Jo-1 |
Adaptado de: Autoimmun Rev. 2006 Jan;5(1):10-7. Epub 2005 Jun 13.
Corresponden a auto-anticuerpos dirigidos contra antígenos propios que se encuentran en los gránulos citoplasmáticos de neutrófilos y monocitos.
Se detectan en forma cualitativa por Inmunofluorescencia Indirecta (IFI) en neutrófilos humanos con fijación de etanol y formalina. De manera cuantitativa por técnica de enzimoinmunoensayo (ELISA) es posible medir auto-anticuerpos anti-PR3 (Proteinasa-3) y anti-MPO (Mieloperoxidasa de neutrófilo).18–20. (tabla 6)
Patrones ANCA y patologías asociadas
| Patrón ANCA | Patología | Prevalencia según enfermedad |
|---|---|---|
| c-ANCA (Anti- PR3+) | Granulomatosis de Wegener | 70-95% |
| Síndrome de Churg Strauss | 30% | |
| Poliangeítis microscópica | 20-30% | |
| Glomerulonefritis rápidamente progresiva | 8% | |
| p-ANCA (Anti-MPO+) | Glomeruonefritis con semiluna idiopática | 65% |
| Poliangeitis con granulomatosis eosinofílica | 30-60% | |
| Poliangeitis microscópica | 45-60% | |
| Poliangeitis con granulomatosis | 10-24% |
En la IFI en neutrófilos humanos, se observan distintos patrones de fluorescencia que determinan tres tipos de ANCA:
- -
c-ANCA: patrón citoplasmático
- -
p-ANCA: patrón perinuclear
- -
a-ANCA: patrón atípico
Fijados en etanol y formalina se observa una tinción citoplasmática de los neutrófilos. En un 90% de los casos se asocia a anticuerpos anti-PR3, determinados por ELISA. Otros antígenos pueden ser la elastasa, catepsina G y lactoferrina. Es importante señalar que hasta un 2% de los casos puede presentar anti-MPO (+)20–22.
p-ANCAEn etanol se observa tinción perinuclear de los neutrófilos, cuando se realiza en formalina, se observa fluorescencia citoplasmática, lo cual confirma el patrón p-ANCA. En un 89-90% de los casos se asocia a anticuerpos anti-MPO medidos por ELISA. Otros antígenos que se pueden observar son PR3, elastasa, lactoferrina, catepsina G.20–22.
a-ANCASe observa un patrón atípico, que no tiene relación específica con anti-MPO o anti-PR3. Se puede observar en vasculitis, pero también en infecciones crónicas, enfermedad inflamatoria intestinal, neoplasias, drogas entre otras. En estos casos se sugiere descartar sobre-posición con ANA.
Factor Reumatoide (FR) y Anticuerpos Anti-Péptido Citrulinado Cíclico (Anti-CCP)Factor Reumatoide corresponden a auto-anticuerpos dirigidos contra el fragmento Fc de una IgG, la más frecuente es de tipo IgM, pero se han descrito también del tipo IgG e IgA23.
Las técnicas más frecuentes para su medición son enzimoinmunoensayos, nefelometría o aglutinación por látex. En esta última, se recubren partículas de látex con anticuerpos IgG humanos que luego son enfrentados al suero del paciente, si este suero tiene anticuerpos que reconocen los fragmentos Fc, habrá aglutinación de las partículas de látex visible a simple vista. Se informa en títulos o en UI/ml dependiendo la técnica utilizada23,24.
La medición de FR clásicamente se asocia al diagnóstico de artritis reumatoide (AR), donde 75% a 90% presenta un FR positivo para IgM en títulos generalmente mayores a 20 UI/ml. Sin embargo, puede estar presente en otras enfermedades reumatológicas como síndrome de Sjögren, enfermedad mixta del tejido conectivo, LES, entre otras; además en infecciones crónicas como tuberculosis, endocarditis bacteriana, sarcoidosis, lepra, etc. Por último es posible encontrarlo en población joven sana hasta en un 5% a títulos bajos, elevándose a 20% en mayores de 60 años25.
Lo anterior refleja lo poco específico del factor reumatoide en el diagnóstico de AR, por eso en la actualidad existe otro auto- anticuerpo llamado anti-péptido citrulinado cíclico mucho más específico para el diagnóstico de artritis reumatoide en forma precoz27.
Los anti-CCP se miden a través de técnica de ELISA, se presentan en forma precoz en artritis erosiva y son altamente específicos (>90%) de AR, pudiendo estar presente incluso en AR seronegativas, además corresponden a un marcador pronóstico y de agresividad. Sin embargo, no son exclusivos de AR, están presentes en baja concentración en síndrome de Sjögren (10%), tuberculosis (7-30%), artritis psoriática (8-16%), entre otras26–28.
APROXIMACIÓN BÁSICA DE LABORATORIO EN EL ESTUDIO DE ENFERMEDADES ALÉRGICASLas enfermedades alérgicas han mostrado un aumento importante en las últimas décadas, el estudio de estas enfermedades tiene varias aristas dependiendo el tipo de manifestación clínica del paciente.
Para optimizar los exámenes complementarios es necesario distinguir entre reacciones de hipersensibilidad inmediata, es decir IgE mediadas y las reacciones por hipersensibilidad retardada mediada por inmunidad celular.
Además dado las características inmunopatológicas de estas enfermedades, existe la posibilidad de realizar estudio alergológico in vivo (prick test, test de parche, entre otros) e in vitro. A continuación se describen los exámenes de laboratorio de inmunología in vitro de uso frecuente en el estudio de patologías alérgicas.
Cuantificación de Inmunoglobulina E (IgE) totalLa IgE total sérica se puede medir por diversas técnicas: turbidimetría, nefelometría, ELISA. Y su reporte se puede hacer en Unidades Internacionales (UI) o nanogramos (ng) por ml (1 IU/mL=2.44ng/mL)29.
Su concentración va aumentado con la edad, siendo el valor normal en adultos menor a 100 ng/ml, sin embargo, es importante destacar que cada técnica utilizada entrega valores propios de normalidad29,30.
Su elevación nos refiere que el paciente puede tener una condición atópica, sin embargo, no es específico porque es posible encontrarla elevada en otras condiciones tales como desórdenes linfoproliferativos, parasitosis, infecciones como VIH, inmunodeficiencias primarias entre otras. Además si está en rangos de normalidad no excluye el diagnóstico de alergia.
Tiene utilidad específica en la sospecha y seguimiento de aspergilosis broncopulmonar alérgica y para evaluar a los candidatos a terapia con anticuerpo monoclonal anti IgE (Omalizumab)29,30.
Además es importante solicitarla al momento de evaluar IgE específica, pues valores muy elevados pueden arrojar resultados falsos positivos.
IgE alérgeno específicaEs el marcador serológico de elección para confirmar sensibilización alérgica en pacientes con historia sugerente y en los cuales no es posible el estudio in vivo con prick tests, tales como enfermedad generalizada de la piel, riesgo elevado de anafilaxia o cuando los pacientes están recibiendo tratamientos que no es posible suspender y que suprimen o interfieren la respuesta cutánea (antihistamínicos, antidepresivos tricíclicos, entre otros).
La primera técnica utilizada en su medición fue RAST (radioallergosorbent test), sin embargo actualmente existen múltiples ensayos basados en el concepto de inmunoadsorción. Esto significa que la IgE específica de interés se une al alérgeno en cuestión que se encuentra unido a una fase sólida o bien libre y luego de que se une la IgE específica se acopla a una fase sólida, de esta manera por lavado se elimina el resto de proteínas e IgE que no se unió en forma específica al alérgeno pegado a la fase sólida. Luego la IgE unida al alérgeno se cuantifica utilizando una anti-IgE humana monoclonal marcada con alguna sustancia que permita su medición (fluorocromo, enzima-ligando, radioisótopo)29,30.
Actualmente los ensayos de elección son los de tercera generación cuantitativos como ImmunoCAP e Immulite 200029,30.
La sensibilidad promedio de este test es de 70 a 75%, comparado con las pruebas cutáneas in vivo (prick test) y con los test de provocación alérgeno específicos que corresponden al estándar de oro. En este contexto su interpretación requiere una adecuada correlación temporal y clínica con el alérgeno sospechoso.
Triptasa séricaSu principal utilidad está dada para evaluar las reacciones anafilácticas y en el estudio de mastocitosis.
La triptasa es producida por mastocitos y basófilos, sin embargo los mastocitos contienen 500 veces más que los basófilos. Cuando los mastocitos se degranulan se libera en forma inmediata triptasa e histamina al medio extracelular. La medición de histamina es compleja pues se degrada rápidamente en cambio la triptasa es posible medirla entre 15 minutos hasta cuatro horas después de los síntomas de anafilaxia29,30.
Existe dos formas: α-triptasa y β-triptasa, la primera es secretada en forma espontanea por mastocitos y se encuentra elevada en mastocitosis, la segunda es liberada cuando el mastocito se degranula y se detecta en forma predominante entre los 15 minutos a dos horas de la reacción anafiláctica29–31.
Comercialmente existe un ensayo de “ImmunoCAP triptasa” que mide ambas formas en combinación, es decir triptasa total.
En la mayoría de los individuos el valor normal es menor a 5ug/L, sin embargo, el límite superior normal es 11,4 ug/L, niveles superiores han sido reportados por varios autores en casos de muerte por anafilaxia29–31.
APROXIMACIÓN DE LABORATORIO EN EL ESTUDIO DE ENFERMEDADES QUE AFECTAN AL SISTEMA HEMATOPOYÉTICO Y A LOS TEJIDOS LINFOIDESLas enfermedades que afectan al sistema hematopoyético y a los tejidos linfoides incluyen linfomas, leucemias, discrasias de células plasmáticas, síndromes mieloproliferativos entre otros. En este sentido el laboratorio de inmunología ofrece algunas herramientas que colaboran en la pesquisa, diagnóstico y seguimiento de algunas de estas patologías. A continuación se ilustran de manera general los exámenes más relevantes.
Electroforesis de proteínas e inmunofijaciónCorresponde a un estudio cualitativo y semi-cuantitativo de proteínas en distintos líquidos biológicos tales como suero, orina y líquido cefalorraquídeo (LCR).
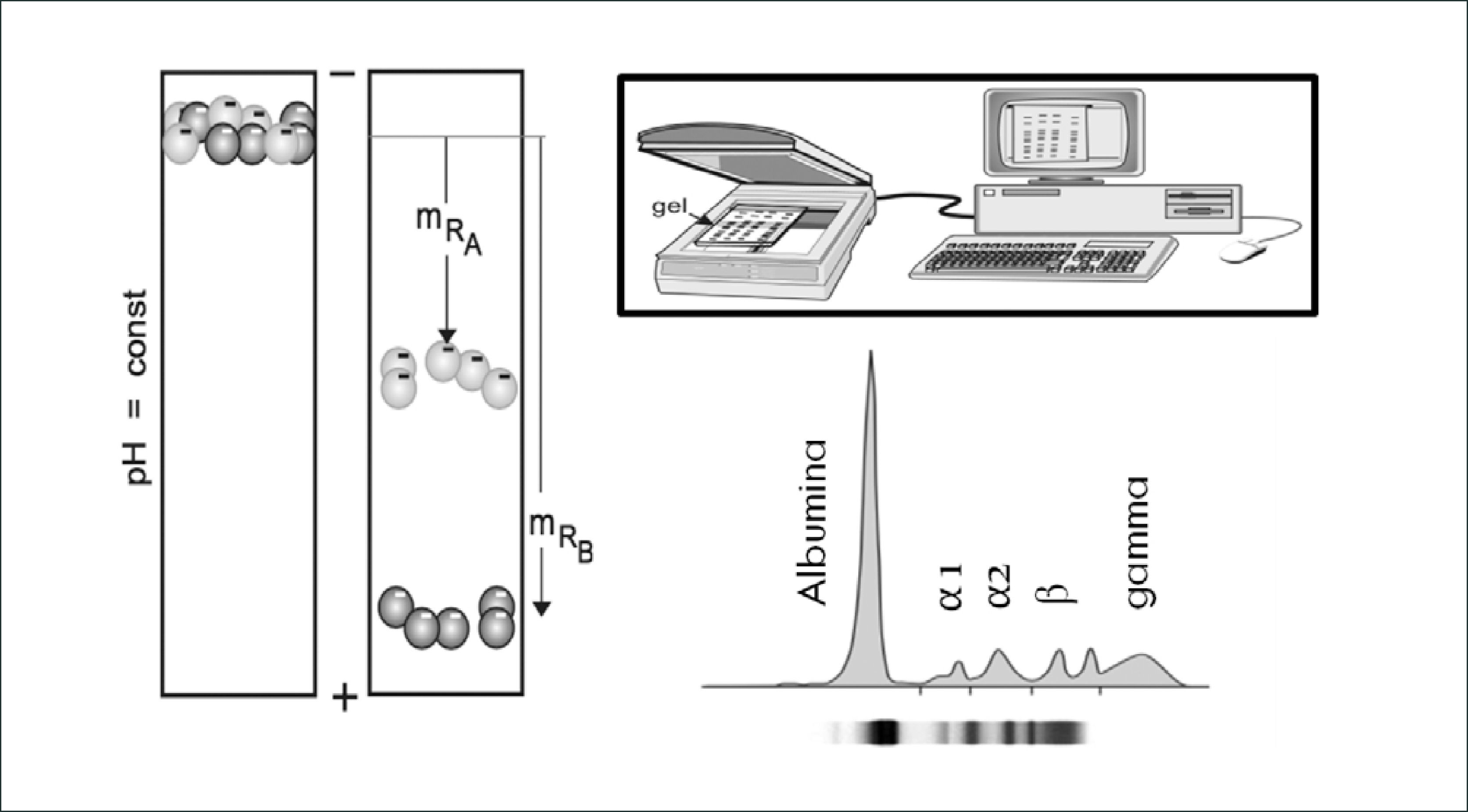
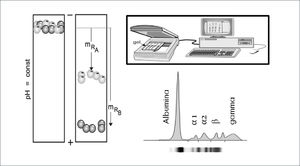
El principio básico de la electroforesis consiste en la migración de las moléculas a través de un gel o matriz de naturaleza porosa, en el cual, por acción de un campo eléctrico serán separadas de acuerdo a su carga eléctrica y peso molecular. Para observar el avance y la separación de las moléculas en la matriz y establecer un patrón de fragmentos, las moléculas son teñidas con diferentes colorantes. Estos pasos facilitan la visualización de las moléculas a manera de simples bandas, luego es posible realizar una medición semi-cuantitativa a través de un scanner densitómetro que mide el grosor de la banda electroforética y gracias a un software en donde se ingresa el valor de las proteínas totales en el suero analizado (rango normal entre 6,5 a 8g/dl) se realiza un cálculo matemático que entrega un valor aproximado de cada banda electroforética32. Figura 1.
La electroforesis de proteínas en suero en gel de agarosa clásicamente muestra 5 bandas proteicas: albúmina, fracción α1-globulinas, fracción α2-globulinas, fracción β-globulinas y fracción g-globulinas32.
Albumina: es la fracción más homogénea y la principal proteína del suero, es sintetizada en el hígado y en la electroforesis se puede observar disminuida (≤3,5g/dl) en diversos trastornos, tales como inflamación aguda, desnutrición proteica, nefropatías y enteropatías perdedoras de proteínas, entre otras.
Las fracciones α1, α2, β y g-globulinas son un grupo de diversas proteínas con funciones biológicas variables que proveen información importante sobre varias enfermedades órgano-específicas.
Fracción α1: encontramos antitripsina que se puede encontrar disminuida por una alteración genética que se manifiesta como EPOC de inicio precoz o bien puede estar aumentada en reacciones de fase aguda (inflamación aguda).
Fracción α2: destaca α2-macroglobulina que aumenta en síndrome nefrótico y haptoglobina que disminuye en hemólisis, déficit de B12 y déficit de folatos.
Región β: destaca transferrina que aumenta en anemia ferropénica.
Región g: clásicamente encontramos a las inmunoglobulinas (IgG, IgA, IgM, IgD e IgE), sin embargo en algunas ocasiones pueden migrar a la región β (sobre todo IgA). Se pueden observar disminuidas globalmente en inmunodeficiencias humorales o aumentadas en forma policlonal en inflamación crónica tal como ocurre en enfermedades autoinmunes, VIH entre otras.
Actualmente la observación de un único peak estrecho en la región gamma de la electroforesis en suero permite sospechar un aumento monoclonal de gammaglobulinas (paraproteina). Este hallazgo corresponde a proteínas electroforéticamente y antigénicamente homogéneas, producidas por un único clon de linfocito B/célula plasmática; que ha proliferado más allá de los mecanismos de control33. Tabla 7.
Descripción de patologías y otros hallazgos asociados a producción de proteínas monoclonales
| Desorden de células plasmáticas | Proteína Monoclonal | Células plasmáticas clonales en medula ósea | Daño tisular | Otros |
|---|---|---|---|---|
| Gammapatia monoclonal de significado incierto | <30 g/L | <10% | No | Sin evidencia de otros desórdenes linfoproliferativos |
| Mieloma Múltiple Silente | ≥30 gr/L | ≥10% | No | -- |
| Mieloma Múltiple | En suero y orina | ≥90% por citometría de flujo o plasmocitoma | Si: hipercalcemia, insuficiencia renal, anemia, lesiones óseas | Hiperviscosidad, amiloidosis, infecciones bacterianas recurrentes |
Adaptado de The International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. British Journal of Haematology, 2003, 121, 749–757.
La sospecha de un peak monoclonal en la región gamma es de gran utilidad pues constituye una herramienta en el diagnóstico y monitorización del tratamiento de gammapatías monoclonales malignas. Además permite el seguimiento de la evolución de componentes monoclonales de significado indeterminado. Por todo lo anterior es considerado un examen de primera línea en el estudio de las discrasias de células plasmáticas. Sin embargo este examen debe solicitarse en combinación con inmunofijación, el cual permite confirmar la monoclonalidad y caracterizar el tipo de cadena pesada y liviana que compone la paraproteína33.
InmunofijaciónPermite identificar la paraproteína específica de un patrón monoclonal. La técnica consiste en realizar una electroforesis tradicional en suero seguido de un marcaje con un antisuero específico contra las cadenas pesadas de IgG, IgA, IgM, IgE, IgD más las dos cadenas livianas kappa y lamba; luego una tinción específica para revelar las bandas reconocidas.
Generalmente como tamizaje (99%) se realiza marcaje solo para: IgG, IgA, IgM, kappa y lambda. En casos específicos (<1%) el laboratorio y/o médico tratante solicita marcaje de IgE e IgD32,33.
El informe es de carácter cualitativo describiendo el tipo de banda monoclonal encontrada.
Tanto la electroforesis como la inmunofijación se pueden realizar en orina si la sospecha de neoplasia de células plasmáticas es alta, de esta manera se mejora el rendimiento de estos exámenes.
Cadenas livianas libresLa mayoría de los desórdenes proliferativos de células plasmáticas presentan exceso de producción de cadenas livianas libres de inmunoglobulinas. Tradicionalmente la electroforesis e inmunofijación en suero y orina han sido el estándar de oro para la pesquisa de estos desordenes, además clásicamente las cadenas livianas se pueden detectar como cadenas libres excretadas en orina lo que es ampliamente conocido como “Proteinuria de Bence Jones”, pero este método se encuentra limitado por la función renal, además que requiere la recolección de orina de 24 horas. Por otra parte, un 15-20% de los pacientes con mieloma múltiple, sólo producen cadenas livianas libres monoclonales, las cuales pueden no ser detectadas por la electroforesis34.
En la actualidad se han desarrollado sistemas que permiten detectar estas cadenas livianas libres en suero mediante nefelometría o turbidimetría.
Esta técnica permite detectar cadenas livianas con mayor sensibilidad (hasta 1mg/L), cuantificarlas y calcular la razón kappa/lamba (k/ℓ). Para poder realizar una diferenciación con las gammapatías monoclonales, se utiliza la relación k/ℓ, cuyo valor normal fluctúa entre 0,26 a 1,65. Un índice k/ℓ alterado orienta a producción clonal de cadenas livianas, así proporciones mayores de 1,65 orientan a un exceso de cadena liviana k y un índice menor que 0,26 refleja un exceso de cadena liviana libre lamda34.
Actualmente las cadenas livianas libres en suero forman parte del tamizaje diagnóstico de las gammapatías monoclonales además permiten identificar factores de riesgo para progresión y realizar seguimiento de la remisión temprana de la enfermedad34.
CONCLUSIÓNDada la variedad de patologías que pueden afectar al sistema inmune, el estudio de laboratorio es muy variado, existiendo exámenes altamente específicos para confirmar diagnósticos y otros principalmente sensibles que ayudan en la pesquisa de patologías, lo más importante es una adecuada anamnesis y examen físico, de esta manera se optimiza el estudio de laboratorio.
Los autores declaran no tener conflictos de interés, en relación a este artículo.
Referencia no citada7.