El análisis del movimiento humano y más concretamente de la marcha, ha interesado a muchos desde tiempos remotos, llevando al desarrollo de diferentes métodos para su estudio. Con el avance de los tiempos, la introducción de los sistemas computacionales y los avances en la informática, se ha logrado obtener los modernos y sofisticados sistemas para análisis del movimiento humano disponibles en la actualidad. Una de las áreas más desarrolladas del estudio del movimiento, corresponde al estudio de la marcha humana normal y sus alteraciones. El análisis cuantitativo de la marcha es reconocido como una herramienta de investigación y enseñanza, además de tener grandes aplicaciones en el campo clínico para el estudio y tratamiento de sus alteraciones. Grandes avances han sido posibles en patologías tales como la parálisis cerebral, espina bífida y enfermedades neuromusculares, entre otras, al facilitar la comprensión de los mecanismos subyacentes de sus alteraciones, definir perfiles de evolución en el tiempo, orientar y controlar de manera más objetiva los tratamientos y sus resultados con una mirada funcional, determinando mejores resultados y optimización de los recursos. El objetivo del artículo es describir parte de la historia del desarrollo del análisis instrumentado de la marcha. Sus utilidades en el campo de la docencia, investigación y especialmente sus aplicaciones clínicas. Se describe el proceso de adquisición, requisitos para solicitud del estudio y sus aportes en el campo clínico en cuanto a definir perfil de comportamiento en el tiempo de diferentes enfermedades, tomar decisiones terapéuticas, controlar sus resultados en el tiempo y lograr una mejor optimización de los recursos.
Human movement analysis and especially gait analysis has interested many people since ancient times, leading to development of different methodologies for its study. With time progress; introduction and advances in computer systems, there have achieved modern and sophisticated systems for human motion analysis available today. One of the most developed areas in movement analysis is normal human gait and its alterations. Quantitative gait analysis is recognized as a teaching and investigation tool, besides having great applications in the clinical field for study and treatment of gait disturbances. Great advances have been possible in conditions such as cerebral palsy, spina bifida and neuromuscular diseases, among others, providing better understanding of alterations underlying mechanisms, defining disease evolution profiles over time, guiding and controlling treatments results with a functional point of view, leading to best results and resources optimization. The aim of the paper is to describe the history and the development of instrumented gait analysis. Its profits in the field of teaching, research and clinical applications. The acquisition process, requirements for application of the study and their contributions in the clinical field are described. Also the defining behavioral profile over time of different diseases, treatment decisions and their results over time and the better optimization of resources.
El análisis del movimiento humano y más concretamente de la marcha ha interesado a muchos desde tiempos remotos, existiendo referencias al respecto por parte de Aristóteles, Leonardo da Vinci, Hipócrates entre otros (1,2).
Otro pionero fue Eadweard Muybridge, fotógrafo e investigador inglés quien realizó importantes aportes al estudio del movimiento a partir del año 1860, mediante el uso de la fotografía seriada, la cual utilizó inicialmente para estudiar el galope de los caballos y determinar si en algún momento se mantenían sus cuatro patas separadas del suelo. Posteriormente realizó estudios en otros animales y en seres humanos. Marey realizó también estudios de movimiento en base a la fotografía y desarrolló un sistema simple para el análisis de presiones plantares (2). Con el tiempo los sistemas se fueron perfeccionando, junto con la introducción de sistemas computacionales y el mayor desarrollo informático, para lograr obtener los modernos y sofisticados sistemas disponibles en la actualidad.
El laboratorio de análisis de movimiento permite el análisis de diferentes tipos de movimientos humanos; no obstante el mayor desarrollo se ha enfocado en estudiar la marcha. Otros tipos de estudio de movimiento disponibles corresponden a análisis de función de extremidad superior, posturografía, estudios de estrategias motoras como “sit to stand”, actos deportivos o estudios ergonómicos. La tecnología del laboratorio de movimiento ha sido empleada también en el último tiempo en el desarrollo de películas animadas, permitiendo dar a sus personajes un aspecto más cercano a la realidad.
La marcha humana corresponde a una secuencia de movimientos coordinados y alternantes que nos permite desplazarnos. Es un proceso complejo que requiere el adecuado funcionamiento e interacción de diferentes estructuras tales como un sistema de control a cargo del Sistema Nervioso Central, palancas que provean el movimiento correspondiente a los huesos y fuerzas para mover las palancas a cargo del sistema muscular. Alteraciones a cualquiera de estos niveles puede determinar alteraciones de la marcha.
A diferencia de lo que ocurre en los animales cuadrúpedos en que el centro de masa se encuentra dentro de la base de soporte, la marcha bípeda propia de los seres humanos es inherentemente inestable, debido a que el centro de masa se encuentra elevado sobre la base de soporte, frente a la vértebra S2. El tronco constituye así una especie de pasajero que debe mantenerse erguido sobre las extremidades inferiores asegurando la mantención del centro de masa dentro de la base de soporte para mantener la estabilidad.
Las aplicaciones del laboratorio de marcha en el campo clínico se remontan a la década de 1960 en Norteamérica, con la creación del primer laboratorio de análisis de movimiento en el Hospital Shriners de San Francisco, por el Dr. David Sutherland (3), para estudiar las alteraciones biomecánicas de niños con parálisis cerebral. El Dr. Sutherland, cirujano ortopedista observó cómo había cambiado el panorama epidemiológico a consecuencia de los progresivos avances en la medicina a partir de la década de los años 40. Estos cambios determinaron la drástica disminución de las enfermedades infecciosas y la erradicación de la poliomelitis por el descubrimiento de los antibióticos y la creación de la vacuna anti polio. Simultáneamente la progresiva mejoría de los sistemas de salud, de los cuidados del embarazo y parto, más la creación de unidades neonatales, determinaron que niños prematuros que antes fallecían, eran capaces de sobrevivir. Desafortunadamente estos niños prematuros tenían y tienen hasta nuestros días un riesgo aumentado de parálisis cerebral, lo cual determinó su prevalencia por sobre las enfermedades observadas en años previos. El Dr. Sutherland observó que la aplicación de los procedimientos quirúrgicos utilizados en pacientes con poliomelitis y enfermedades infecciosas óseas y articulares no lograban mejorar las habilidades de marcha de los niños portadores de parálisis cerebral y por el contrario determinaban en muchos casos un efecto deletéreo en su condición funcional. Con el apoyo del laboratorio de análisis de marcha logró reconocer las causas que determinaban los problemas en la marcha de estos pacientes y desarrollar técnicas quirúrgicas acordes a las necesidades de estos. De este modo progresivamente los laboratorios de análisis de marcha fueron extendiéndose por Norteamérica y el resto del mundo.
Las actividades durante la marcha ocurren simultáneamente a diferentes niveles articulares y en diferentes planos, de modo que resulta difícil captar todos los elementos con el simple análisis observacional. Del mismo modo, las compensaciones que el paciente emplea en su marcha pueden ser enmascaradas y difíciles de diferenciar de las alteraciones primarias a simple vista. En este sentido, los sistemas de análisis de movimiento han ganado campo en la aplicación clínica del estudio de las alteraciones del patrón de marcha, en cuanto a identificar sus anormalidades, definir sus causas y orientar sus tratamientos, cuantificar el resultado de estos, realizar el seguimiento de la evolución a lo largo del tiempo.
Adicionalmente, en la actualidad el análisis cuantitativo de la marcha es ampliamente reconocido y aceptado como una herramienta de investigación y enseñanza.
ImplementaciónEl uso de esta tecnología altamente especializada debe ser dirigido por un equipo de personas altamente calificadas. La experiencia y adecuado nivel de conocimientos del equipo es esencial para la adecuada integración de la información aportada por el laboratorio de marcha. Los datos obtenidos en el laboratorio de movimiento siempre deben ser interpretados en conjunto con los antecedentes de la historia clínica, hallazgos al examen físico, exámenes complementarios y análisis observacional para definir las causas de las desviaciones en la marcha y proponer las posibles alternativas terapéuticas. No es posible concluir adecuadamente sin considerar todos estos elementos. De este modo la confiabilidad de los resultados obtenidos y la interpretación de estos puede fluctuar enormemente en base al nivel de conocimientos y experiencia de los evaluadores, en ocasiones más allá de lo deseable. Por esta razón los profesionales involucrados deben hacer un esfuerzo permanente por mejorar sus destrezas y disminuir las diferencias interobservador.
Proceso de adquisición de datosEl análisis instrumentado de la marcha corresponde al análisis de la condición clínica de marcha de una persona mediante el uso de tecnología altamente especializada.
El paciente es instrumentado mediante la colocación de marcadores pasivos reflectantes sobre la piel en relación a puntos de referencias óseos y de electrodos de superficie y/o aguja para registro de actividad electromiográfica, de acuerdo a protocolos estandarizados. El paciente es monitoreado por un sistema de medición mientras camina libremente a lo largo del sendero de marcha del laboratorio a velocidad autodeterminada. Este sistema de medición está constituido por un sistema optoelectrónico de cámaras infrarrojas y cámaras de videos convencionales ubicadas alrededor del sendero de marcha, plataformas de fuerzas empotradas en el piso y un equipo de registro de electromiografía dinámica (Figura 1). Algunos laboratorios disponen además de tecnología para el cálculo del gasto energético de la marcha y pedobarografía para estudio de presiones plantares.
Deben ser aportados al sistema, medidas antropométricas como peso, talla, largo y diámetros de segmentos anatómicos, necesarios para el cálculo de los centros articulares y los ángulos de movimiento articular. El sistema de medición del laboratorio de marcha debe ser calibrado diariamente y en ocasiones más de una vez cada día, dependiendo del tipo de estudio realizado y de las variaciones de estatura que puede haber entre los pacientes. Este aspecto es fundamental para asegurar la calidad de las adquisiciones.
La información obtenida en el análisis de marcha corresponde a parámetros temporoespaciales, kinemática y kinética articular, más electromiografía dinámica; los cuales se detallan más adelante. Los valores obtenidos de estos parámetros deben ser interpretados en conjunto y comparados con la base de datos de individuos normales de cada laboratorio para identificar las anormalidades y postular las causas que las determinan.
Lo anterior se complementa con videos convencionales en planos sagital y coronal que dan una impresión global del patrón de marcha, facilitan la visualización de detalles y movimientos complejos multiplanares mediante análisis en cámara lenta, además de la posibilidad de obtener una vista ampliada de determinados segmentos del cuerpo como es el caso del pie.
El análisis de marcha en general es pobre en cuanto a la información entregada sobre alteraciones intrínsecas del pie, cobrando importancia
los análisis complementarios como examen físico detallado, análisis radiográficos y de videos.
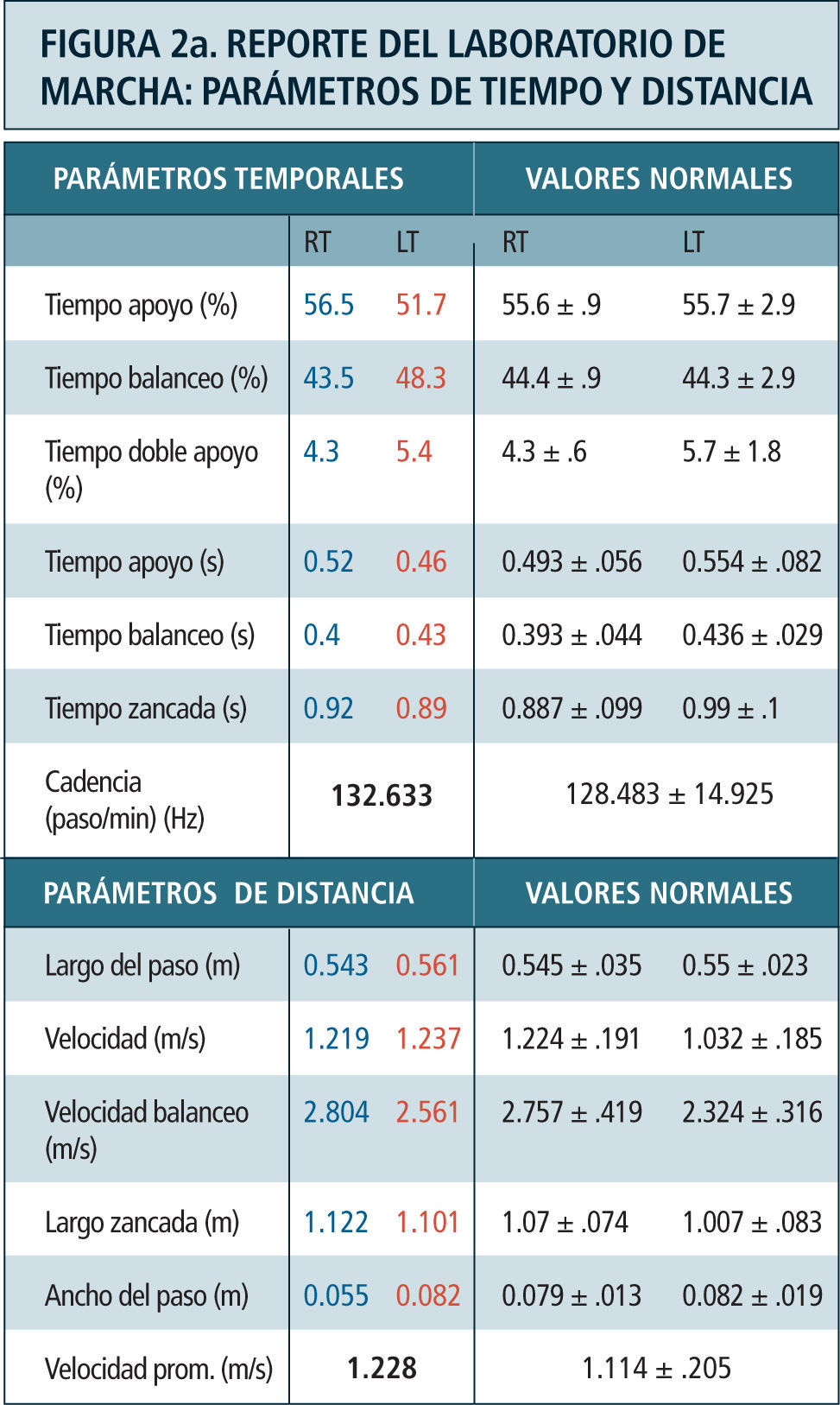
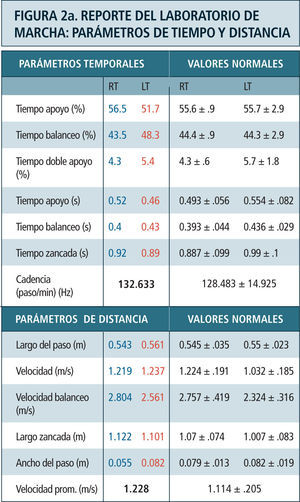
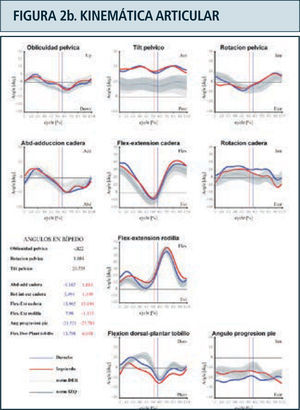
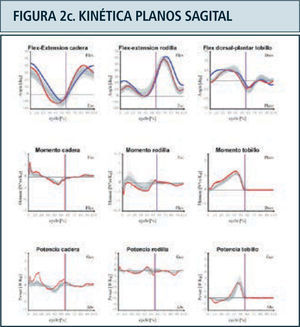
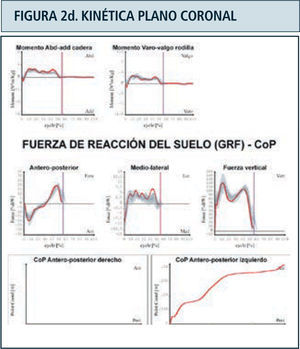
Como ya se mencionó previamente, los parámetros obtenidos en el laboratorio de marcha son (Figura 2):
- a)
parámetros temporoespaciales: Se refiere al cálculo de indicadores tales como la velocidad de marcha, largo de los pasos, cadencia (número de pasos por minuto), ancho del paso y duración de las fases del ciclo de marcha entre otros. Estos son calculados en base a los datos obtenidos de la posición de los marcadores.
- b)
Kinemática: Durante la adquisición del análisis de marcha el individuo camina libremente a lo largo del sendero de marcha del laboratorio, el cual está rodeado por un sistema especial de captura tridimensional compuesto por 6, 8 o 12 cámaras especializadas conectadas a un computador central. Estas cámaras cuentan con un lente central de captura y celdillas periféricas que emiten radiación infrarroja. La radiación infrarroja emitida, es reflejada por los marcadores ubicados sobre la piel del paciente y capturada por el lente central de las cámaras del laboratorio. Las imágenes provistas por el conjunto de cámaras es integrado y procesado por un programa matemático a nivel computacional para la obtención del movimiento articular tridimensional. El análisis kinemático, si bien define los ángulos articulares y movimiento de los segmentos en el espacio, no da cuenta de las causas que determinan ese movimiento.
- c)
Kinética: Corresponde a la medición de las reacciones producidas entre la fuerza ejercida por el peso del individuo sobre la tierra y la fuerza de reacción del piso (GRF). Contempla la medición de los momentos o torques y potencias articulares internos, el punto de aplicación de la GRF bajo el pie y sus tres componentes; vertical, mediolateral y anteroposterior. Aporta información complementaria a la kinemática al definir las causas qué determinan el movimiento articular a lo largo del ciclo de la marcha, es decir qué grupo muscular es el predominante en cada momento y que tipo de contracción muscular está ejerciendo; excéntrica o de frenado o concéntrica para generación de potencia. Define además la presencia de sobrecargas articulares anormales. Se adquiere a través de plataformas de fuerza empotradas en el piso del caminatorio sobre el cual el paciente camina. La información obtenida por las plataformas es integrada junto a la información kinemática, mediante un programa matemático basado en las leyes del movimiento de Newton.
- d)
Electromiografía dinámica: Es el registro de la actividad muscular “on-off”, es decir del momento en que se activan e inactivan los diferentes grupos musculares durante la marcha. Debe ser interpretada en conjunto con los hallazgos kinemáticos y de kinética articular para entender las anormalidades neuromusculares del paciente. Por ejemplo relacionar el movimiento articular observado con la activación de un determinado grupo muscular de acuerdo a la información aportada por datos de la kinética articular y electromiografía. Se registra a través de electrodos superficiales o de aguja en forma de un fino alambre en el caso de músculos profundos, colocados sobre diferentes grupos musculares. No representa ni puede ser homologada con la fuerza muscular, ya que no contempla una estandarización entre la medición de fuerza muscular y amplitud de señal electromiográfica observada.
Destaca en color azul valores lado derecho y en rojo el izquierdo. Ciclo de marcha representado en función del tiempo del 0 a 100%. Línea vertical ubicada alrededor del 60% representa momento del despegue del pie, dividiendo las fases de apoyo y balanceo. Franja en achurado gris representa rango de valores de normalidad. Examen correspondiente a paciente portador de idiopatic toe walking.
El estudio de análisis de marcha debe ser solicitado como un complemento a los antecedentes clínicos, hallazgos en el examen físico y otros exámenes realizados. El médico tratante debe señalar claramente cuáles son las dudas que desea resolver con la realización del estudio, de modo de poder enfocar de mejor manera la adquisición y conclusiones del examen. Como requisitos para solicitar un estudio en el laboratorio de marcha, deben considerarse:
- 1)
Edad sobre 4 años.
- 2)
Mínimo 1 metro de estatura.
- 3)
Buen nivel de colaboración de parte del paciente, por tratarse de un examen largo y que requiere adquisición de varias pruebas. Trastornos conductuales y compromiso cognitivo severo son contraindicación relativas.
- 4)
Paciente con capacidad de marcha, de modo que sea capaz de desplazarse por el sendero de marcha del laboratorio.
La marcha normal ha sido estudiada con la tecnología disponible del laboratorio de análisis de marcha, llevando a establecer la madurez del patrón de marcha en los niños y definir perfiles de marcha normales (4,5). Del mismo modo ha sido posible estudiar la marcha patológica, identificar patrones patológicos comunes y establecer sistemas de clasificación en distintas entidades clínicas que permiten objetivar la condición del paciente en un determinado momento, observar su evolución en el tiempo y en respuesta a las acciones terapéuticas (6–8). De este modo ha sido posible entender que las desviaciones de la marcha son en muchos casos “patología específicos”, siendo las causas subyacentes diferentes y por tanto deben tener un abordaje distinto en cada caso. De este modo no es posible aplicar los mismos principios para el tratamiento de las diversas patologías.
Las aplicaciones del análisis cuantitativo de la marcha tiene múltiples aplicaciones clínicas y detallarlas todas sería extremadamente extenso. A continuación se detallan algunas de las más frecuentes por la relevancia que han tenido sus aportes en el tratamiento de estas:
Parálisis cerebral: Se define como un grupo de desórdenes permanentes del desarrollo de la postura y el movimiento, causantes de limitaciones en la actividad que son atribuidos a alteraciones no progresivas que ocurren en el feto en desarrollo o en el cerebro infantil. Las alteraciones motoras de la parálisis cerebral se acompañan a menudo de trastornos de la sensibilidad, propiocepción, cognición, comunicación y conducta; por epilepsia y problemas músculo-esqueléticos secundarios (9). Estas manifestaciones comprenden problemas primarios derivados directamente de la lesión del sistema nervioso central como hipertonía piramidal o extrapiramidal, paresia muscular, alteraciones del control motor selectivo y del equilibrio. Los problemas secundarios corresponden a acortamientos músculo-tendinosos, retracciones articulares y torsiones óseas que se desarrollan lentamente a lo largo del tiempo y son derivados de los trastornos motores primarios y del crecimiento.
Muchos estudios han mostrado que la parálisis cerebral dejada a su libre evolución, sin tratamiento lleva al deterioro funcional de los pacientes, pérdida de condiciones de marcha y mermas en su calidad de vida. Dado que este resultado no es aceptable su tratamiento está plenamente justificado (10).
El laboratorio de análisis de marcha ha mostrado un rol fundamental en ayudar a comprender las alteraciones de la ambulación, planificar los tratamientos y controlar sus resultados en el tiempo. Esto ha marcado definitivamente un cambio en el tratamiento de la parálisis cerebral al introducir el concepto de cirugía ortopédica multinivel que reduce la necesidad de múltiples intervenciones, mediante la realización de correcciones sobre partes blandas y óseas en distintos niveles en un mismo acto operatorio. Esto disminuye los periodos de reposo, ausentismo escolar y rehabilitación, con mejores resultados y manejo más eficiente de los recursos. Varios estudios han reportado que el uso del laboratorio de análisis de marcha y movimiento influye en la toma de decisiones sobre las acciones terapéuticas con mejores resultados funcionales (11,12), logrando además retardar la edad a la que se realiza el primer procedimiento quirúrgico. Las ventajas de retardar la edad a la que se inician los procedimientos quirúrgicos radica en que permite al niño lograr la madurez del patrón de marcha, siendo más fácil reconocer las alteraciones que causan los mayores problemas y tomar mejores decisiones (13). La necesidad de reintervenir quirúrgicamente a los pacientes, es mayor mientras más tempranamente se inicien producto de la reproducción de deformidades, por efecto del crecimiento. Delp y cols (14) logró aportar evidencia de que los procedimientos quirúrgicos realizados sobre partes blandas, afectan la capacidad muscular de generar torques, de modo que los alargamientos musculares repetidos provocarían mayor paresia muscular, aspecto que debe ser evitado.
Otro importante aporte del análisis de marcha en la parálisis cerebral, es apoyar la toma de decisiones para el tratamiento de la espasticidad, ya sea mediante el uso intramuscular de toxina botulínica o la indicación de rizotomía dorsal selectiva (13). El adecuado control de la espasticidad como alteración primaria de la parálisis cerebral es determinante en la prevención de desarrollo de alteraciones secundarias tales como acortamientos músculo-tendinosos, retracciones articulares y alteraciones óseas torsionales.
Un importante aporte del estudio de la marcha, corresponde al apoyo en la evaluación de necesidades ortésicas, el control de su efecto en la marcha y la posibilidad de comparar diferentes configuraciones ortésicas para decidir la mejor alternativa basándose en mediciones funcionales más objetivas (15,16).
Muchos de los principios observados en la parálisis cerebral (diplejías y hemiparesias) son aplicables al daño cerebral adquirido tanto en niños como adultos. De este modo el análisis de marcha tiene también un rol de utilidad en el tratamiento de las alteraciones de la marcha en pacientes con secuelas de traumatismo encéfalocraneano y accidentes cerebro vasculares de diferentes grupos etáreos.
Marcha idiopática en punta de pies (idiopatic toe walking):Corresponde a una alteración de la marcha de etiología no precisada que se observa en niños neurológicamente sanos, sin antecedentes clínicos y con desarrollo psicomotor dentro de límites normales (17,18). La adquisición de la marcha ocurre a edad normal, pero presenta patrón en punta de los pies desde el inicio y se mantiene más allá de los 3 años de edad. Generalmente se asocia grado variable de acortamiento del tendón de Aquiles y son capaces de corregir su patrón de marcha en forma espontánea si se les solicita hacerlo. Lo anterior da cuenta de un control motor preservado, constituyendo una característica diferencial importante con respecto a otras patologías. Uno de los diagnósticos diferenciales principales es la parálisis cerebral tipo diplejía espástica en su forma leve.
Varios autores han utilizado el análisis de marcha para describir la marcha idiopática en punta de pies y realizar el diagnóstico diferencial con la parálisis cerebral. Hicks y cols (19) describieron el patrón kinemático de un grupo de niños portadores de marcha idiopática en punta de pies y los compararon con un grupo de niños con parálisis cerebral. Las alteraciones principales fueron observadas a nivel de los tobillos, caracterizada por un aumento de flexión plantar durante las fases de apoyo y balanceo. La kinemática a nivel de la rodilla mostró un comportamiento diferente en ambos casos, determinado por tendencia a la hiperextensión de la rodilla durante la fase de apoyo en la marcha idiopática en punta de pies, mientras que en los casos de parálisis cerebral el hallazgo predominante era flexión a este nivel durante la misma fase. Kelly y cols (20) describió comportamiento dentro de límites normales del punto de vista kinemático a nivel de rodillas en niños con marcha idiopática, mientras que los niños con parálisis cerebral leve mostraban frecuentes alteraciones kinemáticas en el plano sagital. Adicionalmente destacó hallazgos característicos a nivel de tobillos durante la fase de balanceo caracterizados por incursión normal hacia la dorsiflexión en el balanceo inicial y medio para favorecer el avance del pie, no obstante hacia el final de esta fase se observaba una desviación hacia la flexión plantar que era mantenida hasta el siguiente contacto inicial, realizando el contacto con el piso con el antepie. Westberry y cols (21) estudiaron 51 niños con diagnóstico establecido de marcha idiopática en punta de pies con el fin determinar los hallazgos kinemáticos y kinéticos y comprobar en forma objetiva si estos pacientes lograban efectivamente corregir su patrón de marcha en forma voluntaria. Como resultado lograron identificar características diferenciales evidentes en la marcha niños con marcha idiopática en puntas v/s portadores de parálisis cerebral, a la vez que hicieron evidente la capacidad de corregir parámetros kinemáticos y kinéticos de la marcha a demanda en la mayoría de los niños con esta alteración. Algunos investigadores han utilizado el análisis de marcha para objetivar perfil temporal de la alteración, hasta la edad adulta, incluyendo casos de evolución espontánea y otros sometidos a diferentes tratamientos ya sea conservadores o quirúrgicos mediante alargamiento de flexores plantares (18,22–25). De este modo ha sido posible establecer la evolución satisfactoria del cuadro en la mayoría de los casos.
Alvarez y cols (8) propuso una clasificación de la marcha en niños con marcha idiopática en punta de pies basada en parámetros kinemáticos y kinéticos del laboratorio de marcha, estableciendo diferentes grados de severidad de la alteración y alternativas terapéuticas en cada caso. Si bien no es una clasificación ampliamente aceptada es una buena aproximación objetiva al problema.
En suma el análisis instrumentado de la marcha permite establecer las alteraciones de la marcha en los niños portadores de marcha idiopática en punta de pies, establecer nivel de severidad de la alteración, realizar seguimiento en el tiempo y establecer diagnóstico diferencial con otras patologías, principalmente con la parálisis cerebral.
Espina bífidaLa incidencia de espina bífida ha ido disminuyendo significativamente a través del tiempo con la introducción de la suplementación con ácido fólico, el diagnóstico prenatal y el término del embarazo permitido en algunos países. También hemos observado cómo ha cambiado el manejo y opciones de tratamiento en estos pacientes en áreas de la neurocirugía, urología, ortopedia, rehabilitación y apoyos ortésicos.
En el campo de la ortopedia, los cambios han ido de la mano con la mejor comprensión de las alteraciones que afectan la marcha de estos pacientes con el apoyo de los estudios en laboratorio de marcha a partir de finales de la década de los 80 (26). Esto ha permitido la introducción de nuevas técnicas y dejar de lado aquellas que si bien tienen buenos resultados en otras patologías, no son siempre la mejor alternativa para estos pacientes. El objetivo del tratamiento será siempre lograr la mejor función y no solo proceder en base a las posibles alteraciones radiológicas observadas. El análisis de la marcha como herramienta de evaluación preoperatoria ha sido el gran paso en lograr esta evolución en el manejo ortopédico de los pacientes ambulantes con espina bífida.
El análisis kinemático y kinético de la marcha permite entender como estos pacientes son capaces de reclutar los músculos más potentes y compensar la función de los más insuficientes.
Varios investigadores han estudiado los patrones de marcha en pacientes con mielomeningocele, (manifestación más frecuente de la espina bífida) con niveles lumbares y sacros, logrando establecer patrones característicos para cada nivel en que las alteraciones observadas reflejaban claramente las deficiencias musculares observadas. A medida que el nivel motor va descendiendo y hay mayor musculatura activa, la marcha va asemejándose cada vez más al patrón normal (27–29). De este modo similar a lo observado en la parálisis cerebral, es posible identificar en la marcha de los pacientes portadores de mielomeningocele alteraciones primarias derivadas directamente del daño de estructuras neurales. Esto es por el defecto del cierre del tubo neural, alteraciones de tipo compensatorias para hacer más eficiente la marcha y suplir la función de la musculatura más afectada, además de alteraciones ortopédicas secundarias a desbalances musculares y torques anormales sobre el esqueleto.
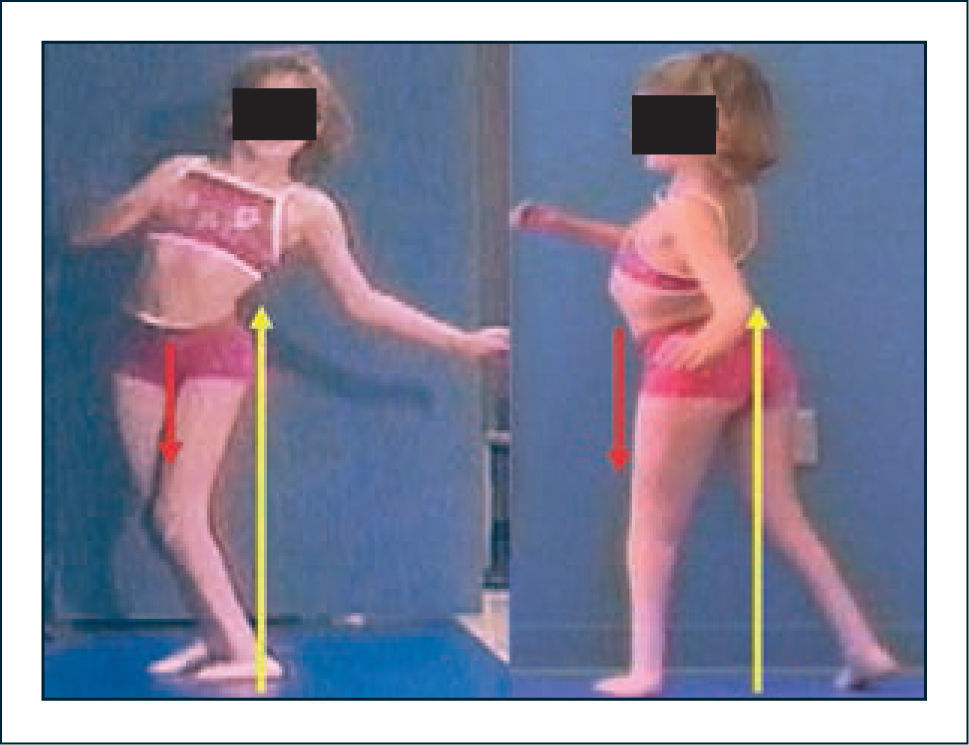
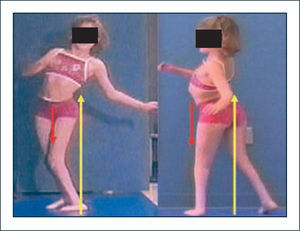
Las alteraciones compensatorias mencionadas, si bien logran mejorar la eficiencia de la marcha, tienen a veces efectos deletéreos en cuanto a generar stress anormal sobre estructuras articulares (30–32). Así se ha logrado entender por ejemplo que el aumento de la movilidad del tronco en el plano coronal y sagital observado en pacientes con niveles lumbares no es una consecuencia de movimientos a nivel de las extremidades sino por el contrario un mecanismo compensatorio para suplir la insuficiencia de los extensores y abductores de caderas respectivamente (33). Gracias a estos mecanismos el paciente logra desplazarse, pero a expensas de generar gran sobrecarga sobre estructuras mediales de la rodilla con la posibilidad de desarrollar dolor y alteraciones degenerativas en el tiempo (32). Si a lo anterior se agrega flexión aumentada de rodillas durante la marcha debido a la falta de inervación de flexores plantares, se agrega un factor adicional de daño articular potencial por sobrecarga anterior (Figura 3).
Mielomeningocele
Mecanismos compensatorios en los planos sagital y coronal. La inclinación lateral del tronco permite compensar la insuficiencia de abductores de caderas, logrando estabilización excéntrica con los aductores. La inclinación posterior del tronco permite compensar la insuficiencia de extensores de caderas mediante estabilización excéntrica de flexores y estructuras capsulares anteriores de la cadera. Vector color amarillo representa a la fuerza de reacción al piso, mientras que el vector rojo representa el momento interno.
La comprensión de estos y muchos otros elementos propios de la marcha de estos pacientes permite tomar decisiones respecto a fisioterapia, órtesis, cirugías, y necesidad de ayudas técnicas como uso de bastones en base a parámetros más objetivos. En esto se basan indicaciones como el uso de bastones para atenuar el bamboleo pélvico y la sobrecarga mediolateral a nivel de la rodilla; mientras que el uso de órtesis tobillo pie permite dar estabilidad al tobillo, controlar el agazapamiento en la marcha y el stress articular anterior de las rodillas (34–36).
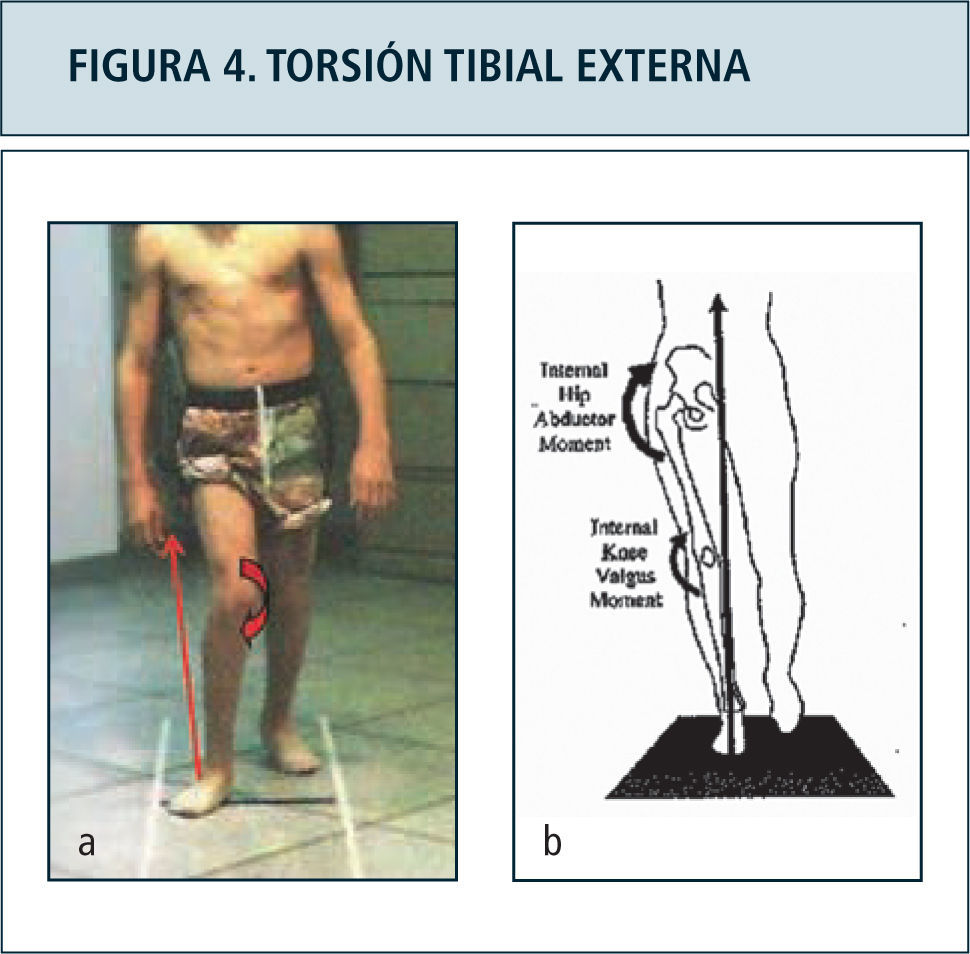
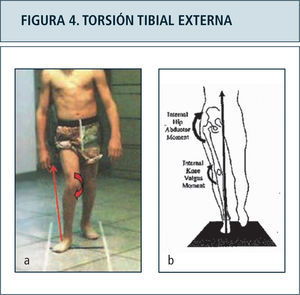
La indicación de cirugías ortopédicas también puede ser mejor orientada en base a parámetros objetivos aportados por el laboratorio de marcha, con criterio multinivel como lo descrito para parálisis cerebral. Ejemplo de lo anterior es el apoyo en la indicación de osteotomías desrotadoras de tibia para corrección de torsión tibial externa, en base al establecimiento de elementos de stress articular determinado por la redirección del vector de fuerza de reacción al piso hacia lateral y posterior (Figura 4). Este mismo efecto ha sido estudiado con respecto a la interferencia generada en la adecuada función ortésica. Vankoski y cols (37) determinaron el efecto de torsiones tibiales externas sobre 20° no logra ser contrarrestado por el uso de órtesis tobillo pie, siendo estas incapaces de controlar la flexión de la rodilla excesiva durante la fase de apoyo. Estos casos sugieren considerarse como candidatos a cirugía.
Figura 4a. Desviación lateral del vector de fuerza de reacción al piso, generando stress sobre estructuras mediales de la rodilla. El vector mal dirigido impide a la vez la adecuada extensión de la rodilla durante la fase de apoyo. Comparar con individuo normal, fgura 4b.
Figura 4b: Vector de reacción al piso normal en la fase de apoyo monopodal, en posición medial al centro articular de la cadera y rodilla.
Corresponden a un grupo de enfermedades determinadas por compromiso ya sea de la 2a motoneurona, raíces nerviosas, nervio periférico, músculos o la unión neuromuscular.
La manifestación preponderante es la debilidad muscular, asociada a hipotonía, atrofia muscular, hiporeflexia o arreflexia. En forma secundaria se asocian alteraciones posturales, de la marcha, retracciones articulares, deformidades de columna y problemas respiratorios. En algunos casos puede asociarse compromiso de otros órganos como corazón y cerebro.
Las alteraciones de la marcha de algunas de estas patologías han sido estudiadas con el apoyo del laboratorio de marcha, logrando establecer patrones característicos, perfil de marcha a través del tiempo, apoyar diferentes alternativas terapéuticas y medir sus resultados en base a parámetros objetivos (38–40). Ejemplos de lo anterior son la distrofia muscular de Duchenne y la atrofia muscular espinal que se caracterizan por presentar debilidad muscular proximal y distal progresiva resultando en la pérdida de la marcha. Del punto de vista clínico, ambas patologías muestran patrones de insuficiencia muscular similares en el análisis de fuerza muscular del examen físico; no obstante a través del análisis de marcha es posible constatar estrategias diferentes para favorecer la progresión hacia anterior. En base a esto destacan los aportes de Armand (39) quienes mostraron que mientras en la distrofia muscular de Duchenne se observa uso de la flexión plantar de tobillos e hiperflexión de las caderas, en la atrofia muscular espinal el avance en la marcha es potenciado por el aumento de las rotaciones pélvicas iniciado por movimiento del tronco para propulsar sus extremidades hacia anterior y alargar los pasos. De este modo ha sido posible entender la importancia de mantener la potencia muscular de flexores plantares y de cadera en el caso la distrofia de Duchenne y de flexores-abductores de caderas en el caso de la atrofia muscular espinal para conservar su habilidad de caminar. Cualquier intervención terapéutica debiera contemplar mantener la potencia de estos grupos musculares. Particularmente en el caso del Duchenne, la posición en equino del tobillo provee una ventaja para la marcha, debiendo potenciarse su máxima fuerza flexora plantar, aspecto relevante de considerar ante el planteamiento de eventuales cirugías de alargamiento de este grupo muscular para corrección del equino. Tan pronto como estos pacientes pierdan su capacidad de marcha, la fuerza muscular comienza a disminuir progresivamente, aumentan las contracturas articulares, aparece o aumenta la escoliosis y la función cardiopulmonar disminuye.
Para el caso de la distrofia muscular de Duchenne, Patte y cols (41) describieron las alteraciones en cuanto a parámetros temporoespaciales, kinemáticos y kinéticos en las diferentes etapas de la enfermedad. Así es posible identificar la secuencia de alteraciones a través del tiempo, aspecto útil al evaluar la progresión de la enfermedad y el efecto de alternativas terapéuticas, ejemplo el uso de órtesis o corticoesteroides, fármaco ampliamente aceptado para el tratamiento de esta patología.
Otras contribuciones se relacionan con la comprensión de mecanismos compensatorios para la mantención de la postura y marcha en pacientes con enfermedades neuromusculares. Lee y cols (42) mediante el apoyo del laboratorio de análisis de marcha describió el mecanismo compensatorio consistente en hiperextensión de la columna para lograr mantener la postura erguida y el balance sagital, ante la acentuada anteversión pélvica, fexión de caderas e hiperlordosis lumbar en una paciente con distrofa fascio-escápulo-humeral. En este caso los extensores de columna relativamente más potentes que los extensores de caderas, lograban suplir la insufciencia de estos, mediante la inclinación posterior del tronco. Este mecanismo ha sido también descrito para pacientes con niveles lumbares de mielome-ningocele debido a la frecuente asociación de extensores de cadera insufcientes. Gracias a este mecanismo logran estabilizar caderas pasivamente contra estructuras articulares anteriores a este nivel, sin necesidad de demandar la activación de extensores débiles.
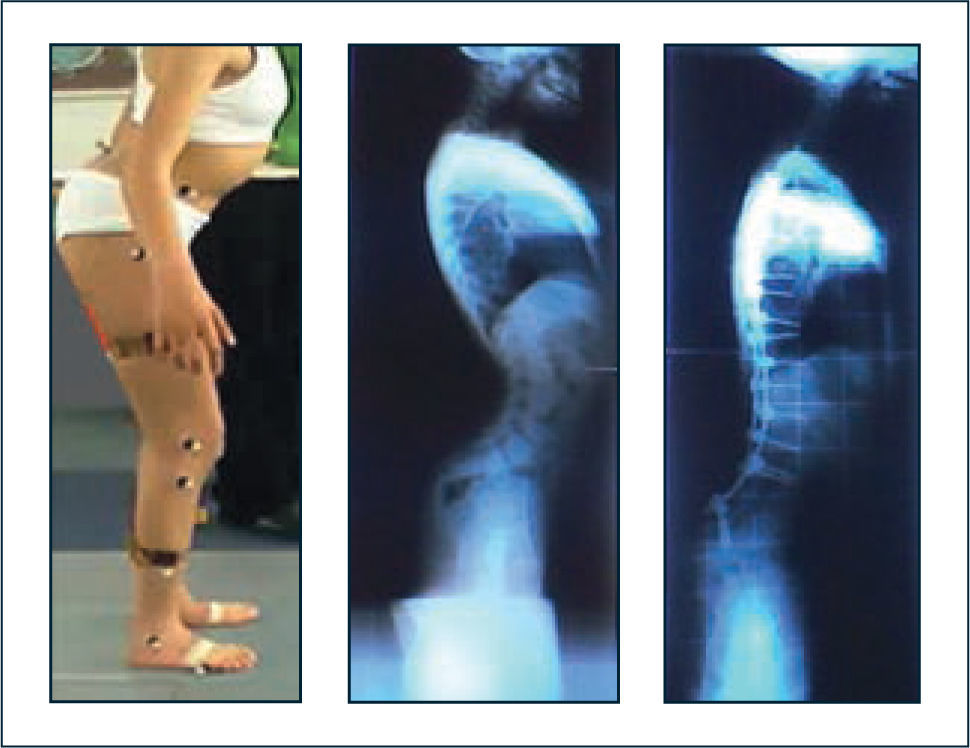
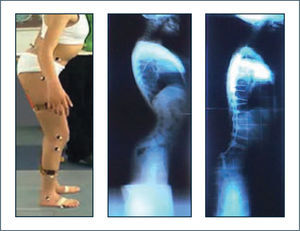
En el tratamiento de las deformidades espinales de las enfermedades neuromusculares es necesario considerar los aspectos anteriores en conjunto con los hallazgos radiológicos, con un abordaje orientado a mantener la función y el adecuado balance espinal sagital (42, 43). Se debe ser extremadamente cuidadoso con la indicación de órtesis de columna o cirugías que impidan la compensación de la insufciencia de extensores de caderas mediante la inclinación posterior del tronco, lo cual podría derivar en posición de inclinación anterior mantenida del tronco o “stooping” (Figura 5).
Enfermedad neuromuscular
Se muestra fenómeno de “stooping” o inclinación anterior mantenida del tronco, debido al bloqueo de la compensación mediante hiperextensión del tronco para mantener el tronco erguido sobre una pelvis muy antevertida por insufciencia de extensores de caderas. Se observa el resultado al bloquear el mecanismo descrito mediante artrodesis de columna. La inclinación anterior mantenida del tronco determina agazapamiento en la marcha.
En resumen, es posible decir que el análisis de marcha permite:
- 1)
Entender las alteraciones dinámicas de la marcha y diferenciar las causales primarias de las alteraciones secundarias y mecanismos compensatorios.
- 2)
Definir perfil de marcha en diferentes patologías.
- 3)
Ayudar en la planificación de los tratamientos con mejor optimización de los recursos.
- 4)
Aportar información para tomar decisiones con objetivos más realistas y aclarar expectativas sobre los tratamientos.
- 5)
Facilita la toma de decisiones quirúrgicas con criterio multinivel, reduciendo el número de veces que el paciente debe ser intervenido, sometido a anestesia y a periodos de rehabilitación.
- 6)
Medir los resultados de tratamientos conservadores y quirúrgicos con estimadores más objetivos y dinámicos.
- 7)
Hablar un lenguaje común que facilita el intercambio de experiencias entre diferentes centros.
- 8)
Es una herramienta ampliamente reconocida para docencia e investigación.
La autora declara no tener conflictos de interés, en relación a este artículo.