La incontinencia fecal (IF) es un problema complejo que afecta desde 2% de la población general, hasta un 45% de los pacientes de casas de reposo. Entre los factores etiológicos destacan causas traumáticas, neurológicas, congénitas e iatrogénicas, siendo uno de las principales, el trauma obstétrico. Resulta fundamental en el manejo de estos pacientes un enfoque multidisciplinario, no solo por la etiología multifactorial, sino porque suele asociarse a otras alteraciones del piso pelviano como prolapso ginecológico e incontinencia urinaria entre otros. Por estas razones puede resultar en una patología devastadora por sus consecuencias tanto sociales, psicológicas, de calidad de vida y económicas. La evaluación clínica resulta fundamental para orientar tanto el estudio como su manejo en forma integral. Existen múltiples opciones de tratamiento médico y quirúrgicas para el tratamiento de la incontinencia fecal. La rehabilitación pelviperineal es una de las estrategias más exitosas ya sea como tratamiento exclusivo o coadyuvante a la terapia quirúrgica. Dependiendo de la causa, la cirugía tiene indicaciones precisas, con resultados variables. La IF es un problema de difícil manejo; no hay un algoritmo único de estudio ni tratamiento, razón por la cual resulta fundamental el enfoque multidisciplinario en su tratamiento. El objetivo de este artículo es resumir los avances en el conocimiento de los mecanismos que conducen a la IF, como también la nuevas estrategias en el diagnóstico y tratamiento de esta patología.
Fecal incontinence (FI) is a complex problem that affects at least 2% of the general population, up to 45% of patients in nursing homes. Etiological factors include traumatic causes, neurological, congenital and iatrogenic, being one of the most frequent obstetrical trauma. It is essential in the management of these patients a multidisciplinary approach, not only because of its multifactorial etiology, more important, it is frequently associated with other pelvic floor disorders such as gynecological prolapse and urinary incontinence. For these reasons FI can adversely impact in terms of social, psychological, economics and quality of life. Clinical evaluation is essential to guide the study and management of the patients in a comprehensive manner. There are multiple options for treatment of fecal incontinence. Pelviperineal rehabilitation is one of the most successful strategies either as sole treatment or before surgical therapy. Surgical treatment has precise indications, with long term decay in terms of cure. The IF is a real challenge for the physicians, there is not a unique algorithm to study or treatment, so, is essential a multidisciplinary approach in these patients.
The aim of this paper is to outline the progress on the knowledge of the mechanisms leading to the IF, and discuss new strategies in diagnosis and treatment of this pathology.
La Incontinencia fecal (IF) es una patología que puede ser devastadora para quienes la padecen, asociándose a una disminución de la autoestima y reducción de la calidad de vida de los pacientes. La IF es la segunda causa de internación en hogares con cuidados de enfermería (1–4). La defnición de IF, más aceptada, porque no existe un consenso al respecto, es el paso incontrolable continuo o recurrente de deposiciones (> 10mL) de consistencia sólida, líquida y gases por períodos de al menos un mes, en pacientes mayores de 4 años. Desde el punto de vista clínico existen tres subtipos de IF: incontinencia pasiva que corresponde al paso involuntario de deposiciones o gas sin darse cuenta; urge incontinencia, que implica el paso de material fecal a pesar de un activo esfuerzo en tratar de retener las deposiciones; y ensuciamiento anal, que es la pérdida de pequeñas cantidades de deposiciones sin darse cuenta, seguido posteriormente de una evacuación de consistencia normal. Algunos autores han dividido la IF en menor cuando existe la presencia solo de un escape inadvertido de gases y deposiciones líquidas. La IF se considera mayor cuando existe la pérdida involuntaria de deposiciones sólidas. La falta de control en la eliminación exclusiva de gases no se considera dentro de la definición de IF, sin embargo esta condición igualmente requiere de un manejo y tratamiento adecuado (1).
EpidemiologíaAunque se trata de una patología frecuente, su prevalencia es variable dependiendo de la definición utilizada y de la población estudiada. Las cifras son difíciles de obtener por la reticencia y vergüenza de las/los pacientes que presentan este problema. Sólo un 1/3 de los pacientes con IF son capaces de discutir su sintomatología con su médico tratante. Estudios recientes muestran una prevalencia en la comunidad en rangos de 2 a 24%, dependiendo del grupo estudiado (2, 3). Sin embargo en pacientes institucionalizados, estudios tanto internacionales como nacionales describen una frecuencia del 30 al 45% (1, 2, 4). La edad es un factor a considerar al momento de evaluar la prevalencia de esta patología llegando desde un 2.6% en personas entre 20 a 29 años hasta un 15% en personas mayores de 70 años. Estudios han mostrado resultados conflictivos sobre una mayor prevalencia en mujeres en comparación a los hombres. En el hombre, el daño esfinteriano post cirugía ano rectal, la proctitis por radiación y la presencia de desórdenes sensomotores que afectan la sensación rectal, suelen ser las causas más frecuentes de IF. En la mujer la principal causa de IF es el daño esfinteriano de causa obstétrica, el cual suele manifestarse entre la 5º a 7º década de la vida. La razón del retardo en la manifestación clínica de esta injuria es aún desconocida, planteándose un probable rol del envejecimiento fsiológico y trastornos hormonales asociados a la menopausia (5).
Además de la edad, han sido identificados otros factores de riesgo, destacando la presencia de un estado de salud deteriorado, limitaciones físicas generales, radioterapia pelviana, alteraciones neurológicas, enfermedad pulmonar obstructiva crónica, síndrome de intestino irritable, incontinencia urinaria, resecciones colónicas y diarrea crónica (3, 6, 7).
FisiopatologíaLa continencia fisiológica depende de varios factores y procesos, que incluyen la función mental, indemnidad anatómica y funcional del aparato esfinteriano, consistencia y volumen de las heces, el tipo y velocidad del tránsito intestinal, la distensibilidad rectal, la función del esfínter anal, la sensación anorectal y los refejos anorectales (1, 2).
La IF aparece cuando se alteran los factores anatómicos y/o funcionales que mantienen la fisiología normal de la defecación (Tabla 1). La incontinencia habitualmente es el resultado de factores patogénicos múltiples y raramente puede ser atribuida a un solo factor. La pérdida de la continencia puede resultar de la combinación de una disfunción del esfínter anal, alteración de la distensibilidad rectal y/o disminución de la sensación rectal.
Causas de incontinencia fecal
| 1. Anormalidades estructurales: |
| Esfínter anal: |
| • Daño obstétrico, cirugía proctológica, dilatación anal, radiación, enfermedad inflamatoria intestinal. |
| Recto: |
| • Prolapso, hipersensibilidad/hiposensibilidad, neoplasia, anormalidades congénitas, descenso perineal excesivo. |
| Músculo Puborectal: |
| • Trauma, daño obstétrico. |
| Nervio Pudendo: |
| • Daño quirúrgico, descenso perineal excesivo. |
| Sistema nervioso: |
| • SNC, médula espinal, SNA: daño médula espinal, AVC, cirugía columna, diabetes, esclerosis múltiple, sífilis, cauda equina, neoplasia. |
| 2. Anormalidades de funcionamiento: |
| • Sensación anaorectal |
| • Daño obstétrico, daño SNC/SNA, diabetes. |
| • Impactación fecal |
| • Alteración del tracto de salida |
| 3. Características de las deposiciones: |
| • Volumen y consistencia |
| • Enfermedad inflamatoria intestinal, síndrome intestino irritable, fármacos, infecciones. |
| • Irritantes |
| • Malabsorción de sales biliares, laxantes. |
| 4. Otros: |
| • Movilidad física y función cognitiva |
| • Edad, discapacidad, demencia, sedación. |
| • Psicosis. |
| • Fármacos: laxantes, anticolinérgicos, antidepresivos, cafeína, relajantes musculares. |
| • Intolerancia alimentaria: Lactosa, sorbitol, fructosa. |
La disrupción o debilidad del Esfínter Anal Externo (EAE) se asocia a la presencia de urgeincontinencia y/o incontinencia asociada a deposiciones líquidas. Esta disminución de la presión del esfínter anal puede ser secundaria a un trauma anal (parto vaginal o cirugía anal), enfermedades neurológicas como diabetes o injuria de la médula espinal o enfermedades infiltrativas locales. Uno de los factores más importantes asociado a la IF es el daño esfinteriano post parto vaginal, el cual es habitualmente sub diagnosticado. El daño obstétrico puede comprometer el músculo puborrectal, el EAE y el Esfínter Anal Interno (EAI), así como causar neuropatía traumática del pudendo. La mayor parte de las pacientes que sufren este tipo de lesiones no presentan alteraciones de la continencia hasta después de los 50 años. Se ha señalado que al efectuar endosonografías o resonancia magnética de pelvis post parto vaginal, hasta un 30% de las primíparas y un 45% de las multíparas presentan alteraciones anatómicas del esfínter, sin embargo, solo un tercio de estas pacientes son sintomáticas. Es probable que la urgencia rectal asociada a trastornos del tránsito intestinal, más que el daño muscular, sea el principal factor de riesgo de IF en este grupo de mujeres. Los síntomas de IF se desarrollan generalmente seis semanas post parto vaginal siendo más frecuentes en los partos en que fue necesario el uso de fórceps. En el caso de daño del nervio pudendo, los síntomas de IF pueden aparecer años después del parto (8).
El daño post cirugía del esfínter puede resultar como consecuencia de una cirugía proctológica sobre el esfínter propiamente tal o sobre estructuras vecinas. Ejemplos incluyen la cirugía de fístulas, hemorroides, esfinterotomías por fisura anal crónica o infrecuentemente post inyección de toxina botulínica por fisuras anales refractarias a tratamiento médico. En pacientes con diabetes mellitus de larga data se ha observado una presión disminuida del EAI el cual puede resultar en IF. La diarrea secundaria a neuropatía autonómica también puede contribuir en la IF que refieren estos pacientes.
Por otra parte, la capacidad y habilidad del recto para percibir la presencia de deposiciones produce una respuesta refleja de contracción del aparato esfinteriano para mantener la continencia. La disminución de la distensibilidad rectal conduce a un aumento de la frecuencia y urgencia de los movimientos intestinales secundario a la pérdida de la capacidad del recto para almacenar las deposiciones. La proctitis, ya sea por una enfermedad inflamatoria intestinal o por radiación, está implicada en la alteración de la distensibilidad rectal y con ello puede producir IF, incluso con función esfinteriana preservada. Un número importante de patologías está asociado a un deterioro de la sensación rectal y con ello la posibilidad de causar IF. Entre estas destaca la diabetes mellitus, esclerosis múltiple, demencia, meningocele e injuria de la médula ósea.
En la población geriátrica, la impactación fecal es una causa frecuente de IF. Esta condición produce una constante inhibición de la presión del EAI (reflejo rectal inhibitorio) asociándose a una pérdida de deposiciones líquidas alrededor de la impactación. Dentro de los factores que pueden contribuir al desarrollo de impactación fecal se destaca el deterioro de la función mental, inmovilidad, hiposensibilidad rectal y una inadecuada ingesta de líquidos y fibras en la dieta.
La IF idiopática o de causa no precisada ocurre con mayor frecuencia en mujeres de edad media o mayores. Su mecanismo más probable es una denervación de los músculos del piso pélvico a expensas de un daño de los nervios pudendo y sacro como consecuencia de un parto vaginal prolongado, esfuerzo defecatorio patológico o anismo. El daño de los pudendos puede producir alteraciones en la sensación rectal y secundariamente impactación fecal y pseudodiarrea (8).
Factores de riesgoRecientemente, se ha sugerido la importancia de la alteración del tránsito intestinal en el desarrollo y evolución de la IF (10, 11). Bharucha y cols. (52) mostraron que en mujeres con IF de inicio tardío la alteración del tránsito intestinal se asociaba a esta patología. Mujeres que presentaban diarrea o síntomas de intestino irritable desarrollaban con mayor frecuencia IF comparados con controles. La diarrea sería un factor importante en el desarrollo de IF en mujeres, no así en hombres. Por lo tanto es importante la prevención o tratamiento de los trastornos del tránsito intestinal en el manejo de la IF.
El prolapso rectal interno, un marcador de debilidad del piso pélvico, ha sido sugerido como un factor en el desarrollo de IF. La prevalencia y severidad de esta condición está aumentada en pacientes con IF comparado con controles (9, 11, 12). La explicación de la contribución del prolapso rectal interno en la IF no está completamente aclarada, sin embargo una disminución de la presión del EAI, estimulación inapropiada del reflejo recto anal inhibitorio y una pérdida post defecatoria por un vaciamiento rectal inhibido han sido sugeridos en el desarrollo de la IF.
Otros potenciales factores han sido señalados, destacando el tabaco, cantidad de fibra en la dieta, índice de masa corporal y eventos adversos a fármacos. Recientemente, el tabaco (10) ha sido asociado a un efecto deletéreo sobre IF. Esta asociación sería independiente de la contribución del tabaco sobre la tos crónica o la EPOC, debido a que éstas producen IF, dado el aumento de la presión intraabdominal que ellas provocan. Diversos estudios han señalado los efectos deletéreos de la nicotina en el tránsito colónico y en la distensibilidad rectal. Pese a esta asociación, no se ha logrado demostrar que al suspender el hábito tabáquico la IF mejore. Por otra parte, Joh y cols. (13) han sugerido que una baja ingesta de fibras estaria asociado a la presencia de IF. La obesidad es reconocida como un factor de riesgo de IF, probablemente mediante el aumento de la presión intrabdominal y el debilitamiento del piso pelviano (1, 8).
Numerosos fármacos pueden alterar la consistencia y frecuencia de las deposiciones como también la función mental de los pacientes y con ello contribuir a la IF. Antiepilépticos, antidepresivos, opiáceos, antipsicóticos entre otros deben ser considerados al evaluar a estos pacientes. En resumen, la pérdida de la continencia fecal es el resultado de una disfunción del aparato esfinteriano, disminución de la distensibilidad rectal o una mayor sensibilidad del recto. Generalmente la IF es multifactorial, siendo los factores más importante los discutidos previamente.
DiagnósticoEs frecuente la asociación de esta patologia con otras alteraciones anatómicas y/o funcionales de la esfera urológica y ginecológica, lo que explica la necesidad de un enfoque multidisciplinario para su manejo. Para poder detectar estas patologias es fundamental un alto indice de sospecha y una anamnesis dirigida a otros síntomas agregados.
Resulta muy importante realizar una anamnesis detallada respecte a la IF, especificar la fecha de inicio, duración, intensidad de los síntomas, variabilidad en el tiempo, probables factores desencadenantes, historia obstétrica incluyendo número de partes – uso de fórceps, radiación pélvica, diabetes mellitus, enfermedades neurológicas, fármacos, etc. Como esta patologia es a veces difícil de abordar por parte del paciente, es importante el uso de cuestionarios defecatoriosy/o cartillas defecatorias (tabla 2).
Evaluación de pacientes con incontinencia fecal
| 1. Obtener Historia Clinica |
| ¿Tiene el paciente incontinencia? |
| ¿Cómo es su hábito intestinal? ¿Se ha modificado? |
| ¿Se asocia a cambios en consistencia de las deposiciones? |
| Tiempo evolución de los sintomas |
| ¿Se asocian a urgencia defecatoria? |
| Anamnesis remota |
| ¿Tiene el paciente historia de: impactación fecal, diarrea, radioterapia |
| pélvica, alteraciones neurológicas o uso de fármacos? Comorbilidades |
| 2. Examen fisico: |
| Examen fisico general |
| Evaluar (inspección) área anorectal. |
| Evaluar reflejo ano-cutáneo |
| Evaluar prolapso de hemorroides, recto u órganos genitourinarios. Tacto rectal. |
Es necesario clasificar el tipo de IF; determinando si esta es pasiva, asociada a urge-incontinencia, diarrea o historia de impactación fecal. Es necesario definir la presencia de incontinencia ya sea a heces sólidas, liquidas o gases como también el grado de sensación rectal.
El examen físico debe necesariamente incluir una inspección del área perianal y un examen de tacto rectal. Una adecuada inspección evaluará la presencia de fístulas, prolapso hemorroidal o rectal y dermatitis perianal, la cual sugerirá una IF crónica. La sensación perianal puede ser evaluada con el reflejo anocutáneo, su ausencia sugerirá un daño neurológico. El tacto rectal permitirá evaluar la presión del canal anal, descartar patología anal como impactación fecal, masas y disfunción del músculo puborectal. Se ha comparado el tacto rectal con la manometría anorrectal, demostrando que el examen físico es sensible y específico en la identificación de la disinergia y el tono normal, siendo de esta manera tan segura como la manometria en la evaluacin de la presión de reposo y contracción del canal, en manos de especialistas con experiencia (14, 15).
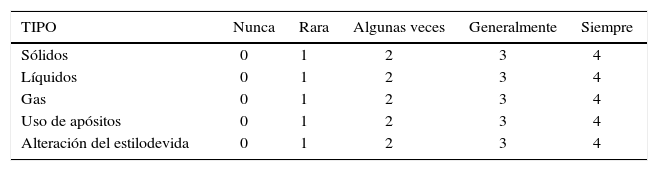
Escala de evaluación de severidad de la IFEn la actualidad existen múltiples escalas de severidad de incontinencia. Su utilidad se basa en objetivar el grado de incontinencia y poder comparar posteriormente el resultado de lostratamientos. Actualmente, la escala más usada es la escala de Jorge-Wexner, en la cual se incluye la frecuencia de los episodios de incontinencia, su relación con el tipo de deposiciones, incontinencia a gases y la necesidad de uso de paños o toallas higiénicas. Asimismo se incluye un item en relación al compromiso de calidad de vida producido por esta patologia (16). (Tabla 3).
Score de incontinencia de wexner
| TIPO | Nunca | Rara | Algunas veces | Generalmente | Siempre |
|---|---|---|---|---|---|
| Sólidos | 0 | 1 | 2 | 3 | 4 |
| Líquidos | 0 | 1 | 2 | 3 | 4 |
| Gas | 0 | 1 | 2 | 3 | 4 |
| Uso de apósitos | 0 | 1 | 2 | 3 | 4 |
| Alteración del estilodevida | 0 | 1 | 2 | 3 | 4 |
Nunca: 0.
Rara vez: menos de una vez al mes.
Algunas veces: menos de una vez por semana, pero más de una vez al mes.
Generalmente: menos de una vez al dia, más de una vez por semana.
Siempre: más de una vez al dia.
0: continencia perfecta.
20: incontinencia total.
La historia clinica y el examen fisico detectan un factor asociado a la IF sólo en el 11% de los pacientes, mientras los exámenes complementarios pueden revelar una anormalidad en el 66% de los pacientes. Además estos test pueden cambiar la estrategia terapéutka hasta en el 76% de los casos (5).
ColonoscopiaLa colonoscopia es necesaria en el estudio de todo paciente con diarrea crónica con el fin de descartar, asociado a estudio histopatológico, la presencia de una neoplasia, enfermedad inflamatoria intestinal, colitis microscópica, enterocolitis eosinofílica u otras colitis. Sin embargo, en pacientes con una historia de IF de larga data sin diarrea, este examen no es necesario si no es indicado por otras razones como es la pesquisa del cáncer colorectal.
Existen varios exámenes específicos que permiten definir los mecanismos asociados en el desarrollo de la IF. La selección de ellos dependerá de la probable etiologia, severidad del sintoma y el impacto en la calidad de vida.
Manometria anorectalLa manometria anorectal permite la evaluación de la presión del esfinter y los reflejos rectoanales. Una presión de reposo disminuida se correlaciona con una anormalidad de EAI y una presión de contracción voluntaria reducida con un defecto del EAE. Se ha descrito que la evaluación de la presión de contracción máxima posee la mayor sensibilidad y especificidad para discriminar pacientes con incontinencia. La tos permite evaluar la capacidad de contracción del EAE. Este reflejo está ausente en pacientes con lesiones de la cauda equina o del plexo sacra. El estudio con balón rectal permite evaluar la sensación y distensibilidad rectal. Un mayor umbral para la percepción sensorial del recto está asociado con una neuropatia diabética o una malformación anorectal neurogénica congénita. La distensibilidad rectal está a menudo disminuida en pacientes con IF, colitis, lesiones de la médula ósea baja y diabetes.
En la práctica, la indicación de manometria anorectal en pacientes con IF estaria justificada sólo en pacientes con síntomas de urge-incontinencia o con sospecha de alteración de la distensibilidad rectal (17).
DefecografiaEn la defecografia convencional, aproximadamente 150ml de medio de contraste es introducido por el recto para posteriormente pedirle al paciente que contraiga la musculatura pelviana y que realice maniobras de pujo y evacuación rectal. Dada la poca concordancia que existe entre los observadores al evaluar las diferentes mediciones, algunos han sugerido realizar un estudio por Resonancia Magnética (Defeco RM). Esta modalidad de estudio es la única que permite evaluar los esfínteres y las estructuras del piso pelviano en un tiempo real sin exposición a la radiación. Las desventajas de la Defeco RM son la disponibilidad y la falta de datos que permitan comparar pacientes sintomáticos con voluntarios sanos (9, 11).
Tiempo de latencia del pudendoLa latencia terminal del nervio pudendo mide la integridad funcional de la porción terminal del nervio pudendo y ayuda a distinguir si un esfinter débil es debido a injuria del nervio o a factores musculares intrinsecos. Un prolongado tiempo de latencia del nervio sugiere neuropatia del pudendo, trauma obstétrico o quirúrgico, descenso perineal excesivo o IF idiopática. Un tiempo de latencia terminal del nervio pudendo normal no excluye la neuropatia del nervio pudendo. Esta técnica es operador dependiente y posee una pobre correlación con los síntomas clínicos y hallazgos histológicos. Por esta razón habitualmente no es usado en la práctica clinica.
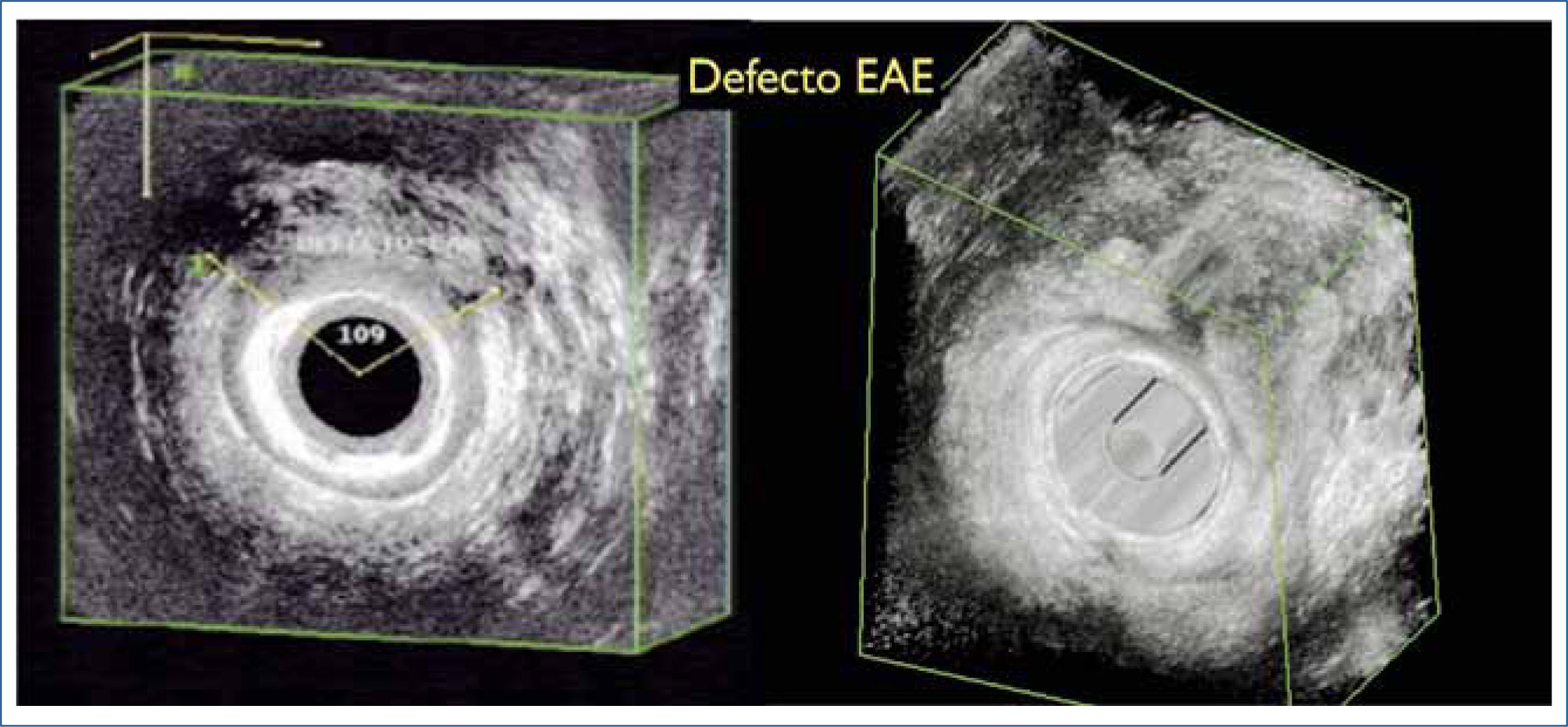
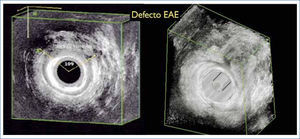
Endosonografía analLa aparición del estudio por imágenes con ecografía endorrectal significó un cambio cualitativo importante en la Coloproctología de los últimos 20 años. Este tipo de estudios ha ganado popularidad por ser mínimamente invasivo, indoloro, y costo/efectivo si se compara con otros estudios por imágenes (CT y RM). La endosonografia, además, es habitualmente realizada por un coloproctólogo y puede ser parte del examen fisico en la consulta (Figura 1).
Actualmente, este estudio se considera indispensable para el estudio de la IF (18).
El examen se basa en la visualización de las estructuras anatómicas anorrectales a través de las imágenes generadas por un transductor endoanal que gira en 360°, las cuales son manejadas por un software dedicado. El cristal del transductor vibra con una frecuencia variable entre 10 y 16 mHz, permitiendo evaluar las distintas estructuras, con mayor o menor profundidad y detaile.
El estudio de la IF con endosonografia implica la visualización del aparato esfinteriano de manera de evaluar su integridad anatómica y la presencia de defectos o disrupciones a nivel de los diferentes músculos que lo componen. Su uso está indicado para definir el grupo de pacientes con indicación de tratamiento quirúrgico (esfinteroplastía), en pacientes con antecedentes de trauma obstétrico y pacientes con antecedentes de cirugias previas. Asimismo se plantea su uso en pacientes con IF “oculta”, es decir pacientes aún asintomáticos, con antecedentes como los señalados anteriormente que van a ser sometidos a procedimientos quirúrgicos que pudiesen comprometer la continencia anal (19). Su uso está también indicado durante la inyección de sustancias de relleno en casos de incontinencia asociada a defectos del EAI, asi como el control de esta terapia en el seguimiento de estos pacientes. Por último, la endosonografia anal está indicada en aquellos pacientes que han sido sometidos a una esfinteroplastía y en quienes reaparece la IF, de manera de evaluar la integridad anatómica lograda con la cirugia. En la experiencia nacional se ha publicado que el 34% de los exámenes de endosonografia anal y rectal son realizados para estudio de la IF (20, 21).
La endosonografia anal permite evaluar y diagnosticar los defecto de cada uno de los componentes del aparato esfinteriano, encontrándose prácticamente un 100% de sensibilidad y especificidad en el tipo de defecto y un 81% de acuerdo interobservadores (22).
La endosonografia 3D, permite realizar un reconstrucción volumétrica de los tejidos, guardando en la memoria del sistema u “cubo” tridimensional de imágenes, con lo cual es posible reconstruir la anatomia y reevaluar las imágenes en tiempo real lasveces que sea necesario, lo cual permite un acuerdo interobservadores cercano al 100% (Figura 2 y 3) (23).
TratamientoEl tratamiento de la IF debe incluir e iniciarse con la educación y cambios de hábitos necesarios para disminuir la posibilidad de pérdidas involuntarias de deposiciones. Es asi como el tratamiento debe manejarse de acuerdo a la necesidad y expectativas del paciente, de su estado de salud y actividades habituales. Debemos tener en cuenta de que el objetivo principal del tratamiento es mejorar la calidad de vida de cada paciente, de acuerdo a su situación particular.
La primera fase, para todos los pacientes es la de implementación de dieta adecuada, modificar los hábitos de alimentación, y regular el tránsito intestinal. Deben evaluarse la necesidad y dosificación de aquellos medicamentos que puedan incidir en la presencia o empeoramiento de la IF
El uso de suplementos de fibra solubles que generen un bolo fecal adecuado puede ayudar en pacientes con diarrea leve y/o en pacientes con dificultad de vaciamiento y ensuciamiento post defecatorio (24). En el caso de incontinencia asociada a diarrea el tratamiento de esta es imperativa. Su tratamiento escapa a los objetivos de este artículo.
Rehabilitación pelviperinealLa Rehabilitación Pelviperineal (RPP) constituye la base del tratamiento actual de la incontinencia fecal. A partir de la década de los 80, se complementa el concepto de ejercicios especificos (Kegel) con otras técnicas y ejercicios adecuados a las disfunciones del piso pélvico (25).
La RPP debe incluye un evaluación inicial, el tratamiento propiamente tal y la terapia de mantención. Dentro de las herramientas más frecuentemente utilizadas se encuentran las técnicas de relajación, mejoría de la potencia muscular específica, biofeedback y electroestimulación. Esto requiere habitualmente de 10 a 12 sesiones en un periodo de 1 a 3 meses. Es importante que el paciente recupere la “localización” cortical (capacidad de contraer voluntariamente) del conjunto muscular pelviano, así como su capacidad de “disociación” a nivel de grupos musculares (capacidad de contraer sólo un grupo muscular específico). Asimismo, el uso de biofeedback es útil para mejorar la acomodación rectal y la sensibilidad rectal, factores de gran importancia en la fisiopatologia de la incontinencia fecal.
La revisión de la literatura muestra resultados dispares en cuanto al éxito de estas intervenciones. Heymen presenta una revisión de 35 estudios publicados entre los años 1973 a 1999, reportando mejoría entre el 65 al 75% de los pacientes (26). En la última revisión sistemática de la base de datos Cochrane se plantea que el biofeedback usando equipos computacionales, asociado a balones intrarrectales tendria mejor resultados que el uso exclusivo de ejercicios dedicados. Asimismo, esta revisión describe que los ejercicios anales, incluyendo estimulación eléctrica directa tendrían mejores resultados que la vía vaginal. Los 21 trabajos incluidos en la revisión usan distintos tipos de tratamiento, lo cual hace dificil su comparación. Sin embargo los trabajo más recientes muestran un incremento en los porcentajes de éxito (27).
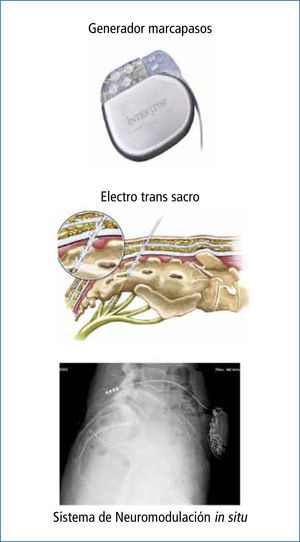
Neuromodulación sacraDentro de las terapias actuales más novedosas se encuentra la neuromodulación de plexo sacra (NMS). Esta técnica fue inicialmente descrita por Tanagho y Schmidt, en 1981 para tratar disfunciones urinarias (28, 29). En estos pacientes se observó que, mediante estímulos eléctricos de los plexos sacros, se producía una mejoría en sus hábitos defecatorios y en la continencia anal. Posteriormente es Matzel quien en 1995 la utiliza por primera vez en Incontinencia anal pura. Desde entonces se han publicado diversas series con muy buenos resultados (30)
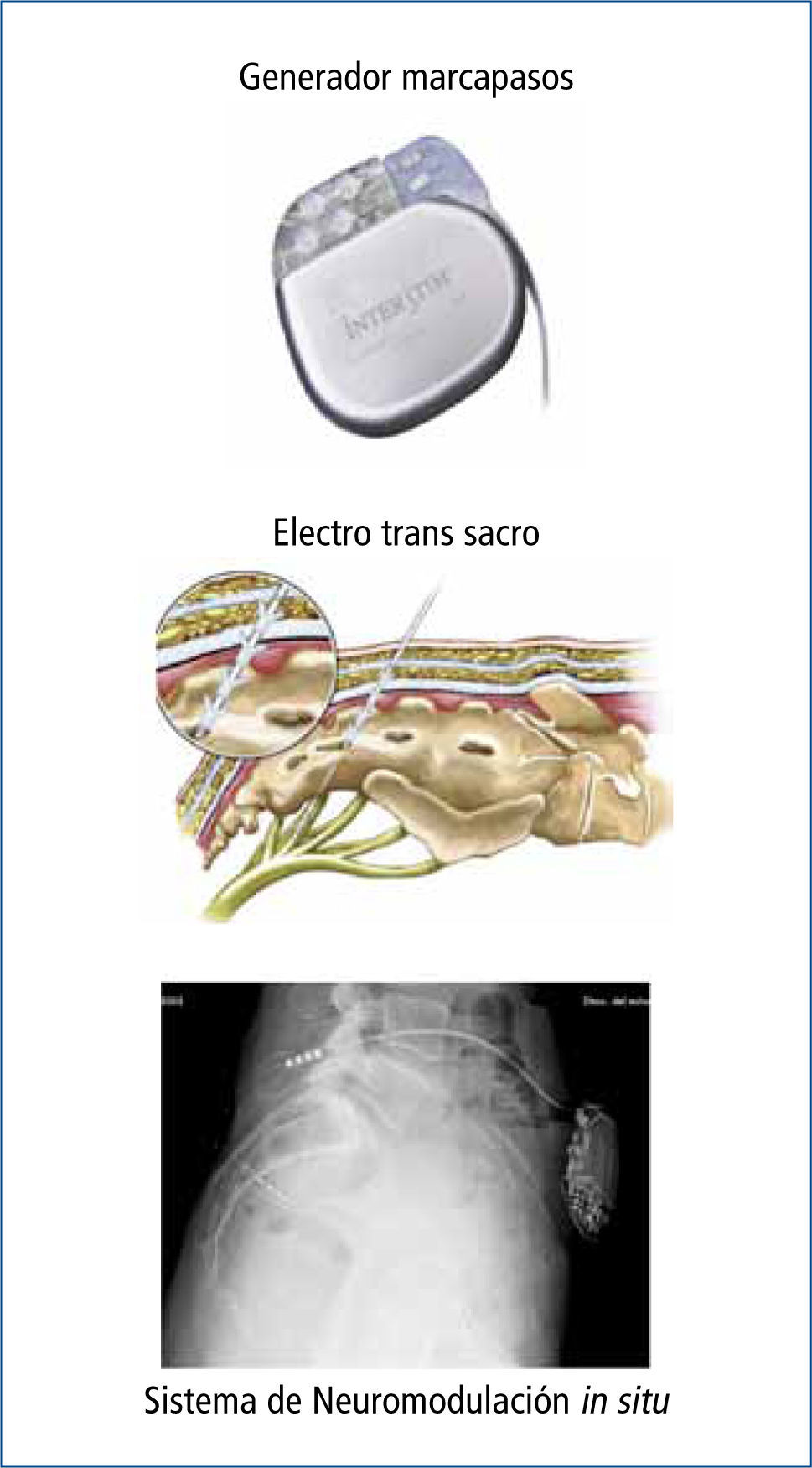
La NMS se realiza colocando un electrodo tetrapolar (Quadripolar Lead Kit Medtronic Interstim®, Minneapolis, Minnesota, United States), por punción percutánea, bajo visión radioscópica. El electrodo se conecta a un generador programable (Medtronic Interstim®, Minnesota, United States) (Figura 4).
El tratamiento consta de 2 etapasa) Fase temporal o de pruebaSe localiza una de las raices sacras S2, S3 o S4 y se estimulan durante un periodo variable de 5 días a 2 semanas mediante un estimulador externo.
b) Fase crónica, definitiva o terapéuticaColocación de marcapaso generador permanente neuroestimulador.
Sólo se pasa de una fase a otra si se objetiva mediante el diario de incontinencia una reducción de ésta en más del 50%.
La NMS actúa “modulando” las respuestas motoras, sensitivas y cognitivas asociadas al mecanismo de la defecación. Si bien es cierto aún no está claro el mecanismo preciso de su acción, la NMS puede mejorar la actividad muscular esfinteriana y conseguir un aumento de presión de reposo. Sin embargo, los mecanismos de acción de la NMS son más complejos. Se describe que el mecanismo de acción se debería a una modulación de los reflejos sacros, lo que originaría modificaciones en la contractilidad rectal y actuaría también sobre la sensibilidad y distensibilidad del recto.
La terapia de NMS fue aprobada por la Food and Drug Administration (EE.UU.) inicialmente para la incontinencia urinaria en el año 1999 y posteriormente en el 2006 para constipación crónica severa e incontinencia anal. Asimismo la comisión de salud de la Comunidad Europea (EMEA) aprobó su uso y se considera actualmente como terapia innovadora pero estandarizada no experimental, para el tratamiento de las patologías descritas.
En su inicio, los criterios de inclusión para la NMS se limitaban a la incontinencia fecal grave con integridad de la conducción nerviosa del pudendo y del esfínter externo. Actualmente se han ampliado sus indicaciones, no estando contraindicada con defectos esfinterianos menores al 50%.
La NMS está contraindicada en:
- •
Enfermedades de la zona sacra que afecten a la implantación del electrodo como la espina bifida o enfermedad dermatológica.
- •
Defectos esfinterianos con posibilidad de reparación quirúrgica.
- •
Grandes defectos que requieren reemplazo esfinteriano con graciloplastia o con el uso de esfinter anal artificial.
- •
Embarazo.
- •
Alteraciones de la coagulación.
- •
Pacientes portadores de marcapaso cardíaco o desfibrilador permanente.
Uno de los aspectos más interesantes de los estudios publicados es que un alto porcentaje (90%) de los pacientes que se benefician de la NMS temporal van a obtener el mismo beneficio en la fase permanente. Por tanto, la fase de prueba tiene una alta fiabilidad para predecir buenos resultados con la NMS a largo plazo. Por otro lado, un 22% de los pacientes no responde a esta terapia, lo cual puede ser detectado ya en la fase de prueba.
La estimuladón sacra no sólo disminuye la frecuencia de los episodios de incontinencia, sino que además consigue que el paciente sea capaz de diferir la evacuación hasta el momento más oportuno, mejorando su calidad de vida. Las complicaciones en la fase inicial o temporal son mínimas. Debe considerarse la NMS transitoria como prueba de elección para seleccionar los candidatos a la fase permanente.
La revisión de la literatura de los últimos años muestra la maduradón de la técnica, así como la “ampliadón” de sus indicaciones. Matzel, en su publicación del 2011, plantea que en el análisis de las series con más de 25 pacientes se observa que los resultados positivos se definen en relación tanto al número de episodios de incontinencia como al Score de Wexner. Todos los estudios señalan un mejoramiento significativo de la función esfinteriana, que es además reproducible, incluso en pacientes con grandes daños anatómicos, en seguimientos de hasta 74 meses. Matzel concluye que la NMS es hoy en dia una terapia efectiva en pacientes con un amplio espectro de causas de incontinencia y debe ser parte del algoritmo del manejo de IF (31, 32).
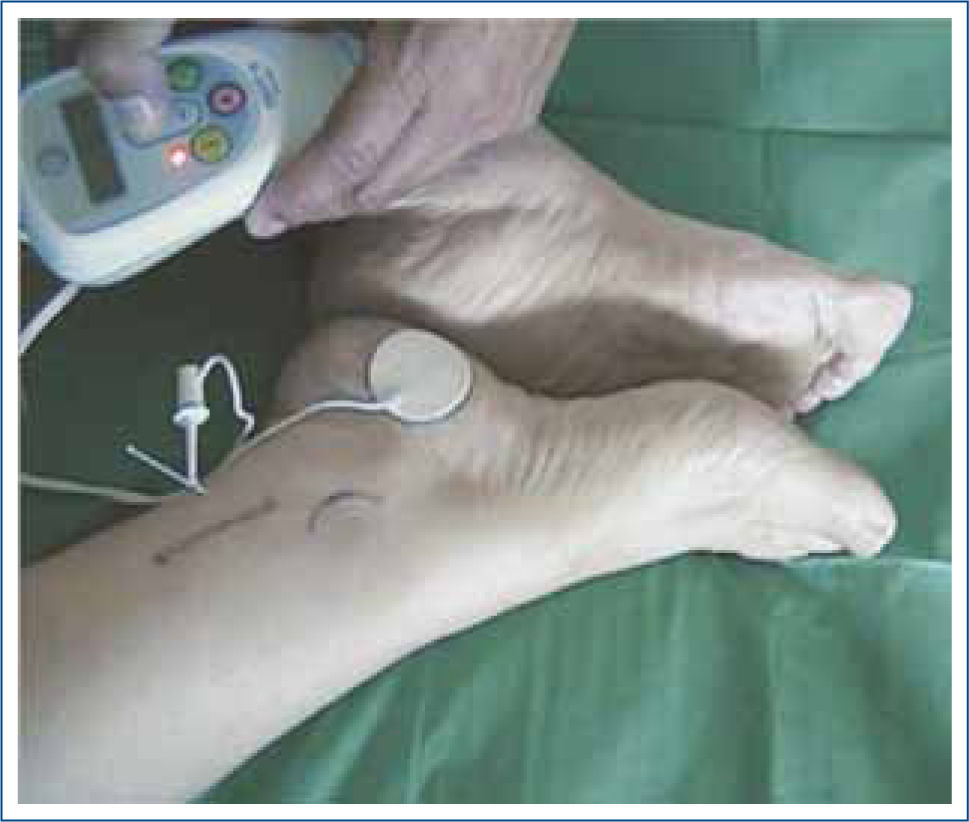
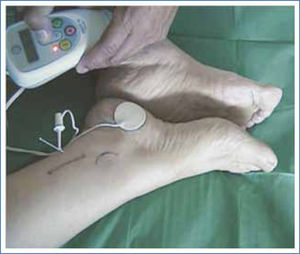
Neuromodulación tibial posterior (NTP)Con los sucesivos avances en técnicas quirúrgicas y la tendencia hacia la minima invasividad es que surge la neuromoduladón periférica por medio de la NTP. En 1983 Nakamura reportó por primera vez la eficacia de este procedimiento por via transcutánea para el tratamiento de la urgeincontinencia urinaria y la vejiga hiperactiva, pero pasan 10 años hasta que Shafik (33) publica la primera experiencia de la NTP para el tratamiento de la IF mediante una punción (via percutánea) con una aguja conectada a un electrodo a nivel del trayecto del nervio tibial posterior (NTP) (Figura 5).
Este procedimiento se basa en que el NTP nace de las raíces nerviosas L4, L5, S1, S2, S3 y contiene fibras sensitivasy motoras. La estimulación de estas a nivel periférico trasmitiría un impulso hacia las raíces sacras y asi en forma retrógrada neuromudularia el recto y los esfínteres anales produciendo un efecto similar al que logra la NMS.
El procedimiento de NTP por via percutánea (PNTP) consiste en la punción subcutánea con una aguja 34 G ubicada 4cm cefálico al maléolo medial y 3-4cms posterior a la tibia. La aguja es conectada a un generador de estímulos eléctricos monopolares (Urgent PC®, Uroplasty Ltd., Geleen, The Netherlands).
La PNTP es una técnica mucho más reciente que la NMS por lo que no existen resultados a largo plazo. La experiencia inicial de Shafik (33) mostró una mejoría de la IF en el 78,2% de los 32 pacientes tratados. Mentes en el 2007 publicó una serie de 2 pacientes con IF secundaria a daño medular, ambos presentaron mejoría en parámetras fisiológicos (umbral de sensibilidad rectal y presión esfinteriana), clínicos (score de Wexner) y de calidad de vida (FIQOL). Estudios prospectivos publicados recientemente muestran resultados similares con sesiones de tratamiento decrecientes en frecuencia luego de una fase inicial de 6 a 12 semanas. En el trabajo de Govaert, 13 de los 22 pacientes reclutados (63,4%) experimentaron una mejoría objetiva de la IF, mostrando también mejoría significativa en los cuestionarios de calidad de vida SF 36 y FIQOL. De la Portilla (34) a su vez, muestra buenos resultados en 10 de 16 pacientes. De la Portilla observó que al dejar a los pacientes 6 meses sin tratamiento, el 50% de los que habían tenido mejoría presentó deterioro parcial de la continencia.
Las publicaciones citadas sugieren que, a diferencia de la NMS, cuyo efecto terapéutico cesa con el explante, la PNTP tiene efectos que se mantienen en el tiempo, y que en caso de recurrencia se puede volver a realizar con sesiones menos frecuentes pero manteniendo buenos resultados, con un seguimiento de hasta 14 meses (35).
CirugíaEsfinteroplastiaLa indicación de cirugía está reservada para aquellos pacientes portadores de IF que no cede a los tratamientos conservadores, incluyendo RPP y NTP, en presencia de un daño anatómico esfinteriano, susceptible de reparación quirúrgica.
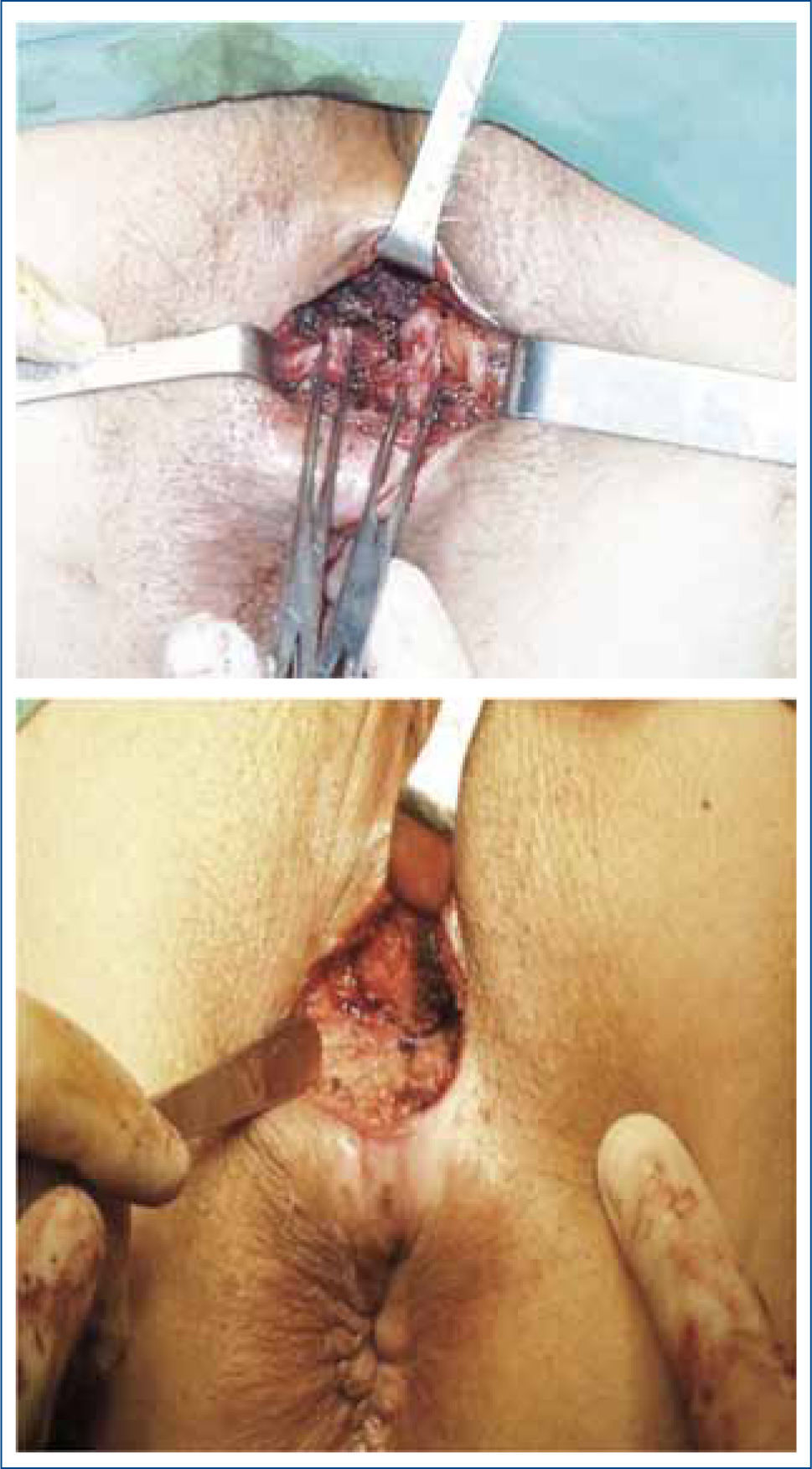
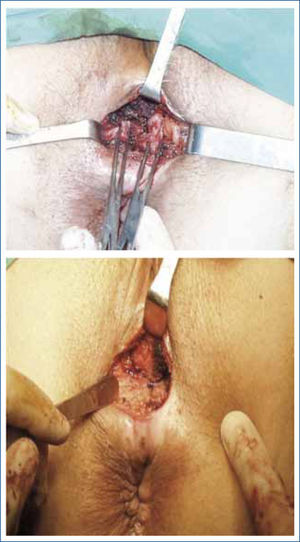
La esfinteroplastia fue inicialmente descrita por Lockhart-Mummary en 1923 (36), reportando la aposición de los cabos del esfínter externo dañado. Posteriormente esta técnica se popularizó gracias a la publicación de Parks (37), quien describió por primera vez la técnica de “superposición” muscular. Desde entonces, se ha considerado a esta técnica quirúrgica el tratamiento de elección en pacientes con daño esfinteriano. Sin embargo, los trabajos de seguimiento a largo plazo demuestran un deterioro funcional con el paso del tiempo, disminuyendo su efectividad inicial. Es así como las publicaciones con seguimientos a corto plazo al canzan el 70% al 90% de éxito. En las publicaciones con seguimiento a más de 5 años la efectividad de la técnica disminuye hasta el 50%. Esto demostraría la importancia de otros factores en la continencia fecal, aparte de la indemnidad anatómica esfinteriana (38).
La esfinteroplastia es usualmente indicada en IF asociada a daño esfinteriano secundario a trauma obstétrico o a lesiones iatrogénicas post cirugía proctológica (ej: fistulas complejas). Se ha tratado de determinar cuales serían los mejores candidatos para este tipo de cirugia, publicándose que los pacientes con peor resultado son aquellos con grandes defectos anatómicos (defecto esfinteriano mayor de 120°) (39) y en pacientes portadores de neuropatia del pudendo (40).Asimismo, los pacientes mayores de 50 años tendrían un peor pronóstico funcional a largo plazo (41) (Figura 6).
Agentes de rellenoEn el tratamiento de pacientes con incontinencia fecal, el uso de la inyección de agentes de relleno fue descrito por primera vez por Shafik en 1993, utilizando politetrafluoroetileno en 11 pacientes (42). Esta terapia estaria indicada en pacientes con defecto del esfinter anal interno o en pacientes con debilidad del aparato esfinteriano sin daño anatómico. Desde ese primer reporte se han utilizado diversos agentes con el fin de aumentar a presión de reposo en la zona submucosa anal. Hay alrededor de 10 agentes descritos, siendo los más frecuentes el PTQ ® y el Durasphere ®.
La forma de administrarlo, varia según el estudio analizado, reportándose grupos de trabajo que inyectan la sustancia de forma totalmente ambulatoria, hasta protocolos que lo hacen con los pacientes bajo anestesia general.
La técnica de inyección se puede clasificar entre las que inyectan el material en el espacio submucoso, espacio interesfintérico o directamente en la zona del defecto esfinteriano.
En una revisión sistemática publicada el año 2011, con 39 estudios, de los cuales 5 eran estudios aleatorios controlados (43), se describe que en el seguimiento a corto plazo (hasta 3 meses), un 56% de los pacientes refirió mejoria de su sintomatología. En el seguimiento a largo plazo (más de 12 meses) hay escasos reportes, manteniendo una buena respuesta solamente en el 45% de los pacientes. Se destaca como factor de riesgo el uso de anestésico local en la aplicación del agente de relleno. En esta revisión los efectos adversos alcanzaron a un 13,5% de los pacientes, siendo el dolor (6,5%) y la filtración de material inyectado los más frecuentes. Otros efectos adversos son la formación de abscesos de la zona de la inyección, eventos hemorrágico de la zona de la inyección, hipersensibilidad, reacción a cuerpo extraño y prurito persistente de la zona (44). La vía de administración interesfintérica se asoció con mayor posibilidad de eventos adversos.
Respecto de la aplicación ideal, aún falta por definir, el tipo de sustancia con menor frecuencia de eventos adversos, su volumen y forma de administración óptima.
NeoesfínteresGraciloplastiaEl uso de reconstrucción del aparato esfinteriano con músculo gracilis estimulado fue descrito por primera vez por Baeten et al en 1988. El procedimiento, denominado Garciloplastia dinámica consiste en posicionar el músculo gracilis alrededor del aparato esfinteriano dañado o no existente, creando un neoesfínter muscular y posteriormente estimularlo eléctricamente con un generador eléctrico programable, de manera de transformar las fibras musculares originales, tipo II en fibras de actividad prolongada o tónicas tipo I (45). Esta técnica ha caido en desuso por la complejidad, costo y alto porcentaje de morbilidad y bajo porcentaje de éxito a largo plazo (46).
Esfinter artificialLa implantación de un esfinter artificial es considerada en aquellos pacientes en quienes han fracasado tratamientos menos invasivos y en quienes no cuentan con un sustrato anatómico adecuado para la cirugia reconstructiva. Esta terapia estaria indicada para lograr la restitución anatómica y funcional anorrectal en casos de malformaciones anorrectales, cirugia reconstructiva oncológica y trauma anorrectal. Las experiencias publicadas corresponden a series de bajo volumen, en trabajos no aleatorios, mostrando morbilidad importante, especialmente relacionada con el riesgo de infección y erosión por el dispositivo y la necesidad de explantarlo. La literatura muestra que aproximadamente un tercio de los pacientes requirieron explantación del esfinter al término del periodo de seguimiento. Esta cifra se acerca al 50% en series a con seguimientos de al menos 5 años (46, 47).
Terapia con células madreLas células madre mesenquimales son capaces de desempeñar tres funciones importantes con habilidades únicas:
* Plasticidad: su potencial para transformarse en otro tipo de células.
* Retorno: pueden viajar al tejido dañado.
* Prendimiento: su capacidad para adherirse al tejido dañado.
Los tejidos más utilizados en terapia celular corresponden a células madre extraidas de médula ósea, sangre de cordón umbilical, tejido adiposo y muscular. Las células madre mesenquimales tienen la habilidad de diferenciarse en células componentes de huesos, músculos, grasa, nervios y cartilagos. Las células madre adultas autólogas, extraidas de tejidos maduros de los pacientes, muestran la misma morfologia, fenotipo inmunológico y capacidad de diferenciación que las células madre obtenidas de la sangre del cordón umbilical. Están fuera del debate ético y provienen generalmente de un tipo de tejido que es abundante y de fácil acceso (médula ósea y tejido adiposo). Una sola muestra de tejido adiposo puede producir más de 200 millones de células madre de las cuales 95% son células madre mesenquimales.
En 2008 aparece en la literatura el primer trabajo sobre el uso de células madre autólogas en la reparación de lesiones del esfínter anal. Se trata de un estudio experimental realizado en ratas sometidas a lesión del esfinter anal en las cuales se inyectan células mesenquimales extraidas del músculo gastrocnemio. Se observó que en este grupo, en comparación con el grupo control, la amplitud de contracción del esfinter fue mayor. En este estudio se observó diferenciación de las células madre hacia miocitos maduros (49).
Es en 2010 cuando White publica en Obstetrics & Gynecology un interesante estudio experimental para evaluar el efecto de las células madre miogénicas en las propiedades contractiles del esfinter anal externo tras realizar una sección del mismo. Este estudio compara el efecto de las células madre en la reparación del esfinter anal con o sin esfinteroplastía. En este modelo animal, la inyección de células madre miogénicas en el momento de la reparación del esfinter anal externo mejoró la función contráctil del mismo a los 90 días en comparación con el grupo en el que sólo se realizaba esfinteroplastía. Sin reparación del esfínter, la función del esfínter anal externo no mejoró con la terapia de células madre. Estos resultados sugieren que la adición de las células madre miogénicas mejora la funcionalidad del esfínter anal externo tras una lesión mecánica tanto en el momento inicial como a largo plazo.
En cuanto a estudios clínicos, en 2010 Frudinger A. publica en GUT un estudio realizado en pacientes con incontinencia fecal por traumatismo obstétrico en el que se inyectan mioblastos autólogos; a los 12 meses de la inyección de mioblastos la puntuación de la escala Wexner habia mejorado de media en 13,7 puntos de igual forma también mejoró la puntuación de calidad de vida. El estudio concluye que la inyección de mioblastos autólogos es segura, bien tolerada y mejora significativamente los síntomas de la incontinencia anal, en el caso del traumatismo obstétrico (50). Hoy en dia diversos grupos trabajan en definir el mejor métodoy tipode células madre para usar en pacientes con IF. Los trabajos más prometedores corresponden al uso de una matriz celular o “arquitectura” base más el uso de células madre de manera de recuperar tanto estructura como función.
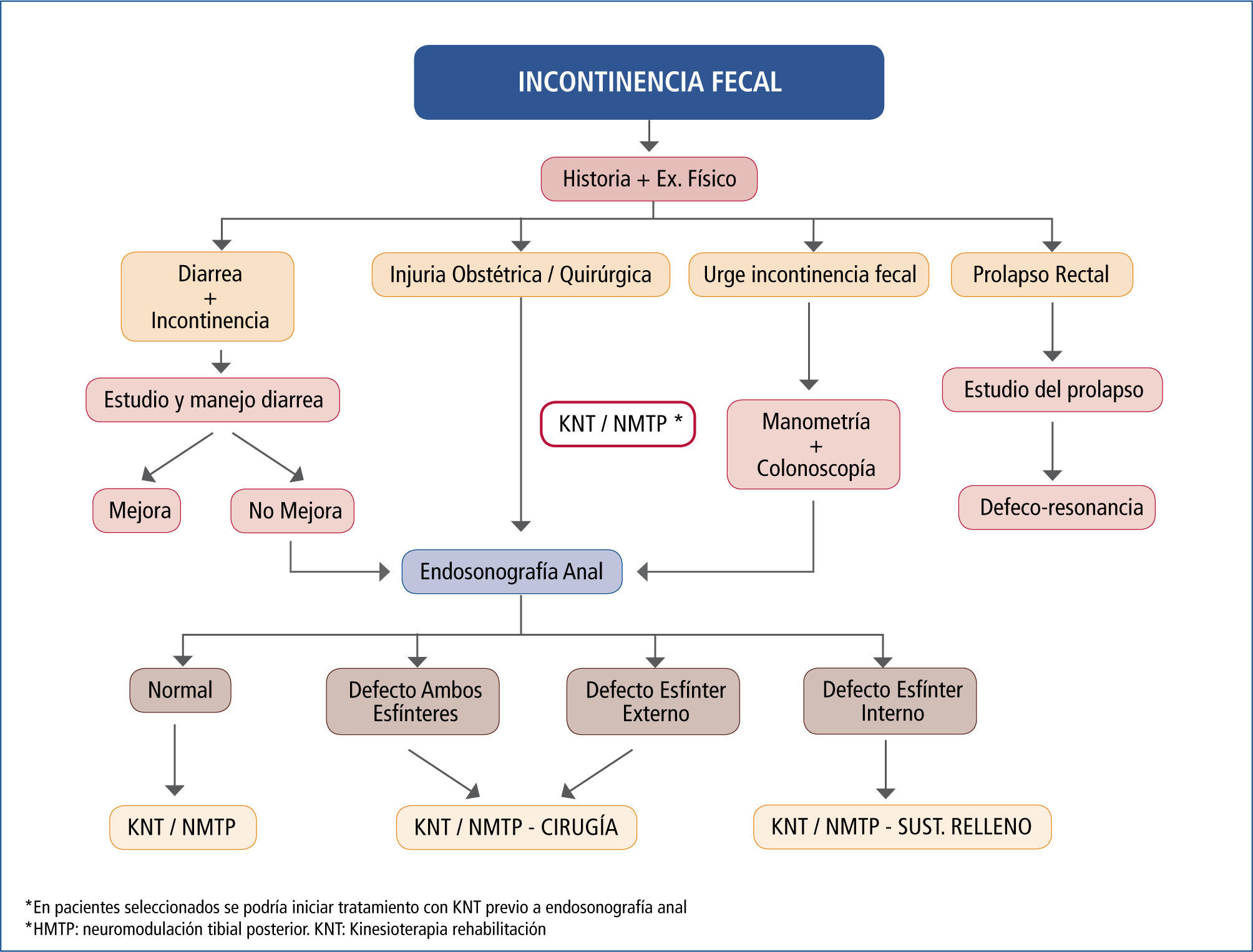
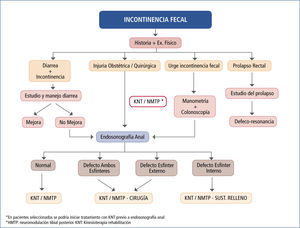
Algoritmos de manejoAl enfrentar un paciente portador de IF, debemos aplicar un algoritmo de manejo o un esquema lógico de manejo de su patología. Esto permite estudiar en forma adecuada a los pacientes y ofrecerles el tratamiento correspondiente a su problema especifico. La creación o adaptación de algoritmos de manejo permite a los miembros de las unidades encargadas, hablar en un mismo idioma y entender más fácilmente el flujo de tratamiento de los pacientes. En la literatura se han publicado múltiples algoritmos de estudio y manejo de la IF (51).
En nuestro centro (Centro de Especialidades en Piso Pelviano de Clinica Las Condes, CEPP) hemos desarrollado un algoritmo de manejo de la IF, basado en los trabajos y algoritmos publicados, asi como en la experiencia práctica de nuestro grupo (Figura 7).
SíntesisLa IF es una patología frecuente con consecuencias devastadoras para aquellos pacientes que la presentan. Un mejor conocimiento de los factores asociados en conjunto a nuevas técnicas diagnóstics y tratamientos emergentes permitirán un mejor enfrentamiento ante esta patología.
Los autores declaran no tener conflictos de interés, con relación a este artículo.