Hay muchos aspectos por abordar en el manejo de las mujeres con epilepsia, relacionados con su rol en la reproducción. Algunos de éstos necesitan ser considerados en la adolescencia, otros están relacionados con el embarazo, afectando tanto a la madre como a su hijo, y algunos con el ciclo menstrual y la menopausia. Esta revisión considera la epilepsia catamenial, contracepción, fertilidad, teratogenicidad y menopausia. También se discuten los efectos del embarazo en el control de las crisis y los efectos de las crisis sobre el feto.
There are many aspects to the management of epilepsy in women related to their role in reproduction. Some of these need to be considered in adolescents, some are related to pregnancy, concerning both the mother and her infant, and others with the menstrual cycle and the menopause. This review considers catamenial epilepsy, contraception, fertility, teratogenicity, and menopause. It also discusses the effect of pregnancy on the control of epilepsy and the effect of seizures on the fetus.
La definición de Epilepsia Catamenial (EC) es aún un concepto arbitrario, que ha sido sometido a variadas discusiones, sin existir aún una definición universalmente aceptada.
En pacientes con epilepsia, ya sea hombres o mujeres, el patrón de crisis no suele ser al azar. La tendencia a que sean periódicas o en “cluster” es alrededor del 50% de los casos. Se describe una ritmicidad temporal de las crisis en al menos el 29% de los hombres y en el 35% de las mujeres con epilepsia (1). En la misma línea, si la periodicidad de las crisis presenta una exacerbación durante el ciclo menstrual, se le denomina EC.
Inicialmente se denominaba EC al patrón de crisis que ocurrían exclusivamente durante el ciclo menstrual, sin embargo, actualmente es aceptado dentro de esta definición, el presentar una exacerbación del patrón de crisis en el período menstrual, atribuible a las propiedades neuroactivas de las hormonas esteroidales y de la variación cíclica de sus niveles plasmáticos. Otros autores han propuesto una definición más estricta de EC, la cual requiere el aumento al doble del promedio diario de las crisis, en relación al número de crisis “basales” (1, 2).
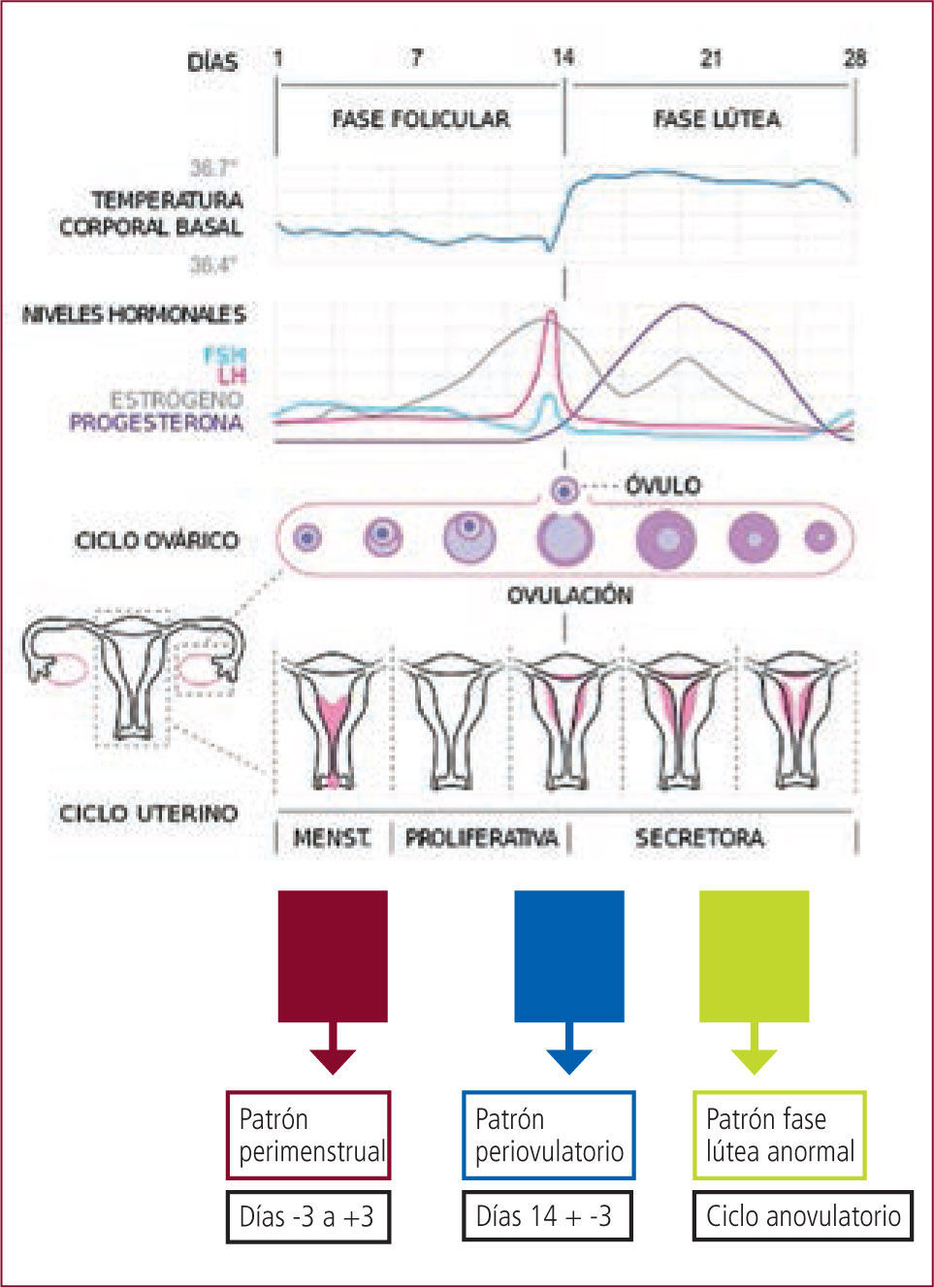
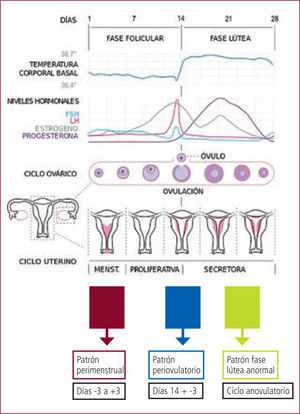
La frecuencia de la EC es variable y depende de los criterios usados para definirla, oscilando así entre el 12,5% y 78% de mujeres con epilepsia (2). En la EC, se describen al menos tres patrones de exacerbación de crisis, según el período del ciclo menstrual:
1) patrón periovulatorio, el que comprende al menos desde el día 10 al 13, atribuible a la presencia de niveles plasmáticos más elevados de estrógenos.
2) patrón perimenstrual, el que comprende los tres días previos y los tres días posteriores al primer día de la menstruación (-3+3) y se atribuye al rápido descenso de los niveles plasmáticos de progesterona.
3) patrón de fase lútea anormal, que comprende desde el día 10 al día +3 (segunda mitad del ciclo menstrual) atribuible a ciclos anovulatorios, donde no se produce un aumento significativo de los niveles de progesterona. Niveles de progesterona superiores a 5ng/ml se consideran ovulatorios (1, 2).
Según los diferentes estudios de la literatura, el patrón más frecuente de crisis, corresponde al patrón perimenstrual (Figura N°1).
Ciclo menstrual y patrones de epilepsia catamenial
Ref. 1, modificado.
Las hormonas reproductivas tienen reconocidas propiedades neuroactivas, las que juegan un importante rol en la fisiopatología de la Epilepsia y en el patrón de aparición de crisis. Se ha demostrado que un aumento de la frecuencia de crisis se produce en las fases del ciclo menstrual caracterizadas por una elevada proporción de estrógenos versus progesterona.
Los estrógenos tienen un efecto excitatorio directo sobre la membrana neuronal, aumentando la unión del glutamato a los receptores de N-methyl-D-aspartato (NMDA), especialmente a nivel de ciertas áreas del hipocampo (neuronas piramidales hipocampales CA1): “efecto pro-convulsivante”.
La progesterona y particularmente algunos de sus neurometabolitos activos (alopregnanolona), producen un efecto inhibitorio directo sobre la membrana neuronal, ejercido a través de potenciación del efecto GABA: “efecto anticonvulsivante”.
Durante el ciclo menstrual, hay tres períodos fundamentales donde se producen las principales variaciones de los niveles hormonales:
- a)
Fase ovulatoria: período de secreción máxima de estrógenos;
- b)
Fase perimenstrual: caída importante de los niveles de progesterona, con predominio relativo de los niveles de estrógenos;
- c)
Ciclos con fase lútea anormal: caracterizada por un aumento sostenido de los niveles de estrógenos durante la segunda mitad del ciclo, dado por una falta de la elevación normal de los niveles de progesterona durante este período.
El reconocimiento de la EC y de su tipo de patrón, fuera de la historia clínica detallada especificando los fármacos anticonvulsivantes que emplea habitualmente la paciente, requiere de la confección de un “diario de crisis” para lo cual la paciente debe ser debidamente instruida. En forma conjunta la paciente debe confeccionar un calendario de su ciclo menstrual. Es aconsejable además realizar mediciones de niveles plasmáticos de progesterona, durante la segunda mitad del ciclo, considerándose valores ovulatorios sobre 5 ng/ml de progesterona.
dMedidas terapeúticasEn la EC y como en cualquier tipo de Epilepsia, el principal objetivo del tratamiento es optimizar el tratamiento anticonvulsivante. No existen tratamientos específicos para el EC. Como medidas universales se sugiere:
- 1-
Control seriado de niveles plasmáticos de los fármacos anticonvulsivantes.
- 2-
Eventual ajuste de dosis (dosis adicional) del fármaco anticonvulsivante durante el período perimenstrual.
- -
Uso de benzodiacepinas: Clobazam en dosis de 10 a 30 mg/día, por un período intermitente y transitorio, no superior a 10 días (período perimenstrual).
- -
Uso de diuréticos: Acetazolamida, potente inhibidor enzimático de la anhidrasa carbónica, la cual aumenta los niveles cerebrales de GABA, favoreciendo así un efecto anticonvulsivante. Se sugiere su uso 10 días antes del comienzo de la menstruación y mantenerla por 10-14 días en total, en dosis de 250 a 1000 mg/día, dividida en 3-4 dosis por día (8-10 mg/Kg).
- -
Tratamiento hormonal: se han intentado varias alternativas terapéuticas de sustitución hormonal, buscando elevar los niveles de progesterona circulante mediante: a) la administración cíclica de progesterona durante la fase lútea del ciclo mestrual; b) Terapia de supresión del ciclo menstrual, produciendo amenorrea, mediante progestágenos inyectables o mediante hormonas análogas de liberación de gonadotrofina. Sus resultados han sido poco satisfactorios, tanto en el control de crisis como en sus efectos colaterales.
El tratamiento cíclico de progesterona ha revelado resultados más alentadores que en años previos, reduciendo significativamente el número de crisis, el cual sería duradero en el tiempo. Sus principales efectos secundarios son: sedación, astenia, inestabilidad emocional. Menos frecuentemente se asocian a metrorragia, mastalgia, aumento de peso. Debe considerarse además la interacción farmacológica entre progesterona y fármacos anticonvulsivantes, especialmente si éstos son inductores enzimáticos, tales como fenitoína, carbamazepina, entre otros; pues favorecen la eliminación de progesterona, requiriendo una mayor dosificación hormonal.
Para optimizar su uso, se sugiere un manejo integral y conjunto con ginecología.
- -
Anticonvulsivantes: LAMOTRIGINA, mención especial requiere este fármaco anticonvulsivante, cuyo uso en monoterapia ha mostrado resultados satisfactorios en el control de la EC. En un estudio prospectivo realizado por Gilad and et al. (3) mostró que la Lamotrigina, en monoterapia y en dosis de 100 mg dos veces al día, fue eficaz en el control de la EC, dado por su efecto anticonvuslvante propiamente tal y por hallazgos que sugieren que la Lamotrigina elevaría los niveles plasmáticos de progesterona. Más estudios se requieren para reafirmar estos promisorios resultados (3).
- -
La edad reproductiva en la mujer con epilepsia nos enfrenta a diferentes escenarios y desafíos: función endocrina, menarquia y ciclos menstruales, sexualidad y contracepción (4), aspectos que serán desarrollados a continuación.
aImpacto de los FAEs en la función endocrina y reproductivaLos fármacos antiepilépticos (FAEs) pueden afectar la función de neurotransmisores incluyendo GABA y glutamato, los principales neurotransmisores inhibitorios y excitatorios del cerebro (5). Las mujeres que los toman tienen más probabilidades de tener anormalidades endocrinas, especialmente con los FAEs que son metabolizados por enzimas hepáticas del sistema citocromo P450. Más aún, los FAEs pueden afectar la función hipofisiaria, vía un efecto directo en las aferencias corticales del eje hipotálamo-hipósis-ovario o alterando el feedback hormonal gonadal, lo que puede afectar la producción de esteroides sexuales gonadales y adrenales (6).
FAEs inductores enzimáticos pueden reducir los niveles circulantes de estrógeno y progesterona y alterar la unión a proteínas plasmáticas (7). Como resultado hay mayores niveles de globulinas transportadoras de hormonas esteroidales y subsecuentemente se reducen las hormonas esteroidales libres, que son las biológicamente activas para realizar las funciones.
Función reproductiva. La epilepsia se puede asociar con un mayor riesgo de disfunción ovárica, llevando a una falla prematura del ovario, un Síndrome de ovario poliquístico y una reducción en la fertilidad (8). Las crisis o la actividad epileptiforme interictal pueden provocar alteraciones en la función del eje hipotálamo-hipófisis-ovario, alterando así la secreción de hormonas. El ciclo menstrual se hace irregular, prolongado, puede haber oligomenorrea o incluso amenorrea (7). La fertilidad también puede verse afectada con mayor riesgo de abortos espontáneos y complicaciones asociadas al embarazo (9).
Se debe sospechar un Síndrome de Ovario Poliquístico, cuando se está frente a ciclos irregulares o anovulatorios en mujeres obesas o con hirsutismo. Se ha sugerido que el SOP y el hiperandrogenismo a menudo afectan en mujeres no obesas, quienes han estado expuestas a valproato (10).
bMenarquia y ciclos mestrualesPubertad, menarquia, menstruaciones y menopausia son momentos en los cuales las hormonas sexuales pueden impactar profundamente en las crisis, aumentándolas o reduciéndolas (11). En ocasiones, como en la Epilepsia Mioclónica Juvenil, se debuta en la pubertad. Opuestamente, otras epilepsias generalizadas primarias y epilepsias parciales benignas de la niñez, pueden regresar en la pubertad.
cSexualidadLas mayoría de las mujeres con epilepsia tienen una vida sexual normal, aunque aproximadamente un 33 a 50% de ellas experimentan algún grado de disfunción sexual (12). Se han reportado mayores niveles de ansiedad y apatía relacionada con el acto sexual así como una reducción en la lubricación vaginal, dispareunia y anorgasmia. Las causas parecen ser múltiples, tanto por crisis frecuentes y el efecto de los FAEs en la función hormonal normal.
dContracepciónSe estima que en Chile existen alrededor de 180.000 mujeres con epilepsia, de ellas unas 70 a 100.000 están en edad fértil (18 a 44 años) (13).
Para las mujeres que padecen de epilepsia, los métodos anticonceptivos son parte integral de la planificación del embarazo.
1-Anticonceptivos orales (ACO). La característica más importante de los ACO es que son altamente efectivos, es decir, su tasa de falla muy baja. Generalmente no se asocian con una exacerbación de las crisis, sin embargo los FAEs, reducen su eficacia (14).
Los FAEs inductores enzimáticos pueden reducir sustancialmente la concentración de estrógeno circulante y reducen la progesterona libre, vía un incremento en la síntesis de la globulina transportadora de esteroides sexuales (SHBG), haciendo que la mujer que toma FAEs inductores enzimáticos pueda sufrir mayores fallas en la contracepción, a menos que use un MAC adicional (15) (Tabla N°1). Todo indica que deben usarse ACO con dosis de estrógenos iguales o mayores a 50 ucg de etinilestradiol en todas las mujeres que toman FAEs inductores enzimáticos. Si ocurre sangramiento la dosis debe aumentarse 75 ó 100 ucg al día A diferencia a la mayoría de los FAEs de primera generación, incluyendo fenitoina, carba-mazepina, oxcarbazepina, fenobarbital y primidona, muchos de los nuevos FAEs, excepto topiramato, no tienen el mismo riesgo de inactivar el efecto de losACO (16)
Efecto de los faes en la concentración de los anticonceptivos orales
| REDUCEN LA CONCENTRACIÓN. DISMINUYEN LA EFICACIA | ||
| • Carbamazepina | • Fenitoína | • Fenobarbital |
| • Primidona | • Oxcarbazepina | • Topiramato |
| AUMENTAN O NO LA CONCENTRACIÓN. NO ALTER AN LA EFICACIA | ||
| • Acido valproico | • Tiagabina | • Zonisamida |
| • Benzodicepinas | • Vigabatina | • Levetiracetam |
| • Lamotrigina | • Gabapentina | |
Modificado de: Morrell Mj. Neurology 1998; 51(5 Suppl 1): S21-S27
Etosuximida, valproato, gabapentina, lamotrigina y levetiracetam no reducen la eficacia de los ACO (Tabla N°1).
2-Otros anticonceptivos hormonalesLas píldoras de progesterona son afectadas por los FAEs inductores enzimáticos. Deben tomarse regularmente y requieren el uso de un método anticonceptivo de barrera. En el caso que se usen inyecciones de medroxiprogesterona (depósito), se ha sugerido que sean cada 10 semanas (en vez de cada 12).
El uso de la píldora anticonceptiva de emergencia (“del día después”) es segura en los pacientes con epilepsia, aunque si la mujer está tomando un FAE inductor enzimático puede ser necesaria una dosis más alta. En estos casos se indica Levonorgestrel 1,5 mg seguido de una 2º dosis 12 horas más tarde (17). Los anticonceptivos hormonales parenterales (como Depo-Provera) y los implantes subdérmicos, no sufren primer paso hepático, sin embargo igualmente pueden ser afectados significativamente por FAEs inductores enzimáticos. Estudios realizado en mujeres con epilepsia y FAEs usando levonorgestrel subdérmico en mplante mostraron que los niveles alcanzados serían insuficientes para que sean efectivos.
3-CondónEs un método de barrera, razonablemente efectivo especialmente asociado a espermicidas. Requiere un uso correcto, dado que se ha reportado una alta tasa de falla por mal uso o del método. No recomendable en mujer con epilepsia como método único.
Fármacos antiepilépticos, teratogenicidad y efectos cognitivosaTeratogenicidadHace más de 40 años, Meadow publicó por primera vez la posible asociación entre el uso de fármacos antiepilépticos (FAE) y malformaciones congénitas (MFC) (18). Se trataba de 6 niños con fisuras orales y otras anomalías, expuestos a fenitoína, fenobarbital y primidona en diferentes combinaciones. Posteriormente, varias series de casos confirmaron que fenobarbital, fenitoína, valproate y carbamazepina, se asociaban con un mayor riesgo de MFC en los recién nacidos (19).
La prevalencia de MFC mayores en hijos de mujeres con epilepsia va de un 4 a 10% (20), lo que es 2 a 4 veces mayor que la esperada para la población general (21).
En análisis agrupados, la politerapia con FAEs está asociada con mayores tasas de malformaciones (6,8%) que en monoterapia (4%) (22), lo que ha sido un hallazgo consistente en los diferentes estudios. Si en la combinación de FAEs está incluido valproato, el riesgo es aún mayor (23). Por ejemplo en casos de politerapia con lamotrigina y valproato, la tasa de MFC es de 9%, mientras que lamotrigina en combinación con otro FAE, tiene una tasa de 3%. En el caso de carbamazepina, su tasa de MFC fue de 3% en monoterapia, 2% si se combina con otro FAE, pero se eleva sorprendentemente a 15% con carbamazepina más valproato (24).
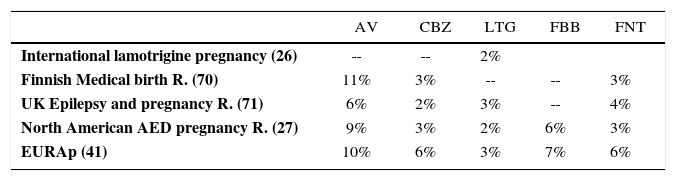
Un gran aporte al conocimiento de la teratogénesis asociada a FAEs ha sido el surgimiento de los registros y bases de datos de epilepsia y embarazo. Estos estudios observacionales prospectivos enrolan un gran número de mujeres embarazadas con el fin de comparar el potencial teratogénico de los FAEs (25). En la Tabla N° 2 se resumen las tasas de MFC mayores encontradas en algunos de estos estudios, ante el uso de valproato, carbamazepina, lamotrigina, fenobarbital o fenitoína.
Tasas de malformaciones congénitas mayores en hijos de mujeres con epilepsia en tratamientos con antiepilepticos: reportes de los grandes estudios prospectivos en el mundo
| AV | CBZ | LTG | FBB | FNT | |
|---|---|---|---|---|---|
| International lamotrigine pregnancy (26) | -- | -- | 2% | ||
| Finnish Medical birth R. (70) | 11% | 3% | -- | -- | 3% |
| UK Epilepsy and pregnancy R. (71) | 6% | 2% | 3% | -- | 4% |
| North American AED pregnancy R. (27) | 9% | 3% | 2% | 6% | 3% |
| EURAp (41) | 10% | 6% | 3% | 7% | 6% |
AV: ácido valproico; CBZ: carbamazepina; LTG: lamotrigina; FBB: fenobarbital; FNT: fenitoina; R: Registry
Modificado de: Tomson T, Battino D. Teratogenic efects of antiepileptic drugs. Lancet Neurol 2012; 11: 803–13
Lamotrigina es el único, dentro de los llamados nuevos FAEs, cuyo registro de embarazos ha enrolado un número suficiente de mujeres como para permitir sacar conclusiones (26). En el NAAPR (North American AED Pregnancy R), lamotrigina en monoterpia se asoció con una tasa de malformaciones de 2% (Tabla N° 2) (13)
Las MFC mayores incluyen un amplio rango con diferentes efectos en la función y en la calidad de vida (Tabla N°3). Por su gravedad destacan la cardiopatía congénita, los defectos del tubo neural, el labio leporino y el paladar hendido (27). Los defectos del tubo neural se han asociado específicamente con el valproato de sodio (28) y carbamazepina (29).
Malformaciones congénitas mayores y anomalias menores descritas en niños nacidos en mujeres con epilepsia en tratamiento con fae
| MALFORMACIONES CONGÉNITAS MAYORES (&) | ANOMALÍAS MENORES (*) |
|---|---|
| Cardiopatía congénita | Ojos: pliegues epicantales, hipertelorismo |
| Labio leporino | Orejas: orejas descendidas |
| Paladar hendido | Nariz: tabique nasal plano, filtrum largo |
| Defectos de las extremidades | boca: microstomía, labio inferior prominente |
| Malformaciones genitourinarias | Dedos: hipoplasia de las falanges distales y las uñas |
| Defectos del tubo neural |
Varios investigadores han propuesto un patrón característico de anomalías menores (Tabla N°3) como los pliegues epicantales, hipertelorismo, orejas descendidas y otras (30). Sin embargo, existe una considerable superposición entre las mismas y se ha cuestionado la existencia de síndromes específicos de los fármacos (31).
bEfectos cognitivos sobre el fetoEl seguimiento a largo plazo de los niños expuestos a FAEs en el útero ha sido limitado, por lo que los efectos más sutiles sobre el desarrollo neurológico y cognitivo posterior de los niños se han estudiado de manera deficiente. Estudios retrospectivos (32) y prospectivos (33) hallaron una prevalencia mayor del retraso del desarrollo, especial en los dos primeros años de vida, en niños nacidos de madres con epilepsia en comparación con los controles en la población general.
Sin embargo, estudios a largo plazo de los efectos de la exposición intrauterina a FAEs en el funcionamiento cognitivo son limitados y a veces conflictivos: mientras algunos hallaron una proporción alta de niños con alguna forma de trastorno del aprendizaje o necesidad de educación especial (34), otros hallaron un deterioro transitorio con recuperación en un estadio posterior (35).
Banach, en el año 2010 publicó los resultados de un metaanálisis (36) que incluyó 67 niños expuestos in útero a ácido valproico,151 a carbamazepina y 494 controles. La exposición a ácido valproico en el embarazo se asoció con una significativa reducción en la inteligencia de los niños cuyas madres estaban siendo tratadas por epilepsia. La exposición a carbamazepina no apareció asociada a este problema, aunque el PIQ (performance IQ) fue más bajo en un subanálisis.
El estudio NEAD, publicado recientemente (37) evaluó los efectos cognitivos de los FAE de uso común (carbamazepina, lamotrigina, fenitoina o valproato) en niños a los 6 años de edad. Se incluyeron 311 niños (seis embarazos dobles), de los cuales 224 completaron los 6 años de seguimiento.
Tras el análisis de multivarianza se observó que los niños expuestos a valproato mostraban a la edad de 6 años un CI más bajo que carbamazepina, lamotrigina o fenitoina. Los niños expuestos a valproato mostraron empobrecimiento en sus rendimientos verbales y de memoria comparados con los expuestos a otros FAE y deterioro de sus funciones no verbales y ejecutivas comparados con lamotrigina (pero no carbamazepina o fenitoina).
Un hallazgo muy relevante es que la exposición fetal a valproato tiene efectos dosis-dependiente, el riesgo se incrementa desde 700 mg/día. Este hallazgo demuestra la importancia de usar las dosis efectiva más baja posible antes de la concepción, independientemente de cuál sea el FAE en uso (38).
Las concentraciones plasmáticas de FAEs en la madre probablemente muestran la exposición del feto al medicamento mejor que la dosis que recibe. Por lo tanto la inclusión de niveles plasmáticos en la monitorización durante el embarazo será importante en el seguimiento clínico y futuros estudios.
El CI promedio fue más alto en niños expuestos a folato periconcepcional (108, 95% CI 106 -111) versus los no expuestos, lo que refuerza el valor protector del ácido fólico.
cRecomendaciones y ConclusionesDe lo anteriormente expuesto es posible plantear las siguientes recomendaciones, en base a la evidencia y a la experiencia de las autoras:
- -
En lo posible, evitar el uso de valproato y de FAEs en politerapia durante el primer trimestre del embarazo, a fin de reducir el riesgo de malformaciones congénitas mayores.
- -
En lo posible evitar el uso de valproato y FAEs en politerapia a lo largo del embarazo para prevenir las consecuencias cognitivas en el niño.
- -
En lo posible evitar el uso de fenitoina y fenobarbital durante el embarazo, para reducir consecuencias cognitivas.
- -
Considerar el uso de ácido fólico pre y periconcepcional. -Si es necesario usar valproato, usar en lo posible dosis inferiores a 700 mg/día
- -
Insistir respecto a un embarazo planificado (se hace énfasis en la educación).
- -
El cambio entre los FAE cuando el embarazo ya está establecido es discutible debido al riesgo y dudoso beneficio de tal cambio.
- -
Dado que sabemos que el riesgo varía según el tipo de tratamiento (FAE y dosis), este hecho debería ser tomado en consideración cuando se inicia terapia en una mujer en edad fértil. Incluso considerando cambiar de fármaco si las condiciones lo permiten.
En la práctica clínica, siempre se debe sopesar el riesgo en relación al beneficio de la terapia: en este caso, los posibles efectos adversos en los hijos cuando sus madres toman FAEs frente a los riesgos asociados con una epilepsia no controlada. En la epilepsia, los riesgos maternos y fetales frente a convulsiones sin un adecuado control, exige un tratamiento continuado de FAE durante el embarazo (39, 40).
Los datos de teratogenicidad potencial de los nuevos FAEs distintos a lamotrigina son escasos. Los datos para gabapentina, oxcarbazepina, levetiracetam, topiramato y otros son insuficientes y en vista de los riesgos asociados con valproato, son una necesidad urgente.
Las grandes cohortes deberían dar información además de combinaciones específicas, respecto de su potencial teratogénico, lo cual es muy importante puesto que un 20% de las mujeres con epilepsia son tratadas con politerapia durante su embarazo (41).
Epilepsia y embarazoaGeneralidadesLa causa más común de crisis convulsivas durante el embarazo está dada por la Epilepsia pre-existente. La presencia de crisis en paciente no epilépticas es bastante menos frecuente. La Eclampsia es una lamentable complicación del embarazo que se asocia altamente a crisis convulsivas. Otras causas de crisis durante la gestación, menos frecuentes aún, son la falla hepática fulminante, alteraciones metabólicas e hidroelectrolíticas (42).
La mujer epiléptica debe enfrentar numerosas interrogantes en el momento de enfrentarse a un eventual embarazo: ¿cuáles son los riesgos de la Epilepsia sobre el embarazo? ¿Cuáles son los riesgos del embarazo sobre la Epilepsia; ¿cuáles son los riesgos de los medicamentos antiepilépticos?; ¿se deben suspender los medicamentos durante el embarazo?; ¿podrá quedar embarazada?; ¿qué riesgos enfrenta el feto?... Son algunas de las numerosas interrogantes, las cuales no son fáciles de responder. No existen estudios con evidencia clase I que puedan responder dichas preguntas (43).
La mujer epiléptica embarazada puede tener hijos sanos, pero con alto riesgo de complicaciones, tanto para la madre como el feto, en relación a la población general. Es responsabilidad del médico minimizar este riesgo (43).
bEfectos del Embarazo sobre la EpilepsiaExisten numerosos factores que pueden afectar y favorecer la frecuencia de crisis de la mujer epiléptica durante el embarazo. Los principales factores involucrados en este mayor riesgo son: cambios hormonales propios del embarazo, cambios metabólicos que alteran la concentración de los fármacos antiepilépticos.
Diferentes estudios han revelado una frecuencia variable de crisis durante el embarazo: un tercio de las mujeres experimentan un aumento de sus crisis; 10-20% pueden tener una disminución de la frecuencia de éstas y solo un pequeño número de pacientes tendrá solo 1 ó 2 crisis durante el embarazo. A pesar de lo anterior, hoy se sabe que la mujer epiléptica bien controlada, en su mayoría, no tendrá alteraciones en la frecuencia de crisis durante el embarazo (44).
Otros estudios publicados han revelado que el cambio en la frecuencia de crisis durante el embarazo, no dependería del tipo de crisis, de la edad de la mujer, de la duración de la Epilepsia o del número de crisis presentadas previas al embarazo. En general, se ha observado que la gran mayoría de crisis pueden ocurrir hacia el término de la gestación, sin embargo, un tercio de ellas pueden ocurrir durante el primer trimestre (45). Ante la gran variabilidad de riesgo de crisis durante el embarazo, lo recientemente más aceptado para optimizar y reducir el riesgo de éstas, es procurar que el año previo a quedar embarazada, la mujer epiléptica debe tener un buen control de sus crisis, lo que permitiría que aproximadamente el 90% de ellas se mantengan controladas durante la gestación (46).
Durante el embarazo, los niveles de estrógenos y progesterona se elevan 10 veces por su nivel normal. Como ya se trató previamente en este mismo artículo, es conocido el efecto “pro-convulsivante” de los estrógenos y el efecto “anticonvulsivante” de la progesterona. A pesar de lo anterior, el incremento de sus niveles hormonales, no se traduce en una mayor frecuencia de crisis (47).
Existen otros factores, no hormonales, que pueden aumentar o favorecer la probabilidad de crisis durante el embarazo.
- -
La privación de sueño es ampliamente reconocida como un potencial gatillante de crisis epiléptica (47, 55). Durante el embarazo, es muy habitual enfrentarse a trastornos del sueño, fundamentalmente durante el último trimestre, dado por desconfort físico, molestias de tipo digestivas, aumento de la frecuencia urinaria, movimientos fetales, entre otros. Trastornos emocionales, tales como la Ansiedad, son frecuentes de observar en la mujer embarazada, especialmente en relación a la salud del feto, los que pueden originar Insomnio.
- -
El metabolismo de los fármacos anticonvulsivantes también se ve afectado durante el embarazo. Los efectos del cambio del metabolismo materno tienden a producirse principalmente después del primer trimestre, pero el efecto sobre el nivel del fármaco anticonvulsivante es más impredecible y depende directamente del tipo de fármaco utilizado. Los fármacos con mayor grado de unión a las proteínas plasmáticas se ven más afectados que aquellos fármacos con menor unión a las proteínas plasmáticas. La mayoría de los neurólogos especialistas en el tema, sugieren control seriado, mensual, de los niveles plasmáticos del fármaco durante todo el embarazo. El metabolismo normal del fármaco se recupera habitualmente 2 a 3 meses después del parto. Una excepción la constituye el fármaco Lamotrigina, la cual retorna a su metabolismo normal a las pocas semanas después del parto, por lo que requiere un ajuste más rápido en su dosis (48-50). Hay que considerar además que muchas de las mujeres epilépticas embarazadas, interrumpen el tratamiento anticonvulsivante, por los riesgos potenciales de éstos sobre el feto (50). Se refuerza la importancia de la relación médico paciente y la comprensión de la mujer embarazada sobre los riesgos y beneficios de un buen control de su epilepsia.
Existe un número significativo de complicaciones durante el embarazo, que son más frecuentes en las mujeres epilépticas. Se describe, según diferentes estudios de la literatura, que el riesgo de sangramiento vaginal, hiperémesis, eclampsia-pre-eclampsia y desprendimiento de placenta aumentan al doble en la mujer epiléptica embarazada en relación a la población general (55). Estos factores a su vez, aumentan la posibilidad de parto prematuro y la realización de cesáreas de urgencia. Algunas de estas complicaciones se atribuyen al efecto directo de las crisis epilépticas, mientras que otros se atribuyen a la combinación de la terapia anticonvulsivante y las crisis propiamente tal. El control de crisis continúa siendo la mejor herramienta terapéutica para evitar dichas complicaciones.
Las crisis convulsivas, especialmente las de tipo tónico clónico generalizadas, pueden ser de alto riesgo durante el trabajo de parto y el parto propiamente tal. Pueden producir acidosis e hipoxia materna, con el consecuente riesgo para el niño, produciendo una disminución de la frecuencia cardíaca fetal, mayor riego de hipoxia y muerte del recién nacido. También se les asocia a un retardo en el desarrollo del niño (51, 55).
Las crisis no convulsivas tienen un menor riesgo materno-fetal, pero pueden interferir en la cooperación de la madre durante el trabajo de parto.
Afortunadamente el riesgo de crisis durante el parto es bastante poco frecuente, presentándose solo en el 1% de las mujeres epilépticas (51, 55).
Si se presentan crisis, deben ser rápidamente controladas mediante benzodiacepinas, con especial alerta de prevenir el riesgo de depresión respiratoria en el neonato. El objetivo principal es evitar que la paciente presente un estado epiléptico.
Diferentes tipos de fármacos anticonvulsivantes pueden producir deficiencia de vitamina K en el recién nacido, causado por la inhibición del transporte de esta vitamina a través de la placenta. Estos fármacos incluyen Fenobarbital, Fenitoína, Carbamazepina, Primidona y Diazepam. Los fármacos antiepilépticos de segunda generación, aún no han sido bien estudiados al respecto. Las potenciales complicaciones hemorrágicas por la falta de vitamina K pueden alcanzar hasta un 30% de mortalidad en el recién nacido (50). Las pacientes que utilizan este tipo de fármacos anticonvulsivantes, deben ser tratadas adicionalmente con vitamina K oral, 10 mg/día, a partir de las 36 semanas de gestación. El recién nacido debe recibir vitamina K 1 mg intramuscular o endovenoso en el momento del parto (51).
dEfectos de las crisis maternas sobre el desarrollo fetalLas crisis convulsivas maternas, especialmente las generalizadas, tienen un alto riesgo para el feto. Las crisis generalizadas producen hipoxia y acidosis fetal. Lo anterior puede desencadenar un aborto espontáneo o hemorragias intracraneales en el niño (43, 52).
El estado epiléptico constituye una emergencia pues puede afectar gravemente tanto la salud materna como fetal. La mortalidad infantil y materna puede alcanzar hasta un 50% y 30%, respectivamente (52). Las crisis epilépticas no convulsivas tienen un efecto menos claro sobre la salud del feto. Estudios recientes se inclinan por afirmar que su efecto es menos dañino y básicamente podrían interferir en el trabajo de parto, por la escasa cooperación materna.
La terapia anticonvulsivante se asocia potencialmente a numerosos efectos dañinos sobre el feto, entre los cuales se puede mencionar: retardo del crecimiento intrauterino, malformaciones congénitas mayores y menores, disfunción cognitiva y mayor mortalidad infantil. (43, 51-54). Numerosos autores han referido el conjunto de síntomas descritos previamente como el Síndrome anticonvulsivante fetal.
Epilepsia y menopausiaLa menopausia es una etapa fisiológica en la vida de la mujer, la cual no ha sido bien estudiada en el caso de la mujer epiléptica. Existen pocos estudios prospectivos; la mayor cantidad de la información que se dispone sobre el tema está basada en la experiencia clínica y en algunos estudios retrospectivos (55). Sin embargo, es fundamental para el médico especialista considerar los efectos de la Epilepsia y de la terapia anticonvulsivante sobre la menopausia y los efectos de los cambios hormonales asociados con la menopausia propiamente tal y con las terapias de reemplazo hormonal sobre la actividad epileptiforme.
En la actualidad, existe numerosa evidencia que muestra que las hormonas femeninas y las fluctuaciones en sus niveles, pueden tener una gran influencia en la frecuencia de crisis en la mujer epiléptica. Los estrógenos, como ya se ha discutido en este mismo artículo, tendrían un efecto pro-convulsivante y la progesterona junto a sus metabolitos, un efecto anticonvulsivante.
En términos operativos, se considera la Menopausia como la ausencia absoluta de menstruaciones, amenorrea, por un período mínimo de un año, acompañado de una estabilización en rangos bajos de los niveles de las hormonas femeninas (56). Durante el período perimenopáusico, los niveles de estrogénos declinan gradualmente y los niveles cíclicos de progesterona, durante la fase lútea, también se reducen. La relación entre los niveles de estrógenos y progesterona se hace más impredecible, por lo que el período perimenopáusico se relaciona con un mayor riesgo de actividad epileptiforme. Diferentes estudios han mostrado este aumento de frecuencia de crisis durante la perimenopausia y es especialmente marcado en aquellas mujeres que han tenido historia de patrón catamenial en sus crisis (56).
Es bien conocido ya que el promedio de edad en que la mujer alcanza la menopausia es entre los 48 y 55 años de edad. Algunos estudios han sugerido que algunos tipos de epilepsia, especialmente del lóbulo temporal, se asociarían con menopausias más precoces (57). Estudios recientes han sugerido que, en general, la mujer que presenta crisis epilépticas durante su vida adulta, alcanzará la menopausia 3 años antes que la población femenina general (56).
Finalmente durante la menopausia, se espera que la gran mayoría de las mujeres experimente una reducción en la tasa de crisis epilépticas. Sin embargo, los estudios publicados señalan que la principal reducción de crisis ocurre en mujeres que han experimentado la epilepsia catamenial, o patrones catameniales en sus crisis, encontrándose reportes que hasta un 69% de dichas mujeres experimentan una reducción de las crisis durante la menopausia (58).
La terapia de reemplazo hormonal en la mujer epiléptica, propia de la menopausia, al igual que en la población general, tendría beneficios demostrados, especialmente en la protección de las osteoporosis, la cual se encuentra exacerbada por la terapia anticonvulsivante (59). Lo importante es determinar que tipo de tratamiento de sustitución hormonal se va a emplear. Deben evitarse preparados con estrógenos exclusivamente, o con testosterona (precursor de estrógenos) pues alteran el metabolismo de los fármacos antiepilépticos y aumentan el riesgo de crisis. Se piensa que lo más adecuado sería combinar terapias con estrógenos y preparados con progesterona natural, lo que minimizaría el riesgo de crisis. Se recomienda igualmente un monitoreo periódico de los niveles de anticonvulsivantes, mientras dure el tratamiento de reemplazo hormonal (60, 61).
La osteoporis es otro problema que debe enfrentar la mujer epiléptica una vez que alcanza la menopausia, período ampliamente conocido por un mayor riesgo de presentarla, por la reducción de las hormonas femeninas. La mujer epiléptica, especialmente por los fármacos anticonvulsivantes, tienen un mayor riesgo de osteoporosis durante toda su vida, pero se incrementa significativamente durante la menopausia.
Según diversos estudios publicados en la literatura, la mujer epiléptica tiene mayor riesgo de fractura, osteopenia y osteoporosis (62-64). El riesgo de fractura sería independiente del tipo de crisis, aunque las crisis tónico-clónico generalizadas tienen mayor riesgo de caídas y traumas, por lo que se asocian a mayor riesgo de fracturas.
Algunos fármacos antiepilépticos son bien reconocidos por su asociación con una mayor pérdida de masa mineral ósea, a través de un mecanismo de inducción enzimática hepática, lo que favorece el catabolismo de la vitamina D (65, 66). Entre estos fármacos destaca el fenobarbital, fenitoína, primidona, carbamazepina y oxcarbazepina (67, 68). Para este grupo de paciente epilépticas se recomienda dietas altas en Calcio y vitamina D, asociado a una adecuada exposición a la luz solar. Algunos autores sugieren el uso de 1000 mg Calcio/ 400 UI Vitamina D, en dosis diarias para la mujer perimenopáusica y 1500 mg Calcio/ 600 UI Vitamina D, en dosis diarias, para la mujer postmenopáusica (69).
Comentarios finalesLa mujer epiléptica requiere un manejo y seguimiento único, que abarque cada etapa de su vida reproductiva, considerando la mejor opción farmacológica antiepiléptica y las variaciones hormonales propias de cada etapa, cuyo objetivo final sea evitar las posibles complicaciones y/o efectos secundarios de la enfermedad o del tratamiento propiamente tal. La mujer epiléptica debe enfrentar mayores riesgos: infertilidad, complicaciones durante el embarazo, teratogenicidad, osteoporosis, entre otros.
Los cambios en los niveles de las hormonas femeninas, propios de cada ciclo reproductivo y lo largo de toda la vida de la mujer, constituye un factor fundamental que puede afectar la frecuencia de crisis epilépticas y alterar el metabolismo de los fármacos antiepilépticos propiamente tal.
Es de suma importancia que el médico entregue una debida educación a la mujer en todas las etapas de su vida reproductiva, procurando un tratamiento individualizado según el ciclo de vida en que se encuentre y planificar en forma conjunta eventos futuros, especialmente el embarazo, de manera de minimizar todos los posibles riesgos maternos y fetales.
Finalmente, como cada vez se disponen de más alternativas terapéuticas para el manejo de la mujer epiléptica en las diferentes etapas de su vida reproductiva, se hace cada vez más necesario un manejo multidisciplinario donde participen neurólogos, ginecólogos y obstetras, buscando optimizar e individualizar el tratamiento según la etapa de vida en que se encuentre la mujer.
Las autoras declaran no tener conflictos de interés, con relación a este artículo.