En el presente artículo se analizan los efectos de la postergación de la maternidad en tres ámbitos:
i) demográfico, ii) clínico y iii) biológico.
Desde luego, la literatura demográfica existente procede fundamentalmente de países con un buen grado de desarrollo, pero se ha realizado un esfuerzo por reunir la mayor cantidad de datos de países en desarrollo. Así se analiza la situación en Europa, EE.UU. y Latinoamérica para finalizar esta sección con la realidad específica en Chile.
Desde el punto de vista clínico, se pone especial interés en los cambios que experimenta la probabilidad de embarazo por ciclo (definida como fecundabilidad) y la fertilidad en general. En los aspectos perinatológicos se enfatiza el incremento de frecuencia de la muerte fetal in útero temprana (aborto espontáneo) y tardía con especial mención de algunas patologías (frecuencia del síndrome de Down y otros). Se establece además la frecuencia significativamente mayor de bajo y muy bajo peso de nacimiento, necesidad de hospitalización del recién nacido (morbilidad perinatal) así como el efecto sobre la mortalidad neonatal.
Biológicamente la postergación de la maternidad tiene su correlato en la pérdida de reserva ovárica y la disminución de la calidad ovocitaria que involucra un aumento en la incidencia de fallas de fecundación y embriones con bajo potencial de desarrollo y aneuploidías dependientes fundamentalmente de la edad materna. También se hace mención a algunos aspectos del envejecimiento uterino y sus consecuencias en el desarrollo y función placentaria. El enfoque se centra fundamentalmente en la mujer, pero incluye aspectos de la contribución masculina a esta temática.
This article analyzes the effects of the postponement of maternity in three areas:
i) demographic, ii) clinical and perinatological and iii) biological.
Of course, the existing demographic literature comes primarily from well-developed countries, but an effort has been made to collect as much data from developing countries. The situation in Europe, the U.S. and Latin America is analyzed to end this section with the specific reality in Chile. From the clinical point of view, special interest is placed on changes in the probability of pregnancy by cycle (defined as fecundability) and fertility in general. In the perinatological aspects, the increased frequency of early fetal death (spontaneous abortion) and stillbirth is emphasized, with special mention of some pathologies (frequency of Down syndrome and others). It is also stressed the significant higher frequency of low and very low birth weight, the need newborn hospitalization (perinatal morbidity), as well as the effects on neonatal mortality. Biologically, the postponement of maternity has its correlation in the loss of ovarian reserve and the decrease in oocyte quality that involves an increased incidence of fertilization failure and embryos with low potential for development and aneuploidies, mainly dependent on maternal age. Some aspects of uterine aging and its consequences on placental development and function are also mentioned. The discussion is mainly focused on women, but includes some aspects of the male contribution to this issue.
Tener el primer hijo después de los 30 años se ha vuelto una realidad cotidiana en muchas partes del mundo. La edad materna al primer parto ha experimentado un fuerte aumento en muchos países a partir de la década del 80 y una de las causas más importantes de este fenómeno es la educación. Es un hecho conocido que los niveles educativos de las mujeres han aumentado a un ritmo más acelerado que los de los hombres en las últimas décadas. La educación femenina tiene un doble efecto de retraso en la edad al primer nacimiento. El primero ha sido denominado “efecto de incapacitación”, porque el inicio y la finalización de la educación son actividades generalmente incompatibles con la crianza de los hijos. El segundo es un “efecto de aspiración”, porque una de las razones por las cuales las personas invierten en su capital humano (incluida, entre otras cosas, la capacitación laboral) es cosechar beneficios económicos en el mercado laboral1. Es probable que el beneficio económico se maximice para las mujeres al retrasar la maternidad. De acuerdo con este punto de vista, en la literatura económica se han enfatizado dos razones principales para posponer el nacimiento de los hijos: el motivo de la planificación profesional y el motivo de moderación del consumo. El primero de ellos, la planificación profesional, plantea que las mujeres tienen su primer hijo cuando es probable que la maternidad ya no represente un obstáculo para su plena realización en el mercado laboral. Esto generalmente ocurre cuando están en la cima de sus carreras o tienen pocas posibilidades de una mayor promoción. Lo anterior deriva del nivel de discriminación de género existente en el mercado laboral de cada país y de la ausencia de instituciones que promuevan la plena conciliación de la familia y el trabajo. El efecto de moderación del consumo está estrictamente relacionado con lo anterior, ya que establece que las mujeres dan a luz cuando es poco probable que los niños afecten negativamente el estándar de consumo de los hogares, es decir, cuando las parejas disponen de suficientes ingresos y riqueza para cubrir los costos agregados. Una interpretación ligeramente diferente de este motivo es que las mujeres (y los padres en general) posponen la maternidad hasta asegurar suficientes recursos que otorguen las mejores oportunidades de vida, o en términos más técnicos cuando tienen los recursos financieros para invertir en calidad de vida infantil2. Otras causas que parecen motivar la postergación de la maternidad son eventuales como no tener una relación de pareja o tener relaciones de pareja inestables. Para ello se ha acuñado el término circunstancialmente sin hijos3 y que se refiere a aquellas mujeres que queriendo tener hijos en algún momento de su vida y que aparentemente son físicamente capaces de concebir, han llegado o se están acercando al final de su vida reproductivas sin haber tenido hijos. Este grupo de mujeres está en la condición de no ser ni “voluntariamente sin hijos” (ya que les gustaría tener un hijo), ni “involuntariamente sin hijos” (ya que no tenían conocimiento de ser infértiles). Desafortunadamente, para este fenómeno que cada vez se hace más frecuente no existen datos aún.
La disminución de la fertilidad con el aumento de la edad y sus bases fisiológicas han sido abordados en profundidad en dos artículos sobre envejecimiento reproductivo en hombres y mujeres. La disminución de la fertilidad femenina con la edad se debe principalmente a la reducción progresiva de folículos en los ovarios y por otra parte a la disminución de la calidad ovocitaria4, factores que difícilmente pueden manejarse o ser corregidos. Las dificultades para concebir (más allá de 12 meses de exposición a embarazo) tienen consecuencias, ya que se ha demostrado que resultan en familias más pequeñas, con un odds ratio (OR) de 1,8 para el riesgo de no tener un segundo hijo y alrededor de 1,6 de no tener un tercer hijo5. La infertilidad representa por lo tanto un obstáculo para alcanzar el tamaño de familia deseado, que promedia en la mayoría de los países europeos en dos hijos. Cuando las mujeres recurren al tratamiento de reproducción medicamente asistida (ART, por sus siglas en inglés) después de 2, 3 o 4 años sin concepción, este procedimiento solo compensa la mitad de los nacimientos perdidos posponiendo los intentos de embarazo entre los 30 y los 35 años, y sólo el 30% de la pérdida después de posponer de 35 a 40 años. En otras palabras, el trabajo de Leridon sugiere que la ART no es capaz de suplir la disminución de la fecundidad por edad6. Además del efecto deletéreo de la edad sobre la fertilidad, la postergación de la maternidad aumenta el riesgo de comorbilidad con amenazas reproductivas para la pareja. Más allá de las enfermedades malignas, otras condiciones médicas pueden disminuir la fertilidad tales como la endometriosis que incrementa su ocurrencia desde los 30 años de edad con una incidencia ajustada por edad de alrededor de un 13,4/100.000, miomas uterinos con una prevalencia de 8-18% y pólipos endometriales con una prevalencia en mujeres pre-menopáusicas de 5,8%7. Esta comorbilidad aumenta el riesgo de problemas reproductivos con cada año de retraso de intentar el embarazo. Además, aumentan los riesgos asociados al estilo de vida como el tabaquismo y obesidad que se acumulan a través de años de exposición.
La presente revisión pretende establecer las consecuencias de la tendencia continua hacia la postergación de la maternidad, en términos de sus patrones en diferentes países y sus consecuencias demográficas, clínicas y biológicas. El Grupo de Trabajo en Reproducción y Sociedad de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) ha publicado excelentes trabajos de revisión acerca de los diversos factores que contribuyen al aplazamiento de la maternidad. Por lo tanto, en el presente trabajo abordaremos los motivos del retraso de la maternidad solo a través de un breve resumen de los principales factores y sus respectivas consecuencias clínicas y biológicas.
Aspectos demográficos del problemaCausas y tendencias de la postergación de la maternidadEn todo el mundo desarrollado, las parejas han retrasado la maternidad a una edad cada vez más tardía durante las últimas tres décadas. Esta tendencia tiende a ser tan generalizada que los demógrafos han propuesto el término transición demográfica de la postergación8. La anticoncepción moderna, especialmente la expansión de la píldora anticonceptiva desde los años 60 mejoraron sustancialmente la planificación del embarazo, permitiendo posponer la crianza para una edad mayor. El aumento del empleo femenino, la expansión de la educación universitaria, el deterioro económico de los adultos jóvenes, el retraso en abandonar el hogar parental y la formación de pareja ya sea con o sin matrimonio, figuran en muchos países como las causas del aumento de la edad media al primer nacimiento entre las mujeres9. Estas tendencias han sido acompañadas por un rápido cambio en los valores familiares, marcados por la resistencia al matrimonio, aumento del divorcio, mayor aceptación a la nuliparidad voluntaria y mayor frecuencia de acuerdos no tradicionales de convivencia. También hay una contribución de la disminución en la brecha de género y el empoderamiento femenino que hace a las mujeres mucho menos dependientes de los hombres. Estos aspectos son más pertinentes en mujeres con educación terciaria quienes tienen más que perder en términos de su carrera en el trabajo, ingreso y estatus social por transformarse en madres y por lo tanto posponen más la crianza que sus contrapartes con menos educación10. A estos factores además se suma un aumento en el desempleo e inestabilidad laboral entre los adultos jóvenes, especialmente en Europa del sur, como también la dificultad de encontrar la pareja adecuada que es citada a menudo como una razón importante para permanecer sin hijos, especialmente en las mujeres que origina la condición circunstancialmente sin hijos.
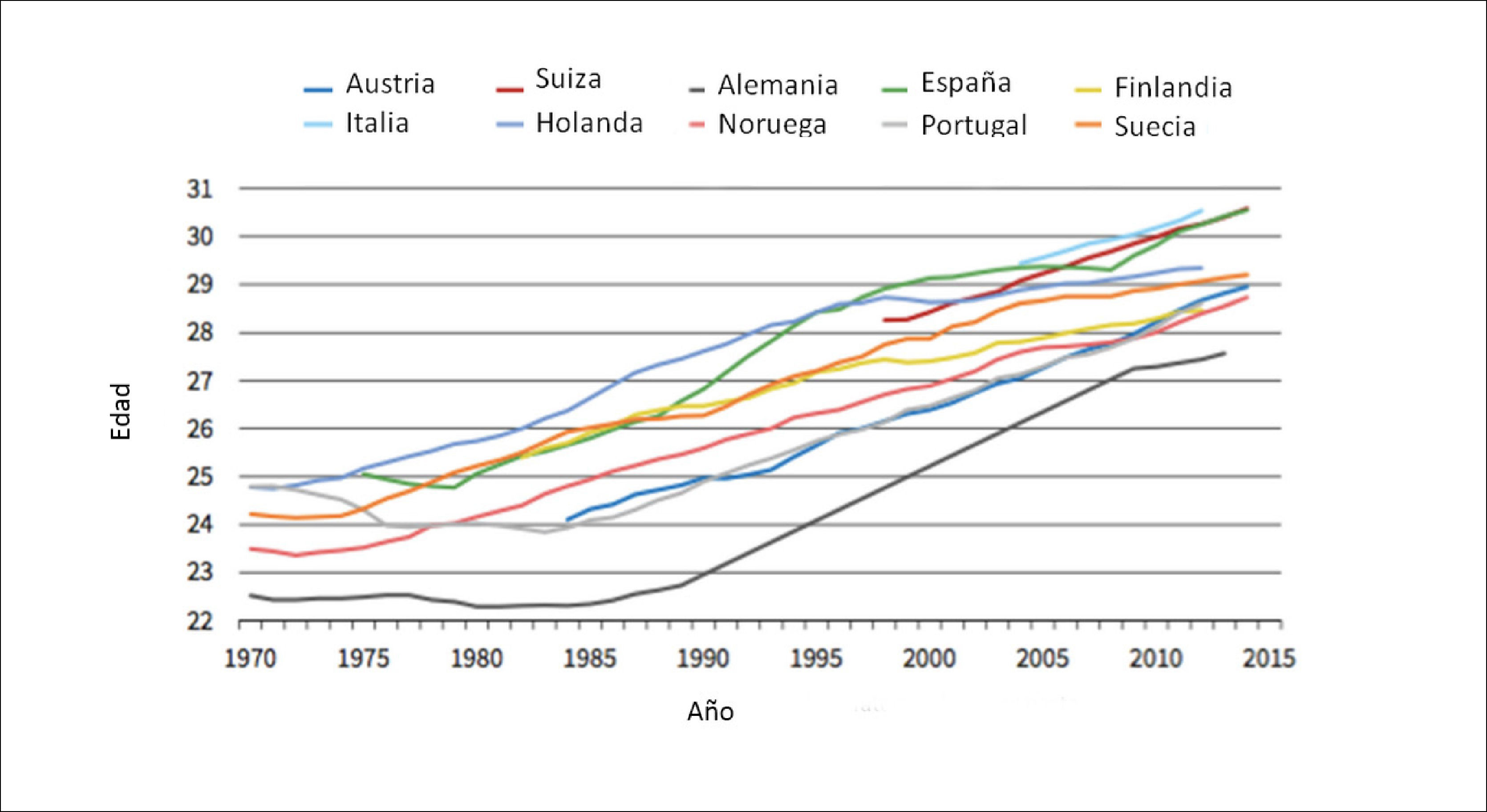
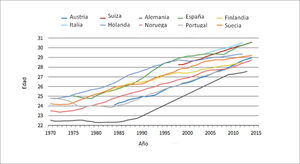
En Europa occidental, del norte y del sur la edad media al primer parto alcanzaba los 28-29 años en 2015, lo que representa un aumento de 4-5 años al comparar con los años 70 (Figura 1)11.
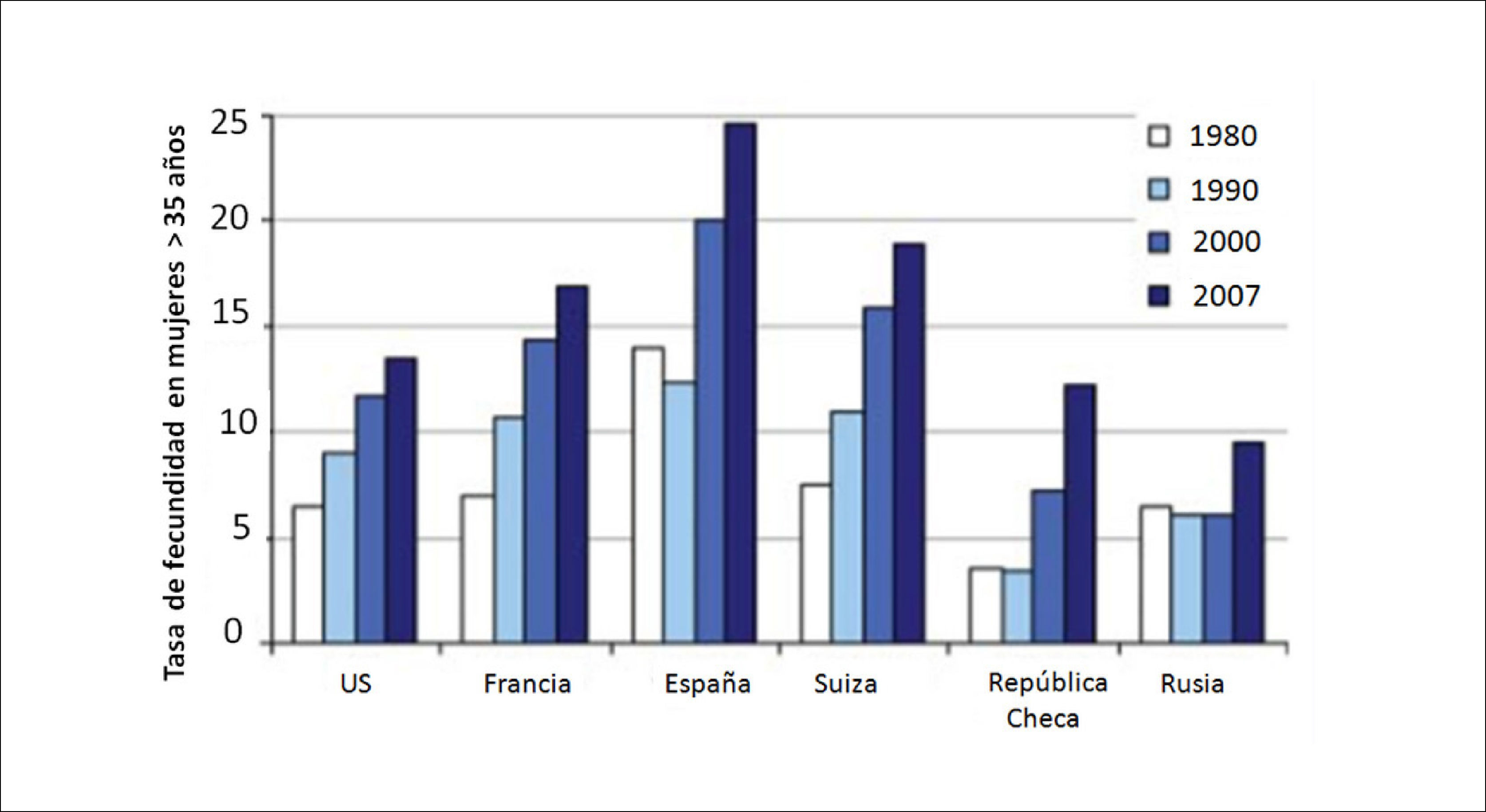
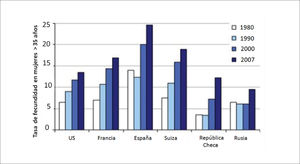
Solo en Europa del Este, especialmente en países de la ex-Unión Soviética y en EE.UU. las primíparas son considerablemente más jóvenes con un promedio de 24-26 años. Esto último se da especialmente en poblaciones hispánicas, de raza negra y en mujeres con menor nivel educacional de EE.UU. Sin embargo, en muchos países la mayoría de los nacimientos ocurren en mujeres sobre los 30 años de edad, con España a la cabeza de esta tendencia con un 60% desde el año 2002 y es el único país de Europa donde desde 2008 poco más del 50% de los primeros partos ocurre después de esa edad. En Francia, esta tasa de natalidad se duplicó del 24% en 1980 al 49% en 2008, mientras que en la República Checa ha cambiado drásticamente del 14% en 1990 al 46% en 2009. En la Figura 2 se observa que las tasas de fecundidad están aumentando rápidamente en mujeres mayores de 35 años.
Sin embargo, la frecuencia de nacimientos en madres de más de 40 años de edad, se mantiene muy por debajo de los niveles históricos alcanzados en el siglo XIX. En las sociedades con familias numerosas y fecundidad poco regulada por el control de la natalidad, un poco más del 10% de la tasa de fecundidad ocurría por sobre los 40 años: en Suecia en 1860 la tasa de fecundidad en mujeres mayores de 40 años alcanzó el 16%, lo que implica que cada sexto hijo nació de una madre de edad avanzada12.
Una población de mujeres hutteritas casadas que no usaban métodos anticonceptivos, tuvo en promedio 1,43 nacimientos por mujer después de los 40 años, es decir, dieron cuenta de tantos nacimientos después de esa edad como el resto de las mujeres en Estados Unidos. Sobotka et al.13 calcularon que las tasas contemporáneas de fecundidad “tardía” eran de entre un 2% (Japón y Rusia) a 7% (Irlanda) de la capacidad reproductiva teórica para mujeres de 40 o más años. Si bien los nacimientos en edades reproductivas extremas han aumentado debido a la ovodonación13, su número sigue siendo marginal. La creciente proporción de mujeres que alcanzan mayores niveles educacionales se relaciona estrechamente con el aplazamiento de la maternidad. Un estudio comparativo de las diferencias de fecundidad por nivel educacional en los países nórdicos encontró que la mitad de las mujeres con educación terciaria nacidas entre 1965-1969 tuvieron hijos entre los 28,9 años (Noruega) y 30,6 (Suecia), lo que fue aproximadamente 3 años más que las mujeres con educación secundaria (entre 24,7 en Noruega y 27,4 en Dinamarca). Además, las mujeres con mayor nivel educacional tienen mayores probabilidades de tener un primer o segundo hijo después de los 35 años. Las circunstancias económicas también son importantes: en Inglaterra y Gales, las mujeres que estaban en la categoría de ingresos del cuartil superior y pospusieron la maternidad para después de los treinta años era el segmento que presentaba una mayor probabilidad de dar a luz en edades reproductivas altas. En Francia, las mujeres en altos cargos experimentaron el mayor aumento en las tasas de fecundidad por sobre los 35 años. Con respecto a la fertilidad masculina, solo hay datos para unos pocos países desarrollados, como Australia, Inglaterra y Gales, Francia y los países nórdicos. Estos muestran que los hombres han retrasado la paternidad en una medida similar a las mujeres14 y su edad es 3 años mayor que las mujeres cuando tienen el primer hijo; por ejemplo, en Inglaterra y Gales, la edad media de los padres alcanzó los 32,4 años en 2007 en comparación con la de las madres que fue 29,3 años. Como los hombres no enfrentan una estricta ‘fecha límite’ biológica para tener hijos, muchos más hombres que mujeres tienen hijos después de los 40 años (alrededor del 10% de los padres en los países con datos disponibles14, aunque el número de hombres que tienen un primer hijo después de los 50 años sigue siendo bajo. En 2007, la proporción de padres mayores de 50 años de la tasa global de fecundidad masculina fue de 0,8% en Dinamarca y de 1,3% en Inglaterra y Gales15. En estas dos últimas regiones, el número promedio de niños nacidos de mujeres de 33 a 35 años aumentó cinco veces desde 0,07 entre 1979-1991 a 0,36 entre 2001-2002. En particular, las mujeres con educación superior y altos ingresos expresaron su intención de tener un hijo a los 35 años. En Austria los datos del año 2001 muestran que el número promedio de hijos que deseaban tener en el futuro mujeres de 35 a 40 años fue de 0,32 para las mujeres con educación secundaria y 0,36 para las mujeres con educación terciaria. Sin embargo, la “Encuesta Austríaca de Generación y Género” de 2008 encontró que el 28% de las mujeres y el 46% de los hombres de entre 35-39 años todavía tenían la intención (cierta o probable) de tener un hijo en el futuro. Estas cifras fueron de 12 y 24% respectivamente a los 40-45 años con porcentajes mucho más altos en mujeres sin hijos (57% a los 35-39 años y 28% a los 40-45 años)16. Estos datos indican que muchas personas tienen intenciones de tener hijos durante el periodo de edad en que existe un riesgo considerable de infertilidad, abortos espontáneos y otros resultados reproductivos adversos.
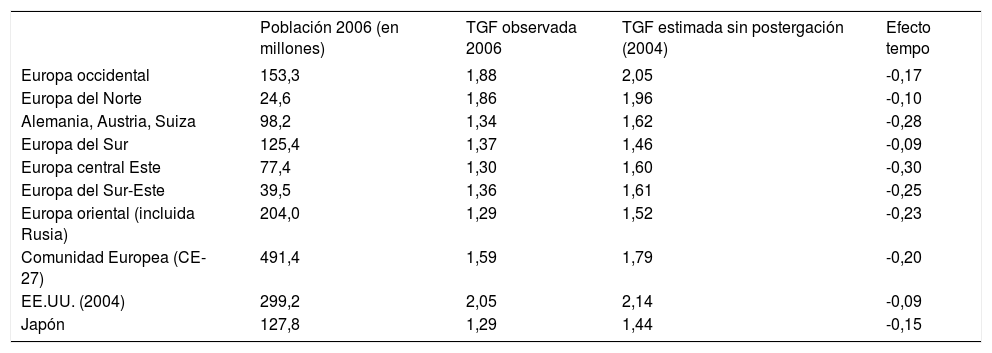
Efectos sobre la fecundidad completa y nuliparidad definitivaHay dos efectos principales del aplazamiento de la maternidad en las tasas de fecundidad. El primero, denominado “efecto tempo” en la literatura demográfica17, el cual surge cuando las parejas posponen la maternidad a edades más avanzadas durante un cierto período y se producen menos partos que en ausencia de tal aplazamiento. El segundo es un efecto deletéreo en la fecundidad completa y aumento de la nuliparidad definitiva atribuible al aumento de la infertilidad relacionado con la edad. El efecto tempo ha tenido una influencia importante y duradera en las tasas de fecundidad de períodos determinados en todo el mundo desde la década del 70. Por ejemplo, si todas las parejas retrasaran la maternidad en tres meses en un año calendario, las tasas de fecundidad observadas se reducirían en una cuarta parte (es decir, 3/12). El aplazamiento de la fecundidad se hizo muy común en muchos países de baja fecundidad durante la década del 90, lo cual generó un efecto tempo que redujo la tasa global de fecundidad (TGF) del período en muchos países a niveles extremadamente bajos como 1,3 hijos por mujer. La Tabla 1 compara la TGF de 2006 observada en las regiones europeas, EE. UU. y Japón y la TGF hipotética que se habría observado en ausencia del efecto tempo, la cual fue estimada utilizando el método de ajuste de Bongaarts y Feeney18.
Tasa global de fecundidad (TGF) del periodo, observada (2006) y estimada en ausencia de postergación (2004) en regiones de Europa, EE.UU. y Japón
| Población 2006 (en millones) | TGF observada 2006 | TGF estimada sin postergación (2004) | Efecto tempo | |
|---|---|---|---|---|
| Europa occidental | 153,3 | 1,88 | 2,05 | -0,17 |
| Europa del Norte | 24,6 | 1,86 | 1,96 | -0,10 |
| Alemania, Austria, Suiza | 98,2 | 1,34 | 1,62 | -0,28 |
| Europa del Sur | 125,4 | 1,37 | 1,46 | -0,09 |
| Europa central Este | 77,4 | 1,30 | 1,60 | -0,30 |
| Europa del Sur-Este | 39,5 | 1,36 | 1,61 | -0,25 |
| Europa oriental (incluida Rusia) | 204,0 | 1,29 | 1,52 | -0,23 |
| Comunidad Europea (CE-27) | 491,4 | 1,59 | 1,79 | -0,20 |
| EE.UU. (2004) | 299,2 | 2,05 | 2,14 | -0,09 |
| Japón | 127,8 | 1,29 | 1,44 | -0,15 |
Para la CE en su conjunto, la TGF observada de 1,59 fue 0,2 menor que la TGF estimada en ausencia del efecto tempo. Incluso ajustando por este último, las tasas de fecundidad siguen siendo bajas en todas las regiones, excepto en EE.UU., Europa occidental, el norte de Europa, Australia y Nueva Zelanda, donde las TGF alcanzaron 1,9-2,1 en 2008. En la mayor parte del mundo desarrollado, las tasas de fecundidad aumentaron entre 1998 y 2008, alcanzando en algunos países niveles no vistos desde la década del 70. La razón más importante de este aumento fue una disminución importante en el aplazamiento de la maternidad, lo cual redujo concomitantemente el efecto tempo19.
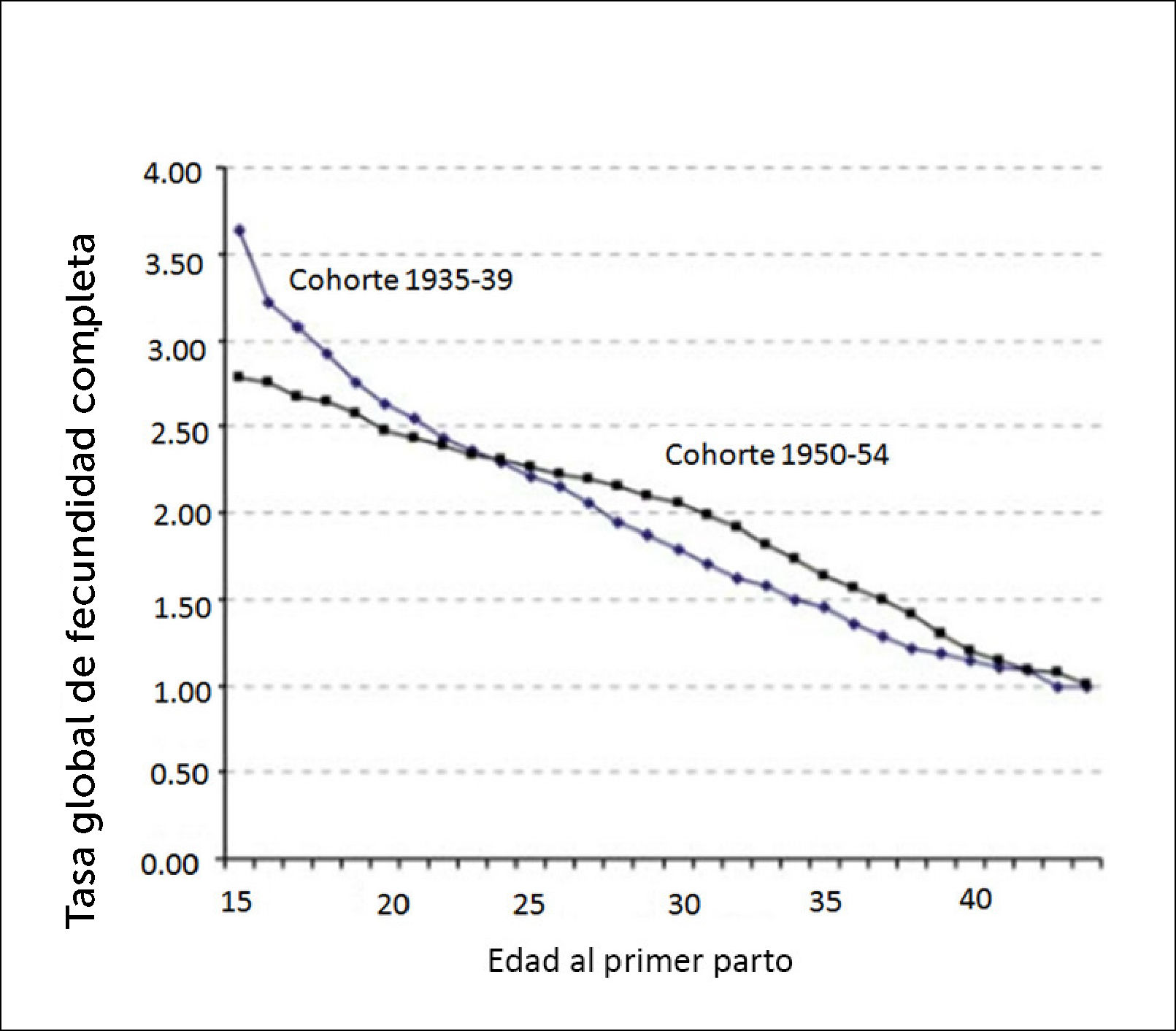
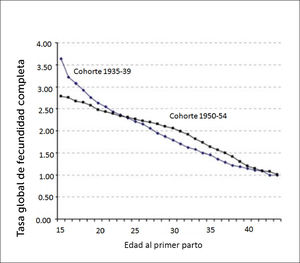
La influencia del efecto del aplazamiento de la maternidad en la finalización de la fecundidad de cohorte y la nuliparidad son difíciles de cuantificar. Primero, cuando las tasas de fecundidad disminuyen, como fue el caso de las cohortes nacidas en las décadas del 50 y 60 en casi todos los países desarrollados, es metodológicamente difícil distinguir qué proporción de esa reducción puede ser atribuida a infertilidad por aplazamiento de la maternidad y la de parejas que solo decidieron tener menos hijos. En segundo lugar, los índices de fecundidad completos de las mujeres nacidas en los años 70 y principios de los 80, que continúan ejerciendo la maternidad a una edad posterior, solo se conocerán una vez que las mujeres alcancen el final de su período reproductivo. La disminución de la fecundidad de cohorte debido al aplazamiento se ha estudiado principalmente utilizando datos sobre la edad al primer parto y la fertilidad posterior, así como modelos de fecundidad, pérdida del embarazo y tiempo de concepción por edad. Las comparaciones simples entre países no muestran una asociación negativa agregada entre la edad al primer parto y la fecundidad. Muchos países europeos que se caracterizan por un patrón de primer parto tardío, por ejemplo, Dinamarca, Francia, Irlanda, Países Bajos y Suecia, muestran las tasas de fecundidad más altas de Europa; mientras que algunos países con primeros partos tempranos, como Moldavia y Ucrania, tienen una fecundidad muy baja. Al analizar los datos de fecundidad de cohortes, Toulemon20 mostró que aquellos países europeos que experimentaron el mayor retraso para el primer parto, paradójicamente, tuvieron las menores disminuciones en la fecundidad completa entre las cohortes de los años 50 y 60. El efecto general de retrasar el primer nacimiento en las tasas de fecundidad completa es una combinación del impacto de la infertilidad y otros factores principalmente conductuales; pero también componentes relacionados con la salud. Billari y Borgoni21, que aplicaron modelos de selección de muestras para estimar los efectos de la edad al primer parto, mostraron efectos importantes sobre la fecundidad en Italia, Hungría, España y Suecia. Un año de retraso en el primer parto redujo la fecundidad completa en un 2,8% en Suecia y un 4,6% en España. Sin embargo, se encontraron efectos mucho mayores para las tasas de progresión del segundo nacimiento, que disminuyeron entre 7,2% (Suecia) y 11,7% (España) con el aplazamiento del primer nacimiento en 1 año21. Si el aplazamiento es de 5 años para el primer parto, la tasa de fecundidad completa se reduce entre 0,14 (Suecia) y 0,23 (España) niños por mujer. Las diferencias considerables del efecto entre países indican que otros factores además de la infertilidad y los factores relacionados con la salud, como la baja compatibilidad profesional y familiar para las mujeres, influyen en la fortaleza de esta asociación. La relación entre la edad al primer parto y la fecundidad completa fue considerablemente más débil entre las cohortes más jóvenes. Andersson et al.22 reportaron que las mujeres suecas nacidas entre 1950-1954 tuvieron menos hijos que aquellas nacidas entre 1930-1934 cuando tuvieron su primer hijo antes de los 24 años, pero tuvieron más hijos que las cohortes anteriores cuando tuvieron su primer hijo entre los 24 y 44 años. Las mujeres de 30 años todavía tenían más de dos hijos (2,06) en promedio en comparación con 1,79 entre la cohorte mayor de 1935 a 1939 (Figura 3).
Morgan y Rindfuss23 reportaron que en EE.UU. entre 1950 y 1989, la cantidad de mujeres que tuvieron un segundo hijo dentro de los 36 meses posteriores al primer nacimiento es inversamente proporcional a la edad. En particular, en el último período analizado, 1975-1989, estas proporciones fueron de 0,38 a 0,39 para las mujeres con su primer nacimiento a la edad ≤24 años, 0,34 a la edad de 25-34 y 0,31 a la edad de 35-39 años.
En la mayoría de los países, la postergación de la maternidad está vinculada a una mayor tasa de nuliparidad y al aumento de la indecisión y ambivalencia sobre la maternidad, no solo debido a la creciente infertilidad con la edad, sino también porque muchas parejas posponen indefinidamente la decisión de tener un hijo hasta que finaliza la vida fértil o se acostumbran a permanecer sin hijos24. Es difícil evaluar los efectos de la postergación de la maternidad en la falta de hijos involuntaria sin contar con encuestas realizadas regularmente y que proporcionen datos adecuados. El modelo de Leridon25 estima el porcentaje de mujeres que permanecen nulíparas al comenzar un intento de embarazo en 6% a los 30 años; mientras que este valor sería de 14%, 34,8% y 78,9% a los 35, 40 y 45 años respectivamente. El aumento estimado de la nuliparidad definitiva se debe en gran medida a un aumento en el riesgo de muerte fetal y solo se atribuye en parte a la disminución de la fecundabilidad (la probabilidad mensual de concepción sea cual sea el resultado).
La situación de América LatinaAmérica Latina se acerca rápidamente a los niveles de reemplazo de fecundidad. Aunque el ritmo de disminución de la fecundidad ha sido desigual en todos los países, los datos recientes muestran que más de la mitad de los 20 países latinoamericanos tenían TGF cercanas o inferiores a los niveles de reemplazo para 200526. Este grupo incluye los cuatro países más grandes de la región: Brasil, México, Colombia y Argentina; así como cinco países con poblaciones que ya han cruzado el umbral de reemplazo (con TGF inferior a 2,1): Uruguay, Chile, Costa Rica, Puerto Rico y Cuba. Los patrones y tendencias de fecundidad en estos niveles bajos pueden estar fuertemente determinados por el comportamiento de las mujeres al ingresar a la maternidad; es decir, por tasas de primeros nacimientos y rangos de edad. Si la maternidad continúa siendo casi universal y temprana, parece poco probable que la región alcance los niveles de fecundidad muy bajos como los observados en varios países de Europa y Asia Oriental. Sin embargo, si una mayor proporción de latinoamericanos opta por tener su primer hijo a edades más avanzadas o no tener hijos, la región podría alcanzar tales niveles de fecundidad.
Hasta ahora, una característica distintiva del proceso de disminución de la fecundidad en América Latina es que se llevó a cabo sin cambios importantes en el inicio de la formación familiar, como lo indican tasas y edades con números bastante estables en la primera unión y el primer parto27. Sin embargo, parece que América Latina ha entrado en una nueva etapa del proceso de disminución de la fecundidad en los últimos años. La proporción de mujeres menores de 30 años que han hecho la transición a la maternidad ha disminuido significativamente en la mayoría de los países latinoamericanos en la última década. En Costa Rica, por ejemplo, la proporción estimada de mujeres que serían madres antes de los 30 años, según las tasas del año de estudio, cayó de más del 80% a aproximadamente el 65% entre 1995 y 2005. Si analizamos esta reducción en las tasas de maternidad entre los adultos jóvenes latinoamericanos encontraremos un cambio novedoso en la edad de inicio de la crianza, renuncia a la crianza o una combinación de ambos.
La comparación de los datos de las Encuestas Mundiales de Fecundidad y las Encuestas Demográficas y de Salud revela que la nuliparidad definitiva ha disminuido en América Latina desde la década del 7028. Sin embargo, la proporción de mujeres sin hijos de 25 a 49 años ha aumentado recientemente en varios países de la región, lo que sugiere que una proporción cada vez mayor de adultos jóvenes pospone (o renuncia) intencionalmente la maternidad.
Rosero-Bixby et al.29 reportaron los niveles y tendencias de la nuliparidad entre las mujeres adultas jóvenes en 16 países latinoamericanos entre 1970 y 2000 con datos de cuatro censos de población. También identificaron los factores asociados con la nuliparidad utilizando datos a nivel individual de una serie de encuestas de 2006 realizadas en 14 países de América Latina. El artículo se centró principalmente en la fecundidad de cohortes, dado que se ha demostrado que los indicadores de período de fertilidad pueden estar distorsionados por lo que Ryder30 llamó efectos de “traducción demográfica”, también conocidos como el efecto tempo. Por ejemplo, mientras las tasas de fecundidad total del período son bajas llegando a 1,2 y 1,3 en varios países europeos, las estimaciones más bajas de fecundidad de cohorte completa en América Latina están en el orden de 1,5 a 1,7 nacimientos entre las cohortes nacidas en los 70. El aplazamiento persistente de los nacimientos disminuye las estimaciones de las tasas de fecundidad del período porque puede haber una recuperación de la fertilidad a edades más avanzadas. Sin embargo, está bien documentado que, en general, “más tarde significa menos hijos”31, o incluso ningún hijo.
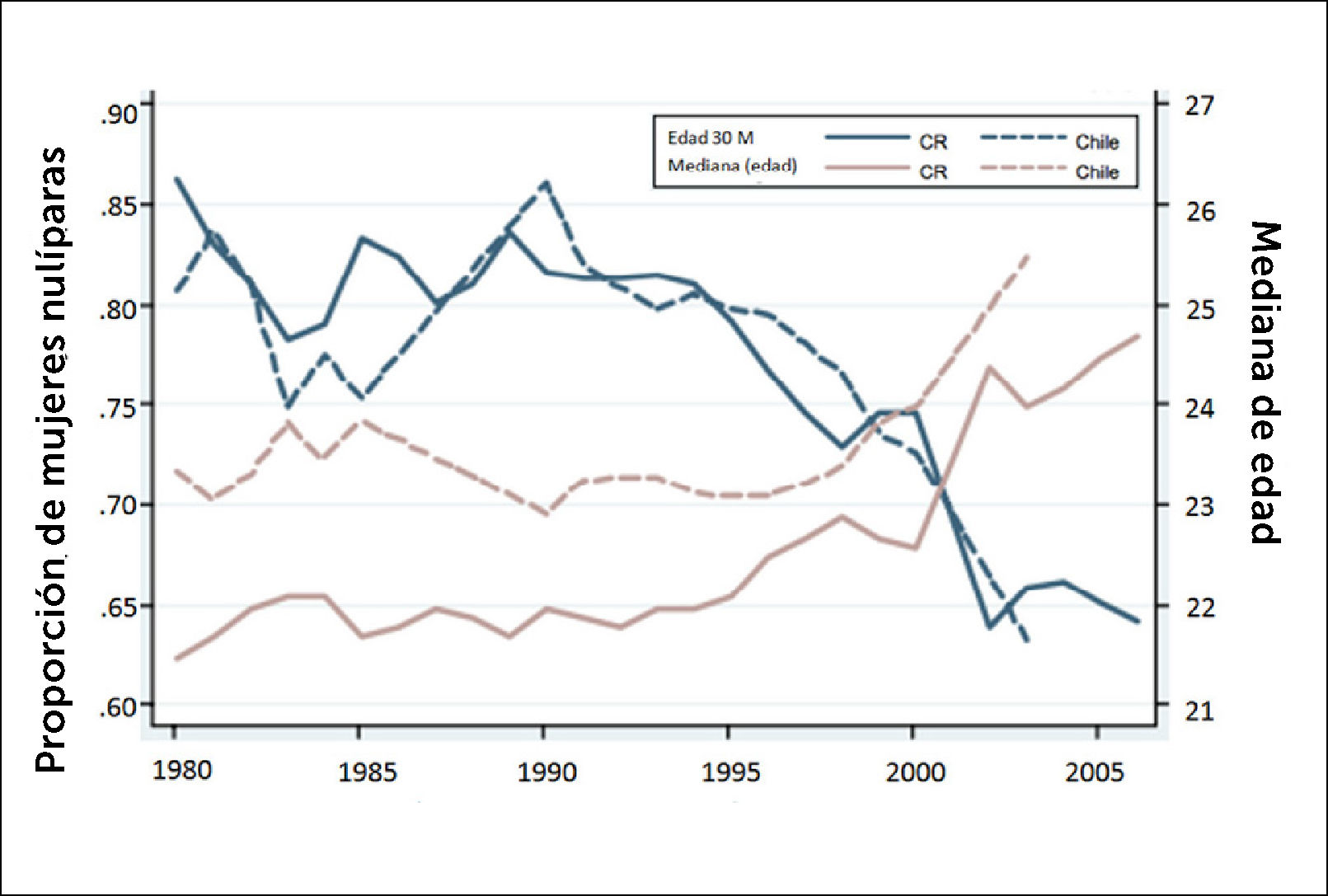
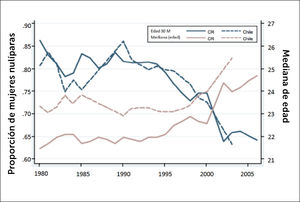
En la Figura 4 tanto en Chile como en Costa Rica (únicos dos países con información suficientemente larga para estos propósitos en Latinoamérica) podemos apreciar los siguientes tres aspectos:
- (1)
no hay tendencias claras antes de 1990;
- (2)
a partir de aproximadamente 1990, hay un claro aumento de casi tres años en la mediana de edad al primer nacimiento durante un período de aproximadamente 10 años; y
- (3)
hay una fuerte caída de casi 20 puntos porcentuales en la cantidad de mujeres que se encuentran nulíparas a los 30 años de edad (M) en la década de 1990.
Chile se encuentra dentro de los países latinoamericanos que más han disminuido su tasa global de fecundidad, superando el nivel de reemplazo de 2,1 hijos por mujer. Según el Instituto Nacional de Estadísticas de Chile (INE), la tasa bajó de 5,4 en 1960 a 1,68 en 2017; generándose un perfil demográfico muy cercano al europeo, destacando además que las mujeres chilenas se embarazan cada día más tarde. Si en los años setenta la edad en que las mujeres en edad fértil tenían su primer hijo era más cercana a los veinte años (22,47 años en 1972), hoy es un proceso que se vive 3 años después aproximadamente (25,04 años en 2016).
Ser madre joven es ahora menos frecuente. De hecho, desde 2010 a 2016 han aumentado en 13,7% los nacimientos de primer hijo en mujeres de entre 25 y 39 años: si en 2010 fueron 39.242 nacimientos, para 2016 esta cifra pasó a 44.646. Al contrario, los niños que nacieron de madres primerizas de entre 20 y 24 disminuyeron en 17,1%, pasando de 35.498 a 29.427, en el mismo periodo.
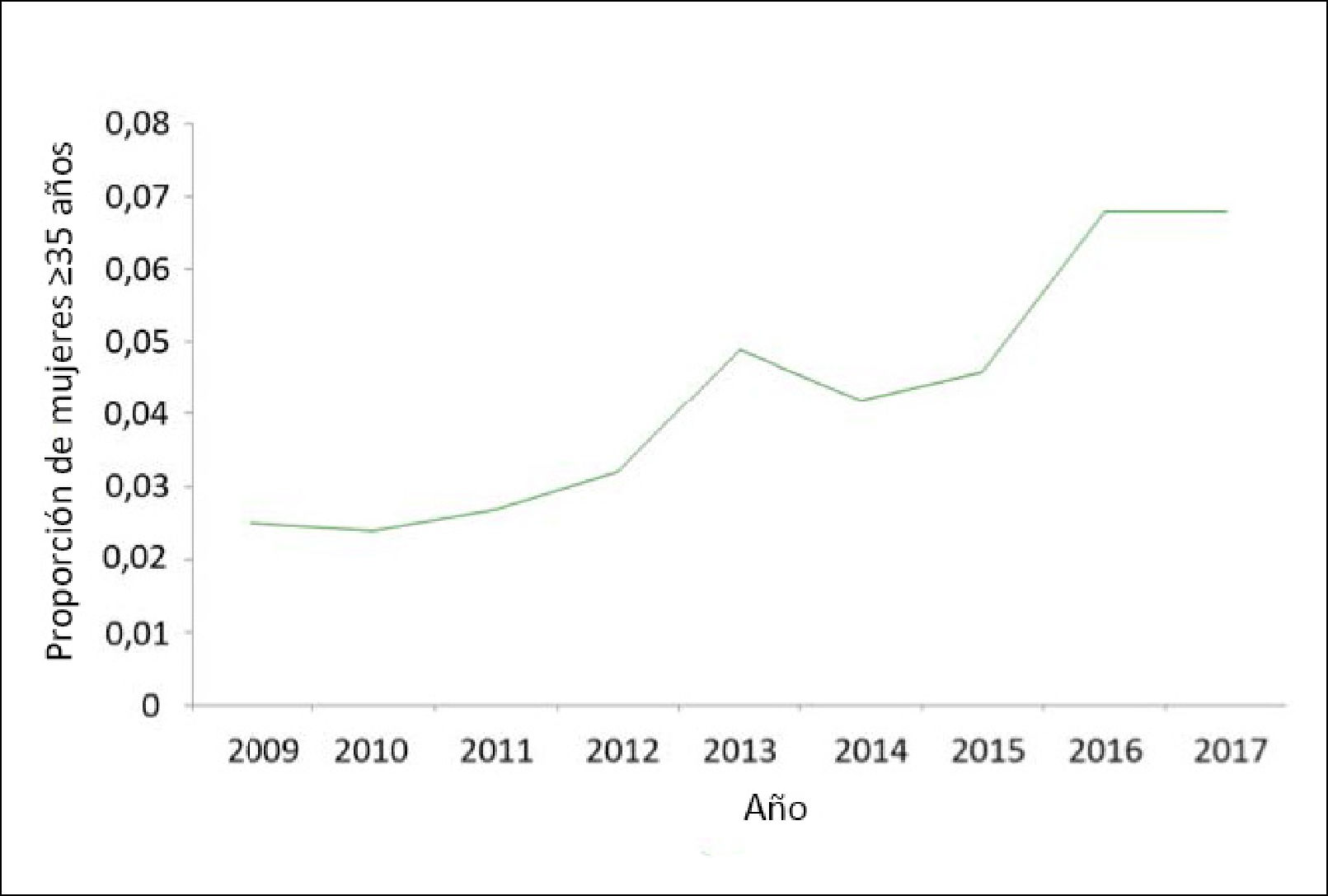
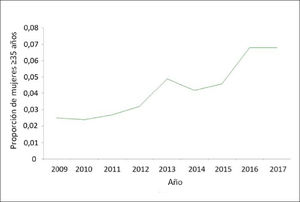
Un estudio realizado por nuestro grupo en 201032 mostró que al comparar la edad al momento de tener el primer hijo entre las beneficiarias de un hospital del sistema estatal de salud que atiende una población de estrato socioeconómico bajo y una clínica privada dirigida al nivel socioeconómico alto, la edad al primer parto era significativamente mayor en el segmento socio-económico alto. Sin embargo, esto ha experimentado un importante cambio epidemiológico ya que al reevaluar la edad de las mujeres atendidas en el Hospital San Borja Arriarán una década más tarde33 observamos que la edad al primer parto está aumentando también en este estrato social, con un incremento anual constante durante los 9 años estudiados. La proporción de mujeres chilenas de este grupo etario ha ido creciendo consistentemente a lo largo de estos 9 años aumentando desde 2,5% en 2009 a 6,8% en 2017 (Figura 5).
Por esto, parece importante comenzar a educar a las mujeres chilenas para que planeen adecuadamente su maternidad y no la posterguen para el final de su vida reproductiva.
Consecuencias clínicas de la postergación de la maternidadFecundabilidad, fertilidad e infertilidadPosponer los intentos de lograr la maternidad hasta una edad reproductivamente avanzada se asocia con un riesgo elevado de infertilidad, prolongación del plazo necesario para concebir y una serie de resultados adversos del embarazo.
La disminución de la fecundabilidad femenina y masculina con la edad se refleja en el aumento de la prevalencia de infertilidad en los estratos de edad avanzada. La prevalencia de infertilidad ha sido estimada de dos maneras en la literatura: aquellas mujeres y parejas que no han logrado un embarazo clínico después de 12 meses de exposición al riesgo de embarazo y aquellas que no han logrado un embarazo con hijo vivo. Como una proporción de embarazos terminan con la muerte fetal, las tasas de prevalencia de infertilidad son considerablemente más altas en comparación con las tasas de prevalencia centradas en embarazo clínico. Van Balen et al.34 informaron que alrededor del 10% de las mujeres de 20 a 28 años eran infértiles y que esta cifra sube a 25% en las mujeres de 35 años en un plazo de 12 meses. En contraste, Gnoth et al.35 no encontraron diferencias de edad en infertilidad (embarazo clínico) en un estudio entre 346 parejas que usaban planificación familiar natural para concebir: la edad media de las mujeres fue 29±3,6 y el 8% no logró concebir dentro de un plazo de 12 ciclos menstruales. Leridon6 muestra que, en condiciones naturales, el 75% de las mujeres que comienzan a intentar concebir a los 30 años tendría una concepción que terminaría en un nacido vivo dentro de los 12 meses. Esto cae a 66% a los 35 años y a 44% a los 40 años. Cuando se usa un período de observación de 48 meses, el 94% de las mujeres que comienzan a tratar de concebir a la edad de 30 años logra una concepción que conduzca a un nacido vivo. Este porcentaje disminuye a 86% a los 35 años y a 65% a los 40.
En un estudio prospectivo de fecundabilidad entre parejas que no estaban usando anticonceptivos, Dunson et al.36 mostraron que el porcentaje de infertilidad, definido como un plazo mayor a 12 meses sin embarazo clínico, fue de 8% entre las mujeres de 19-26 años, el cual aumenta a 14% de 27-34 años y a 18% a la edad 35-39 años. Para los hombres menores de 35 años no se observan efectos sobre la fertilidad, pero a partir de finales de la tercera década el impacto de la edad masculina es pronunciado. Para una pareja en que la mujer tenía 35 años, la prevalencia de infertilidad de 12 meses (embarazo clínico) fue del 18% si la pareja masculina tenía 27-34 años la cual aumenta al 28% si esta última tenía 35-39 años. Cabe notar que la población de estudio tiene un sesgo, ya que las parejas fueron reclutadas de centros para la planificación familiar natural por lo que estas parejas pueden haber experimentado ciclos y ovulaciones más regulares que la población promedio. Sin embargo, un estudio de revisión sobre la fertilidad paterna concluyó que una edad superior a los 30 años es un factor de riesgo de infertilidad37. Sartorius y Nieschlag38 también coinciden con esta conclusión, al menos en parejas donde los hombres son mayores de 40 años y las mujeres tienen al menos 35 años. Por lo tanto, la postergación de la paternidad aumenta el riesgo de infertilidad y la necesidad de un tratamiento de fertilidad para lograr el embarazo, cuya tasa de éxito es más limitada a mayor edad. Respecto a posibles causas de este fenómeno, se ha observado que el aumento de la edad paterna se asocia con disminución de los niveles de andrógenos, deterioro de la calidad de los espermatozoides y daño al ADN de estos últimos6. Esto también puede causar una disminución en la fecundidad de las parejas, contribuyendo al aumento al número de parejas que requieren terapias de reproducción asistida (TRA), especialmente inyección espermática intracitoplasmática (ICSI). En línea con esto Frattarelli et al.39 encontraron una disminución significativa en la tasa de formación de blastocistos en hombres >50 años de edad en parejas sometidas a ovodonación.
Abortos espontáneosEl aumento del riesgo de aborto espontáneo con la edad está bien documentado tanto en concepción natural como con TRA. Los datos del registro nacional de población de Dinamarca entre 1978-1992 que abarca todos los resultados de los embarazos registrados (nacido vivo, mortinato, aborto espontáneo, aborto inducido, embarazo ectópico), muestran que la tasa de aborto espontáneo después de la concepción natural fue del 9,2% en el grupo de edad femenino de 20 a 29 años, 12% a los 30 a 34 años, 19,7% a edad 35-39, 40,1% a la edad 40-44 y 74,7% con ≥45 años40. En una revisión, Leridon6, muestra que la tasa de abortos espontáneos, aumenta de 13,6% a los 25-29 años, a 16% a los 30-34 años, 20% a los 35-39 y 27% a los 40-44. En un estudio de cohorte longitudinal, las tasas de aborto involuntario se mantuvieron más o menos constantes entre 10,3 y 13,5% hasta los 34 años de edad materna, sin embargo, esta aumenta a 17,5% en el grupo de edad de 35-39 años. Los embarazos logrados por TRA son un buen modelo para estudiar el aborto espontáneo, ya que todos estos embarazos son deseados, tienen una edad gestacional bien definida y un buen seguimiento ecográfico y de niveles de hCG. Basados en todos los embarazos clínicos después de un primer ciclo fresco autólogo en Australia entre 2002 y 2005, se demostró que el riesgo de aborto espontáneo en embarazos clínicos fue casi constante entre 10 y 15% en la población de mujeres bajo 35 años de edad. A los 37-38 el índice llegó a 20% para subir a 25-30% en el grupo de 39-40 años de edad41. Un estudio basado en el registro de todas las mujeres que presentaron una hCG positiva dos semanas después de la trasferencia embrionaria en EE.UU. entre 1999 y 2002, muestra que la tasa de aborto espontáneo bajo los 35 años de edad materna fue de 22,4%, la cual aumenta a 27,1% a los 35-37; 36,6% a los 38-39 años y a 51,2% a la edad de 41-42 años.
El aumento de la edad paterna también se ha relacionado con una mayor tasa de aborto espontáneo. En las concepciones espontáneas, la tasa de aborto ajustada por edad materna, se relacionó con la edad paterna de más de 40 años: el riesgo de aborto espontáneo tenía un OR de 2,8 (IC 1,86-4,45) cuando la pareja femenina tenía menos de 35 años, pero el OR aumenta a 5,65 (IC 3,20-9,98) cuando la edad paterna era superior a 40 y la edad materna superior a 3542. En un estudio de más de 17.000 inseminaciones intrauterinas, Belloc et al. encontraron un OR de aborto espontáneo de 1,71cuando la edad paterna era superior a 44 años. Basado en un estudio de cohorte entre 23.821 mujeres embarazadas Nybo Andersen et al.43 encontraron que el riesgo de muerte fetal (aborto espontáneo o mortinato) era 2 veces más alto cuando la edad del hombre superaba los 50 años comparados con aquellos de menor edad y ajustando los datos por edad materna. En línea con este hallazgo, en un estudio en parejas tratadas por fertilización in vitro, Frattarelli et al.39 observaron un aumento significativo de aborto espontáneo en hombres mayores de 50 (41,5% versus 24,4% en menores de 50 años). Sin embargo, no todos los reportes han encontrado esta asociación.
Muerte fetal in úteroLa edad materna también es un factor de riesgo de muerte fetal in útero. En un estudio de cohorte basado en población hospitalaria (1978-1996), Huang et al.44 informaron un OR ajustado para muerte fetal inexplicada de 1,57 (IC95% 0,78-3,18) entre mujeres de 35 a 39 años y un OR de 3,69 (IC95% (1,28-10,58)) entre las mujeres de ≥40 años en comparación con las mujeres de 20 a 34 años. Para resumir, los estudios sobre concepciones espontáneas y asistidas muestran que el riesgo de abortos espontáneos se mantiene relativamente estable hasta la edad materna de 35 años. Desde los 35 hasta los 40 años, la tasa de aborto aumenta alrededor del 15-30%, y se alcanza una tasa del 50% alrededor de los 42 años. En comparación, el efecto de la edad masculina sobre los abortos espontáneos es menos pronunciado, pero la edad masculina de ≥50 años casi duplica el riesgo.
TrisomíasEstá bien establecido que la edad materna avanzada está asociada con mayor riesgo de trisomía 21 o síndrome de Down (SD)45, que es la principal causa de defectos de nacimiento. Por otra parte, Hulten et al.46, muestran un efecto incremental de la edad materna sobre el SD con una incidencia por cada 1.000 nacidos vivos de 0,81 a la edad de 25-29 años; 1,39 a la edad de 30-34; 3,50 a la edad de 35-39; 13,17 a la edad de 40-44 y 32,52 en ≥45 años. Khoshnood et al.47 reportaron que la prevalencia de SD en mujeres embarazadas ha aumentado de 15 por 10.000 en 1981 a >30 hacia finales de los ‘90, pero la prevalencia efectiva del SD entre los niños nacidos vivos disminuyó en alrededor de 3% por año calendario en el período estudiado. Estos datos sugieren un posible rol del aborto inducido en la génesis de este fenómeno.
Consecuencias biológicas de la postergación de la maternidadLa senescencia ovárica es un fenómeno biológico relevante en la postergación de maternidad. Esta se asocia a una disminución de la capacidad reproductora femenina relacionada con la edad, caracterizada por una reducción gradual en la cantidad y calidad de los ovocitos48. Factores de tipo neuroendocrino, genético y ambiental están involucrados en la progresión de la senescencia ovárica los cuales inciden en la reducción de la cantidad y calidad de los ovocitos. A su vez, se ha observado que la mala calidad ovocitaria se asocia a anomalías meióticas, defectos mitocondriales y al deterioro del citoplasma ovocitario; factores claramente vinculados a resultados reproductivos adversos en mujeres con edad materna avanzada49. Adicionalmente se debe considerar la senescencia uterina, lo cual se asocia a una menor tasa de implantación embrionaria, mayor riesgo de complicaciones del embarazo y peores parámetros del recién nacido.
Senescencia ováricaEl envejecimiento ovárico involucra una pérdida progresiva de la reserva de folículos primordiales. El potencial reproductivo de la mujer difiere cualitativamente del masculino ya que la evidencia apunta a que la totalidad de los folículos primordiales se forma durante la vida fetal, conformando lo que se conoce como la reserva ovárica. Esta última se agota progresivamente hasta la menopausia, lo cual determina el fin del potencial reproductivo de una mujer. Sin embargo, el envejecimiento ovárico no solo involucra depleción folicular, sino que también un deterioro progresivo en la capacidad de los ovocitos de ser exitosamente fecundados y originar embriones con buen potencial de desarrollo. Se han descrito numerosos defectos celulares que ocurren en el envejecimiento ovocitario, lo cual afecta negativamente las tasas de fecundación y el potencial de desarrollo embrionario. Además, la incidencia de errores en el número de cromosomas o aneuploidía de los ovocitos aumenta abruptamente a partir de los ∼35 años, pudiendo llegar a un 80% a los 45 años50. Si un ovocito aneuploide logra fecundarse, inevitablemente dará origen a un embrión con alteraciones cromosómicas que tendrá muy pocas probabilidades de implantarse, y si lo hace culminará en un aborto espontáneo o un recién nacido con trastornos genéticos.
Calidad ovocitaria y edadUn aspecto clave del envejecimiento reproductivo es la disminución de la calidad y la cantidad de ovocitos. El impacto de este fenómeno se hace evidente cuando las tasas de embarazo en mujeres de edad materna avanzada aumentan al nivel de mujeres jóvenes cuando se recurre a la ovodonación en TRA51. En mujeres con ovocitos envejecidos, una concepción exitosa es más probable que produzca un aborto espontáneo ya que se observa que se incrementa dramáticamente con el aumento de la edad materna39. El deterioro de la capacidad de los ovocitos de generar embriones viables con la edad, se relaciona con la disminución en la calidad de ciertos componentes de su citoplasma y también como se menciona anteriormente, con el aumento de las aneuploidías cromosómicas.
En humanos, los cromosomas homólogos se recombinan en la etapa de ovocito primario durante el desarrollo fetal para formar una configuración bivalente en la profase I de la meiosis. Esta configuración debe mantenerse durante años, durante los cuales los ovocitos permanecen detenidos (etapa de dictioteno). Eventualmente podrían madurar post-menarquia, activándose la reanudación de la meiosis y la segregación cromosómica. Sin embargo, durante este período prolongado de inactividad, la estructura bivalente de los cromosomas puede debilitarse, lo que lleva a la formación de univalentes o la separación de las cromátidas hermanas en la primera división meiótica. La incidencia de ambos eventos se correlaciona con el aumento de la edad materna y la reducción de la tasa de recombinación52. La anomalía más frecuente es la segregación reversa en la cual ocurre una separación prematura de las cromátidas hermanas en vez de los cromosomas homólogos en la meiosis I. Eventualmente este fenómeno podría corregirse en forma espontánea en la segunda división meiótica. Sin embargo, esto último aparentemente no ocurre con frecuencia y constituye la principal fuente de aneuploidías cromosómicas en ovocitos humanos53. Se ha observado que los ovocitos de mujeres con edad avanzada muestran un compromiso en las moléculas que mantienen unidas a las cromátidas hermanas en el centrómero.
El huso meiótico es responsable de la separación de los cromosomas homólogos y las cromátidas hermanas, por lo tanto, es esencial para garantizar una segregación precisa54. Sin embargo, no solo la integridad huso es relevante en la no disyunción cromosómica, sino que también las proteínas involucradas en la sujeción y separación de las cromátidas. Se ha comparado la morfología de los husos meióticos en ovocitos humanos en la segunda división meiótica (metafase II) entre mujeres jóvenes y de edad avanzada. Las observaciones de microscopía revelan que los ovocitos jóvenes forman husos bipolares compactos, orientados ortogonalmente con respecto a la membrana plasmática con cromosomas dispuestos adecuadamente en la placa ecuatorial y cada polo del huso está asociado con un anillo de proteínas del centrosoma. En el caso de mujeres con edad materna avanzada, casi el 80% de los ovocitos presentan husos más difusos con un perfil alargado y/o más pequeño55. Además, muestran un ensamblaje defectuoso debido a una dinámica caótica de los microtúbulos produciendo husos multipolares y cromosomas unidos irregularmente con ubicaciones que predisponen al ovocito a errores de segregación cromosómica56. Además, el mecanismo de control de ensamble del huso, que es un complejo de proteínas que garantiza una correcta formación del huso antes de la separación cromosómica, pierde eficiencia con la edad materna avanzada57. De hecho, algunas proteínas de este complejo presentan niveles disminuidos en ovocitos de mujeres mayores. Esto impide que se pueda detener la progresión meiótica en caso de una desalineación cromosómica lo cual contribuye a la generación de ovocitos aneuploides en mujeres de edad avanzada57.
Dado que los embriones aneuploides pueden no implantarse, producir un aborto espontáneo o dar origen a un recién nacido con trastornos genéticos, se ha recurrido a la realización de pruebas genéticas que permitan evitar la transferencia de un embrión con anomalías cromosómicas. Para ello, se toma una biopsia embrionaria (un grupo de células del embrión, habitualmente del trofoectodermo) para determinar su integridad genómica lo cual se ha denominado prueba genética preimplantacional para aneuploidías (PGT-A). Aunque el potencial beneficio de la PGT-A aún no se ha establecido con total certeza, la transferencia de embriones diagnosticados por PGT-A como euploides parece reducir el efecto negativo de la edad materna avanzada sobre las tasas de implantación. Por lo tanto, el envejecimiento ovárico no afecta el potencial de implantación de los embriones euploides, sino que reduce en gran medida el número de embriones cromosómicamente normales que se pueden conseguir debido a la disminución de la reserva ovárica y el deterioro en la calidad de los ovocitos.
El PGT-A, que cada día es más utilizado en clínica, ha creado una percepción distorsionada de que los embriones humanos de IVF son en su mayoría aneuploides por lo que se requiere la selección de un embrión con diagnóstico cromosómico normal para lograr el embarazo. Sin embargo, los avances en tecnologías de secuenciación masiva en célula única muestran que solo ∼1 de 10 embriones de IVF contiene un 100% de células cromosómicamente normales58. Esto demuestra que las aneuploidías embrionarias no son un factor ‘todo o nada’, sino que pueden ser en mosaico y su severidad dependerá de la extensión y tipo de alteración. De hecho, se ha reportado recién nacidos genéticamente sanos después de la transferencia de embriones con mosaico cromosómico, lo cual sugiere que durante el desarrollo operan posibles mecanismos de autocorrección genética59. Aunque la no disyunción meiótica es la consecuencia más importante del envejecimiento de los ovocitos, también se ha descrito una mayor incidencia de alteraciones en la disyunción mitótica durante el desarrollo embrionario temprano. Esto contribuye a explicar la alta incidencia de mosaicismo cromosómico en embriones de mujeres de edad avanzada.
Otra de las razones de la disminución de la calidad del ovocito con la edad se relaciona con la función mitocondrial60. Todas las mitocondrias del embrión son de origen materno, que derivan de aquellas contenidas en las ovogonias y que permanecen con esa célula durante toda la ovogénesis. Este organelo posee su propio DNA (DNAmt) y constituye la principal contribución materna a la embriogénesis. Cumple un rol muy importante durante maduración citoplasmática y nuclear de los ovocitos también durante la formación del huso meiótico. Su función también es clave durante las primeras fases del desarrollo preimplantacional. También se ha observado que, en ovocitos de pacientes con edad materna avanzada, las mitocondrias presentan alternaciones morfológicas y funcionales. El envejecimiento ovocitario también se asocia con un aumento en la agregación mitocondrial en los ovocitos, una reducción en el contenido de DNA mitocondrial (DNAmt) y una reducción en las concentraciones de ATP citoplasmático en los ovocitos en metafase II. Esto último incide directamente en alteraciones en el ensamblaje del huso meiótico, regulación del ciclo celular y segregación cromosómica de ovocitos envejecidos61. Por otro lado, el DNA mitocondrial carece de histonas protectoras y mecanismos eficientes de reparación de su DNA. Por lo tanto, la tasa de mutaciones del DNAmt es ∼25 veces mayor que la del DNA nuclear. De esta manera, cuanto más largo es el período de reposo, mayor es la probabilidad de acumular mutaciones en el DNAmt. También se ha descrito que la concentración de ADNmt esta disminuida en los ovocitos de pacientes mayores, lo que se correlaciona con una menor competencia de ovocitos y embriones62. Se ha propuesto que el contenido de DNAmt en biopsias de trofectodermo en la etapa de blastocisto podría eventualmente ser un biomarcador del potencial de implantación. Sin embargo, los estudios clínicos realizados hasta la fecha han mostrado resultados controversiales. Las mitocondrias también están presentes en las células de la granulosa (GC) que rodean al ovocito desde las primeras etapas de la ovogénesis. Las GC están directamente involucradas en la fisiología del ovocito a través del diálogo bidireccional que se establece entre ambos63. Se ha descrito que las GC de mujeres con edad materna avanzada poseen altos niveles de deleciones en el DNAmt y daño mitocondrial. También se ha visto que la cantidad de DNAmt en las GC se correlaciona con la calidad del embrión. Esto sugiere que tal como las mitocondrias del ovocito posteriormente apoyan el desarrollo embrionario temprano, las mitocondrias de las GC apoyan la maduración de los ovocitos; de manera que las poblaciones mitocondriales de ambos (CG y ovocito) modulan la competencia embrionaria. Esta hipótesis es concordante con la alta correlación entre los niveles de DNAmt en ambos compartimentos del folículo64.
Además de la biología mitocondrial, el envejecimiento también tiene un efecto deletéreo sobre la regulación de la actividad transcripcional de los ovocitos, la cual es necesaria para la maduración citoplasmática y las divisiones meióticas. En particular, se ha observado alteraciones en la regulación de proteínas involucradas en el control transcripcional, lo cual tiene como consecuencia fallas en la meiosis, progresión del ciclo celular y extrusión del polocito I en ovocitos envejecidos. Esto último incide en una mayor frecuencia de cigotos de tres pronúcleos (3PN) en mujeres de edad materna avanzada, producto de un compromiso en la extrusión del polocito II.
Adicionalmente, tanto la zona pelúcida como la membrana plasmática de los ovocitos envejecidos experimentan cambios estructurales que los predisponen a fallas de fecundación, lo que se traduce en menores tasas de fecundación o una mayor incidencia de poliespermia debido a fallas en los mecanismos que la previenen. Además, aumenta el riesgo para de desarrollar un embarazo molar de origen androgénico65.
Los telómeros son regiones de DNA no codificante que protegen los extremos de los cromosomas. Su función es esencial para la meiosis ya que, durante la profase temprana, los telómeros unen a los cromosomas con la envoltura nuclear para facilitar el apareamiento entre homólogos y formación de quiasmas, evitando así la no disyunción. Se ha demostrado que los telómeros son más cortos en los ovocitos de mujeres con ciclos fallidos de IVF o aborto espontáneo recurrente, así como en los ovocitos que originan embriones fragmentados o aneuploides66. Dado que los telómeros se van acortando con la edad, es posible que la reducción de su longitud en mujeres con la edad materna avanzada contribuya a la disminución de la calidad ovocitaria.
Efectos del envejecimiento uterinoAdemás de los efectos del envejecimiento discutidos anteriormente en el ovario, el útero aparentemente también se afecta con el paso del tiempo lo cual incide en la capacidad de lograr y mantener un embarazo. El modelo de ovodonación proporciona un paradigma muy útil para evaluar el papel del envejecimiento uterino en el potencial reproductivo. Los estudios que utilizan el modelo de ovodonación han mostrado tasas similares de implantación, embarazo, aborto espontáneo y parto en ovoreceptoras de diferentes edades67, lo que sugiere que la función uterina para permitir el embarazo se conserva incluso a edades más avanzadas. Sin embrago, recientemente se ha descrito una asociación entre el aumento de la edad materna con una disminución de la tasa de implantación de embriones euploides. Este estudio incluyo un total de 8.175 transferencias de embrión único autólogo euploide después de hacer PGT-A. Estas se dividieron en cinco grupos por edad de la paciente: <35, 35-37, 38-40, 41-42 y >42. Después de ajustar por factores confundentes, las mujeres ≥38 años tuvieron una tasa de implantación significativamente menor que las <35 años (OR 0,85 para 38-40 años; 0,69 para 41-42 y 0,69 para >42). Estas diferencias también fueron significativas para la tasa de embarazo clínico y la tasa de recién nacido vivo.
Este resultado sugiere que, aunque la aneuploidía es uno de los factores más importantes en la disminución de la fecundidad con la edad, también habría otros factores posiblemente de origen uterino que estarían involucrados. Desafortunadamente hasta ahora no hay datos en humanos respecto a deterioro de la función endometrial por envejecimiento. Sin embargo, estudios en modelos animales muestran que la edad materna avanzada disminuye la fertilidad incluso cuando se transfieren blastocistos de hembras jóvenes a receptoras mayores, hay una mayor tasa de falla de implantación68. Si bien la causa subyacente de este efecto dependiente de la edad no está clara, se presume que la edad avanzada podría afectar el proceso de decidualización endometrial.
El envejecimiento uterino también podría afectar la mantención del embarazo dada la asociación entre el aumento de la edad materna y la muerte fetal; asociación que se mantiene incluso ajustando por comorbilidades y otros factores confundentes. En consecuencia, el riesgo de muerte fetal en madres mayores de 40 años es aproximadamente el doble que el de las madres más jóvenes, aunque el riesgo absoluto sería <10 por 1.000 nacimientos. Aun no se tiene completa certeza respecto a la biología que subyace a esta asociación, pero podría relacionarse con un deterioro en la función decidual y placentaria69.
El embarazo y parto exitoso de una receptora de ovodonación de 70 años demuestra anecdóticamente que el útero puede albergar un embarazo mucho más allá del período de fertilidad natural. Sin embargo, las receptoras de ovocitos tienen un riesgo casi 2 veces mayor de complicaciones perinatales, parto prematuro y bajo peso al nacer en comparación con las mujeres que usan sus propios ovocitos después de ajustar por otros factores maternos51. Colectivamente, estas evidencias sugieren que la decidualización y la placentación pueden verse negativamente afectadas por la edad materna, sin embargo, se requieren más estudios al respecto. También se debe considerar que la primiparidad de mujeres de edad materna avanzada se correlaciona negativamente con los parámetros del recién nacido al parecer por una menor capacidad vascular del útero y placenta70. Se ha observado que independientemente de la paridad, la perfusión uteroplacentaria disminuye a medida que las mujeres envejecen, lo que puede afectar el crecimiento fetal e incluso contribuir a un mayor riesgo de mortalidad perinatal70.
Perspectivas futurasNo es posible aun asegurar que la postergación de la maternidad constituya un patrón que progresivamente se extenderá a la población en su conjunto. Los niveles de desigualdad en el mundo y especialmente en América Latina, y los procesos sociales que provocan cambios en el tamaño familiar en los diferentes estratos continúa observándose de manera muy heterogénea. Esta polarización socioeconómica que caracteriza a muchas sociedades latinoamericanas representa una barrera difícil de superar en la difusión de los valores sociales con respecto a la familia, la paternidad y el calendario óptimo para las transiciones de la edad adulta. Sin embargo, parece claro que el imperativo social de la maternidad temprana que prevaleció durante la mayor parte del siglo XX ha comenzado a experimentar transformaciones. Siendo el aplazamiento de la maternidad una tendencia emergente, no muchos países latinoamericanos han invertido en la investigación demográfica en los últimos años. Los estudios de cohortes parecen ser la respuesta que ha encontrado el mundo desarrollado para abordar el efecto de esta problemática y aislarlo adecuadamente de las variables confundentes brevemente señaladas en esta revisión. Adicionalmente, se requiere examinar la prevalencia y las correlaciones de la falta de hijos entre los hombres, ya que el género representa una variable clave para el análisis de las expectativas socioculturales y las oportunidades competitivas que configuran las actitudes, las decisiones y el comportamiento de la fecundidad.