El desarrollo de la cadera comienza in útero y termina con la cadera adulta. Existe consenso en la necesidad de un screening que combine en forma eficiente la evaluación clínica con los estudios de imágenes para conseguir un diagnóstico certero y un tratamiento precoz. Tanto la radiografía como la ecografía permiten la caracterización de la cadera con diferencias técnicas que sustentan sus debilidades y fortalezas. La indicación y oportunidad de estos estudios está condicionada en nuestro medio por nuestra historia de screening universal con radiografía simple. El objetivo de esta revisión es actualizar conceptos en una patología prevalente y cuyo manejo genera controversias.
The development of the hip begins in uterus and finishes with the adult hip.
Consensus exist in the need to have a screening combining in efficient form the clinical evaluation with the images studies in order to get a accurate and precious diagnosis.
X-ray and ultrasound are useful to obtain a characterization of the hip with technical differences that support their weaknesses and fortresses.
Indication and opportunity of these studies are also conditioned in our country by our history of universal screening with x-ray.
The objective of this review is to bring up to date concepts in a prevalent pathology with controversial management.
El desarrollo de la cadera
No deja de ser un desafío hacer una revisión sobre una patología que desde su definición es tema de debate (1, 2). De los múltiples intentos de definición que es posible encontrar en la literatura y que consideran tanto las alteraciones estructurales como el proceso que lleva a ellas, podríamos decir que el concepto de displasia del desarrollo de la cadera, establece como eje de la patología la anormal relación entre la cabeza femoral y el acetábulo y la sobrecarga mecánica acumulativa que daña las estructuras articulares y que puede causar artrosis. Esta más amplia definición nos permite cobijar bajo el concepto de alteración del desarrollo, a la displasia del desarrollo de la cadera (3, 5), a la epifisiolisis (6, 8) y al pellizcamiento acetabular (1, 4, 9), en caderas que no logran alcanzar la plenitud estructural y funcional, más allá del inicio de la marcha. Estas alteraciones serían el resultado de la influencia de múltiples genes sobre nuestra historia de adaptación a la marcha bipodal, interacción que producirían un determinado tipo morfológico de cadera, el que asociado a un cartílago genéticamente vulnerable, favorecerían el daño articular precoz (9, 10).
La mayoría de los rasgos que caracterizan a la pelvis humana de desarrollan durante la vida fetal (10). Desde el punto de vista embriológico, durante el desarrollo de la cadera se produce el reencuentro de dos estructuras, la cabeza femoral y el acetábulo, que formaron parte de un solo bloque de mesénquima hasta la semana 8 de gestación y que se constituyen en una articulación aproximadamente durante la semana 11. Desde ese momento, la cabeza femoral crece mucho más rápido que el acetábulo lo que determina en este período la menor cobertura de la cabeza por parte del acetábulo. A contar de la semana 12 de gestación las extremidades inferiores se reacomodan, rotándose medialmente, situación que favorece la dislocación. Alrededor de la semana 18 se desarrollan los músculos de la cadera momento en que las alteraciones neuromusculares dan cuenta de un segundo momento de riesgo de dislocación en la vida intrauterina. El resultado de las alteraciones producidas durante las semanas 12 y 18 se conoce como luxación teratológica y corresponde aproximadamente al 2% de los pacientes con displasia de caderas (1).
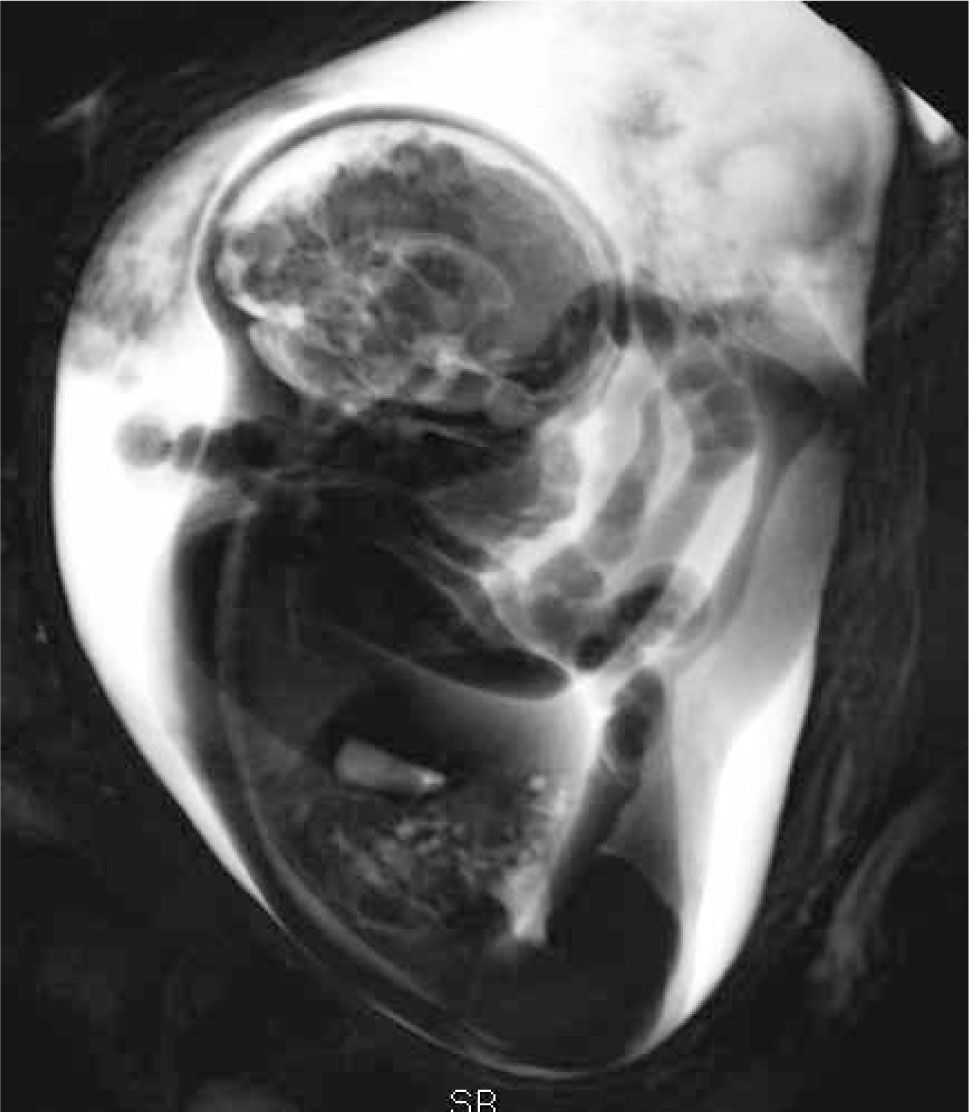
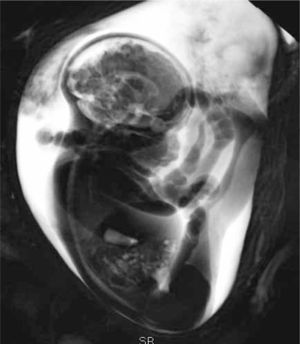
Durante las últimas 4 semanas de gestación reaparece el riesgo de luxación, en relación a factores mecánicos, como son aquellos relacionados a oligoamnios o a presentación podálica (figura 1). Los fetos en presentación podálica se encuentran en la cavidad uterina con las rodillas extendidas y las caderas en flexión, situación que se asocia a una franca mayor frecuencia de displasia, reportada como cercana al 23% (11).
Desde el momento del nacimiento, el acetábulo acelera su crecimiento, aumentando la cobertura de la cabeza femoral, pero manteniendo una cápsula laxa que permite la dislocación y la recolocación de la cabeza femoral. El fémur proximal se encuentra constituido principalmente por cartílago; la osificación de la cabeza femoral parte con un centro secundario que aparece entre los 2 y los 7 meses de edad, momento en que las discusiones y controversias sobre el screening cesan en la literatura.
Sin embargo, la cadera continúa su desarrollo, con osificación progresiva del cartílago tri-radiado y del fémur proximal, con disminución del ángulo acetabular y con aumento del ángulo centro-borde, apreciándose los mayores cambios en estos parámetros alrededor de los 8 años (12). Más tarde, durante la pubertad, las epífisis presentes en el aspecto lateral del acetábulo progresan en su desarrollo y aumentan la profundidad del acetábulo (13). El labrum se desarrolla paralelamente contribuyendo también a la profundidad y estabilidad del acetábulo (14). De esta forma, el proceso normal de formación de la cadera, que comienza en la vida fetal con la aparición y crecimiento de estructuras óseas, musculares y ligamentosas está lejos de completarse con la aparición del núcleo de osificación de la cabeza femoral y en verdad concluye con la cadera estructuralmente adulta y funcionalmente competente.
En relación a la extensión del proceso de crecimiento y desarrollo de la cadera más allá de los límites de cualquier screening propuesto, existe entre nuestros colegas la experiencia de pacientes con displasia de presentación tardía, que debutaron clínicamente luego de tener examen físico e imágenes normales a los 3 meses. Estos casos se suman a los reportes en la literatura sobre pacientes que se presentaron con displasia entre los 6 meses y los 19 años, con screening clínico e imágenes normales, con y sin historia de inestabilidad o luxación al nacimiento (15, 19).
Incidencia, historia natural y screeningLa historia natural de la enfermedad es variable, hecho que hemos podido apreciar en el seguimiento de nuestros propios pacientes. Algunos pacientes pueden tener inestabilidad al nacimiento y normalizarse posteriormente; pacientes con displasia acetabular, sin inestabilidad pueden evolucionar con caderas normales sin tratamiento; pacientes con displasia anatómica e inestabilidad demostrarán cambios progresivos, aplanamiento del acetábulo y desplazamiento superior y lateral de la cabeza femoral, con la consecuente limitación funcional.
El primer reporte de inestabilidad clínica data de 1879 (20). La verdadera incidencia ha sido siempre debatida debido a la ausencia de un método considerado universalmente como “estándar dorado” para el diagnóstico (11). La prevalencia entonces ha sido también variable en la literatura dependiendo del método de screening utilizado. En nuestro medio se estima en aproximadamente 1 por 500 niños nacidos vivos lo que determina la aparición de aproximadamente 400 casos nuevos al año (21). Clarke y sus colaboradores recientemente reportaron una incidencia de inestabilidad neonatal de 15 a 20 por 1000 nacidos pero con incidencia de franca dislocación en 1 a 2 por 1000 nacidos de la población no sometida a screening (15), lo que apoya el concepto de la resolución espontánea de un porcentaje importante de pacientes y mantiene la controversia sobre el sobrediagnóstico.
A pesar de la importancia del examen físico (22), el diagnóstico precoz de displasia requiere la participación de las imágenes. El examen clínico requiere habilidad y paciencia. El examen centrado en la pesquisa de asimetría tiene el riesgo de pasar por alto una alteración bilateral. El examen además se modifica a medida que el recién nacido crece, sin signos patognomónicos de dislocación. Por otra parte, los signos clínicos pueden estar ausentes en pacientes con displasia acetabular sin luxación (11). Es por esto que a pesar de las controversias e inconsistencias en la literatura, la mayoría coincide en la utilidad de un screening con imágenes para disminuir la prevalencia de displasia con luxación.
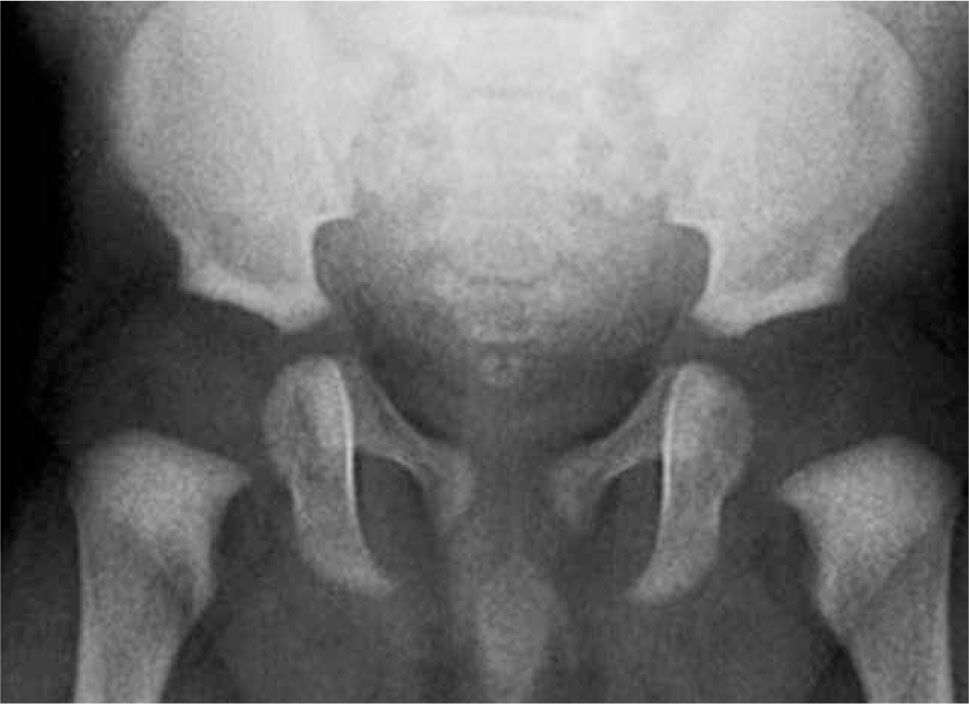
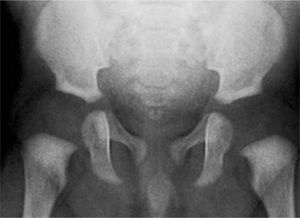
La radiografía ha sido tradicionalmente utilizada en la evaluación de pacientes con displasia de caderas. Sin embargo, por la naturaleza cartilaginosa de la cabeza femoral hasta los 4 o 6 meses, su valor en la literatura ha sido considerado como limitado en el diagnóstico precoz a pesar de su amplia disponibilidad y de su bajo costo, reservando su uso para el diagnóstico durante la lactancia tardía y en el seguimiento de pacientes en tratamiento (11, 20). Desafiando la opinión mundial, en el año 1968 el radiólogo chileno doctor Armando Doberti, reportó el hallazgo de un signo precoz en el diagnóstico de displasia de cadera utilizando radiografía simple. El notó que la cabeza femoral, aun en estado cartilaginoso es responsable de la formación y ubicación de la foseta acetabular. Por otra parte, describió también que el techo acetabular presenta mayor densidad sobre la foseta, por el impacto ejercido por la cabeza femoral cartilaginosa, por lo que no sería necesario esperar la osificación de la cabeza femoral para determinar su localización. El mismo artículo establece que el ángulo formado por el techo acetabular y la línea horizontal (oblicuidad del techo) es independiente del tamaño, profundidad o localización de la foseta acetabularm (23) (figura 2).
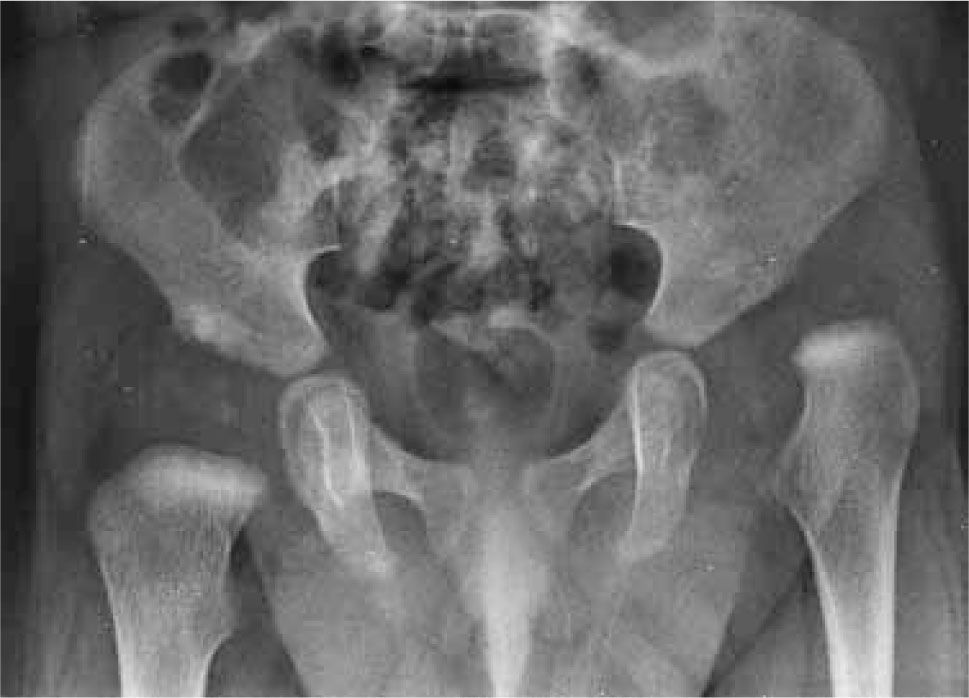
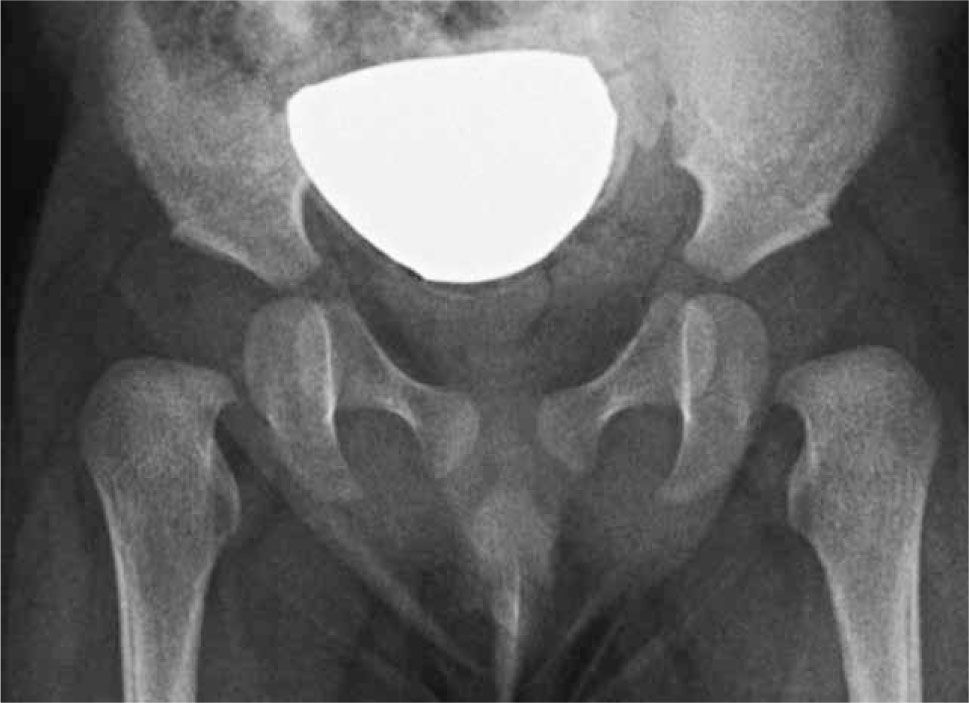
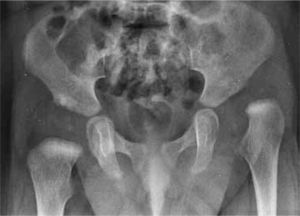
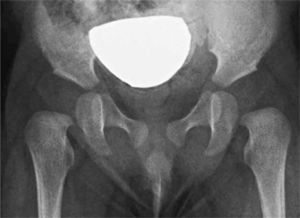
La aparición de estos conceptos marca para nosotros el comienzo de nuestro screening local con radiografía a los 3 meses de vida. La cadera radiológicamente normal entonces, tiene una foseta acetabular central como hallazgo cardinal; la presencia de una ceja cotiloídea bien desarrollada, de un techo acetabular con angulación menor de 30°, de un núcleo de osificación de la cabeza femoral bien situada y la continuidad del arco de Shenton, son hallazgos adicionales que acompañan una relación articular saludable. La implicancia en el pronóstico de cada uno de estos signos sin embargo, no ha sido determinada todavía (20). Esto pudiera explicar, por ejemplo, que si bien existe acuerdo en el aspecto de la cadera considerada normal por radiólogos, traumatólogos y pediatras, existen matices en el diagnóstico de displasia entre los diferentes especialistas (figura 3). Así, si bien la presencia de la foseta acetabular debiera ser el hallazgo central que nos indica que la cabeza femoral se encuentra apoyada en buena posición, en ausencia del soporte estadístico, el signo se debilita en presencia de una ceja cotiloídea escasamente desarrollada o de un arco de Shenton incompleto (figura 4).
Displasia de cadera izquierda con luxación. Techo acetabular de oblicuidad aumentada, con mínimo desarrollo de la ceja cotiloídea. El fémur se encuentra lateralizado y desplazado superiormente; la cabeza femoral cartilaginosa no se encuentra apoyada en el acetábulo concordante con la ausencia de esclerosis de la foseta acetabular.
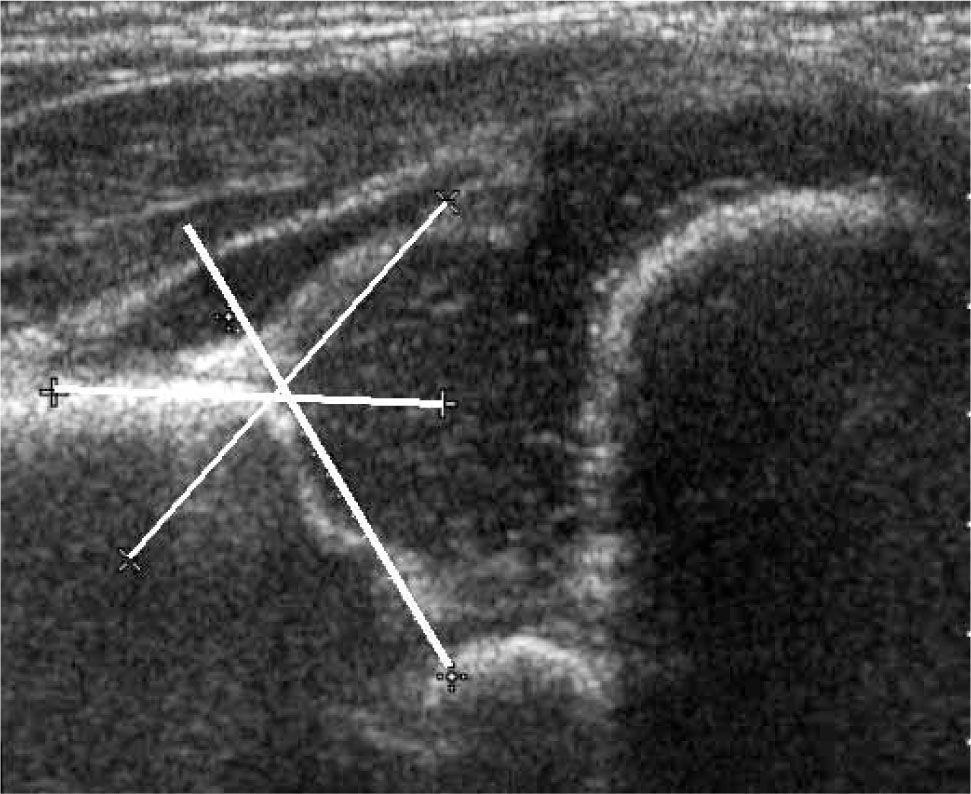
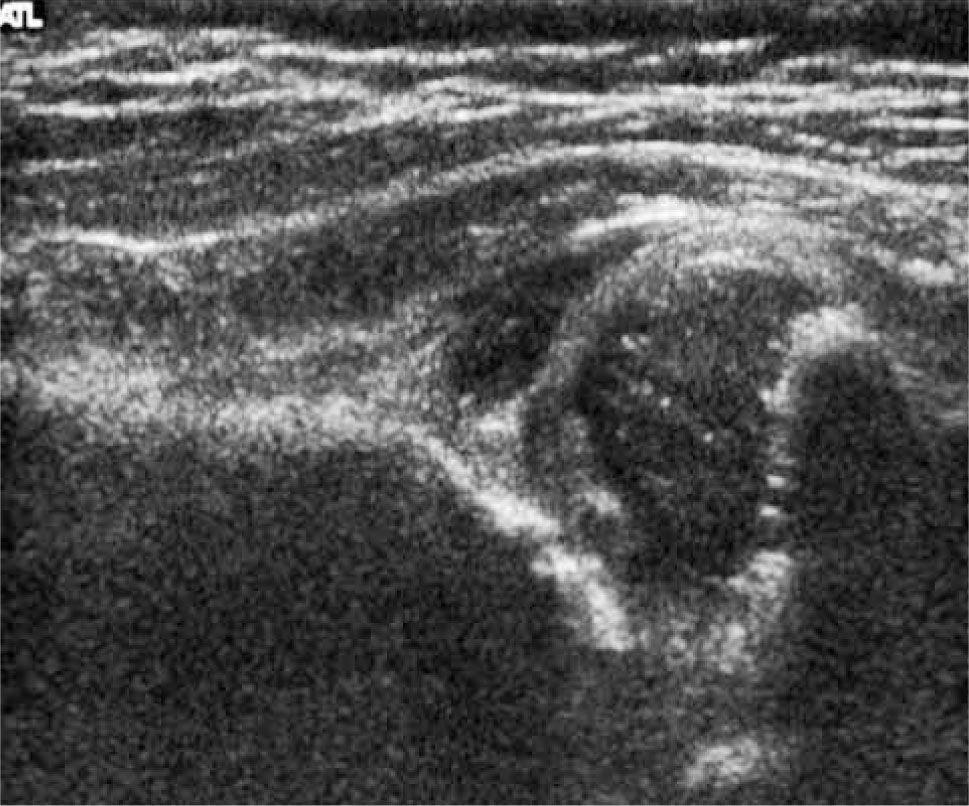
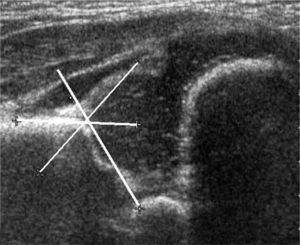
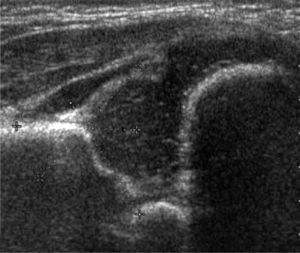
La ecografía por su parte ha sido considerada como un método preciso en la evaluación de la cadera durante los primeros meses de vida. Con esta técnica es posible visualizar la cabeza femoral cartilaginosa, caracterizar el acetábulo y evaluar la presencia de inestabilidad. A principios de los 80s Reinhard Graf, traumatólogo austríaco, dio a conocer el resultado de sus trabajos experimentales utilizando ultrasonido para la evaluación de la pelvis en niños. Su técnica de examen, más popular en Europa, corresponde a un examen estático, obtenido con el paciente en decúbito lateral, en una mesa especial dotada de un cojín que limita los movimientos de la cadera. El énfasis del examen está puesto en la estructura del acetábulo, evaluado en un plano único, standard, dado por la representación gráfica de algunas estructuras anatómicas coincidentes. Sobre este plano standard se caracteriza el acetábulo y se mide la oblicuidad del techo acetabular (ángulo acetabular) (24, 25) (figura 5).
Entendiendo el espectro de alteraciones morfológicas como un continuo, Graf clasificó las caderas en cuatro tipos morfológicos, que consideran la edad del paciente y que plantea la necesidad de tratamiento: (21, 24).
a) Cadera Tipo I: corresponde a la cadera morfológicamente normal, con adecuado techo acetabular óseo, techo cartilaginoso envolvente, ceja ósea angular y ángulo alfa igual o mayor que 60°, a cualquier edad. No requiere tratamiento (figura 6).
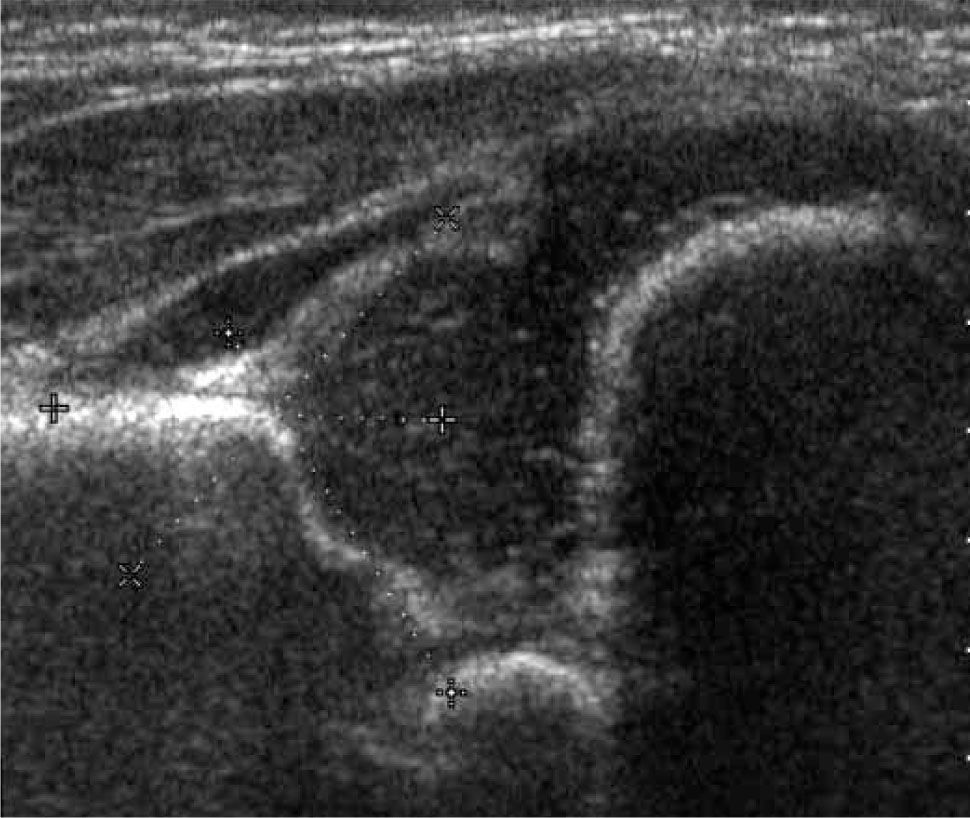
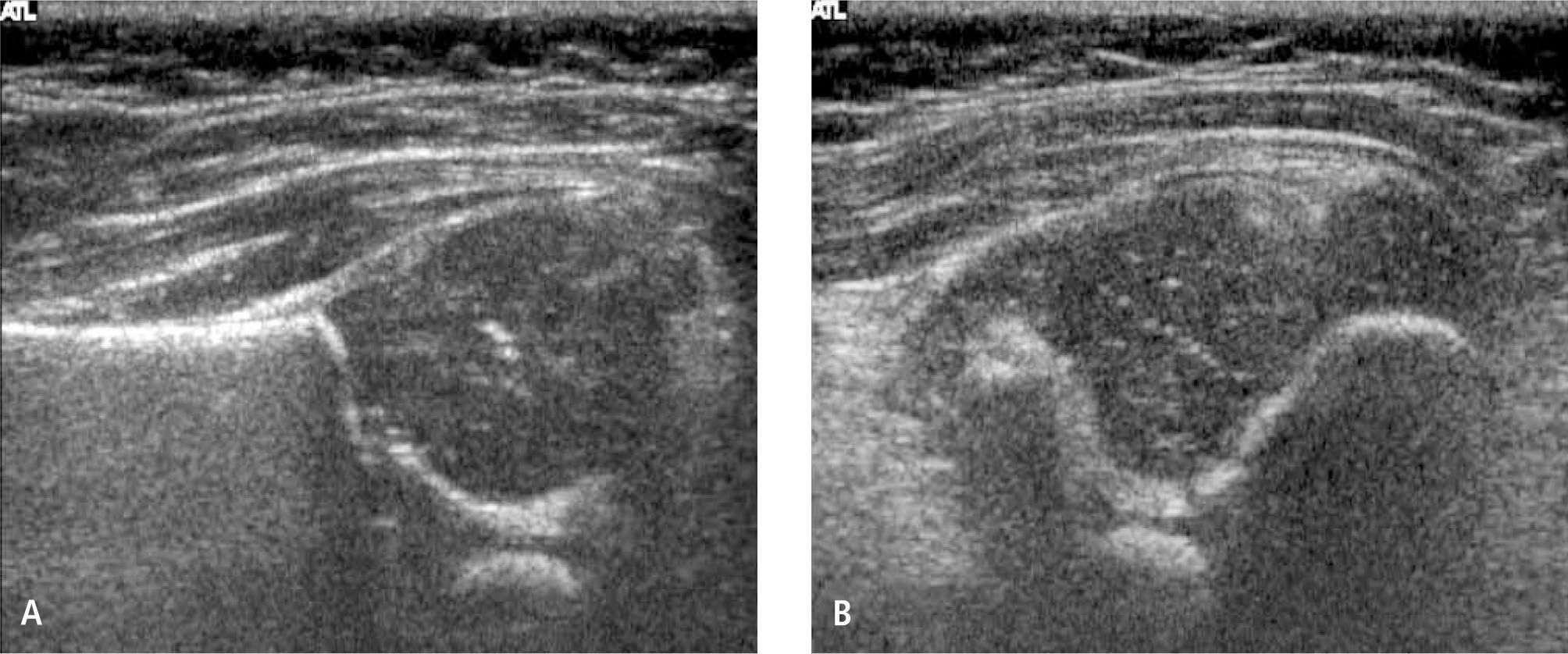
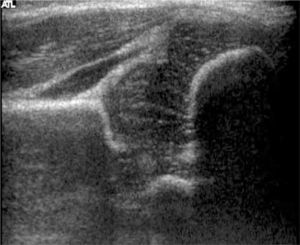
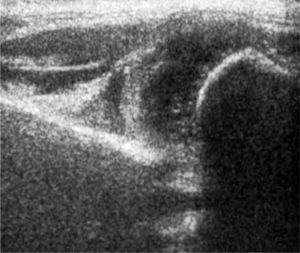
b) Cadera Tipo II: representa una transición estructural y temporal entre la cadera normal y la cadera francamente luxada. El tipo IIa, corresponde a una cadera inmadura, en menores de 3 meses, que debiera alcanzar el aspecto normal a los 3 meses por lo que no requeriría tratamiento; morfológicamente tiene una ceja redondeada, con un ángulo entre 50 y 59° pero con un techo suficiente. Los mismos hallazgos corresponden a la cadera tipo IIb, pero en mayores de 3 meses. El tipo IIc describe una cadera centrada, pero con techo insuficiente y ángulo alfa entre 43° y 49°, se describe inestabilidad. El tipo IId corresponde a la primera etapa de la luxación, con techo insuficiente, ángulo entre 43° y 49° y cabeza descentrada. Los tipos b, c y d requieren tratamiento (figura 7).
c) Cadera Tipo III: corresponde a una cadera descentrada, con techo insuficiente y desplazamiento superior del techo cartilaginoso, el que puede o no mantener su ecoestructura (subtipos a y b). Requiere tratamiento (figura 8).
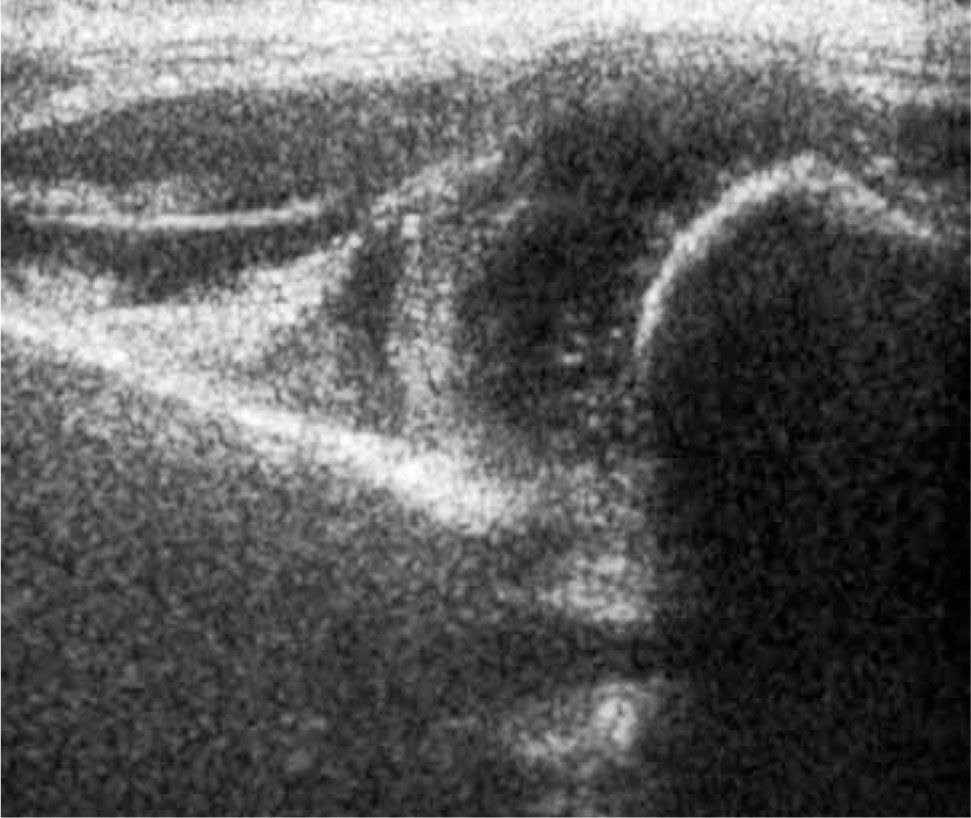
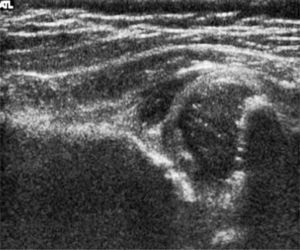
d) Cadera Tipo IV: describe también una cadera descentrada, pero con desplazamiento inferior, hacia el cotilo, del techo cartilaginoso, el que se interpone al momento de la reducción. Requiere tratamiento (figura 9).
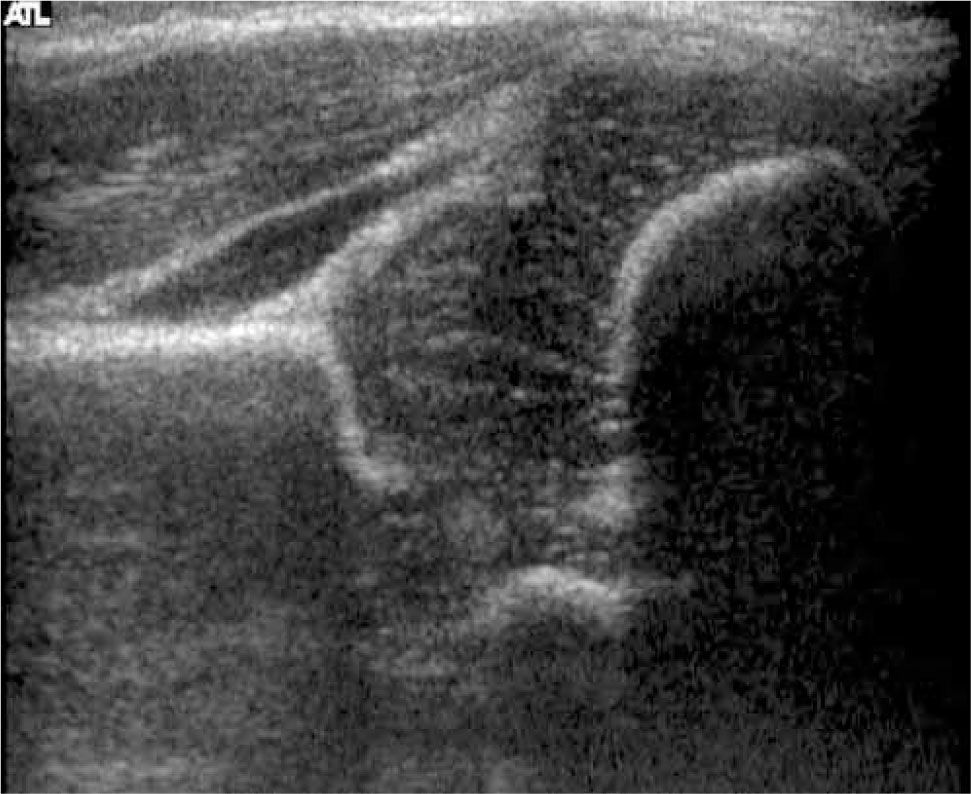
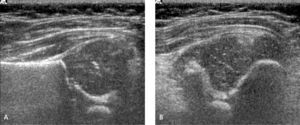
Pocos años más tarde del reporte inicial de Graf, el radiólogo americano Theodore Harcke y sus colaboradores publicaron su experiencia con una nueva técnica de exploración. Ellos reconocieron en su artículo el gran potencial diagnóstico revelado previamente por Graf, pero consideraron su técnica como compleja respecto del equipamiento y del entrenamiento necesario para obtener imágenes satisfactorias (26, 27). La nueva técnica que ellos propusieron corresponde a una exploración dinámica de la cadera, obteniendo dos planos standard de evaluación, uno coronal y otro trasversal, sin y con maniobras dinámicas, equivalentes a las de Ortolani y Barlow. (figura 10) Harcke clasificó las caderas como estables, cuando no presentan cambios con las maniobras dinámicas; inestables, cuando existe una pequeña separación de la cabeza con respecto al fondo de acetábuo o cuando la cabeza se luxa lateralmente pero vuelve a su posición concéntrica durante el examen; y dislocada, cuando la cabeza está situada permanentemente lateral a la línea de base. Morfológicamente, la cadera estable de Harcke es equivalente al tipo I de Graf; la cadera inestable tiene su símil en el tipo IIc; y la cadera dislocada abarcaría el espectro de los tipos IId, III y IV de Graf. Las mediciones han sido consideradas como opcionales en esta técnica. (28-30).
De los dos métodos descritos, fue la técnica dinámica la que se hizo popular entre nuestros radiólogos y es la que actualmente se practica en forma mayoritaria en nuestros país. Sin embargo, la obtención de un plano standard de imagen para caracterizar la articulación es compleja cuando no se considera en forma rigurosa la continuidad del plano con el fémur proximal como lo hace Graf, dada la naturaleza tridimensional del acetábulo. Aquellos que han sido entrenados en la técnica de Graf sostienen que la identificación de los hitos anatómicos permite la obtención de un único plano anatómico para análisis disminuyendo la variabilidad inter e intra observador. Esta afirmación ha sido apoyada por Peterlein y colaboradores quienes, apegándose al standard metodológico, obtuvieron exámenes comparables, independiente del grado de experiencia previa del operador (31).
Por otra parte, la inestabilidad que persigue el método dinámico, es de difícil interpretación, considerando que aparece también como un signo transitorio en caderas que evolucionan como normales sin tratamiento. Rosendahl y colaboradores, utilizando el estándar de Graf en la clasificación morfológica y simultáneamente el método dinámico en la búsqueda de inestabilidad, encontraron que las caderas inestables pero sin alteraciones morfológicas se estabilizaron espontáneamente y consideraron que la inestabilidad ecográfica en una cadera morfológicamente normal sería clínicamente irrelevante (28). Por su parte Koºar y colaboradores compararon también la ecografía estática de Graf con el método dinámico en 6800 caderas, reportando un 8% de caderas morfológicamente normales pero inestables (Tipos I y IIa de Graf). Seguidos ecográficamente, sólo 1,5% de este grupo de pacientes presentó una alteración persistente que requirió tratamiento (0,13 % del total de la muestra) (32).
Coincidiendo con los reparos sobre el método dinámico y valorando las oportunidades que ofrece el método de Graf respecto del seguimiento, nuestro grupo de radiólogos infantiles cambió la técnica de la ecografía de caderas. Desde mediados del año 2009, con la colaboración del equipo de traumatólogos infantiles, se realiza en nuestro centro un examen estático, en mesa especial, con un plano único de análisis y los hallazgos se reportan utilizando la clasificación propuesta por el D r. Graf.
Factores de riesgo y recomendacionesPara la displasia de caderas hay acuerdo de que tanto los factores genéticos como ambientales son importantes. No ha sido posible, sin embargo, determinar elementos específicos de causalidad ni aislar genes determinantes. Esta patología se ha considerado más bien como una condición multifactorial, que combina factores mecánicos como aquellos que restringen los movimientos in útero, con condiciones que contribuyan al mal desarrollo primario del acetábulo.
Respecto de los factores genéticos, se ha reportado, una probabilidad 6% mayor de displasia con un hermano mayor, pero con padres normales. La probabilidad sube a un 12% si uno de los padres tuvo displasia, pero no el hermano previo, y alcanza un 36% si la displasia de caderas está en la historia de uno de los padres y de al menos uno de los hermanos (33).
La displasia es también más frecuente en niñas, hecho que se atribuye a una mayor laxitud ligamentosa, potenciada transitoriamente por los altos niveles de hormonas maternas circulantes. El primer hijo se ve afectado con mayor frecuencia, posiblemente por efecto físico del útero grávido por primera vez y por la presencia de una pared abdominal sin distensión por embarazos previos. Por su parte, la cadera izquierda se afecta con mayor frecuencia, posiblemente por el apoyo del feto, con la cadera izquierda yaciendo posteriormente contra la columna materna con abducción más limitada (21).
Otros factores que se asocian son deformaciones posturales incluyen la presentación podálica, el oligohidroamnios, anormalidades de los pies (metatarso varo y talipes equiovaro) y tortícolis congénita.
La Academia Americana de Pediatría, a través del Subcomité de Displasia del Desarrollo de la Cadera recomendó en el año 2000 que todos los recién nacidos deben tener un examen físico dirigido, idealmente por un ortopedista o por un profesional entrenado; la presencia de un examen alterado, hace necesaria la derivación a un ortopedista. Desde este punto, las recomendaciones de la Academia discrepan de las hechas por nuestra Guía Clínica Ministerial, insistiendo en el valor del seguimiento clínico, restringiendo la ecografía para casos donde persiste la sospecha clínica a las dos semanas de vida o como seguimiento a las 6 semanas en pacientes con factores de riesgo y reservando la radiografía para el seguimiento de pacientes con factores de riesgo, como control a los 4 meses, subrayando su mayor precisión sobre los 6 meses (11).
El eje de las recomendaciones emitidas por el panel de expertos que trabajaron en la elaboración de nuestra Guía Clínica Ministerial es el uso de la radiografía diagnóstica precoz. Desde la publicación del Dr. Doberti, la radiografía a los 3 meses ha mostrado su amplia disponibilidad, de la mano de la recomendación de los pediatras, con una importante experiencia acumulada que ha sido insuficientemente reportada hasta ahora. En el escenario de un mayor costo y menor número de profesionales entrenados, la ecografía se ha instalado en nuestro screening local colaborando con el diagnóstico en el recién nacido con factores de riesgo o con examen físico alterado y como parte del algoritmo diagnóstico frente a radiografías consideradas como dudosas.
En atención a esta experiencia, a los falsos negativos del examen clínico y a la displasia de aparición tardía, nuestros recién nacidos debieran seguir siendo parte de un screening universal. Así entonces, y en concordancia con la norma ministerial, en pacientes sin factores de riesgo y con examen físico normal debiera realizase una radiografía de caderas a los 3 meses, como parte del screening universal. En recién nacidos con factores de riesgo o con examen físico alterado, la necesidad de imágenes se adelanta y debiera realizarse una ecografía entre la 2° y 6° semanas de vida, manteniéndose la necesidad de una radiografía de control a los 3 meses, para confirmar la continuidad del desarrollo normal en una cadera de riesgo.
La necesidad de control radiográfico durante la infancia o más aún, el beneficio de un control radiográfico terminando la adolescencia, abren un nuevo frente de preocupación y controversia, motivado por las teorías y consideraciones sobre la patología de cadera del adulto joven.
La autora declara no tener conflictos de interés, con relación a este artículo.