La presente revisión tiene por objetivo el concientizar e ilustrar al médico sobre el concepto, etiopatogenia y generalidades del tratamiento de la diabesidad. El concepto de diabesidad se fundamenta en las epidemias gemelas de obesidad y diabetes. Ante un balance calórico positivo, la incapacidad del tejido adiposo subcutáneo para expandirse condiciona el depósito de grasa visceral y ectópica, lo que favorece los fenómenos de lipotoxicidad e inflamación, los cuales causan insulinorresistencia a nivel hepático y muscular. En etapas iniciales, la célula beta pancreática compensa esta insulinorresistencia con hiperinsulinemia, sin embargo, la lipotoxicidad e inflamación gatillan la apoptosis beta celular. Esto dificulta la compensación, apareciendo de esta forma la hiperglicemia, primero en rango de prediabetes, y luego franca diabetes. Por otro lado, la lipotoxicidad e inflamación afectan a otros órganos y sistemas, como el corazón, sistema circulatorio y riñones, los cuales a su vez son blanco de las complicaciones propias de la diabetes, constituyendo de esta forma el síndrome metabólico-cardio-renal. La reducción de peso mediante el estilo de vida saludable, el eventual uso de fármacos antidiabéticos que producen disminución de peso y procedimientos intervencionales endoscópicos o quirúrgicos permiten disminuir la morbilidad y mortalidad de la diabesidad.
The purpose of this review is to raise awareness and educate physicians about the concept, pathogenesis, and general aspects of diabesity treatment. The concept of diabesity is based on the twin epidemics of obesity and diabetes. Given a positive caloric balance, the inability of subcutaneous adipose tissue to expand leads to the deposition of visceral and ectopic fat, which favors lipotoxicity and inflammation, causing insulin resistance in the liver and muscle. At early stages, pancreatic beta cells compensate insulin resistance with hyperinsulinemia. However, lipotoxicity and inflammation trigger beta cell apoptosis, rendering them unable to compensate, resulting in hyperglycemia, first in the prediabetic range and later, full-blown diabetes. Furthermore, lipotoxicity and inflammation affect other organs and systems, such as the heart, circulatory system, and kidneys, which in turn are targets for the complications of diabetes, thus constituting a metabolic-cardio-renal syndrome. Weight loss through a healthy lifestyle, the eventual use of antidiabetic drugs that produce weight loss, and endoscopic or surgical interventional procedures, can reduce the morbidity and mortality associated with diabesity.
La presente revisión tiene como objetivo concientizar tanto al médico endocrinólogo, cuya práctica se centra no únicamente en la obesidad y patologías metabólicas asociadas, como al médico no especialista que debe enfrentar estas condiciones, sobre las epidemias gemelas de diabetes y obesidad de las cuales hemos sido testigos los últimos 30 años, las cuales se fusionan, en un juego de palabras, de una manera operacional y didáctica en el concepto de diabesidad. Se revisan asimismo la etiopatogenia común entre diabetes y obesidad y las opciones terapéuticas tanto no farmacológicas como farmacológicas disponibles actualmente en Chile.
Concepto de diabesidadOrigen de la definiciónEl término “diabesidad” fue utilizado originalmente por Sims en la década de 1970 para referirse a la asociación reversible entre el sobrepeso experimental en humanos y la alteración de la tolerancia a la glucosa. Sin embargo, cobró interés a partir de la primera década de este siglo con la Dra. Francine Kaufman, quien destacó el comportamiento como epidemias gemelas de la obesidad y la diabetes tanto en la población general como en el individuo1.
Antecedentes epidemiológicosLa prevalencia de obesidad ha aumentado en forma casi exponencial en todo el mundo en los últimos 50 años, siendo este aumento más acelerado en los países en desarrollo. La mayor prevalencia de obesidad se asocia no solamente con un aumento en la prevalencia de diabetes, sino también de dos graves comorbilidades; la hipertensión arterial y la dislipidemia. En Chile la prevalencia de diabetes se ha triplicado entre 2003 y 2017, pasando de un 4,2% a un 12,3%2. En cuanto a la diabesidad propiamente tal, su prevalencia es del 5,7%, lo que refleja que el 55% de las personas con diabetes presentan obesidad3.
Obesidad subcutánea vs. obesidad visceralLa estimación de la obesidad mediante el cálculo del índice de masa corporal (IMC) no siempre refleja el riesgo de morbilidad y mortalidad de un individuo, y un ejemplo de esto se observa en los pacientes con enfermedad coronaria, en quienes la mortalidad es similar entre individuos normopeso y con obesidad mórbida, siendo menor en individuos con sobrepeso y obesidad no mórbida4.
La distribución de los depósitos de tejido adiposo ha sido reconocido como un factor clave en el riesgo de morbimortalidad asociado a la obesidad. Ante un balance calórico positivo, la capacidad del tejido adiposo subcutáneo para expandirse se asocia a un mínimo o ausente depósito de grasa en otros tejidos, con un perfil metabólico favorable. Sin embargo, cuando el tejido subcutáneo no es capaz de expandirse ocurre el depósito de grasa visceral intraabdominal y ectópica, en distintos órganos y tejidos, como hígado, músculo esquelético, páncreas y epicardio, resultando en un perfil metabólico alterado e indicativo de un riesgo cardio-metabólico elevado: insulinorresistencia, dislipidemia, inflamación crónica subclínica, alteraciones neurohormonales, desregulación metabólica y disfunción endotelial5. En el primer caso, se constituye lo que se ha denominado obesidad metabólicamente saludable, cuya definición más aceptada es la presencia de un IMC igual o mayor a 30kg/m2 en ausencia del síndrome metabólico6. En el segundo, se favorece la aparición de la insulinorresistencia, la prediabetes, la diabetes y, en último término, la enfermedad cardiovascular y renal.
Obesidad visceral e insulinorresistenciaEn comparación con el tejido adiposo subcutáneo, el tejido adiposo visceral libera o expresa en forma aumentada una serie de factores, como ácidos grasos libres, citoquinas proinflamatorias (como el factor de necrosis tumoral alfa (TNF-α) y la interleuquina-6 (IL-6)), proteína transportadora de ésteres de colesterol (CETP) y, el inhibidor del activador tisular del plasminógeno tipo 1 (PAI-1), entre otros, lo cual favorece los fenómenos de lipotoxicidad, inflamación, dislipidemia y un estado protrombótico7.
La “primera estación” de estos fenómenos de lipotoxicidad e inflamación la constituye el hígado, donde la llegada de los ácidos grasos libres junto con promover el depósito de triglicéridos produce un bloqueo a nivel post receptor de insulina, disminuyendo la respuesta de este órgano a la acción de la hormona, lo cual se manifiesta como enfermedad hepática esteatósica asociada a disfunción metabólica, hiperinsulinemia y eventualmente hiperglicemia de ayunas. Por otro lado, el depósito de triglicéridos hepáticos se asocia a la producción de partículas de lipoproteínas de muy baja densidad (VLDL) grandes, las cuales al ser metabolizadas mediante la enzima CETP producen un mayor catabolismo de las lipoproteínas de alta densidad (HDL) y la formación de las lipoproteínas de baja densidad (LDL) pequeñas y densas, altamente aterogénicas8. Algo similar ocurre en el músculo, donde los ácidos grasos libres y citoquinas proinflamatorias también producen un bloqueo a nivel post receptor de insulina, lo cual se traduce en la no traslocación del transportador de glucosa transportador de glucosa-4 (GLUT-4) desde el citoplasma hacia la superficie celular y manifestándose como hiperinsulinemia y eventualmente hiperglicemia post prandial o post carga9.
La respuesta de las células beta pancreáticas ante la insulinorresistencia hepática y/o muscular es un aumento inicial en su función y su masa, lo cual está mediado por señales provenientes del tejido adiposo, hígado, intestino y sistema nervioso central10. Esta respuesta hiperinsulinémica es por un lado beneficiosa, ya que permite mantener la normoglicemia en etapas iniciales, pero por otro lado es deletérea, ya que aumenta la reabsorción tubular renal de sodio y el tono simpático, produciendo a su vez un aumento de la presión arterial11.
La asociación de elementos clínicos y de laboratorio, como la obesidad de predominio visceral o abdominal, hipertensión arterial, dislipidemia aterogénica (hipertrigliceridemia y HDL bajo) e hiperglicemia constituye lo que se conoce como el síndrome metabólico12.
Insulinorresistencia y diabetesParalelamente al depósito de triglicéridos hepáticos ocurre el depósito de triglicéridos intrapancreáticos13, el cual gatilla la apoptosis de las células beta, siendo éstas incapaces de mantener la hiperinsulinemia compensatoria y apareciendo de esta forma la hiperglicemia, primero en rango de prediabetes y luego en rango de franca diabetes14. La tabla 1 muestra los puntos de corte para diagnosticar diabetes y prediabetes15. Taylor y colaboradores, en el Reino Unido, basados en estudios de imágenes, han propuesto la hipótesis de los “ciclos gemelos” para explicar la etiopatogenia de la diabetes tipo 2: ante un balance calórico positivo la acumulación de triglicéridos en el hígado y el páncreas se asocia a insulinorresistencia, hiperinsulinemia y finalmente hiperglicemia16.
Puntos de corte para diagnosticar diabetes y prediabetes
| Criterio y grado de alteración | Normal | Prediabetes | Diabetes |
|---|---|---|---|
| Glicemia en ayunas | <100mg/dl | 100-125mg/dl | ≥126mg/dl |
| Glicemia postcarga 120minutos | <140mg/dl | 140-199mg/dl | ≥200mg/dl |
| HbA1c | <5,7% | 5,7-6,4% | ≥6,5% |
Abreviaturas: HbA1c: hemoglobina glicada A1c.
En pacientes con síntomas sugerentes de diabetes basta solo una glicemia al azar >200mg/dl para hacer el diagnóstico. En todos los otros casos se requieren dos exámenes alterados para el diagnóstico, ya sea en la misma muestra o en muestras distintas1.
Implicancias de la diabesidadPronóstico de la diabesidad: complicaciones macro y microvascularesLa obesidad de predominio visceral, que lleva a la insulinorresistencia hepática y muscular, que es compensada con hiperinsulinemia y se acompaña de la dislipidemia aterogénica e hipertensión arterial, es decir, lo que entendemos como síndrome metabólico, se asocia a un riesgo cerca de 1,5 veces mayor de enfermedad coronaria, infarto agudo al miocardio y accidente cerebrovascular17. Además, la hiperglicemia que aparece producto de la claudicación de las células beta prácticamente duplica este riesgo ya aumentado de eventos macrovasculares y gatilla un aumento en el riesgo de complicaciones microvasculares, propias de la hiperglicemia, como la retinopatía, nefropatía y neuropatía diabéticas18.
No es de extrañar, por tanto, que al diagnóstico de la diabetes tipo 2 cerca de un 20% de los pacientes presenten ya alguna manifestación de enfermedad cardiovascular y un porcentaje similar presenten alguna manifestación de enfermedad renal crónica19. Tampoco sorprende que, tras pocos años de evolución, tres cuartas partes de los pacientes presenten un riesgo cardiovascular alto o muy alto20 y la mitad de los pacientes presenten enfermedad renal crónica, ya sea por una tasa de filtración glomerular reducida o bien una excreción urinaria de albúmina aumentada21.
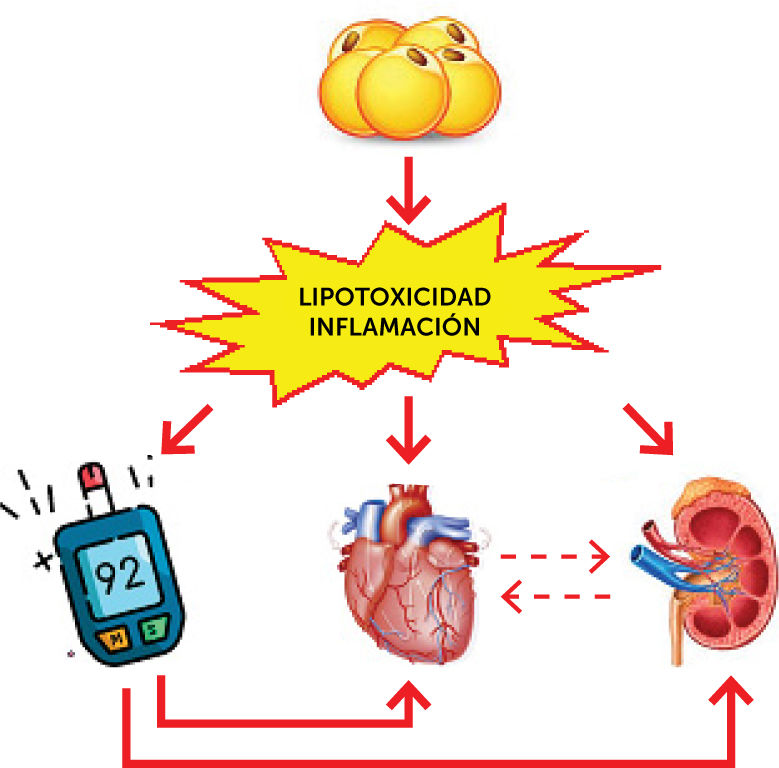
Las complicaciones cardiovasculares y renales constituyen, por un lado, la macro y microangiopatía diabética propiamente tales, pero pueden originarse por lipotoxicidad e inflamación directa en estos órganos de forma independiente de la diabetes, configurando lo que se conoce actualmente como el síndrome metabólico-cardio-renal, que se esquematiza en la figura 122.
Concepto de síndrome metabólico-cardio-renal.
La lipotoxicidad e inflamación derivadas de la obesidad sumadas a la hiperglicemia secundaria a la diabetes constituyen el síndrome metabólico cardio renal en la diabesidad.
Adaptado de Ndumele, et al. (2023)22.
De acuerdo con un análisis prospectivo de la Segunda Encuesta Nacional de Salud de Chile,la diabesidad propiamente tal aumenta en un 37% el riesgo de mortalidad general23.
La enfermedad cardiovascular y renal en la diabetes son por un lado complicaciones crónicas de la enfermedad (macro y microvascular respectivamente) pero también son el resultado de la lipotoxicidad e inflamación.
TratamientoLa reducción de un 5 a 10% del peso corporal se asocia a una reducción del 30% del tejido adiposo visceral, lo cual disminuye la lipotoxicidad e inflamación y mejora la sensibilidad a la insulina, la dislipidemia aterogénica, disminuye el estado protrombótico y la disfunción endotelial, todo lo cual se traduce en un menor riesgo cardiovascular24. Desde la perspectiva de la diabesidad, las opciones terapéuticas disponibles son el estilo de vida saludable, el uso de medicamentos antidiabéticos que producen una reducción en el peso corporal, y los procedimientos intervencionales ya sean endoscópicos o quirúrgicos.
Estilo de vida saludableDatos del Programa de Prevención de Diabetes de los EE.UU. muestran que por cada kg de peso que se pierde disminuye en un 16% el riesgo de diabetes, siendo el riesgo mínimo con reducciones de 10kg o más25. En el caso de la diabetes ya diagnosticada, tanto la remisión parcial (a estados pre diabéticos, sin uso de medicamentos) como la completa (a normoglicemia, sin uso de medicamentos) son proporcionales a la reducción de peso. Una reducción de menos del 10% en el peso se asocia a un 5% de remisión parcial, siendo ésta de casi un 50% con una reducción de peso entre un 10 y un 19%, casi un 70% con una reducción de peso entre un 20 y un 29% y casi un 90% con una reducción de peso de un 30% o más. En cuanto a la remisión completa, ésta es de casi un 50% con una reducción de peso entre un 20 y un 29% y de casi un 80% con una reducción de peso de un 30% o más26.
El beneficio de la reducción de peso tanto en la prevención como en el tratamiento y eventual remisión de la diabetes puede explicarse por la reversibilidad de los ciclos gemelos postulado por Taylor et al.: un balance isocalórico posterior a una reducción sustancial en el peso disminuye la lipotoxicidad en el hígado y en el páncreas, mejorando la insulinosensibilidad, disminuyendo la hiperinsulinemia y normalizando los niveles de glucosa en plasma16. Estudios funcionales y de imágenes muestran una recuperación del volumen pancreático y un aumento en la producción de insulina, similares a sujetos normales27.
Es importante tener en cuenta que la reducción de peso lograda en los estudios de prevención de diabetes es mayor a la reportada en la práctica habitual, y en ambos casos va disminuyendo en el tiempo: en los estudios de prevención de diabetes se observa una reducción de entre 4,4 y 7,4kg al año, 4,2kg a los tres años y 2,1kg a los cinco años, mientras que en los estudios de vida real es de entre 1,4 y 5,1kg al año y 1,4kg a los tres años28. En individuos con diabetes que ingresaron a un programa de estilo de vida saludable para prevenir eventos cardiovasculares, se reduce el peso corporal y la circunferencia de cintura, aumenta la actividad física, y disminuye la hemoglobina glicada A1c (HbA1c) al año, tendiendo luego a acercarse al grupo control hacia los diez años de seguimiento29. Si bien la reducción de peso puede ser difícil de mantener, en estudios diseñados para evaluar la remisión de la diabetes (definida como una HbA1c menor a 6,5% sin el uso de fármacos por al menos dos meses) se observa una relación lineal entre la reducción de peso lograda y la remisión de la diabetes, sin embargo, una proporción de pacientes, si bien menor (14%), bajó más de 15kg en un año sin lograr la remisión de la enfermedad30.
El hecho que la reducción de peso no siempre ocurre, si ocurre puede ser transitoria, y si es persistente puede no lograr la remisión de la diabetes junto con la mejoría en los otros parámetros metabólicos, puede hacer necesario recurrir al uso coadyuvante de fármacos.
FármacosDurante muchos años no se dispuso más que de la insulina, sulfonilureas y metformina para el tratamiento de la diabetes, siendo los efectos adversos más comunes en las dos primeras el aumento en el peso corporal y las hipoglicemias. En los últimos 20 años han aparecido nuevos fármacos con un efecto neutro o incluso favorable en el peso. Los fármacos que han cobrado relevancia en el tratamiento de la diabesidad son aquellos inicialmente destinados a disminuir la hiperglicemia sin producir aumento en el peso e idealmente produciendo una reducción de éste.
MetforminaLa metformina o dimetilbiguanida ejerce su acción principalmente al activar la enzima AMP quinasa, la cual incrementa la insulinosensibilidad en el hígado y la captación de glucosa por el músculo, disminuyendo también los depósitos de triglicéridos hepáticos31. Si bien no es considerada un fármaco antiobesidad, la metformina produce una reducción modesta (4%) en el peso y el IMC, sin disminuir la masa magra, pero si una reducción de un 15% en el tejido adiposo visceral, en un seguimiento a seis meses en personas con diabetes32. Una publicación más reciente del Programa de Prevención de Diabetes de los EE.UU. ha mostrado que aquellos individuos que disminuyen su peso en más de un 5% logran mantenerlo, en un seguimiento a 15 años, si se mantienen con el medicamento, no así los individuos de los grupos de cambios intensivos en el estilo de vida y el grupo placebo33.
Como beneficio adicional, individuos con esteatohepatitis que reciben metformina mejoran sus niveles de transaminasas, mejoran la infiltración grasa ecográfica y mejoran algunos parámetros en la biopsia hepática en comparación con un grupo con manejo dietario34.
El principal respaldo para el uso masivo de este fármaco en personas con diabetes y obesidad lo constituye el estudio prospectivo inglés sobre diabetes UKPDS, que incluyó a 4 209 individuos con diabetes tipo 2 recién diagnosticada. Aun cuando metformina logró un control metabólico similar a las otras terapias (insulina y sulfonilureas), se asoció a una reducción significativa de 42% en muertes por diabetes, 36% en mortalidad general y 39% en infarto al miocardio, reducciones no observadas con las otras terapias35.
Terapias basadas en incretinasEl término “incretina” (INtestinal seCRETion INsulin) fue acuñado en 1922 por LaBarre, para referirse a la respuesta insulínica tras el aporte de glucosa oral, asumiendo que el intestino producía insulina. Hoy sabemos que las terapias basadas en incretinas producen un aumento en los niveles de enteropéptidos, especialmente el péptido similar al glucagón tipo 1 (GLP-1), liberado por las células L del íleon distal y el polipéptido inhibidor gástrico (GIP), liberado por las células K del duodeno y yeyuno proximal. Ambos estimulan la secreción de insulina por las células beta pancreáticas y promueven la expansión de su masa celular, observándose en la diabetes tipo 2 una respuesta conservada a GLP-1 pero con una secreción disminuida, y una respuesta defectuosa a GIP, pero con una secreción conservada. GLP-1, además, inhibe la secreción de glucagón, el vaciamiento gástrico, y a nivel central inhibe la ingesta alimentaria promoviendo de esta forma la reducción de peso. Ambos péptidos son inactivados por la enzima dipeptidil peptidasa-4 (DPP-4), que se expresa a nivel endotelial36.
Se dispone actualmente en Chile de dos familias de fármacos con efecto incretina: los agonistas del receptor de GLP-1 y los inhibidores de la enzima DPP-4. Los niveles de GLP-1 obtenidos con los agonistas del receptor son del orden de los 60 a 90pmol/l, mientras que con los inhibidores de DPP4 son alrededor de 15pmol/l37, por lo que su eficacia antidiabética, su efecto en el peso y también sus efectos adversos (principalmente digestivos) son mayores para los agonistas de GLP-1.
Los primeros reportes de una reducción significativa en el peso corporal con agonistas de GLP-1 muestran una disminución de entre 3,0 y 3,5kg con las dosis antidiabéticas38, observándose una respuesta mayor, dosis-dependiente, de hasta 10kg, con las dosis mayores, antiobesidad39.
Se observa, asimismo, un beneficio en individuos con esteatosis hepática: los agonistas de GLP-1 han demostrado disminución de transaminasas y mejoría objetiva en la biopsia hepática40.
A diferencia del UKPDS, realizado en pacientes con reciente diagnóstico, los estudios de resultados cardiovasculares con agonistas de GLP-1 han sido desarrollados en pacientes con diabetes de larga data, con factores de riesgo o enfermedad cardiovascular establecida, mostrando el primer estudio publicado, con liraglutida, una disminución de un 13% en el resultado primario, de un 22% en la mortalidad cardiovascular y de un 13% en las hospitalizaciones por insuficiencia cardíaca41. Resultados similares fueron también observados en pacientes sin enfermedad cardiovascular establecida, en que dulaglutida mostró una reducción de 12% en el resultado cardiovascular compuesto y un 24% en el accidente cerebrovascular no fatal42. En estudios más recientes, en pacientes con enfermedad cardiovascular y renal establecida, semaglutida de administración subcutánea demostró una reducción de un 24% en el resultado compuesto de progresión de la enfermedad renal crónica, muerte cardiovascular y muerte renal43. Semaglutida oral también logró una reducción de un 21% en el resultado primario cardiovascular y de un 49% en la muerte cardiovascular en pacientes con diabetes tipo 2 y enfermedad cardiovascular previa44.
Inhibidores del cotransportador tubular renal de sodio-glucosa (SGLT2)Los inhibidores de la proteína transportadora de sodio y glucosa 2 (SGLT2) son fármacos análogos de la florizina, molécula aislada en 1835 desde la corteza del manzano. A comienzos de siglo XX se observó que florizina provocaba glucosuria, polidipsia y reducción de peso en animales sanos y en la década de 1980 se observó que florizina normalizaba los niveles de glucosa en sangre en animales sometidos a una pancreatectomía del 90%. Los inhibidores de SGLT2 producen una inhibición del cotransportador de sodio y glucosa en los túbulos proximales renales, disminuyendo la reabsorción renal de glucosa y sodio45.
La acción antidiabética de los inhibidores de SGLT2 es independiente de la acción de la insulina, siendo muy eficaces en el manejo de la hiperglicemia. La glucosuria, por otro lado, contribuye a una reducción de entre 3 y 4kg de peso. Estudios de imágenes han evidenciado una reducción en la esteatosis y volumen hepático, tejido adiposo visceral y subcutáneo abdominal tras el uso de estos fármacos46. Estudios histológicos han mostrado resultados muy promisorios en la mejoría de distintas alteraciones observadas en el daño hepático crónico en personas con diabetes47.
Estudios clínicos en pacientes con insuficiencia cardiaca y sin diabetes, muestran una disminución en el riesgo de desarrollar diabetes de entre un 15 y un 30%48,49.
Al igual que los estudios con agonistas de GLP-1, los estudios de resultados cardiovasculares con inhibidores de SGLT2 han sido desarrollados en pacientes con diabetes de larga data, con factores de riesgo o enfermedad cardiovascular y renal establecida, mostrando el primer estudio publicado, con empagliflozina, una disminución de un 14% en el resultado primario, de un 38% en la mortalidad cardiovascular y de un 35% en las hospitalizaciones por insuficiencia cardíaca50, y una disminución de un 39% en la aparición o empeoramiento de la nefropatía51.
Nuevas terapiasEn un futuro cercano, en Chile contaremos con nuevas presentaciones y fármacos para el tratamiento de la diabesidad, como son semaglutida (agonista de GLP-1) en dosis altas de hasta 2,4mg semanales y tirzepatide (agonista de GLP-1 y GIP), los cuales logran una reducción de peso de entre un 15 y un 20% el primero y entre un 20 y un 25% el segundo52.
Procedimientos intervencionalesDistintos procedimientos quirúrgicos, ya sean restrictivos, malabsortivos o mixtos, han demostrado un porcentaje de remisión de la diabetes mayor al porcentaje de reducción del exceso de peso53, por lo cual se prefiere el término “cirugía metabólica” o “cirugía bariátrica/metabólica” más que “cirugía bariátrica”, ya que este último hace alusión solamente a la reducción de peso. Los mecanismos de mejoría de la diabetes luego de la cirugía son numerosos, pero pueden resumirse en reducción de peso por el efecto restrictivo y/o malabsortivo, reducción de la ingesta alimentaria por efecto sobre enteropéptidos como la ghrelina y el péptido YY, y efecto incretina, por aumento de GLP-1 y de GIP. Tanto la reducción en la ingesta como el efecto incretina son mecanismos independientes de la reducción de peso, lo cual respalda el empleo de técnicas específicas ya sean endoscópicas o quirúrgicas, en individuos con diabetes sin obesidad importante54. En 2016 fueron publicados por la Asociación Americana de Diabetes los resultados de una iniciativa patrocinada por numerosas sociedades científicas del mundo, entre ellas la Sociedad Chilena de Endocrinología y Diabetes y la Sociedad Chilena de Cirugía Bariátrica y Metabólica, en los cuales se recomienda la cirugía en individuos con diabetes tipo 2 y obesidad clase III, y en aquéllos con obesidad clase II con mal control de su diabetes, y se considera en aquéllos con obesidad clase II y control adecuado de su diabetes y con obesidad clase I y mal control55.
ConclusionesLas epidemias gemelas de obesidad y diabetes se acompañan de una pesada carga de comorbilidades y complicaciones, mediadas fundamentalmente por los fenómenos de lipotoxicidad e inflamación. Ante un balance calórico positivo, un factor clave lo constituye la capacidad o incapacidad de expansión del tejido adiposo subcutáneo, produciéndose en este último caso el depósito de grasa visceral y ectópica. Resulta clave, asimismo, lograr un balance de energía negativo en base a un estilo de vida saludable como base del tratamiento de la diabesidad.
Por su mecanismo de acción, que no produce hipoglicemias, su efecto beneficioso en el peso corporal y en los depósitos de grasa ectópica, pero especialmente por su beneficio cardiovascular (enfermedad ateromatosa e insuficiencia cardiaca) y renal, la Asociación Americana de Diabetes propone el uso específico de agonistas de GLP-1 e inhibidores de SGLT2 en la diabetes tipo 2, especialmente en presencia de obesidad. Junto con el control glicémico, de la presión arterial y de los lípidos constituye uno de los cuatro pilares del tratamiento moderno de la diabetes tipo 2. El empleo de estos fármacos, asociados o no a la metformina, produce beneficios tanto en el control glicémico como en el peso corporal, como también reconocida protección cardiovascular y renal, con un perfil de seguridad aceptable, lo cual a la luz de la evidencia es posible afirmar que es un efecto clase tanto para los agonistas de GLP-1 como para los inhibidores de SGLT2.
Estos beneficios, ampliamente demostrados en personas con diabetes, están siendo también observados en personas en estadios previos y en comorbilidades cardiorrenales, por lo que con toda seguridad seremos testigos en los próximos años de una expansión en sus indicaciones de uso en la práctica médica.
Conflictos de interésEn los últimos cinco años he recibido:
- -
Honorarios por asesorías o conferencias: AstraZeneca, Axon Pharma, Boehringer Ingelheim, Eli Lilly, Laboratorio Chile, Merck, Novartis, Novo Nordisk, Sanofi, Tecnofarma.
- -
Invitación o apoyo para asistencia a cursos o congresos: AstraZeneca, Boehringer Ingelheim, Novo Nordisk, Sanofi, Tecnofarma.