El hallazgo frecuente de un incidentaloma suprarrenal (IS) se debe principalmente al incremento en la El hallazgo frecuente de un incidentaloma suprarrenal (IS) se debe principalmente al incremento en la solicitud de tomografías computarizadas (TC) y a su mejor resolución. En la actualidad, guías clínicas solicitud de tomografías computarizadas (TC) y a su mejor resolución. En la actualidad, guías clínicas basadas en evidencia han establecido las recomendaciones para el abordaje de estas lesiones.basadas en evidencia han establecido las recomendaciones para el abordaje de estas lesiones.
El objetivo de este artículo es destacar las principales recomendaciones para la correcta evaluación del IS. El objetivo de este artículo es destacar las principales recomendaciones para la correcta evaluación del IS. Se revisarán los principales elementos utilizados en el diagnóstico diferencial de lesiones suprarrenales Se revisarán los principales elementos utilizados en el diagnóstico diferencial de lesiones suprarrenales benignas y malignas, como las unidades Hounsfield (UH) y el tamaño del IS en la TC sin contraste; benignas y malignas, como las unidades Hounsfield (UH) y el tamaño del IS en la TC sin contraste; la indicación de imágenes adicionales; exámenes indicados en la evaluación de hiperfunción; la indicación de imágenes adicionales; exámenes indicados en la evaluación de hiperfunción; definición de secreción autónoma leve de cortisol (MACS) y sus implicancias; la introducción de definición de secreción autónoma leve de cortisol (MACS) y sus implicancias; la introducción de la determinación de metabolitos de esteroides suprarrenales que han demostrado utilidad en la determinación de metabolitos de esteroides suprarrenales que han demostrado utilidad en el diagnóstico diferencial de IS con el diagnóstico diferencial de IS con ≥10UH en TC sin contraste. También las nuevas mutaciones 10UH en TC sin contraste. También las nuevas mutaciones relacionadas con síndromes de neoplasias endocrinas múltiples, que deberían sospecharse sobre relacionadas con síndromes de neoplasias endocrinas múltiples, que deberían sospecharse sobre todo frente a lesiones suprarrenales bilaterales. Finalmente, mencionaremos la conducta actual todo frente a lesiones suprarrenales bilaterales. Finalmente, mencionaremos la conducta actual respecto al seguimiento de lesiones benignas no funcionantes y pacientes con MACS.respecto al seguimiento de lesiones benignas no funcionantes y pacientes con MACS.
The frequent finding of adrenal incidentalomas (AI) is mainly due to the increased request for The frequent finding of adrenal incidentalomas (AI) is mainly due to the increased request for computed tomography (CT) scans and their improved resolution. Currently, evidence-based clinical computed tomography (CT) scans and their improved resolution. Currently, evidence-based clinical guidelines have established recommendations for the management of these lesions.guidelines have established recommendations for the management of these lesions.
The aim of this article is to highlight the main recommendations for the correct evaluation of AI. We The aim of this article is to highlight the main recommendations for the correct evaluation of AI. We will review the main elements used in the differential diagnosis of benign and malignant adrenal will review the main elements used in the differential diagnosis of benign and malignant adrenal lesions, such as Hounsfield units (HU) and AI size on unenhanced CT; the indication for additional lesions, such as Hounsfield units (HU) and AI size on unenhanced CT; the indication for additional imaging; tests indicated in the evaluation of hyperfunction; the definition of mild autonomous imaging; tests indicated in the evaluation of hyperfunction; the definition of mild autonomous cortisol secretion (MACS) and its implications; and the introduction of adrenal steroid metabolite cortisol secretion (MACS) and its implications; and the introduction of adrenal steroid metabolite testing, which has proven useful in the differential diagnosis of SI with testing, which has proven useful in the differential diagnosis of SI with ≥10 HU on unenhanced CT. 10 HU on unenhanced CT. We will also review new mutations associated with multiple endocrine neoplasia syndromes, which We will also review new mutations associated with multiple endocrine neoplasia syndromes, which should be suspected especially in bilateral adrenal lesions. Finally, we will mention the current should be suspected especially in bilateral adrenal lesions. Finally, we will mention the current approach regarding the follow-up of non-functioning benign lesions and patients with MACS.approach regarding the follow-up of non-functioning benign lesions and patients with MACS.
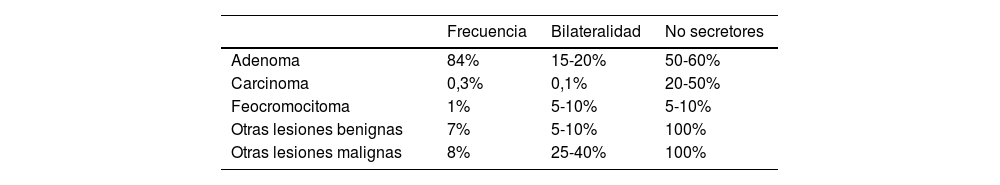
Las masas suprarrenales, descubiertas accidentalmente en exámenes de imágenes realizados para estudio de patología no relacionada con la sospecha de enfermedad suprarrenal, denominados incidentalomas, han aumentado en las últimas décadas. En una serie que evaluó la frecuencia de incidentalomas suprarrenales (IS) en tomografías computadas (TC) de abdomen y tórax en un centro universitario de Santiago, encontramos una frecuencia de IS de 1,8%, con edad promedio de los casos de 64 años1. La frecuencia incrementa con la edad, alcanzando 7-10% en mayores de 70 años. Un 85-90% son adenomas no secretores o no funcionantes (NF) y de un tamaño menor a 4cm (tabla 1).
Características de los incidentalomas suprarrenales10
| Frecuencia | Bilateralidad | No secretores | |
|---|---|---|---|
| Adenoma | 84% | 15-20% | 50-60% |
| Carcinoma | 0,3% | 0,1% | 20-50% |
| Feocromocitoma | 1% | 5-10% | 5-10% |
| Otras lesiones benignas | 7% | 5-10% | 100% |
| Otras lesiones malignas | 8% | 25-40% | 100% |
Otras lesiones benignas: mielolipomas, quistes, hematomas.
Otras lesiones malignas: metástasis, linfoma, sarcomas.
Desde inicios de los 2000, se han publicado consensos de expertos y guías clínicas que han permitido estandarizar el estudio funcional, la indicación quirúrgica y cómo realizar el seguimiento de los IS2,3. El objetivo de esta revisión es remarcar las principales recomendaciones para la correcta evaluación del IS.
Imágenes en la evaluación inicial del incidentaloma suprarrenalLa importancia de un adecuado diagnóstico por imágenes en IS radica en que la biopsia no se recomienda, ya que tiene una baja sensibilidad para diagnosticar carcinoma suprarrenal, dejando su indicación solo frente a la sospecha de un compromiso metastásico4. Por esto, se han buscado parámetros objetivos en las imágenes que permitan discriminar entre adenomas y otras lesiones sólidas.
Tomografía computarizadaLa TC sin contraste es un buen examen para evaluar nódulos suprarrenales. Una experiencia retrospectiva publicada en 2005 evaluó el valor del coeficiente de atenuación, medido en unidades Hounsfield (UH) en fase no contrastada de la TC, para diferenciar adenomas/hiperplasia de no adenomas (carcinoma, feocromocitoma, metástasis). La escala de Hounsfield es un método cuantitativo que permite definir diferentes niveles de radio densidad de los tejidos. Un valor negativo, indica alto contenido de grasa y un valor más positivo, escaso contenido de lípidos. Este estudio demostró que ningún no adenoma tuvo menos de 10UH en TC, excepto mielolipomas, por su composición grasa. La gran mayoría de los no adenomas presenta más de 20UH. La especificidad y sensibilidad para el punto de corte 10UH fue 98% y 60% respectivamente5. Sin embargo, alrededor de 1/3 de los adenomas tienen escaso contenido lipídico y pueden presentar >10UH. En estos casos sería útil evaluar el porcentaje del lavado en TC con contraste. La especificidad de un lavado absoluto ≥60% a los 15 minutos post contraste para diferenciar entre un adenoma pobre en lípidos y un no adenoma, va entre 76-95%, según la serie6,7. Esta diferencia se debería a que, alrededor de un 15% de los feocromocitomas pueden tener un lavado rápido al ser ricamente vascularizados6. Posteriormente, se ha demostrado que un lavado relativo >58% tiene un valor predictivo positivo de 99% para distinguir entre adenomas y lesiones malignas por lo que sería un parámetro más recomendable3,8. Sin embargo, actualmente hay controversia respecto a la utilidad del lavado en el diagnóstico diferencial ya que, según algunos autores, clasificaría en forma incorrecta alrededor de 35% de las masas adrenales8–10.
Por otra parte, se ha demostrado que 10UH tiene una baja especificidad para discriminar entre adenomas y carcinomas y que un valor cercano a 20UH aumentaría la sensibilidad a 65-100% y la especificidad a 64-80%11–14. Sin embargo, en la guía actual3 se mantienen los criterios para diagnosticar adenomas ya que, aún falta evidencia para realizar nuevas recomendaciones, pero deberíamos analizar cuidadosamente los casos entre 10-20UH.
Otro elemento a evaluar es el tamaño del incidentaloma. Se ha demostrado que un punto de corte en 4cm tiene una sensibilidad >90% para discriminar entre adenomas y carcinomas y es uno de los parámetros utilizados para definir la indicación quirúrgica15–17. Más recientemente algunos autores han sugerido que, un tamaño alrededor de 3,5cm discrimina mejor entre adenomas y carcinomas13. Se recomienda que la medición se haga en 3 dimensiones ya que, la medición bidimensional puede subestimar el tamaño18.
En lesiones con ≥10UH o masas indeterminadas, también se debe evaluar otras características: homogeneidad, presencia de necrosis, calcificaciones, signos de invasión local y bilateralidad. Una lesión heterogénea, con necrosis central, vascularizada y lavado retardado en fase con contraste es sugerente de feocromocitoma. Pero, habitualmente se requiere realizar un segundo examen de imágenes, el cual se selecciona de acuerdo a la clínica que presenta el paciente.
Resonancia magnética (RM)La RM con desplazamiento químico está indicada para diferenciar adenomas pobres en lípidos de otras lesiones, con sensibilidad de 94% y especificidad de 95%19.
La mayoría de los estudios que han evaluado su utilidad en el análisis de lesiones en pacientes con malignidad extra adrenal, han utilizado equipos de 1.5 Tesla. En estos casos se ha encontrado una sensibilidad de 89-99% y especificidad de 60-93% para la relación suprarrenal-hígado, suprarrenal-bazo, suprarrenal músculo y para la pérdida de intensidad de señal9.
Respecto de otras masas indeterminadas, una lesión brillante en T2 es sugerente de feocromocitoma por lo tanto, ante la sospecha clínica es el examen de imagen de segunda línea de elección.
Tomografía con emisión de positrones (PET)El PET con 18-fluorodesoxiglucosa (FDG) es útil ante la sospecha de lesiones malignas, las que se presentan como áreas hipermetabólicas. Un metanálisis publicado en 2011, demostró que tiene una sensibilidad y especificidad sobre 90% para diferenciar lesiones malignas de adenomas, siendo superior el análisis visual o cualitativo que el uso de la SUVmax (maximal standardized uptake value)20. Posteriormente, otro metaanálisis encontró una menor especificidad (73%) para una SUVmax >3,4, lo cual no lo haría superior a la TC sin contraste para el diagnóstico diferencial9. Esta discrepancia en los resultados puede deberse a que, hasta ahora los distintos trabajos han evaluado diferentes parámetros, por lo tanto, PET/CT-FDG continúa siendo el examen de imagen de segunda línea recomendado para el estudio de masas indeterminadas con sospecha de malignidad.
Conjuntamente con la evaluación de la imagen, se debe realizar anamnesis y examen físico completo buscando hipertensión arterial o signos de hipercortisolismo. En la anamnesis es importante indagar sobre medicamentos que puedan interferir con el estudio funcional.
Estudio funcionalEn todo IS, adenoma o masa indeterminada, se debe establecer si es no funcionante (NF) o hipersecretor. Con el fin de descartar hipersecreción de cortisol, aldosterona y catecolaminas, se utilizan las pruebas de laboratorio recomendadas en las guías, basándose en la clínica y las UH en la TC sin contraste3. Este se debe realizar siempre en condiciones basales y nunca en situaciones de estrés agudo.
Test de supresión nocturna con 1mg de dexametasona (TSD)En toda masa suprarrenal se debe descartar la hipersecreción de cortisol, aún en ausencia de clínica. Para esto, el examen indicado es la medición del cortisol matinal después de una dosis nocturna de 1mg de dexametasona. El punto de corte diagnóstico es igual que para síndrome de Cushing (SC): 1,8μg/dl. Previamente se utilizaron puntos de corte más altos (3 o 5μg/dl) pero, se sub diagnosticaban los casos denominados secreción autónoma leve de cortisol (MACS por sus siglas en inglés)21. Como veremos más adelante, estos pacientes no presentan signos clínicos característicos de SC pero tienen riesgo aumentado de desarrollar complicaciones metabólicas, hipertensión y osteoporosis. Antes de solicitar el examen se debe descartar el uso de estrógenos orales (anticonceptivos, terapia de reemplazo hormonal) porque inducen la síntesis hepática de CBG (cortisol binding globulin), lo que aumenta el cortisol plasmático unido a la globulina. De igual modo, se deben descartar los fármacos que aumentan el metabolismo de la dexametasona (inductores de la CYP3A4). En todo paciente con TSD alterado en que se considere cirugía, se debe confirmar un hipercortisolismo ACTH independiente solicitando ACTH y dehidroepiandrosterona sulfato (DHEAS). Si existen elementos clínicos, aunque sean inespecíficos, que hagan sospechar SC, se debe solicitar cortisol libre en orina de 24 horas y/o cortisol salival nocturno. Si esos exámenes resultan normales, se puede confirmar MACS.
Relación aldosterona/actividad de renina plasmática (ARP)En todo paciente hipertenso con o sin terapia se debe medir potasio, aldosterona y ARP para descartar hiperaldosteronismo. También se debe descartar en paciente normotenso con hipokalemia. La muestra de sangre debe tomarse antes de las 9 AM, después que el paciente haya estado levantado al menos 2 horas y haya permanecido 15 minutos sentado antes de la toma de muestra. En mujeres en edad reproductiva, la muestra debe ser tomada en fase folicular. En pacientes que usan antagonistas del receptor de mineralocorticoides, se deben suspender al menos 4 semanas antes de realizar los exámenes. Cuando se mide la concentración de renina directa, se debe dividir por 12 para obtener la ARP.
Aunque aún hay controversia respecto al punto de corte diagnóstico de la relación aldosterona/ARP, una relación aldosterona (en ng/dl) y ARP (en ng/ml/h) >30 confirmaría el diagnóstico y <20 lo descartaría. Valores entre 20-30 se consideran sospechosos y es recomendable repetir la medición, corrigiendo potasio, liberando el sodio de la dieta y suspendiendo antihipertensivos que pueden falsear la relación. Los estrógenos orales aumentan el angiotensinógeno, lo que aumenta la angiotensina II que disminuye la renina directa, dando un falso positivo en la relación. Según los resultados, se debe realizar algún test confirmatoriol22. Sin embargo, si hay hipokalemia espontánea, ARP suprimida o concentración de renina en rango normal bajo y concentración de aldosterona >20ng/dl, no se requiere realizar otro test para confirmar el diagnóstico22. Alrededor del 20% de los pacientes con hiperaldosteronismo primario y una lesión suprarrenal presentan co-secreción de cortisol y, por lo tanto, TSD alterado.
MetanefrinasEn lesiones con menos de 10UH no es necesario medir metanefrinas dado que la probabilidad de que se trate de un feocromocitoma es cercana a cero23. Alrededor de 20% de los feocromocitomas pesquisados incidentalmente, no manifiestan hipertensión24. Por lo tanto, en IS con ≥10UH siempre se debe descartar. También se recomienda excluir un feocromocitoma en pacientes con lesión maligna extra suprarrenal conocida y una masa indeterminada, aunque se sospeche metástasis3.
El examen indicado es la medición de metanefrinas libres en plasma (sensibilidad 90-100% y especificidad 79-80%) o, metanefrinas fraccionadas en orina de 24h (sensibilidad 85-97% y especificidad 69-95%). La técnica de determinación recomendada es la cromatografía líquida de alta resolución (HPLC), por sus siglas en inglés). El examen nunca debe ser realizado en condición de estrés y se deben considerar fármacos que pueden interferir con la determinación y, por lo tanto, con el resultado25. Se considera diagnóstico un valor aumentado 3 o más veces el límite superior del rango normal para muestra en plasma y 2 o más veces para muestra en orina.
Otras determinacionesDe acuerdo a la clínica y características de la lesión en las imágenes, puede ser necesaria una evaluación bioquímica adicional. En lesiones bilaterales sugerentes de hiperplasia nodular bilateral, se debe solicitar 17-OH progesterona para descartar hiperplasia suprarrenal congénita. En lesiones bilaterales sugerentes de metástasis se debe solicitar cortisol y ACTH matinal para descartar insuficiencia suprarrenal primaria. Frente a la sospecha de un carcinoma o, si existen signos de androgenización o virilización en la mujer o de estrogenización en el hombre, se debe solicitar DHEAS, testosterona total, androstenediona y estradiol. Los carcinomas pueden co-secretar andrógenos, cortisol y mineralocorticoides pero, habitualmente corresponde a metabolitos no detectables por las determinaciones habituales. En estos casos se ha demostrado la utilidad de evaluar el perfil de precursores de esteroides, como describiremos más adelante. En pacientes con hiperplasia bilateral, TSD alterado y signos de hipercortisolismo, se debe solicitar ACTH para descartar un SC ACTH dependiente.
Una vez establecido si el IS es NF, se define la conducta a seguir de acuerdo a las guías vigentes3,25. La figura 1 muestra un algoritmo simplificado de enfrentamiento al IS.
Diagrama de flujo para el enfrentamiento de un paciente con incidentaloma suprarrenal.
* En los IS con <10UH en TC sin contraste no se deben medir metanefrinas. En todas los IS se debe realizar TSD y en casos con hipertensión arterial se debe medir aldosterona, ARP o concentración de renina directa y potasio. Estudios adicionales: RM con desplazamiento químico, PET/CT-FDG o, biopsia ante sospecha de lesión metastásica de tumor primario de otro origen.
A: porcentaje lavado absoluto.
B: porcentaje lavado relativo.
Abreviaciones: IS: incidentaloma suprarrenal; UH: unidades Hounsfield; TC: tomografía computada; TSD: test de supresión con 1mg de dexametasona; ARP: actividad de renina plasmática; RM: resonancia magnética; MACS: secreción leve autónoma de cortisol.
Como ya se mencionó, cuando el TSD es >1,8μg/dl y no hay elementos clínicos de SC, estamos frente a un caso de MACS, previamente denominado SC subclínico. Este es la causa más frecuente de IS funcionantes, con una prevalencia de 30-50%10,26. Aunque estos casos no tienen signos de hipercortisolismo clínico, un meta-análisis demostró que IS con MACS tienen mayor frecuencia que los NF de: hipertensión arterial (64% vs. 58%), prediabetes (50% vs. 11,5%), diabetes tipo 2 (28% vs. 14%) y en el seguimiento, mayor proporción de ganancia de peso u obesidad (21% vs. 9%) y de eventos cardiovasculares (15,5% vs. 6%)26. Pacientes que previamente tenían diabetes o hipertensión, presentan deterioro del control. Desde el punto de vista óseo, se asocia a una disminución de la densidad mineral ósea y calidad del hueso, con mayor prevalencia de osteoporosis y fracturas vertebrales comparado con IS no funcionantes27. La causa más frecuente de muerte es cardiovascular pero no hay diferencia entre IS funcionantes y NF (alrededor 4%). Se ha sugerido que serían factores de riesgo, mayor edad y un valor de cortisol más alto en el TSD28–30. Sin embargo, a pesar de ser funcionantes no todos los IS <4cm con MACS tienen indicación quirúrgica. Se sugiere en estos casos mantener un seguimiento extendido, evaluando la aparición o deterioro de complicaciones metabólicas al menos cada 6 meses y la disminución de la densidad mineral ósea cada 18 meses, independiente de la edad31. La indicación quirúrgica debe ser evaluada por un equipo multidisciplinario considerando las características de la lesión en la imagen, si es uni o bilateral, la edad del paciente, valor de cortisol post dexametasona, el número y severidad de comorbilidades presentes y también las preferencias del paciente3,10. Por otra parte, existe evidencia que en mayores de 65 años el riesgo de mortalidad por esta causa disminuye significativamente por lo que en estos casos, el manejo debería ser menos agresivo3,30.
Metabolómica de esteroides urinariosDesde hace más de una década se investiga la utilidad de la determinación de precursores de esteroides suprarrenales en muestra de orina de 24 horas para discriminar entre diferentes patologías. La mayor utilidad sería para diferenciar entre adenomas y carcinomas. Se ha observado que alrededor de 2/3 de los carcinomas aparentemente NF detectados como IS, secretan precursores de esteroides32. Esto se debe a una falla en la expresión enzimática. Utilizando técnicas de espectrometría de masa (MS, por sus siglas in inglés) se ha demostrado que los carcinomas secretan significativamente más precursores de metabolitos de andrógenos, de andrógenos activos, precursores de metabolitos de glucocorticoides y metabolitos de glucocorticoides que adenomas. Por otra parte, los adenomas secretan significativamente más metabolitos de glucocorticoides vs. controles, sin diferencia significativa para precursores de mineralocorticoides entre los 3 grupos32,33. Un estudio más reciente sugiere que su uso combinado con las UH y el tamaño de la lesión en la TC sin contraste mejora la detección de carcinomas suprarrenales, lo que disminuye costos en exámenes de imágenes adicionales, favorece una cirugía precoz en verdaderos positivos y evita cirugías innecesarias en falsos positivos de lesiones benignas con más de 10UH12. La última guía clínica sobre manejo de IS sugiere que, ante la sospecha de carcinoma, se debe medir los precursores de esteroidogénesis por MS en tándem3. Sin embargo, para esta determinación, aún no existe un punto de corte estandarizado para todas las poblaciones y no está disponible en nuestro medio.
Incidentalomas bilateralesUn 10-15% de los IS pueden ser bilaterales. La mayoría de estos corresponde a metástasis de un tumor primario de otro origen. Entre las etiologías suprarrenales de origen cortical están la hiperplasia macronodular bilateral (HMNB) y los adenomas bilaterales. Otras causas corresponden a: feocromocitomas, hiperplasia secundaria a síndrome de Cushing ACTH dependiente, hiperplasia suprarrenal congénita e hiperaldosteronismo primario por hiperplasia bilateral. Otras lesiones pueden corresponder a mielolipomas, linfoma, infecciones (tuberculosis), infiltración (amiloidosis) y hemorragia bilateral34. Es importante recalcar que siempre se debe analizar cada lesión por separado.
Con respecto a la hipersecreción, se ha reportado que MACS es más frecuente en IS bilaterales que en unilaterales, con una prevalencia entre 35-42% vs. 12-18%35,36.
La hiperplasia cortical suprarrenal puede ser macronodular (nódulos >1cm) o micronodular (nódulos <1cm). Esta última habitualmente corresponde a la enfermedad nodular primaria pigmentada (PPNAD, por sus siglas en inglés) que, excepcionalmente se presenta como IS a diferencia de HMNB. La HMNB en la TC sin contraste se presenta habitualmente con nódulos con <10UH pero, también puede aparecer como un aumento de tamaño difuso de la suprarrenal, sin nódulos evidentes, lo que lleva a que se diagnostique erróneamente como IS unilateral. Por esto, se han propuesto métodos de análisis de imágenes que ayuden en la caracterización de las suprarrenales, que además puedan correlacionarse con hipersecreción37.
La HMNB puede presentarse en forma asintomática, como MACS o como SC clínico. Respecto a la etiología, se ha demostrado que en algunos adenomas e HMNB, la esteroidogénesis puede ser estimulada vía adenilato ciclasa por otras hormonas además de ACTH. Esto se debería a la expresión en los nódulos, de receptores aberrantes acoplados a proteína G, los que pueden ser estimulados por: catecolaminas, GIP, angiotensina II, vasopresina, LH o serotonina. Lacroix diseñó un protocolo para la identificación de estos receptores en pacientes con hipercortisolismo. La relevancia de la búsqueda sistemática de receptores aberrantes en pacientes con HMNB radica en la posibilidad de una terapia médica38.
Estudio genéticoLa gran mayoría de los IS son esporádicos, pero se debe sospechar la posibilidad de un síndrome genético por mutación germinal cuando se presentan a edad temprana, hay historia familiar o, en lesiones bilaterales como feocromocitomas o HMNB. Alrededor de 10% de los pacientes con carcinomas y 40% de los que presentan feocromocitomas/paragangliomas son portadores de una mutación10. Los feocromocitomas bilaterales pueden asociarse con alta probabilidad a sindromes genéticos como: neoplasia endocrina múltiple (NEM) tipo 2 o Von Hippel-Lindau (VHL), entre otros. Más recientemente se ha publicado que portadores de mutaciones en genes supresores de tumor: MAX y TMEM127, pueden desarrollar feocromocitomas bilaterales39. La HMNB puede asociarse, aunque con baja frecuencia, a síndromes genéticos como NEM tipo 1, poliposis adenomatosa familiar o leiomiomatosis hereditaria. La mutación en el gen supresor de tumor ARMC5, se ha descrito en 25% de los casos de HMNB y, en alrededor del 50% de los casos que manifiestan hipercortisolismo más severo40. La mutación en el gen PRKAR1A, habitualmente asociado al complejo de Carney con PPNAD y SC, también se ha encontrado en formas esporádicas de adenomas productores de cortisol y carcinomas7.
Los carcinomas suprarrenales bilaterales son muy poco frecuentes y se debe sospechar en casos con componentes de algún síndrome genético. La tabla 2 resume algunos de los síndromes genéticos que pueden presentar como una de sus manifestaciones un tumor suprarrenal y para los cuales se puede realizar la búsqueda dirigida de la mutación.
Algunos síndromes genéticos asociados con tumores suprarrenales
| Síndrome | Gen involucrado | Modo de herencia | Lesión suprarrenal | Otras manifestaciones |
|---|---|---|---|---|
| NEM 1 | MEN1 | Autosómica dominante | AdenomasAdenomas múltiplesHiperplasia nodularQuistesCarcinomas(90% lesiones no funcionantes) | HiperparatiroidismoTu enteropancreáticosAdenoma hipofisiarioCarcinoide bronquialAngiofibromaColagenomaTu tiroideos, de mamaMeningioma |
| NEM 2 | RET | Autosómica dominante | Feocromocitoma en 50% de los casos 60% bilaterales | NEM2ACa medularHiperparatiroidismoAmiloidosis cutáneaNEM2BCa medularNeuromas mucocutáneosHiperlaxitudHábito marfanoideGanglioneuromas intestinales |
| Poliposis adenomatosa familiar | APC | Autosómica dominante | ∼25% lesiones bilaterales.HMNB | Pólipos adenomatosos de colon y recto |
| Síndrome | Gen involucrado | Modo de herencia | Lesión suprarrenal | Otras manifestaciones |
| Leiomiomatosis y cáncer renal | FH | Autosómica dominante | 15% lesiones bilaterales.HMNB (poco frecuente).Sindrome de Cushing,Feocromocitomas bilaterales poco frecuentes pero, con riesgo de malignidad. | Leiomiomas cutáneos y uterinos |
| Von Hippel-Lindau | VHL | Autosómica dominante | Feocromocitoma en 20% de los casos.40% bilaterales | Hemangioblastomas cerebralesHemangioblastomas espinalesCa células renalesTu neuroendocrino de páncreasAngiomas retinales |
| Paragangliomas 1, 4, 5 | SDHA, SDHB, SDHD | Autosómica dominante | SDHB y SDHD: 25% presenta feocromocitomas Pueden ser bilaterales.En SDHB >40% malignos.SDHA: Feocromocitomas son muy poco frecuente. | ParagangliomasCa células renalesAdenoma hipofisiarioGIST |
| Neurofibromatosis tipo 1 | NF1 | Autosómica dominante | 6% de los casos presentan feocromocitoma. 15% bilaterales. Pueden ser malignos.Carcinoma infrecuente | Manchas café con leche en piel.Gliomas de SNCNeurofibromasNódulos de LischRabdomiosarcomaGISTLeucemia mielomonocítica juvenilCa de mamaCardiopatía congénita |
| Mutación MAX | MAX | Autosómica dominante | ∼70% tiene feocromocitomas bilaterales.Hasta 25% son malignos | Paragangliomas |
| Mutación TMEM127 | TMEM127 | Autosómica dominante | ∼40% presenta feocromocitomas bilaterales∼10% malignos | Ca de células renales |
| HMNB | ARMC5 | Autosómica dominante | HMNB y MACS/síndrome de Cushing | Meningioma |
| Li-Fraumeni | TP53 | Autosómica dominante | 80% de los carcinomas en niños.Hasta 7% en adultos. | Tu cerebralesCa de mamaCa pulmonarSarcomaLeucemia |
| Complejo de Carney | PRKAR1A | Autosómica dominante | Hiperplasia nodular pigmentada y Sindrome de Cushing.Carcinoma poco frecuente | Mixomas cutáneos y cardiacos.SchwanomasLéntigos cutáneosNódulos/Ca tiroidesAcromegalia (adenoma/hiperplasia hipofisiaria)Tu benignos de mamaTu ováricosTu células de Sertoli |
| Sindrome de Lynch | MLH1, MSH2, MSH6, PMS2, EPCAM | Autosómica dominante | 3% de los carcinomas en adultos | Tumores malignos de:EstómagoColonPáncreasVía biliarEndometrioOvarioGenitourinarioPróstataCerebro |
Abreviaciones: MEN: multiple endocrine neoplasia; RET: receptor tirosin quinasa; FH: fumarato hidratasa; SDH: succinato dehidrogenasa; MAX: MYC-associated factor X; TMEM127: proteína transmembrane 127; ARMC5: armadillo repeat containing 5; TP53: tumor protein 53; PRKAR1A: subunidad reguladora de la proteína quinasa tipo 1-alfa dependiente de AMPc; MLH1: MutL homolog 1; MSH: MutS homolog; PMS2: Postmeiotic segregation increased 2; EPCAM: molécula de adhesión de célula epitelial; NEM: neoplasia endocrina múltiple; HMNB: hiperplasia macronodular bilateral; MACS: secreción autónoma leve de cortisol; GIST: tumor estromal gastrointestinal; Ca: cáncer; Tu: tumor(es); SNC: sistema nervioso central.
De acuerdo a evidencia reciente, no se recomienda el control periódico de imágenes en IS NF. En seguimiento a 4 años, solo 2,5-3% de estos nódulos aumenta >0,5-1cm/año, pero no evolucionan a carcinoma. Un 4-28% desarrolla MACS pero la probabilidad de desarrollar exceso hormonal clínico es <0,1%13,29.
Por lo tanto, la indicación en nódulos NF sería: nódulos <1cm, sin evidencias clínicas de hipersecreción, no requieren estudio ni seguimiento con imágenes. Nódulos de 1-3,9cm, con <10UH, solo requieren seguimiento clínico y si aparecen signos de hipersecreción, realizar estudio bioquímico. No requieren control de imágenes salvo que el estudio funcional resulte alterado. En nódulos homogéneos, con 11-20UH, evaluar TC con contraste o RM para descartar lesión potencialmente maligna y luego controlar imagen a los 12 meses.
ConclusiónEn la actualidad, la mejor resolución de los equipos de tomografía, nuevos métodos de análisis de imágenes, implementación de técnicas de laboratorio y estudios genéticos han optimizado el diagnóstico etiológico y la orientación sobre el potencial maligno o base genética de los IS.
El seguimiento con imágenes y los tiempos dependen de las características del IS.
Una condición que requiere un análisis multidisciplinario por sus implicancias es el MACS, evaluando en cada caso la indicación quirúrgica o seguimiento.
El enfrentamiento al IS es un tema en evolución y, probablemente habrá cambios en algunas recomendaciones en un futuro próximo.
Conflictos de interésLa autora declara no tener conflictos de interés.
FinanciamientoLa autora declara no haber recibido financiamiento para la redacción de este manuscrito.