Las pacientes infértiles tienen un riesgo aumentado de resultados obstétricos y perinatales adversos que dependen de los factores de infertilidad subyacentes previos y de factores inherentes a los tratamientos recibidos para lograr el embarazo. La edad materna, las patologías previas ginecológicas, hormonales, endocrinológicas, metabólicas y anatomo funcionales son reconocidas como factores de riesgo para resultados adversos obstétricos y perinatales. Los tratamientos como la hiperestimulación ovárica y los tratamientos de reproducción asistida condicionan riesgos adicionales, especialmente por el aumento de embarazos múltiples que se generan con estas terapias. El aumento de la edad materna de pacientes tratadas por infertilidad y la necesidad creciente de tratamientos de reproducción asistida determinan probablemente, un mayor riesgo futuro de complicaciones obstétricas y perinatales. Muchos de estos factores de riesgo pueden ser modificados y manejados antes de iniciar los tratamientos con la finalidad de mejorar el pronóstico para la madre y el recién nacido. La consideración de estos factores de riesgo y sus consecuencias en el embarazo son parte esencial del consejo reproductivo que debiera recibir toda paciente que se somete a tratamientos por infertilidad.
El objetivo de esta revisión es mostrar la relación existente entre las pacientes que consultan por infertilidad, los tratamientos usados y los potenciales riesgos obstétricos y perinatales cuando se produce el embarazo.
Infertile patients have an increased risk of adverse obstetric and perinatal outcomes that depend on underlying infertility factors and on those treatments recieved to become pregnant. Maternal age, hormonal, endocrinologial, metabolic and anatomic/functional gynecological diseases are widely recognized risk factors for adverse obstetric and perinatal outcomes. Infertility treatments like controlled ovarian hyperstimulation and assisted reproductive technologies add aditional risks, specially related to multiple pregnancies that are associated to. The higher maternal age of patients seeking for infertility treatment and the increasing need of assisted reproductive technologies probably determines a higher and increasing risk of obstetric and perinatal adverse outcomes. In many cases risk factors can be adequately modified and controlled before treatments are initiated thus improving maternal and neonatal prognosis. This risk factors and their consequences in pregnancy have to be strongly considered in reproductive counselling that should recieve every patient treated for infertility.
The aim of this article is to show the relation between infertile patients seeking for treatment and their potential risks of obstetric and perinatal adverse outcomes when they get pregnant.
La evolución del embarazo y las complicaciones obstétricas y perinatales de las pacientes tratadas por infertilidad han sido motivo de estudio y controversia desde hace décadas. Los estudios muestran que las pacientes sub-fértiles que se embarazan espontáneamente o aquéllas sometidas a tratamiento para lograrlo, muestran tasas de complicaciones obstétricas y perinatales más altas que las pacientes con fertilidad normal.
Este mayor riesgo en las parejas infértiles está determinado por varios factores como la edad materna y paterna, patologías crónicas de base, disfunciones endocrinas y metabólicas, patología anatómica o funcional del tracto genital, alteraciones inflamatorias, tiempo de exposición y tipos de tratamientos requeridos para lograr el embarazo.
Estos factores de riesgo se presentan generalmente combinados en una misma paciente lo que dificulta la identificación de causalidad en las complicaciones obstétricas y perinatales observadas en las pacientes infértiles.
Un número creciente de estudios ha mostrado que las disfunciones reproductivas aumentan per se el riesgo de complicaciones del embarazo por mecanismos similares. Esto aplica para enfermedades sistémicas como la obesidad y el síndrome de ovario poliquístico (SOP) y, para patologías ginecológicas como los miomas, endometriosis y adenomiosis1.
Se ha establecido que las técnicas de reproducción asistida (TRA) se asocian con riesgos para la madre y el feto2, pero los datos disponibles son complejos ya que muchos de los factores maternos asociadas con la infertilidad pueden contribuir a efectos adversos del embarazo más que los procedimientos de TRA por sí mismos3.
En los últimos años se nota una tendencia marcada a la postergación de la maternidad a edades más avanzadas y por esto, a la necesidad de tratamientos de alta complejidad para un número creciente de mujeres aumentando así los embarazos de alto riesgo.
Por su parte, el embarazo múltiple producto de los tratamientos de infertilidad, ya sea con o sin TRA, es un factor de riesgo adicional a los antes mencionados y con la mejoría de los procedimientos en el laboratorio y transferencia embrionaria es en cierta medida prevenible.
La edad materna avanzada y el embarazo múltiple en las parejas infértiles son los factores de riesgo que más aumentaron en los últimos años y que con mayor frecuencia se asocian a complicaciones obstétricas y perinatales.
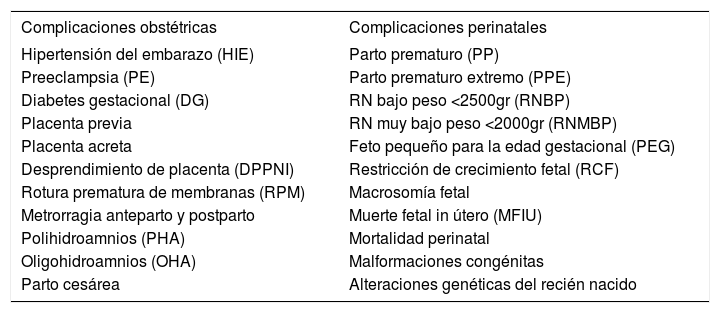
La Tabla 1 muestra una lista con las complicaciones obstétricas y perinatales a la que se hará referencia en el desarrollo del texto.
Complicaciones obstétricas y perinatales más frecuentes
| Complicaciones obstétricas | Complicaciones perinatales |
|---|---|
| Hipertensión del embarazo (HIE) | Parto prematuro (PP) |
| Preeclampsia (PE) | Parto prematuro extremo (PPE) |
| Diabetes gestacional (DG) | RN bajo peso <2500gr (RNBP) |
| Placenta previa | RN muy bajo peso <2000gr (RNMBP) |
| Placenta acreta | Feto pequeño para la edad gestacional (PEG) |
| Desprendimiento de placenta (DPPNI) | Restricción de crecimiento fetal (RCF) |
| Rotura prematura de membranas (RPM) | Macrosomía fetal |
| Metrorragia anteparto y postparto | Muerte fetal in útero (MFIU) |
| Polihidroamnios (PHA) | Mortalidad perinatal |
| Oligohidroamnios (OHA) | Malformaciones congénitas |
| Parto cesárea | Alteraciones genéticas del recién nacido |
La edad materna avanzada es definida como la maternidad en mujeres de 35 años o más. La edad materna en que se busca el embarazo es responsable en gran medida del aumento de la infertilidad en los últimos años y por lo tanto de la creciente necesidad de tratamientos de reproducción asistida (TRA).
Muchas mujeres retardan la maternidad hasta la cuarta y quinta décadas de la vida por diferentes factores socio culturales que incluyen mejor acceso a la anticoncepción, educación más prolongada y metas laborales más altas, matrimonios más tardíos, deseo de estabilidad financiera y otros.
Si bien la fecundidad de la mujer es un proceso continuo y variable, está claramente establecido que disminuye rápidamente a partir de los 35 años y que el retraso de la maternidad a edades avanzadas aumenta la demanda de tratamientos de medicina reproductiva incluyendo fertilización in vitro (FIV) y ovo donación (OD).
El aumento de la edad materna al momento de embarazarse ha sido una tendencia creciente, especialmente en países de altos ingresos4. En Inglaterra y Gales el año 2013 un 20% de los partos fue en mujeres de >35 años y un 4% en mayores de 40 años, comparados con el 6% y 1% respectivamente reportados en 19805. En Chile entre 2010 y 2017 los partos en mujeres >35 años aumentaron de 16,5 a 19,7% del total6 y en ese mismo período del total de mujeres sometidas a TRA el porcentaje de pacientes >35 años aumentó de 60 a 69%7.
Se sabe que la EMA aumenta el riesgo de complicaciones obstétricas y perinatales y que se asocia a un aumento de tratamientos de infertilidad especialmente TRA, los que por su parte suman también riesgo de complicaciones para la madre y el recién nacido8. En mujeres con fertilidad probada, las tasas de infertilidad aumentan de 10-20% después de los 35 años y hasta 45% después de los 40 años, lo que también ocurre en mujeres nulíparas9.
Un estudio de cohorte con datos del Multicountry Survey on Maternal and Newborn Health (WHOMCS) de la OMS, con más de 314.000 partos en 29 países y divididos por grupo etario, mostró aumento significativo de muerte materna con una tasa de probabilidad u odds ratio (OR) de 1,7 para grupo 35-39 años IC95% (1,2-2,6), de 2,6 para grupo 40-44 años IC95% (1,4-4,7) y de 4,3 para pacientes de ≥45 años IC95% (1,5-12,1). El riesgo de complicaciones perinatales como parto prematuro (PP), muerte fetal in útero (MFIU), mortalidad perinatal, RN bajo peso <2500gr (RNBP) y hospitalización en Unidad de Cuidados Intensivos Neonatales (UCIN) aumentó en los tres grupos etarios de un modo edad materna dependiente10. Hallazgos semejantes reporta otro estudio que incorpora la obesidad a la edad en el análisis de los resultados. Se demostró un aumento en las tasas de cesárea, diabetes gestacional (DG), PP y RNBP en las pacientes obesas y no obesas mayores de 40 años y un aumento más marcado de la hipertensión del embarazo (HIE), parto prematuro extremo (PPE) y admisión a UCIN en pacientes obesas mayores de 40 años11. Datos semejantes se observan en otro estudio retrospectivo y que reporta además una duplicación de la mortalidad perinatal con el aumento de la edad materna (4,9% a 9,5% de los embarazos)12. Una revisión sistemática y meta-análisis más reciente analizó resultados adversos del embarazo en mujeres de edad avanzada. Hubo 185.384 MFIU en un total de 44.723.207 partos (0,42%) lo que corresponde a un aumento de 75% en EMA, siendo más notorio este aumento en pacientes multíparas. Los resultados fueron semejantes para riesgo de restricción de crecimiento fetal (RCF), muerte neonatal, ingreso a UCIN y DG. Otros 12 estudios reportaron un 23% más de recién nacidos con RCF en EMA comparadas con pacientes más jóvenes (OR 1,23 IC95% (1,01- 1,52)).
En las pacientes nulíparas de edad avanzada el riesgo de RNBP aumentó a más del doble del riesgo basal (OR 2,28 CI95% (1,25-4,13)). Respecto de los resultados secundarios, hubo en pacientes EMA mayor número de fetos pequeños para la edad gestacional (PEG), RNBP, PP, muerte neonatal, ingreso a UCIN y desprendimiento de placenta (DPPNI), siendo el riesgo del doble o más para la preeclampsia (PE) y DG13.
La mayoría de las condiciones relacionadas al aumento de riesgo materno y perinatal en mujeres de edad avanzada tienen asociación biológica con disfunción placentaria. La disfunción placentaria es una entidad compleja y aún poco comprendida que parece tener relación con complicaciones como la muerte fetal in útero (MFIU), la PE y la RCF. Lean et al. han demostrado envejecimiento placentario acelerado y transporte de nutrientes y función vascular alterados en placentas de pacientes de edad avanzada14.
Cabe mencionar brevemente el aumento significativo de aneuploidías en los embarazos de mujeres con EMA al momento que se embarazan y que se correlaciona con un aumento importante de abortos de primer trimestre15, asociación con variadas malformaciones y morbimortalidad perinatal significativamente más alta especialmente asociada a trisomías 21, 13 y 1816.
Síndrome de Ovario Poliquístico (SOP)El SOP es un síndrome endocrino metabólico heterogéneo que se caracteriza por disfunción ovárica, hiperandrogenismo y en alrededor de un 50% de los casos sobrepeso, obesidad y resistencia a la insulina. Son pacientes que aparte de la disfunción reproductiva tienen alteraciones metabólicas que se asocian a mayor riesgo de enfermedades crónicas como hipertensión arterial, dislipidemias, obesidad, enfermedad cardiovascular y diabetes mellitus.
El aumento de riesgo de complicaciones del embarazo en mujeres con SOP es el resultado de varios factores como la obesidad, resistencia a la insulina, disfunción metabólica, tipo de tratamiento por infertilidad, embarazo múltiple e inflamación y alteraciones placentarias.
La obesidad asociada al SOP aparece como responsable de alteraciones metabólicas e inflamatorias que afectan el proceso reproductivo en etapas claves como desarrollo folicular y endometrial, implantación, placentación y función placentaria y de membranas en el embarazo avanzado, favoreciendo así la aparición de complicaciones del embarazo y del feto en desarrollo.
El embarazo múltiple que se ve con frecuencia en mujeres con SOP, especialmente en las pacientes anovulatorias tratadas por infertilidad, es uno de los factores de riesgo principales para resultados adversos obstétricos y perinatales.
En mujeres con SOP se ha demostrado un riesgo aumentado de aborto temprano, DG, HIE y PE, PP, RNBP y partos cesárea. Los recién nacidos de mujeres con SOP tienen mayor riesgo de mortalidad perinatal, prematuridad y hospitalización en UCIN17.
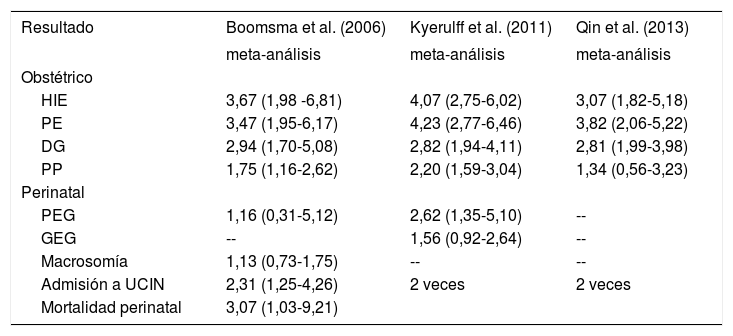
Como se muestra en la Tabla 2, diferentes meta-análisis han mostrado un aumento de 3-4 veces del riesgo de HIE y PE en pacientes SOP y 2-3 veces el riesgo de DG18–20.
Complicaciones obstétricas y perinatales en mujeres con SOP
| Resultado | Boomsma et al. (2006) | Kyerulff et al. (2011) | Qin et al. (2013) |
|---|---|---|---|
| meta-análisis | meta-análisis | meta-análisis | |
| Obstétrico | |||
| HIE | 3,67 (1,98 -6,81) | 4,07 (2,75-6,02) | 3,07 (1,82-5,18) |
| PE | 3,47 (1,95-6,17) | 4,23 (2,77-6,46) | 3,82 (2,06-5,22) |
| DG | 2,94 (1,70-5,08) | 2,82 (1,94-4,11) | 2,81 (1,99-3,98) |
| PP | 1,75 (1,16-2,62) | 2,20 (1,59-3,04) | 1,34 (0,56-3,23) |
| Perinatal | |||
| PEG | 1,16 (0,31-5,12) | 2,62 (1,35-5,10) | -- |
| GEG | -- | 1,56 (0,92-2,64) | -- |
| Macrosomía | 1,13 (0,73-1,75) | -- | -- |
| Admisión a UCIN | 2,31 (1,25-4,26) | 2 veces | 2 veces |
| Mortalidad perinatal | 3,07 (1,03-9,21) |
Los datos son OR (IC del 95%).
HIE: Hipertensión del embarazo; PE: Preeclampsia; DG: Diabetes gestacional; PP: Parto prematuro; PEG: Feto pequeño para la edad gestacional; GEG: grande para la edad gestacional; UCIN: Unidad de Cuidados Intensivos Neonatales.
Adaptado de Palomba et al., 2015 (ref. 21).
Un estudio de cohorte de 3.787 pacientes con SOP y 1.191.336 sin SOP mostró un aumento significativo de la PE (OR 1,45 IC95% (1,24-1,69)) y más del doble de PP en pacientes con SOP (OR 2,21 IC95% (1,69-2,90)) especialmente en aquellas pacientes hiperandrogénicas (OR 2,28 IC95% (1,51-3,45))17. Otro de los riesgos que aumentan significativamente en las pacientes con SOP es la RCF y algunos estudios han mostrado más del doble de riesgo de fetos PEG comparado con pacientes sin SOP (OR 2,62 IC95% (1,35-5,10))19,21.
En el estudio de la fisiopatología de las complicaciones obstétricas y perinatales de las pacientes con SOP se ha descrito que prevalecen las alteraciones metabólicas, pero también son relevantes las alteraciones hormonales e inflamatorias.
Disfunciones hormonales previas al embarazo como resistencia a progesterona, hiperinsulinismo y, especialmente el hiperandrogenismo, parecen alterar mecanismos de placentación, función placentaria en tercer trimestre y, función del cérvix y miometrio aumentando así los resultados obstétricos y perinatales adversos21.
Se ha planteado que en el SOP mecanismos hormonales e inflamatorios en endometrio y miometrio se asocian a mayor riesgo de PP, en cambio las alteraciones hormonales y metabólicas llevarían con más frecuencia a PE y DG1.
Infertilidad de causa desconocida (ICD)La ICD se ve en un 10-20% de las parejas infértiles y se asocia a mayor riesgo obstétrico y perinatal. La infertilidad por sí misma es considerada un factor de riesgo para complicaciones del embarazo y algunos estudios han mostrado que independiente del tratamiento usado, la ICD se asocia a mayor riesgo de HIE y PE, hemorragia anteparto, PP y parto cesárea23–25.
En el meta-análisis de Messerlian et al. de 2013, con una muestra de 1.269.758 nacimientos que incluyó 19.983 casos de mujeres que se demoraron más de 12 meses en embarazarse se vio un aumento significativo de PP (OR 1,39 IC95% (1,20-1,62) y RNBP (OR 1,5 IC95% (1,27-1,78))25. Datos semejantes reportan Pinborg et al. para PP en aquellas mujeres que demoraron más de 12 meses en lograr embarazo (OR 1,35 IC95% (1,22-1,50))25.
Un estudio retrospectivo de más de 40.000 pacientes mostró un aumento global de 50% de DG en pacientes que demoraban más de 12 meses en embarazarse (IC95% 1,34-1,69) y de 44% para pacientes con ICD (IC95% 1,14-1,84)26.
Este mismo estudio muestra aumento de 83% de DG en mujeres con factor tubario (IC95% 1,20-2,77) y de más de 50% en disfunción ovulatoria (IC95% 1,23-1,87).
Por otro lado, se ve que la infertilidad per se y no los tratamientos para embarazarse se asocia con mayor riesgo obstétrico y perinatal. No hubo diferencia en resultados comparando pacientes infértiles que se embarazaban con o sin tratamiento, pero si se vio aumento de 18% de PE (IC95% 1,02-1,37), 32% de hemorragia anteparto (IC95% 1,18-1,47) y 96% de PPE (IC95% 1,53-2,49) en mujeres subfértiles que se embarazaban comparadas con mujeres fértiles27.
Se han descrito factores hormonales, metabólicos e inflamatorios que actúan en placenta y membranas, cérvix y miometrio de mujeres con ICD que actuarían como mediadores en las complicaciones del embarazo, especialmente relativas a crecimiento fetal y parto prematuro1.
Patología ginecológica anatómica y funcionalAlteraciones ginecológicas anatómicas y/o funcionales como endometriosis, adenomiosis y los miomas uterinos, comparten con el SOP y la ICD mecanismos inflamatorios, alteraciones hormonales y anomalías vasculares que pueden afectar negativamente el desarrollo del embarazo. Estas alteraciones a nivel endometrial, del miometrio, cérvix y placenta pueden modificar las condiciones durante la implantación y el embarazo contribuyendo al desarrollo de complicaciones obstétricas como riesgo de PP, RCF, patologías placentarias y cuadros hipertensivos.
Miomas: Patología más frecuente en mujeres en edad reproductiva (30-70%) por lo que ve en hasta 12-15% de los embarazos. Han sido asociados en magnitud variable con infertilidad y están relacionados con complicaciones obstétricas y perinatales, más frecuentemente con hemorragia ante e intraparto, PP especialmente en miomas intramurales (IM) grandes, distocias de presentación, restricción del crecimiento fetal intrauterino (RCIU), placenta previa, DPPNI y hemorragia postparto. Como consecuencia de la tasa más elevada de PP también aumenta la morbilidad perinatal y UCIN.
Los miomas submucosos (SM) se asocian más con alteraciones de la implantación y abortos de primer trimestre lo que puede explicarse por alteraciones inflamatorias y circulatorias en sitio de implantación que modifican la receptividad del endometrio al embrión y alteran proceso de placentación.
No existe evidencia consistente respecto del riesgo obstétrico asociado a miomas subserosos (SS) aunque podrían estar asociados a mayor tasa de cesárea según ubicación que determine distocia de presentación o efecto de tumor previo en el canal del parto.
Para los miomas intramurales (IM) existe controversia respecto de su rol en complicaciones del embarazo. Los resultados de meta-análisis han sido contradictorios para tasas de aborto en miomas IM pero coinciden en disminución de tasas de recién nacidos vivos de un 30% (IC95% 0,6-0,8), lo que también se vio en pacientes <37 años sometidas a TRA (IC95% 0,6-0,9)28. Un estudio prospectivo mostró aumento de 10% de PP (25 a 35%) en pacientes con miomas >5cm29 y un aumento de 20% en la tasa de cesárea en pacientes con miomas ≥3cm (OR 1,2 IC95% (1,1-1,3))30.
También la presencia de miomas IM se ha asociado a MFIU, ocurriendo la mayoría en embarazos <32 semanas comparado con >32 semanas (OR 4,2 IC95% (1,2-14,7))31.
El útero con miomas se caracteriza por un ambiente inflamatorio crónico y disminución de actividad de ocitocinasa por lo que habría una mayor predisposición a PP y rotura prematura de membranas. La alteración de contractilidad uterina, distorsión anatómica de la cavidad y eventual placentación anómala contribuirían a la activación anticipada del parto32.
No hay evidencia consistente de diferencias significativas para otras complicaciones obstétricas y perinatales asociadas a miomas IM. Tampoco la evidencia es clara en diferencias respecto de resultados en pacientes sometidas a miomectomía previa al embarazo, independiente de la vía operatoria utilizada33.
Endometriosis: es una enfermedad inflamatoria que afecta a un 10% de las mujeres en edad reproductiva y hasta un 50% de las pacientes con infertilidad. La incidencia de complicaciones obstétricas en pacientes con endometriosis que se embarazan espontáneamente o con TRA es controvertida. La endometriosis por si misma es considerada un factor de riesgo para complicaciones obstétricas34.
Ha sido asociada a aborto primer trimestre, embarazo ectópico, hemoperitoneo espontaneo durante el embarazo, PP, placenta previa y hemorragia ante y postparto35.
Hay reportes que muestran un aumento de riesgo de PP en pacientes con endometriosis y TRA respecto de pacientes con endometriosis que se embarazaron espontáneamente (OR 1,4 IC95% (1,3-1,5))36.
Un estudio retrospectivo caso control mostró más del doble de PP (IC95% 1,0-4,2) y hospitalización de recién nacidos (IC95% 1,1-5,5) en mujeres con endometriosis y TRA37.
Las pacientes con endometriosis tendrían en su primer embarazo mayor riesgo de PEG, DG, rotura prematura de membranas y PP con hospitalizaciones más prolongadas de la madre y el recién nacido38.
Las complicaciones del embarazo dependen también de la severidad de la endometriosis. La presencia de endometriomas ováricos en pacientes que se embarazan con TRA duplicaría el riesgo de PP y PEG cuando se compara con otras formas de endometriosis39 y, en estadio IV, se duplica el riesgo de PP (IC95% 1,07-3,89) y aumenta más de 10 veces la placenta previa (IC95% 4,4-61,7) comparada con estadios I a III y con pacientes sin endometriosis40.
Se ha planteado que el mayor riesgo de complicaciones obstétricas en pacientes con endometriosis podría resultar de alteración en la invasión trofoblástica y placentación debida a decidualización defectuosa por resistencia del endometrio a la progesterona, un patrón inflamatorio específico y/o la zona de unión uterina engrosada1. Por su parte, el patrón inflamatorio que se ve en la endometriosis puede tener efecto directo en cambios en el cérvix, contractilidad uterina y rotura prematura de membranas (RPM) favoreciendo el PP34.
Adenomiosis: Existen estudios que asocian a la adenomiosis con mayor riesgo de complicaciones del embarazo. Pacientes con adenomiosis con o sin miomas uterinos, tienen un riesgo 2 a 3 veces mayor de aborto temprano respecto de mujeres que sólo tienen miomas o úteros normales41. Un estudio caso-control de pacientes con adenomiosis diagnosticada por ecografía o resonancia magnética (RM) mostró un riesgo 80% mayor de PP (IC95% 1,3-4,3) y el doble de RPM (IC95% 1,4-3,2)42. Mochimaru et al. en un estudio retrospectivo de cohorte muestran en mujeres con adenomiosis un aumento entre 4 y 6 veces del riesgo de PP (IC95% 2,2-11,4), RPM (IC 95% 1,7-17,7), tasa de cesárea (IC95% 2,1-9,7), feto PEG (IC 95% 1,8-10,3), HIE (IC95% 2,2-19,0) y distocia de presentación (IC95% 1,6-10,8)43.
Como mecanismos patogénicos en las complicaciones obstétricas de la adenomiosis se han propuesto, al igual que para la endometriosis, una regulación anómala de las vías de inflamación con aumento de citoquinas pro-inflamatorias34.
Malformaciones uterinas: Por su parte, algunas malformaciones uterinas condicionan mayor riesgo obstétrico y perinatal. Los defectos de canalización, como el útero septado, se asocian a mayor riesgo de aborto de primer y segundo trimestres, el doble de PP (IC95% 1,5-3,1) y más de 6 veces de distocia de presentación (IC95% 4,1-9,6). Estos mismos riesgos y en magnitud semejante se observan en defectos de unificación como el útero bicorne44.
Tratamientos Reproducción Asistida (TRA)Existe evidencia desde hace algunos años que los niños nacidos como consecuencia de TRA tienen mayor riesgo neonatal25 y los embarazos de IVF se asocian a mayor riesgo de complicaciones obstétricas comparados con embarazos espontáneos45,46.
Existen varios estudios y meta-análisis que coinciden en que los embarazos únicos logrados con TRA están asociados a mayor riesgo de complicaciones obstétricas y resultados perinatales adversos comparados con aquéllos producto de concepciones espontáneas47–49.
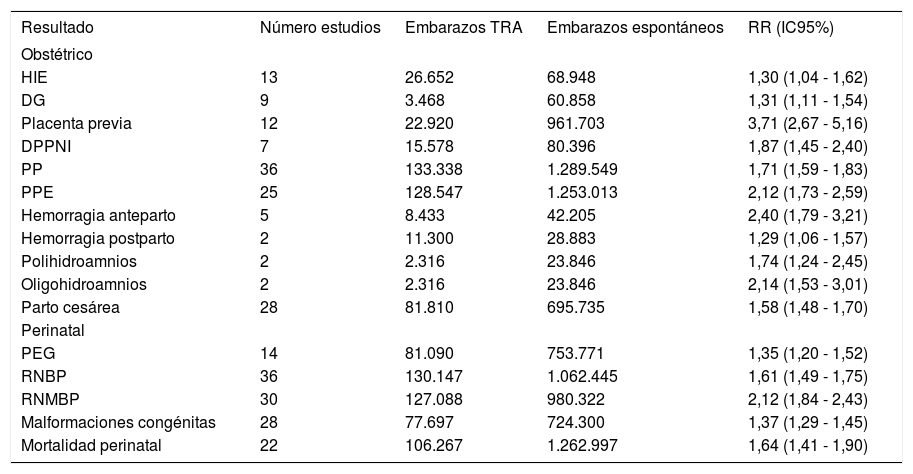
En la Tabla 3 se resumen los resultados principales de un meta-análisis más reciente y con mayor poder estadístico, coincide con los estudios anteriores y muestra que la mayoría de las complicaciones obstétricas y perinatales aumentan entre un 30 y un 100% en los embarazos únicos logrados por TRA comparados con aquéllos producto de concepciones espontaneas50.
Complicaciones obstétricas y perinatales en TRA
| Resultado | Número estudios | Embarazos TRA | Embarazos espontáneos | RR (IC95%) |
|---|---|---|---|---|
| Obstétrico | ||||
| HIE | 13 | 26.652 | 68.948 | 1,30 (1,04 - 1,62) |
| DG | 9 | 3.468 | 60.858 | 1,31 (1,11 - 1,54) |
| Placenta previa | 12 | 22.920 | 961.703 | 3,71 (2,67 - 5,16) |
| DPPNI | 7 | 15.578 | 80.396 | 1,87 (1,45 - 2,40) |
| PP | 36 | 133.338 | 1.289.549 | 1,71 (1,59 - 1,83) |
| PPE | 25 | 128.547 | 1.253.013 | 2,12 (1,73 - 2,59) |
| Hemorragia anteparto | 5 | 8.433 | 42.205 | 2,40 (1,79 - 3,21) |
| Hemorragia postparto | 2 | 11.300 | 28.883 | 1,29 (1,06 - 1,57) |
| Polihidroamnios | 2 | 2.316 | 23.846 | 1,74 (1,24 - 2,45) |
| Oligohidroamnios | 2 | 2.316 | 23.846 | 2,14 (1,53 - 3,01) |
| Parto cesárea | 28 | 81.810 | 695.735 | 1,58 (1,48 - 1,70) |
| Perinatal | ||||
| PEG | 14 | 81.090 | 753.771 | 1,35 (1,20 - 1,52) |
| RNBP | 36 | 130.147 | 1.062.445 | 1,61 (1,49 - 1,75) |
| RNMBP | 30 | 127.088 | 980.322 | 2,12 (1,84 - 2,43) |
| Malformaciones congénitas | 28 | 77.697 | 724.300 | 1,37 (1,29 - 1,45) |
| Mortalidad perinatal | 22 | 106.267 | 1.262.997 | 1,64 (1,41 - 1,90) |
TRA: Técnicas de reproducción asistida; HIE: hipertensión del embarazo; DG: diabetes gestacional; DPPNI: desprendimiento de placenta; PP: parto prematuro; PPE: parto prematuro extremo; PEG: feto pequeño para la edad gestacional; RNBP: RN bajo peso <2500gr; RNMBP: RN muy bajo peso <2000gr. Traducido de Qin et al., 2016 (Ref. 50).
Los factores que influyen en el mayor riesgo perinatal en los embarazos asociados a TRA se derivan de la estimulación ovárica controlada, de los procedimientos de laboratorio y del número de embriones transferidos. Los tipos y dosis de medicamentos usados para la inducción de la ovulación y apoyo del embarazo, tiempos de cultivo y medios usados para gametos y embriones, proceso de criopreservación y descongelación, manipulación de los gametos, alteración del ambiente hormonal al tiempo de la implantación y otros, estarían de algún modo involucrados en los resultados del embarazo51–53. Sin embargo, existen varios estudios que plantean que los procedimientos realizados con TRA no serían los responsables sino los factores subyacentes de infertilidad, ya que también se ven resultados adversos obstétricos y perinatales en mujeres subfértiles que se embarazan sin TRA22,23,54.
La evidencia actual sugiere que los TRA independiente de los factores de infertilidad subyacentes aumentan el riesgo obstétrico y perinatal ya que aún en estudios de hermanos no TRA versus TRA y estudios en madres surrogadas persiste un riesgo aumentado para PP y RNBP para embarazos de TRA.
También se ha visto mejor pronóstico obstétrico y perinatal cuando se realizó transferencia de embriones criopreservados versus transferencia de embriones en ciclos en fresco. Hubo menor riesgo de placenta previa, DPPNI, RNBP y RNMBP, PP extremo, PEG y mortalidad perinatal en transferencia de embriones criopreservados, y mayor riesgo de HIE, hemorragia postparto y recién nacidos grandes para edad gestacional comparado con transferencia de embriones en fresco55,56.
Respecto de defectos congénitos, un meta-análisis que evaluó 45 trabajos mostró un aumento significativo de riesgo en pacientes con TRA versus no TRA, con aumento de 32% global (IC95% 1,24-1,42), de 36% para embarazos únicos (IC95% 1,30-1,43) y de 42% para defectos congénitos mayores (IC95% 1,29-1,56)57.
La ovodonación (OD) es una opción de tratamiento en parejas cuyo factor principal es la disminución de reserva ovárica, pacientes pobre respondedoras, casos de falla repetida de IVF y en aquellas portadoras de enfermedades hereditarias. Se ha visto un gran aumento de casos en la última década llegando a alrededor de 40.000 ciclos anuales en Europa y 20.000 en Estados Unidos58,59.
Los resultados de diferentes estudios son consistentes en mostrar un aumento de 2 a 3 veces el riesgo de PE y entre 1,5 y 2 veces el riesgo de PP y RNBP en las pacientes receptoras60,61.
Embarazo múltipleEl embarazo múltiple es una condición de alto riesgo materno y fetal que aumentó significativamente en las últimas décadas. La mayoría de los embarazos gemelares son espontáneos pero el aumento considerable observado se debe especialmente al mayor acceso de las parejas a tratamientos de infertilidad que incluyen los TRA. Los tratamientos de baja complejidad (no TRA) aumentan las tasas de embarazo múltiple entre 20 y 50% según la causa de infertilidad, siendo las más altas asociadas al SOP. Por su parte, los TRA aumentan alrededor de 10 veces la tasa de multigestación. En Chile y Latinoamérica las tasas de embarazo gemelar en TRA han sido cercanas al 21-23%, observándose una tendencia a la disminución desde 2016 llegando en Chile a 17,4% el año 2017 asociada a un aumento de las transferencias de embrion único7.
La causa más importante de complicaciones obstétricas y perinatales derivada de los tratamientos para la infertilidad es el embarazo múltiple. La alta tasa de PP y RNBP asociado a los embarazos múltiples da cuenta de la mayoría del riego perinatal, pero también está asociado a otras complicaciones cuando se compara con embarazos únicos, como RCF, HIE, PE y DG entre otras.
Existen además complicaciones únicas en los embarazos múltiples como crecimiento discordante de los fetos, síndrome de transfusión feto-fetal, gemelos monoamnióticos y secuencia de perfusión arterial reversa en uno de los gemelos, que a su vez dan cuenta de un mayor riesgo obstétrico y perinatal.
La tasa de mortalidad perinatal en Chile para embarazos obtenidos por TRA entre los años 1990 y 2016 fue de 17,1 por mil para gemelares dobles y 72,1 por mil para triples o de mayor número, siendo de 6,9 por mil la tasa en los embarazos únicos7.
Los embarazos gemelares tienen 10 veces más recién nacidos PEG y 6 veces más PP que los embarazos únicos62,63.
Sibai et al. mostraron un aumento al doble de HIE y 2,6 veces de PE en embarazos gemelares comparados con únicos, así como mayor frecuencia de síndrome de HELLP (haemolysis, elevated liver enzymes and low platelets o hemólisis, aumento de enzimas hepáticas y disminución de las plaquetas, por sus siglas en inglés) en los embarazos gemelares64, datos que coinciden con resultados de varios estudios posteriores. La DG aumenta un 70 a 75% en los embarazos gemelares comparado con embarazos únicos65.
La mayoría de los riesgos observados aumentan significativamente en embarazos múltiples de alto número (triples o más) con tasas de prematuridad cercanas al 95%, HIE de 32%, DG 10%, anemia 25% y hemorragia postparto >20%66.
El promedio de edad gestacional al parto para embarazos triples y cuádruples es de 32 y 29 ½ semanas y el riesgo de mortalidad infantil de 52,5 por mil y 96,3 por mil respectivamente. En estos embarazos de alto número se ve un aumento de 5 veces la MFIU, 7 veces la mortalidad perinatal y tasa de 28 por mil de parálisis cerebral para los triples67.
Cuando se compara la evolución de los embarazos gemelares espontáneos con aquéllos producto de tratamientos de infertilidad (inducción ovulación, inseminación intrauterina o TRA), los resultados obstétricos y perinatales son poco consistentes ya que variables como edad, paridad, factores de infertilidad y patologías crónicas de las pacientes actúan como sesgo. Cuando se ajustan los resultados por estos factores confundentes hay estudios en que no se observa diferencias en el riesgo de complicaciones del embarazo y del recién nacido entre los diferentes tipos de tratamiento y tampoco comparado con los embarazos gemelares espontáneos68.
Por todo lo antes mencionado, es que la prevención de la multigestación en los tratamientos de infertilidad, debe ser una prioridad central a considerar en los esquemas de inducción de la ovulación usados, en las nuevas técnicas en laboratorio y diagnóstico preimplantacional en TRA y en el número de embriones a ser transferidos.
ComentariosLa infertilidad y sus patologías subyacentes son factores de riesgo para complicaciones del embarazo y del recién nacido. La identificación de causalidad de cada factor es compleja ya que las pacientes generalmente presentan combinaciones de factores y son sometidas a diferentes modalidades de tratamiento que por su parte pueden aumentar los riesgos. A pesar de existir una relación entre los tratamientos de reproducción asistida y un mayor riesgo obstétrico y perinatal, la evidencia actual no permite establecer clara causalidad debido a la heterogeneidad de los estudios, los sesgos involucrados y la multicausalidad de las complicaciones asociadas. Se necesita mayor evidencia y de mejor calidad destinada a individualizar los riesgos de las pacientes y su relación con los tratamientos usados.
La edad materna, los tratamientos de alta complejidad y el embarazo múltiple dan cuenta de una buena parte del aumento de los riesgos maternos y perinatales de los últimos años. Es por esto que, los estudios y el desarrollo de tecnologías a futuro debieran estar enfocadas en identificar y manejar los riesgos individuales de cada paciente y los tratamientos deben pretender optimizar las condiciones previas tanto del ambiente intrauterino como de las características de los embriones utilizados de tal modo de buscar siempre un embarazo único, con un embrión normal y en una paciente en óptimas condiciones de salud.
Así, un adecuado y oportuno consejo reproductivo y, el manejo anticipado de factores de riesgo tratables, son de vital importancia para disminuir las complicaciones obstétricas y perinatales de las pacientes tratadas por infertilidad.
Declaración de conflicto de interésEl autor declara que no tener ningún conflicto de interés.