La Cirugía Refractiva se ha constituido en una desafiante subespecialidad de la Oftalmología. Importantes avances tecnológicos permiten la opción de tratamiento quirúrgico de los vicios de refracción. Las cirugías de miopía, hipermetropía y astigmatismo, han logrado excelentes resultados en eficacia, estabilidad y seguridad; permitiendo reducir o eliminar la dependencia de anteojos y lentes de contacto. Las técnicas más utilizadas son las queratorefractivas con láser excimer, especialmente la queratomileusis in situ con láser (LASIK) y la queratectomía fotorefractiva (PRK). Ambas dominan el campo del tratamiento quirúrgico de las ametropías bajas y moderadas. En las altas ametropías, y en pacientes con córneas de grosor insuficiente para el tratamiento con láser, está aumentando el uso de las técnicas intraoculares. Una de estas técnicas es el implante de lentes intraoculares fáquicos, en que se conserva el cristalino natural del paciente, y se utiliza hasta alrededor de los 50 años. Los vicios de refracción también se pueden corregir con lentes intraoculares seudofáquicos, que reemplazan el cristalino del paciente, y se usan de rutina en cirugía de catarata. En el área refractiva, están restringidos más bien a pacientes mayores de 50 años. Estos lentes tienen la posibilidad adicional, en casos seleccionados, de corregir la presbicia, que es, aún, el último desafío a ser resuelto en Cirugía Refractiva.
Refractive Surgery has become a challenging subspeciality in Ophthalmology. Important technological advances, currently allow the option of surgical treatment of refractive errors. Surgical treatments of myopia, hyperopia, and astigmatism, have achieved excellent results in efficacy, stability and safety; allowing to reduce or eliminate the dependence on glasses and contact lenses. The most used techniques are keratorefractive with excimer laser, specially laser in situ keratomileusis (LASIK) and photorefractive keratectomy (PRK). Both dominate the field of surgical treatment for low and moderate refractive errors. In high refractive errors or patients with insufficient corneal thickness for laser treatment, the intraocular techniques are increasingly used. One of these techniques is the phakic intraocular lens implantation, in which the natural lens is preserved. That implant is used in patients up to 50 years of age. Refractive errors can be also corrected with pseudophakic intraocular lenses, that replace the natural lens, and are used always in cataract sugery. Their refractive indication is usually restricted to patients 50 years or older. These lenses have the additional possibility, in selected cases, to correct the presbyopic condition, that to date is still the last challenge to be resolved in Refractive Surgery.
La Oftalmología, como especialidad médica, ha tardado más de cien años en reconocer a la Cirugía Refractiva como una auténtica subespecialidad (1). De los estudios de Bates y Lans (2), desde 1880 a los albores del siglo XXI, la Cirugía Refractiva se ha desarrollado gradualmente hasta lograr su aprobación; una aceptación corroborada por la aparición de un congreso anual de Cirugía Refractiva, como subespecialidad, dentro del seno de la Academia Americana de Oftalmología, así como un libro propio dentro del curso de Ciencia Básica y Clínica de esta Academia.
El desarrollo del láser excimer en 1983 (3) expandió el mundo de la Cirugía Refractiva, con procedimientos como la queratectomía fotore- fractiva (PRK) y, después, la queratomileusis in situ con laser (LASIK). Actualmente, la Cirugía Refractiva motiva múltiples congresos y publicaciones alrededor del mundo, con un desarrollo vertiginoso y notables avances tecnológicos.
Vicio de RefracciónEl Vicio de Refracción se puede explicar como una condición ocular en la que los rayos luminosos que ingresan al ojo no son enfocados en la lámina de fotoreceptores de la fóvea, en la retina, resultando en visión borrosa. De los vicios de refracción, miopía, hipermetropía y astigmatismo son los tres tipos más comunes, con alternativas de tratamiento quirúrgico bastante consolidadas en la actualidad.
Prevalencia del vicio de refracciónLos errores refractivos explican más de la mitad de las bajas visiones y cegueras en el mundo. En Australia los vicios de refracción dan cuenta del 62% de las personas con baja visión y 4% de la personas con ceguera (4). La prevalencia de miopía en Estados Unidos de Norteamérica, Europa Occidental y Australia es de 25.4%, 26.6%, y 16.4%, respectivamente (5). Globalmente, se estima que alrededor de 1,6 billones de personas en el mundo tienen miopía. La Organización Mundial de la Salud ha estimado que el vicio de refracción no corregido es responsable de baja visión en 153 millones de personas, y de ceguera en 5 millones de personas en el mundo (6).
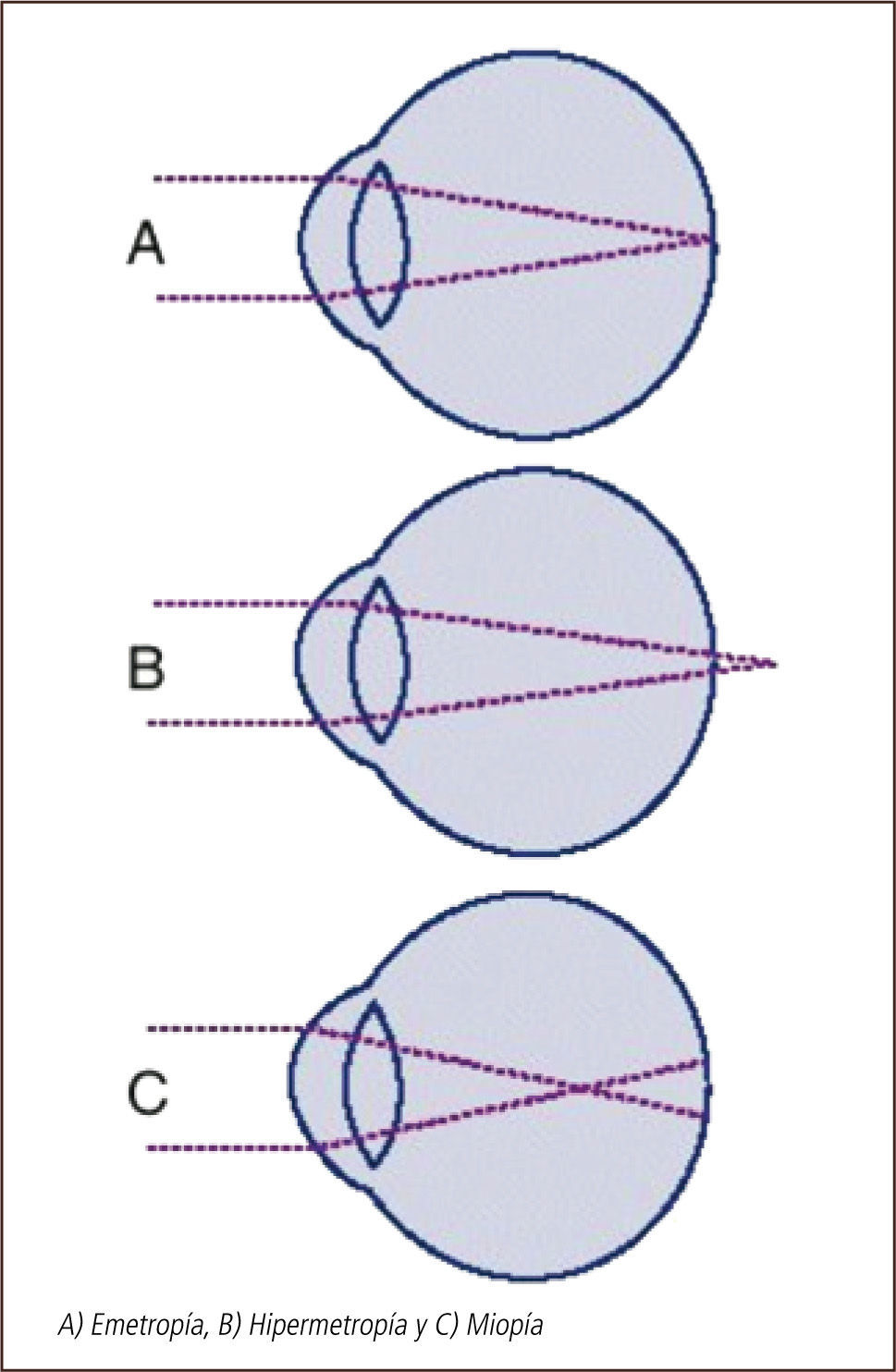
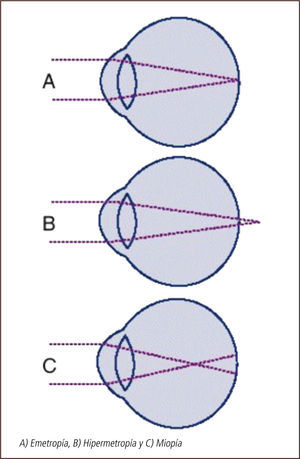
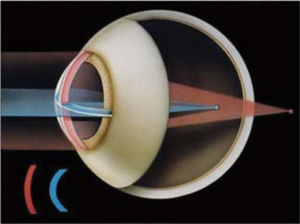
Emetropía, ametropías y presbiciaLa potencia refractiva del ojo está determinada en su mayor parte por tres variables: la potencia de la córnea, la potencia del cristalino y la longitud axial del ojo. En la emetropía estos tres elementos se combinan de tal manera que no existe un defecto refractivo. En el ojo emétrope, un haz de luz paralelo al eje óptico se enfoca en un punto en la retina (Figura 1).
www.ocularis.es; Dr. R. Pascual.
En el ojo miope, un haz de rayos paralelos se enfoca en un punto por delante de la retina (Figura 1). Este defecto se puede corregir con lentes divergentes, minus o negativos. Estos pacientes son cortos de vista, es decir ven mal de lejos, y, en general, tienen buena visión cercana.
En el ojo hipermétrope, por el contrario, el haz de rayos paralelos se enfoca en un punto posterior a la retina (Figura 1). Este defecto puede corregirse con lentes convergentes, plus o positivos. El mecanismo de acomodación del cristalino, puede incrementar la potencia positiva lo suficiente para lograr que los rayos de luz se enfoquen en la retina. Ello permite compensar en muchos casos el defecto hipermetrópico, especialmente en pacientes jóvenes, con mayor capacidad de acomodación. Es así como estos pacientes, conservan buena visión de lejos por largos períodos, pero a costa de un esfuerzo acomodativo compensador, que va disminuyendo con la edad. La visión cercana es la que se ve más comprometida.
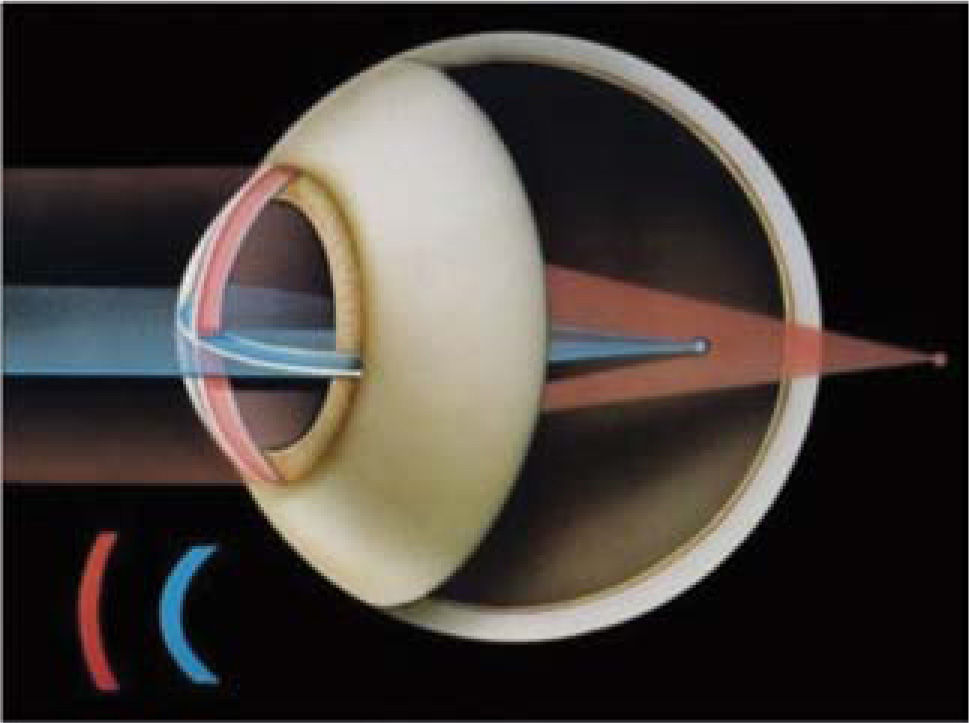
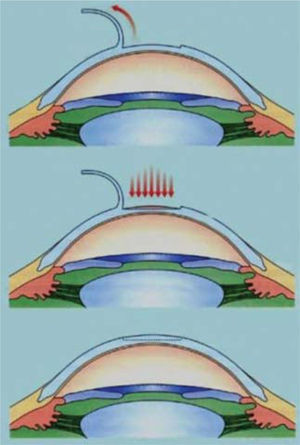
El astigmatismo se debe, generalmente, a que la córnea sea tórica, es decir, con sus meridianos de distinta curvatura (Figura 2); o menos frecuentemente, al efecto astigmático del cristalino. El astigmatismo es regular cuando puede corregirse con lentes cilíndricos o esferocilíndricos, de modo que los haces de luz de objetos distantes puedan enfocarse en la retina. El resto de los astigmatismos se consideran irregulares.
Astigmatismo.
www.ocularis.es; Astigmatismo y formación de imágeens en la retina. Dr. O. García.
La cirugía refractiva se ha visualizado como un tratamiento alternativo y de larga duración para el vicio de refracción, que elimina o reduce la dependencia de anteojos y lentes de contacto. Sin embargo, este procedimiento no es adecuado para todos los pacientes. Los criterios de selección pueden tener algunas variaciones, pero los pacientes elegibles deberían ser, en general, mayores de 18 años y tener una refracción estable por al menos 12 meses, una agudeza visual mejor corregida de 6/18 o mejor en ambos ojos, queratometrías estables después de estar libres de lentes de contacto blandos por al menos 1 semana, o de lentes de contacto semirígidos por al menos 2 semanas, y tener ausencia de patología ocular tal como; queratocono, queratitis herpética, u otras enfermedades oculares cornéales, de retina o nervio óptico; que puedan interferir con el resultado de la cirugía refractiva.
Los pacientes solicitan cirugía refractiva por diversas razones (7–9). La motivación más frecuente es el deseo de reducir el uso de anteojos o lentes de contacto. Algunos pacientes necesitan mejorar su agudeza visual espontánea (no corregida) por motivos profesionales. Otros prefieren practicar deportes o disfrutar de sus momentos de recreación sin anteojos o lentes de contacto. También hay pacientes que padecen afecciones oculares o sistémicas, que hacen que el uso de lentes de contacto sea difícil o peligroso. Algunos son francamente intolerantes a lentes de contacto. En pacientes con anisometropías, es decir, diferencias en la magnitud de ametropía de un ojo con respecto al otro, el uso de anteojos puede ser también mal tolerado. Otro motivo para desear cirugía refractiva, en pacientes intolerantes a lentes de contacto, puede ser el aspecto estético.
Técnicas y resultadosLas técnicas de cirugía refractiva para la corrección de la miopía, la hipermetropía y el astigmatismo consiguen la emetropía modificando el sistema óptico del ojo. Las categorías principales son:
- –
Técnicas queratorefractivas.
- –
Técnicas intraoculares.
La córnea representa el 60% de la potencia refractiva del ojo, y pequeños cambios en su curvatura pueden producir cambios refractivos importantes. Todas las técnicas queratorefractivas modifican el grosor corneal para producir cambios en la curvatura anterior, excepto las técnicas incisionales, que producen aplanamiento corneal mediante el debilitamiento tectónico, sin producir cambios en el grosor.
La ley de espesores de Barraquer describe que al sustraer tejido del centro de la córnea o agregar tejido en la periferia, se produce un aplanamiento de la curvatura corneal, que es capaz de corregir un defecto miópico. Por el contrario, al sustraer tejido de la periferia de la córnea o agregar tejido en el centro se produce un aumento de la curvatura corneal que es capaz de corregir un defecto hipermetrópico (10).
Cirugía IncisionalLa cirugía refractiva viene de los primeros intentos por usar incisiones corneales para corregir astigmatismos por Schiotz en 1885 (11). En 1950, Sato publicó sus intentos de corrección de miopías y astigmatismo usando incisiones corneales posteriores (12). En 1970, la técnica de Sato fue corregida por Fyodorov y Durnev (13), quienes se enfocaron en incisiones corneales anteriores. Su método quirúrgico, llamado queratotomía radial (RK), hacía 4 a 8 incisiones radiales profundas (90% del grosor corneal) en la periferia de la cornea usando un cuchillete mecánico de diamante que aplanaba la córnea central para reducir su curvatura (14, 15). Sin embargo, la cirugía refractiva incisional con RK se ha asociado con inestabilidad biomecánica de la córnea, que conduce a cambios indeseados en la refracción, tales como; fluctuación diurna del error refractivo, subcorrección, sobrecorrección, y desviación hipermetrópica (16). La evaluación prospectiva de la queratotomía radial (PERK) (17) encontró que después de 10 años, 11 % de los pacientes estaban subcorregidos en más de 1 dioptría (D), un 30% estaban sobrecorregidos en más de 1 D, y 43% experimentaban desviación progresiva hacia la hipermetropía.
Hoy día la cirugía incisional ha sido desplazada por la cirugía con láser excimer, salvo algunas técnicas que se utilizan para tratar astigmatismos asociados en cirugía de cataratas, como son las incisiones relajantes limbares.
Cirugía laminarLa cirugía refractiva laminar fue desarrollada por José Ignacio Barraquer en 1949 (10). El proceso laminar inicial fue la Queratomileusis Miópica (MKM) (del griego keratos – córnea, smileusis – esculpir) que involucraba la creación de un disco laminar usando un cuchillete, que posteriormente fue reemplazado por un microquerátomo inventado por el mismo Barraquer (18). El disco era congelado y remodelado en un criolato antes de ser reposicionado en el ojo del paciente (19). El procedimiento no fue muy difundido por las dificultades técnicas que limitaban su seguridad, predictibilidad y exactitud; pero sirvió de base al desarrollo futuro de las técnicas laminares corneales.
Láser ExcimerEl láser excimer se usaba en litografía de semiconductores, particularmente para ablacionar la superficie de chips de silicona. Hasta que en 1983, Trokel et al (3) demostraron la precisión y repetibilidad del láser excimer de 193nm en ablacionar tejido estromal corneal de ojos bovinos con mínimo daño térmico al tejido corneal circundante. Esto condujo a la cirugía ablativa y al desarrollo explosivo de la cirugía refractiva. El principio detrás del láser excimer es un proceso llamado fotodescomposición ablativa. Pasando una mezcla de gas argón-fluor a través de electricidad de alto voltaje en una cavidad de láser, se produce un estado de dímero excitado (de ahí el término “excimer”) con un alto nivel de energía. La emisión resultante de pulsos de láser ultravioleta logra romper enlaces moleculares entre las proteínas, glucosaminoglicanos y ácidos nucleicos de la córnea, produciendo la vaporización de fragmentos de tejido del lecho estromal (20). Este concepto de fotodescomposición ablativa forma las bases de los procedimientos de queratectomía fotorrefractiva (PRK) y la queratomileusis in situ con láser (LASIK).
Queratectomía Fotorefractiva (PRK)El primer procedimiento de PRK fue efectuado en un ojo humano por McDonald en 1989 (21). La PRK es una técnica de ablación de la superficie corneal que involucra la remoción mecánica del epitelio corneal con un cuchillete quirúrgico seguido por una ablación con láser excimer a través de la membrana de Bowman y del estroma corneal. Posteriormente, se han usado métodos alternativos para la remoción epitelial, incluyendo ablación con el mismo láser excimer, uso de alcohol diluido, y abrasión con cepillo.
La PRK demostró mayor predictibilidad y estabilidad que las técnicas previas de queratotomía radial (RK), en miopías (22). Sin embargo, la PRK va perdiendo predictibilidad en miopías mayores, en las que aumenta la posibilidad de cicatrización corneal (haze) y regresión del efecto; por lo que la mayoría de los estudios la recomiendan para miopías bajas y moderadas, en general, menor de 6 dioptrías (23) y en hipermetropías hasta alrededor de 4 dioptrías.
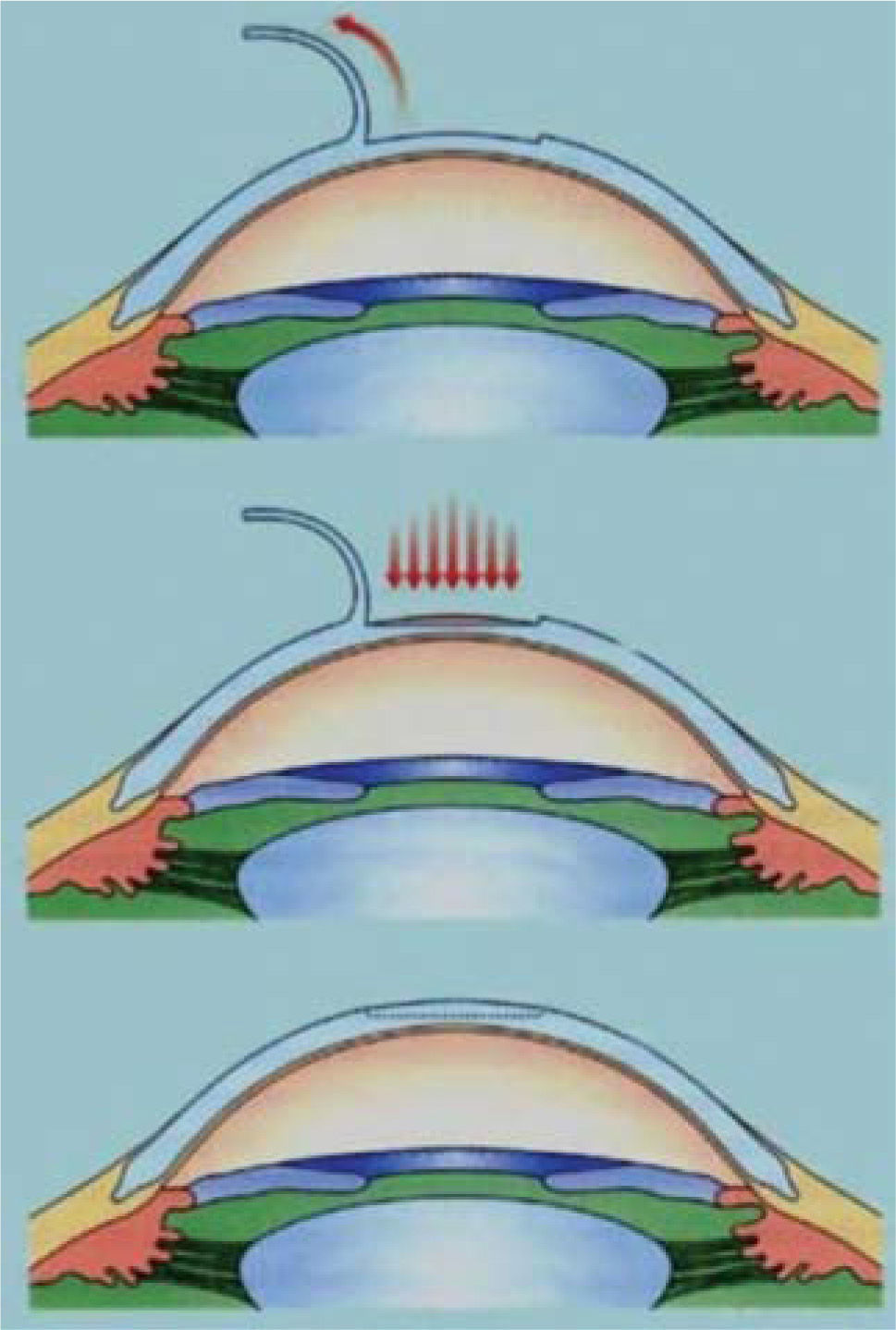
Queratomileusis in situ con láser (LASIK)En los inicios de los años 90, Pallikaris (24) y Buratto (25), integraron exitosamente el láser excimer con las técnicas laminares in situ, dando lugar al LASIK. En contraste con el PRK, el LASIK es una técnica laminar que usa un microquerátomo, o más recientemente, un láser de femtosegundo para crear un flap corneal constituido por epitelio, membrana de Bowman y estroma corneal anterior. El flap se levanta dejando una bisagra nasal o superior, a lo que sigue una ablación con láser excimer del lecho estromal. Después de la ablación, se reposiciona el flap para permitir que se adhiera al lecho estromal por acción de la bomba endotelial (Figura 3).
LASIK para la correción de miopía.
www.ocularis.es; Dr. R. Pascual.
PRK y LASIK han sido las principales técnicas en cirugía refractiva, con más de 8 millones de procedimientos realizados en el mundo sólo hasta el año 2006 (26). Aunque ambos procedimientos usan láser excimer para ablacionar la córnea, ellos difieren en las láminas de tejido corneal remanente después de la ablación. Al final del PRK, el epitelio y la lámina de Bowman son removidas, mientras que en el LASIK, esas láminas son preservadas con la reposición del flap corneal. La conservación del epitelio en el LASIK, explicaría el poco dolor postoperatorio y la rápida recuperación visual, comparado con el PRK (27). También hay evidencias a nivel celular, que la apoptosis de queratocitos seguida por una proliferación de queratocitos y transformación miofibroblástica, ocurre más intensamente en PRK para alta miopía, que en PRK para baja miopía y que en LASIK para alta miopía (28). Algunos estudios demuestran que el uso de mitomicina-C profiláctica durante la cirugía podría disminuir el riesgo de cicatrización corneal en PRK para miopías más altas, como una alternativa al LASIK (29, 30).
El LASIK también ha mostrado resultados más predecibles y exactos en el tratamiento de la alta miopía con respecto al PRK (31, 32). Otras ventajas del LASIK incluyen; una estabilización más rápida de la agudeza visual postoperatoria, mínima formación de opacidades (haze) corneales, menor tiempo de medicamentos postoperatorios, y más facilidad de retratamientos levantando el flap preexistente.
Sin embargo, la creación del flap del LASIK interrumpe las láminas del estroma anterior, lo que puede debilitar las propiedades biomecánicas de la córnea después de la cirugía en ciertos casos (33, 34). Al mismo tiempo, la transección de nervios corneales durante la formación del flap puede conducir a epiteliopatía neurotrófica, que puede resultar en síndrome de ojo seco, especialmente en los primeros meses postoperatorios de pacientes susceptibles. De tal manera que, los perfiles y expectativas de los pacientes son importantes en determinar la elección del procedimiento quirúrgico.
Variantes del PRK1LASEKLa queratectomía subepitelial asistida por laser (LASEK) preserva el epitelio corneal central, creando un flap epitelial, usando un trépano lleno con solución de alcohol diluido que suelta el anclaje epitelial. El flap se levanta con una espátula, dejando una bisagra, similar al LASIK, pero este flap es sólo de epitelio, sin Bowman, ni estroma, por lo que no debilita las láminas estromales (35). Posterior a la ablación con láser excimer se reposiciona el flap epitelial a su posición original, protegiéndolo con un lente de contacto blando. Algunos autores sugieren que el conservar el flap epitelial podría reducir el dolor postoperatorio y la formación de opacidades (haze) corneales en comparación con el PRK (36), pero la consistencia de esas ventajas es controvertida.
2Epi-LASIKEs similar al LASEK, pero se diferencia en que, con el objeto de evitar el uso de alcohol diluido para desprender el epitelio, se utiliza un microqueratomo especial, el epiquerátomo, que fue diseñado para producir cortes subepiteliales precisos sin dañar la lámina estromal (37). Acá también el flap es sólo epitelial. Por tanto PRK, LASEK y epi-LASIK son todas técnicas de superficie, a diferencia del LASIK, que es una técnica estromal laminar.
Láser de femtosegundoEl uso del láser de femtosegundo para crear flaps laminares en procedimientos de LASIK fue reportado por Ratkay-Traub en el 2003 (38). Siendo un láser de estado sólido, el láser de femtosegundo usa pulsos infrarrojos para causar fotodisrupción (distinto a la fotoablación usada por el láser excimer) dentro del estroma corneal con mínima inflamación y daño tisular colateral. La disección del flap se logra por la descarga de pulsos de láser separados por espacios muy pequeños enfocados a una profundidad preestablecida dentro del estroma. Este produce una burbuja de cavitación que contiene agua y dióxido de carbono, que resulta en la separación física del estroma en esa lámina. Comparado con el microquerátomo, el láser de femtosegundo parece producir un grosor de flap más uniforme y más predecible (que podría reducir el eventual riesgo de ectasia postoperatoria), menos astigmatismo inducido por la construcción del flap, y menos probabilidad de daño epitelial que pudiera afectar la rehabilitación visual postoperatoria (38, 39).
Evaluacion de Resultados 1EficaciaSe determina por la agudeza visual sin corrección (AVSC) y el equivalente esférico de la refracción manifiesta (EERM). La AVSC se define como al agudeza visual sin ninguna ayuda visual (anteojos o lentes de contacto), típicamente evaluado usando logMAR (logaritmo del mínimo ángulo de resolución) o cartilla de Sellen (tablero de optotipos para medir agudeza visual). La AVSC se informa en términos de la proporción de pacientes que logran AVSC igual o mejor a 6/6 (equivalente a 20/20 en notación de Snellen), que es la visión media estadística de la población, junto con la proporción que logra una AVSC postoperatoria igual o mejor a 6/12 (equivalente a 20/40 en la notación de Snellen), que es el umbral funcional para la conducción de automóviles. El EERM mide los componentes combinados esférico y cilíndrico del error refractivo (esfera más la mitad del cilindro) después de la cirugía y se informa generalmente como el porcentaje de ojos que caen dentro de +/− 0.5 dioptrías o +/− 1 dioptría de la corrección refractiva intentada. Estas medidas de EERM se usan también para indicar la predictibilidad de la cirugía refractiva.
2EstabilidadSe mide determinando el cambio medio del EERM en un intervalo de tiempo definido. Acá interesa el período en lograr la estabilidad refractiva y el comportamiento futuro en cuanto a la posibilidad de pérdida del efecto refractivo o regresión. Las técnicas de superficie tienden a tener períodos más largos de estabilización y de regresión que las técnicas laminares, debido a la mayor duración de la curación epitelial y estromal. La profundidad de la ablación también es vital en predecir la cantidad de regresión; las ablaciones más profundas en tratamientos de altas ametropías son más susceptibles de tener regresión.
3SeguridadSe mide de dos maneras: el porcentaje de pacientes con pérdida postoperatoria de 2 ó más líneas de agudeza visual mejor corregida (AVMC) en la cartilla de Snellen, y la incidencia de complicaciones quirúrgicas. La AVMC se define como la medida de agudeza visual obtenida con ayuda visual (lentes) usando log MAR o cartilla de Snellen. La pérdida de AVMC postquirúrgica puede estar relacionada con las complicaciones quirúrgicas de la cirugía refractiva. En el pasado, ablaciones descentradas e islas centrales eran más comunes que hoy día, gracias a la evolución y mayor desarrollo de los equipos de láser excimer. La formación de opacidades (haze) transitorias de 1 a 2 años de duración en el estroma subepitelial anterior han sido más comunes después de PRK, que después de LASIK, donde la formación de opacidades corneales es rara y más bien localizada en los márgenes del flap (30). En estudios de PRK, la incidencia de opacidad (haze) clínicamente significativa se ha reportado entre 0.5% a 3% (40). Los pacientes de PRK a menudo acusan dolor y disconfort ocular en la fase postoperatoria precoz. La posibilidad de infección en PRK y LASIK es rara, con porcentajes que oscilan entre 0.02% a 1.5% (41). El síndrome de ojo seco y síntomas visuales nocturnos, como halos y deslumbramiento se pueden asociar con LASIK, pero también con PRK. La creación del flap laminar en el LASIK puede causar complicaciones únicas del LASIK, como flaps irregulares, con agujeros, colgajos libres (cap libres), desplazamientos y pliegues postoperatorios. La ectasia corneal (como resultado de un debilitamiento inducido del estroma o de una debilidad previa que paso inadvertida en el estudio preoperatorio) se puede ver en PRK, pero típicamente se reporta más como una complicación post LASIK.
Miopía baja a moderada (-0.5 a -5.99 dioptrías)La mayoría de los estudios muestran que en PRK se logra una AVMC de 6/12 o mejor en 85% de los ojos y en LASIK alrededor de 90%. El EERM postoperatorio dentro de +/− 1 dioptría ha sido más del 70% de los ojos en estudios de PRK y más del 90% de los ojos en estudios de LASIK. Pareciera que en ese rango la eficacia del LASIK fuera algo mayor que el PRK, pero los estudios de LASIK tienden a ser más recientes, con probables influencias por mejorías en los algoritmos y nomogramas de tratamiento más que un efecto del LASIK per se. Estudios comparativos (42) no han logrado establecer diferencias significativas para ambos procedimientos en ese rango de dioptrías. No hubo estudios de LASIK que reportaran bajas de AVMC de 2 líneas o más, y en PRK esta baja osciló entre 0% a 12.5%, por lo que en correcciones de miopía baja a moderada parece haber una eficacia y estabilidad comparables en tratamientos con PRK y LASIK, pero el LASIK podría tener mayor seguridad.
Miopía alta (-6 dioptrías o más)En estos rangos los tratamientos son más inexactos y menos predecibles aumentando la incidencia de subcorrecciones y sobrecorrecciones. La eficacia y estabilidad ha sido mejor para LASIK que para PRK en miopías de -6 o más dioptrías. En estudios de PRK más del 50% de los tratamientos han logrado visiones sin corrección de 6/12 o más y en estudios de LASIK sobre el 70%. Helmy (43) obtuvo visiones sin corrección en PRK mejor o igual a 6/12 en 67.5% y en LASIK en 75%. Por otra parte encontró un equivalente esférico postoperatorio dentro de +/− 1 dioptría en un 64% en PRK y en un 85.7% en LASIK. Además se observó mayor regresión en PRK que en LASIK en esos rangos de miopía. Es importante hacer notar, que en el tema de la seguridad, los estudios han mostrado una baja de visión mejor corregida mayor o igual a 2 líneas hasta en un 20% de los ojos, tanto en estudios de PRK, como de LASIK, en rangos altos de miopía. Esto abre la necesidad de tratamientos alternativos al láser excimer corneal para altas ametropías, como son los lentes intraoculares. Hoy se tiende a limitar el uso del LASIK hasta alrededor de -8 dioptrías de miopía.
Astigmatismo miópicoEn estudios de la FDA con LASIK para astigmatismo miópico se ha logrado visiones postoperatorias de 6/12 o más sin corrección entre 84% a 99% de los ojos y equivalentes esféricos postoperatorios entre +/− 1 dioptría de la refracción intentada entre 82% a 92% de los ojos. En general se tratan astigmatismos miópicos con láser excimer corneal hasta alrededor de -6 dioptrías.
HipermetropíaEn contraste con la ablación miópica, donde se aplana la córnea central, en el tratamiento hipermetrópico se incurva la córnea central tallando un área circular en la media periferia. En estudios clínicos de la FDA de LASIK para hipermetropías de hasta +6 dioptrías un 86% a 87% de los ojos estuvieron dentro de +/− 1 dioptría de la corrección intentada y con hasta 3.5% de pérdida de 2 o más líneas de visión mejor corregida. Estudios con zonas ópticas más grandes han mostrado buenos resultados para hipermetropías de hasta +4 a +5 dioptrías, pero la predictibilidad y la estabilidad se reducen notablemente al tratar defectos mayores a éstos.
Astigmatismo hipermetrópicoEn correcciones con LASIK se logra 87% a 91% de ojos dentro de +/− 1 dioptría de la corrección intentada. Al igual que en el tratamiento hipermetrópico la eficacia disminuye con rangos mayores a los también descritos para la hipermetropía.
Astigmatismo mixtoSe define como un error refractivo con un cilindro mayor que la esfera y de signo opuesto. El LASIK ha sido aprobado por la FDA (en USA) para el astigmatismo mixto de hasta 6 dioptrías. En el tratamiento el laser excimer aplana el meridiano más curvo e incurva el meridiano más plano para transformar una córnea tórica, en una córnea esférica. Este se conoce como tratamiento bitórico, bicilíndrico o de cilindro cruzado. Un 88% a 96% de los ojos tratados logra estar dentro de +/− 1 dioptría de la corrección intentada.
RetratamientosAunque el LASIK reduce el error refractivo y mejora la agudeza visual sin corrección en casi todos los casos, algunos pacientes tienen un error refractivo residual, o presentan regresión del efecto, por lo que pueden requerir un retratamiento (44). El grado de defecto refractivo que justifique un retratamiento dependerá del estilo de vida y expectativas del paciente. Las tasas de retratamiento varían, siendo mayores con correcciones iniciales más altas, presencia de astigmatismo y en grupos de pacientes con expectativas más altas. Normalmente se recomienda esperar un período de estabilidad de unos 6 meses post LASIK, tiempo que post PRK puede ser mayor. Post LASIK el retratamiento generalmente se realiza levantando el flap laminar preexistente y aplicando la ablación adicional con láser excimer en el lecho estromal. El hacer un nuevo corte puede tener riesgos de intersectarse con el corte previo, con riesgos de pérdida de tejido corneal, que podría generar astigmatismo irregular. Los flaps previos se pueden levantar hasta muchos años del procedimiento original, pero mientras más años, parece haber mayor riesgo de crecimiento epitelial de la entrecara, que puede complicar la evolución. En ciertos casos se puede considerar el uso de un retratamiento en superficie tipo PRK o LASEK, sobre un flap de LASIK. En estos casos, debido a mayor posibilidad de cicatrización y haze, se puede considerar el uso de Mitomicina-C en el intraoperatorio. Un estudio reportó una tasa global de retratamientos de hasta 10.5%. Sin embargo, hoy día con la evolución de los perfiles de ablación de los láseres, y la exclusión de ametropías mayores, que pueden ser tratadas con lentes intraoculares, las tasas de retratamiento post LASIK, debieran ser probablemente menores al 5%.
Técnicas intraocularesLa mayor parte de las técnicas de cirugía refractiva realizadas en la actualidad son queratorefractivas. Sin embargo, existen contraindicaciones absolutas o relativas que pueden desaconsejar la práctica de la cirugía corneal en determinados pacientes. Por ejemplo, los pacientes con córneas muy delgadas o ametropías elevadas, no son candidatos ideales para realizar ablaciones con láser, porque consumirían demasiado tejido corneal, deteriorando la calidad visual y aumentando el riesgo de ectasia. En estos pacientes, las técnicas intraoculares proporcionan un método alternativo para reducir la dependencia de anteojos y lentes de contacto. Estas consisten en el implante de lentes intraoculares (LIOs) para la corrección de las diversas ametropias; y en casos seleccionados, la presbicia. Otra ventaja de los procedimientos con LlOs es mantener una córnea normal para un eventual ajuste posterior mediante un procedimiento con láser excimer, combinación denominada Bioptic (45) o cirugía refractiva ajustable (46). Los LIOs se pueden clasificar en 2 grandes categorías considerando si se remueve o no el cristalino al momento de realizar la intervención quirúrgica.
1)Lentes intraoculares fáquicos (LIO-f)Estos lentes se comenzaron a desarrollar en la década del 50 con Strampelli y Barraquer, sin embargo, no fue hasta las últimas 2 décadas cuando lograron gran aceptación debido al desarrollo que se logró en relación a los materiales de confección y al diseño de los lentes.
Estos lentes se implantan en el ojo manteniendo el cristalino natural o estado fáquico de la persona, por lo que una de sus principales ventajas es mantener la acomodación, permitiendo que personas que aún no presentan presbicia logren obtener buena agudeza visual tanto de lejos como de cerca. Otras ventajas incluyen evitar las complicaciones de la cirugía sobre el cristalino como el riesgo de desprendimiento de retina, la eventual reversibilidad mediante el explante del lente, una muy buena calidad de visión (sensibilidad de contraste) y la posibilidad de corregir altas ametropías, ya que actualmente se dispone de lentes para la corrección de miopía hasta −23.5 D, hipermetropía hasta +17 D y astigmatismos hasta 7.5 D, con buenos resultados (47), (48) y (49).
Las principales indicaciones de los LIO-f en la actualidad son precisamente pacientes con ametropías que están fuera del rango del láser (miopía sobre −8 e hipermetropía sobre +5) y un grosor, curvatura o patología corneal (ej.: Keratocono frustro) que imposibilita la cirugía con láser. Dentro de los requisitos para poder implantar un LIO-f se encuentran parámetros oculares estrictos, objetivados con exámenes pre operatorios, como la profundidad de la cámara anterior mayor a 2.8mm. (Distancia del cristalino al endotelio corneal), un conteo de células endoteliales de la córnea > 2000 x mm2, una distancia blanco a blanco (limbo a limbo) precisa para el cálculo del lente, una refracción y evaluación de retina muy cuidadosas. Además, en general se plantea esta cirugía en mayores de 21 años, una vez lograda la estabilidad refractiva y en menores de 50 años, ya que sobre este límite de edad se prefiere la cirugía sobre el cristalino por la frecuente aparición de catarata en ese grupo etario.
Entre las desventajas de estos dispositivos intraoculares están las complicaciones comunes a cualquier cirugía intraocular, como las infecciones y sus complicaciones inherentes que incluyen entre otras, la formación de catarata, la descompensación corneal y el glaucoma agudo, que difieren en frecuencia según el modelo de lente utilizado (50). Si bien estas últimas son muy infrecuentes, exigen un seguimiento periódico de por vida para su detección precoz, mediante los exámenes pertinentes, situación que debe ser comprendida y aceptada por el paciente previo a la cirugía.
Los modelos actualmente utilizados han demostrado ser eficaces, predecibles y estables, con una baja tasa de complicaciones, aunque algunos de ellos requieren mayor tiempo de seguimiento para evaluar eventuales complicaciones a largo plazo. Los diversos modelos pueden ser agrupados en 3 grandes categorías en base al sitio anatómico del ojo donde se implantan: En el ángulo iridocorneal, fijados en el iris o en la cámara posterior.
- a)
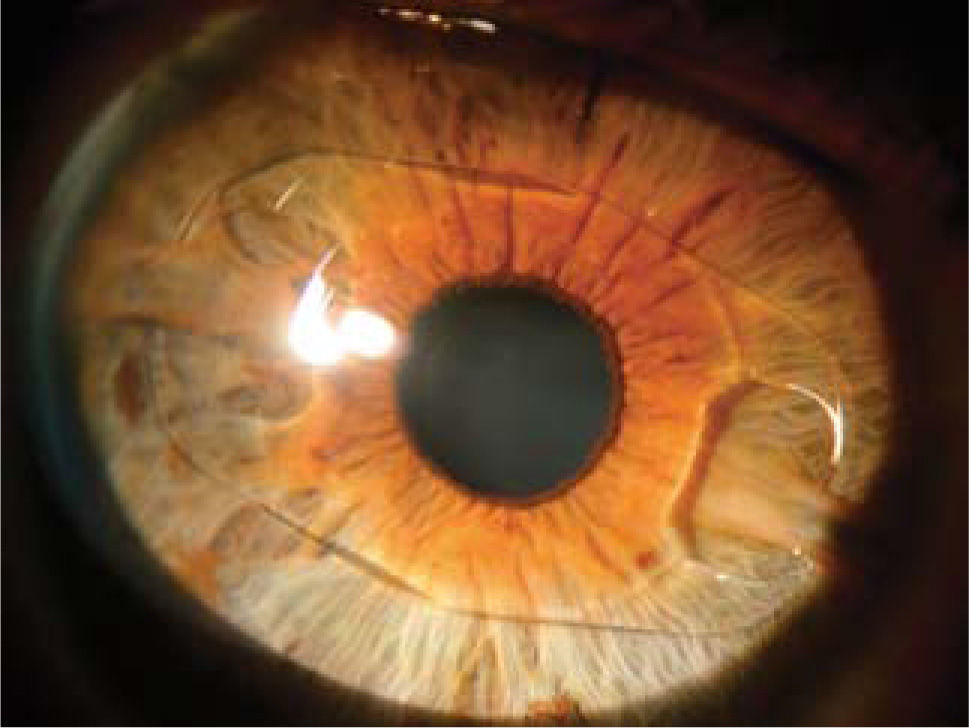
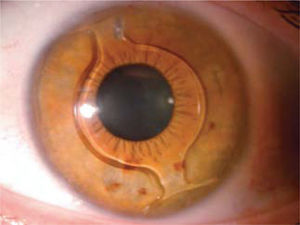
LIO-f de apoyo angular (cámara anterior): el lente más usado dentro de este grupo es el Acrysof Cachet (Alcon), un lente plegable que se implanta a través de una incisión de 3.0mm. Queda apoyado en el ángulo que se forma entre la córnea y el iris, es el de más reciente introducción y por ahora no está disponible para hipermetropía ni astigmatismo (Figura 4).
- b)
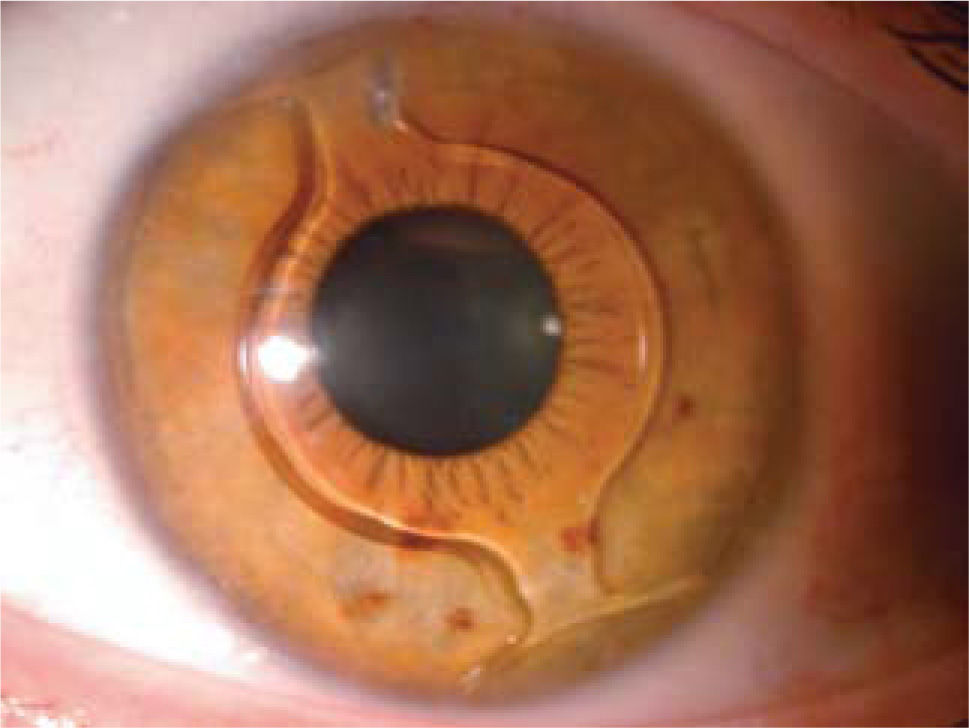
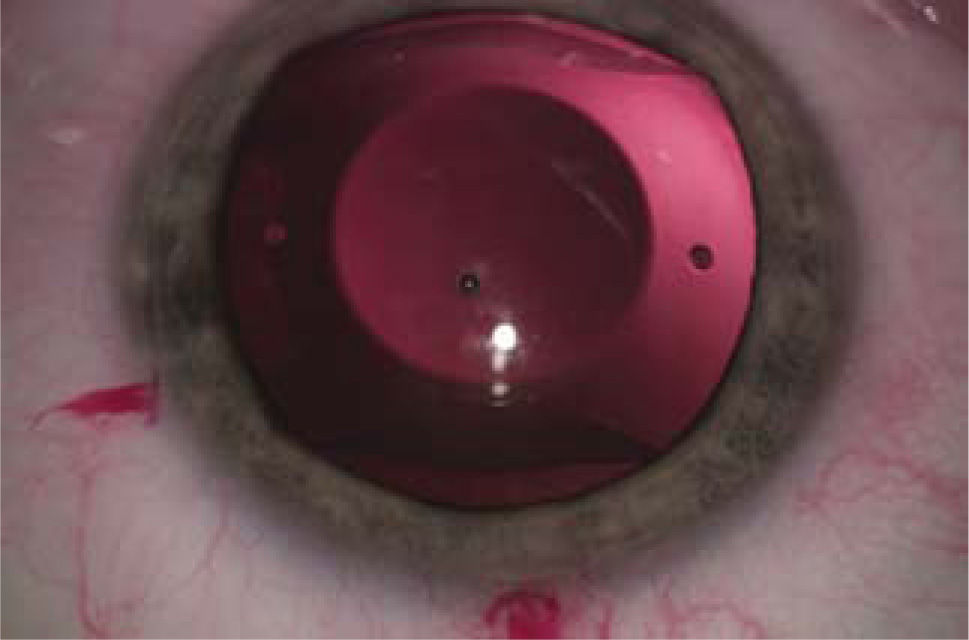
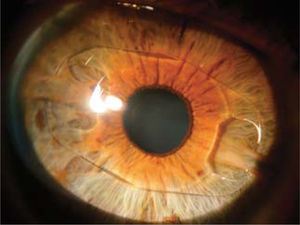
LIO-f de fijación iridiana (cámara anterior): Los lentes Artisan (Ophthec) y Verisyse (AMO) no son plegables y se implantan a través de incisiones de 5 a 6mm. según el modelo utilizado. Los modelos Artiflex y Veriflex son plegables y se pueden implantar por incisiones de 3.2mm. Artisan y Artiflex también se encuentran en plataformas tóricas permitiendo la corrección simultánea de astigmatismo. Este grupo de lentes se apoyan en el iris y son fijados por medio del enclavamiento de las asas o hápticas del lente en el estroma del iris (Figura 5).
- c)
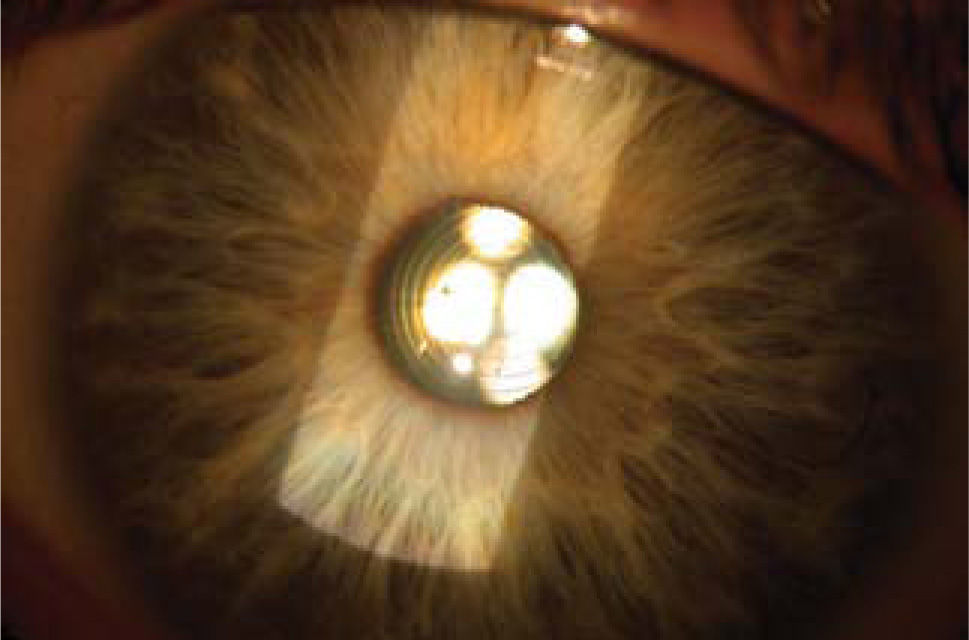
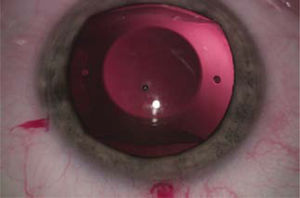
LIO-f de cámara posterior: El lente ICL (STAAR) y su opción para astigmatismo, ICL tórico, son ambos plegables y se pueden insertar a través de incisiones de alrededor de 3.0mm. Estos se implantan en el surco ciliar que es el espacio posterior al iris y anterior al cristalino (Figura 6).
El recambio del cristalino con propósitos refractivos con el implante de un lente intraocular seudofáquico mediante cirugía faco-refractiva ofrece algunas ventajas sobre la cirugía refractiva corneal y los lentes fáquicos; como es el caso de altas ametropías en pacientes mayores de 50 años (con presbicia), particularmente hipermétropes (51), quienes no tienen buena visión de lejos ni de cerca, y en los cuales la predictibilidad del láser, así como los riesgos de patología retinal son menores que en la miopía.
El RRC consiste en la extracción del cristalino mediante la técnica de facoemulsificación con ultrasonido, de la misma manera que se realiza la cirugía de catarata, a través de incisiones corneales pequeñas, de 2.2 a 2.75mm. y el implante de un LIO en el saco capsular, donde se encuentra el cristalino en condiciones fisiológicas. Esto se ha realizado con diversos tipos de LIO, mostrando ser seguro, predecible, estable y efectivo, lo que ha sido posible gracias al gran desarrollo tecnológico de los equipos e instrumental para la facoemulsificación, así como de las fórmulas para calcular el poder adecuado del LIO a implantar en cada paciente.
En cuanto a las desventajas están las complicaciones, dentro de las que encontramos las comunes a toda cirugía intraocular ya mencionadas y las inherentes a la cirugía sobre el cristalino, que van desde problemas frecuentes como la opacidad capsular posterior (52), hasta problemas infrecuentes pero graves como el riesgo de desprendimiento de retina, particularmente relevante en altos miopes (53), jóvenes, sin desprendimiento previo del vítreo, en los que se mantiene como una técnica controvertida. Además se debe tener presente que al retirar el cristalino normal del paciente, éste perderá la acomodación, por lo que esta técnica generalmente se reserva para pacientes que ya tienen presbicia.
Los diversos modelos de LIO seudofáquicos disponibles en la actualidad se pueden agrupar en las siguientes categorías:
- a)
Lentes monofocales: Se calcula su poder para permitir obtener muy buena agudeza visual para lejos, pero obligan a la utilización de un lente para actividades de cerca (de lectura) o mediana distancia (computador). Han mostrado buenos resultados en alta miopía (52) y alta hipermetropía (54).
- b)
Lentes tóricos: En el último tiempo contamos con este subgrupo de lentes monofocales, que permiten la corrección de la ametropía esférica y además del astigmatismo (55), lo que es un gran aporte, ya que entre un 15 y un 29% de los pacientes tiene un astigmatismo significativo, mayor de 1.5 dioptrías (56).
- c)
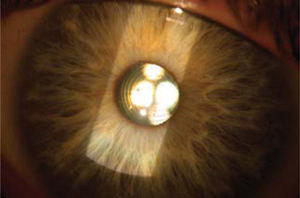
Lentes multifocales: Estos son una de las principales razones del desarrollo que ha presentado el RRC como una alternativa dentro de la cirugía refractiva (57), ya que permiten corregir simultáneamente la ametropía y la presbicia, una notable ventaja sobre las técnicas con láser. Existen diversos modelos que se diferencian en el mecanismo para obtener buena visión para lejos y cerca (Figura 7), logrando independencia de lentes para ambas distancias en un 80 a 90 % de los casos (58). Sin embargo, requieren una selección muy cuidadosa del paciente, ya que a veces no logran una visión para lejos de la misma calidad que los monofocales. Están contraindicados en pacientes que presentan otras patologías oftalmológicas, como alteraciones retinales y se prefieren en personas que no necesitan una visión demasiado exigente, especialmente en la noche (conductores nocturnos), ya que a veces pueden tener mayor visión de halos con las luces que los LIO monofocales. Además, para el óptimo funcionamiento del lente, es requisito que el astigmatismo corneal residual sea menor de 1.0 D. Es preferible el implante bilateral y se debe anticipar un periodo de adaptación neurosensorial de varios meses.
Este último año, se dispone también de LIO multifocales tóricos, que, además de las características ya mencionadas, permiten la corrección de astigmatismo.
ConclusionesHoy día, si bien el manejo de los vicios de refracción sigue siendo principalmente a través del uso de anteojos y lentes de contacto; la alternativa quirúrgica de su tratamiento ha logrado en forma progresiva importantes avances en la eficacia, estabilidad y seguridad de sus resultados. El LASIK es la técnica predominante en cirugía refractiva y permite tratar con buenos resultados ametropías bajas y moderadas. Los tratamientos de superficie, como el PRK, también permiten tratar ese rango de ametropías, especialmente en caso de córneas delgadas, u otra condición que justifique evitar la construcción de un flap corneal. El rango de tratamiento es algo más limitado que el LASIK, por el riesgo de haze y regresión, que son mayores a medida que aumenta la cantidad de dioptrías a tratar, lo que puede ser aminorado por el uso de mitomicina-C intraoperatoria.
En el grupo de altas ametropías (ej miopías mayores de −6 o −8 D) y en algunas ametropías consideradas extremas (Ej miopías mayores de −12 D), las técnicas que utilizan lentes intraoculares han demostrando superioridad y varios modelos de lentes se han consolidando en base a seguimientos de largo plazo.
La presbicia es la última frontera que está siendo abordada en casos seleccionados, especialmente en tratamientos asociados a otra ametropía preexistente, pero aún no tiene un tratamiento consolidado.
El abordaje correcto del paciente en cirugía refractiva, comprende el estudio cuidadoso y detallado de sus características oculares, generales y psicológicas; y la selección apropiada por parte del médico de la técnica adecuada.
Los autores declaran no tener conflictos de interés, en relación a este artículo.