La artrosis (OA) de rodilla es una condición progresiva, incapacitante en distintos grados en sus etapas, terminando en el colapso y destrucción articular que requiere de cirugía protésica en las etapas más avanzadas. La cirugía biológica pre-protésica, concepto que hoy en día se implementa en el manejo de las etapas precoces de la OA, se basa en el diagnóstico precoz de esta condición y de los factores de riesgo que aseguran el progreso a estados más avanzados. Su objetivo es prolongar la vida útil de la articulación nativa y retardar o eliminar la necesidad de una prótesis de rodilla. Esto ha motivado innumerables estudios preclínicos y clínicos en base al uso de nuevos elementos de ingeniería de tejidos, uso de implantes de condrocitos autólogos y manejo de células madre. Los resultados en el corto y mediano plazo son auspiciosos, pero se requieren mejores niveles de evidencia científica de estos estudios y seguimientos más prolongados. En el presente artículo se analiza el concepto de la artrosis temprana, la detección de las lesiones de cartílago y los factores de riesgo de los pacientes que los llevan a una artrosis y los protocolos actuales de tratamiento biológico de Clínica Las Condes.
Knee osteoarthritis (OA) is a devastating, progresive and imparing condition of the joint, during its evolution leading to prosthetic surgery at its end stage. Preprosthetic biological surgery, a concept nowadays devoted to treat early stages of OA is based upon the well-timed diagnosis of this condition and the risk factors involved.Suited to preserve the native joint, delay the prosthetic surgery, or avoid it, has raised strong development of preclinical and clinical trials using novel elements in tissue engineering, techniques of autologous condrocite implantation andstem cellsmanagement. Outcomes in short and médium term are encouraging, but better cientific evidence level trials and longer follow up are needed at this time. This paper describe the concept of early osteoarthritis, the detection ofcartilage damage and the patient's risk factors to lead them to osteoarthritis and our present protocol for biologycal management of their condition.
La artrosis (Osteoartritis, OA) es la condición que con mayor frecuencia afecta las articulaciones y la rodilla es, de las articulaciones mayores, la más frecuentemente comprometida por esta enfermedad. El envejecimiento es el factor más importante en la patogénesis de la OA. En pacientes jóvenes esta condición está relacionada con condiciones biomecánicas desfavorables y/o secuelas de traumatismo, que predisponen al cartílago articular a una degeneración prematura. En ambos grupos, el daño del cartílago y el hueso subcondral, una vez establecidos, evoluciona al deterioro de la articulación, (con dolor e incapacidad variable pero progresiva), no sólo del cartílago y hueso sub-condral sino también de ligamentos y músculos que controlan la función articular, para llegar en estadios finales a graves deformidades con rigidez y subsecuente invalidez, que requiere de cirugía protésica para su solución.
Los cambios socioeconómicos y culturales y el progreso científico en salud, han prolongado por una parte, las expectativas de tiempo y calidad de vida y por otra se ha incrementado la cantidad de población que realiza actividad física desde más temprana edad y hasta edades más avanzadas, en busca de calidad de vida y salud física y psicológica. Estos pacientes, cuando presentan síntomas de OA, son reticentes a tratamientos paliativos o a recibir una prótesis de rodilla ya que el éxito de las prótesis totales de rodilla radica en revertir la condición de invalidez provocada por el cuadro clínico de OA avanzada, a una condición que permite recuperar funcionalidad para gran parte de las actividades de la vida diaria. En algunos casos, incluso una práctica deportiva con restricciones, aun con los diseños más avanzados y materiales de mayor resistencia a la fricción. Las prótesis totales y parciales enfrentan el desgaste inevitable en el tiempo y la pérdida irreparable de la propiocepción y estabilidad de la articulación por el daño de ligamentos por la OAy la técnica de implante de las prótesis, enfrentando la posibilidad de revisiones con menor tasa de éxito. Por esta razón existe franca resistencia de los pacientes y de los cirujanos ortopédicos a implementar esta solución en pacientes jóvenes y activos. Esta doble tarea, de aliviar los síntomas y al mismo tiempo llenar las expectativas de los pacientes bajo 50 años implica altas exigencias, motivando a la comunidad científica mundial a investigar la detección precoz de la OA y a implementar procedimientos biológicos que retarden el daño articular y prolonguen la vida útil de la articulación nativa.
Cirugía biológica (C.B.): el conceptoLa cirugía biológica implica solucionar los problemas de reposición del cartílago dañado y déficit de meniscos y de las condiciones biomecánicas desfavorables asociadas de la rodilla, con el propósito de conservar la articulación nativa funcional para las actividades diarias y alguna práctica deportiva. En el caso de la rodilla, ambos son los objetivos de la CB. El éxito en la implementación de la reparación de la superficie de cartílago dañada, requiere una rodilla estable con alineamiento normal, funcionalidad de los meniscos y una articulación pátelo-femoral balanceada con mecánica normal, en un paciente con peso adecuado (2). Si estas condiciones no existen, deben realizarse los procedimientos necesarios para recuperarlas, ya sea reconstrucción o reparación de ligamentos, osteotomías femorales o tibiales de alineamiento, estabilización o alineamiento de la articulación patelo femoral y sustitución meniscal, así como también manejo del IMC.
Selección de pacientesPacientes con OA temprana
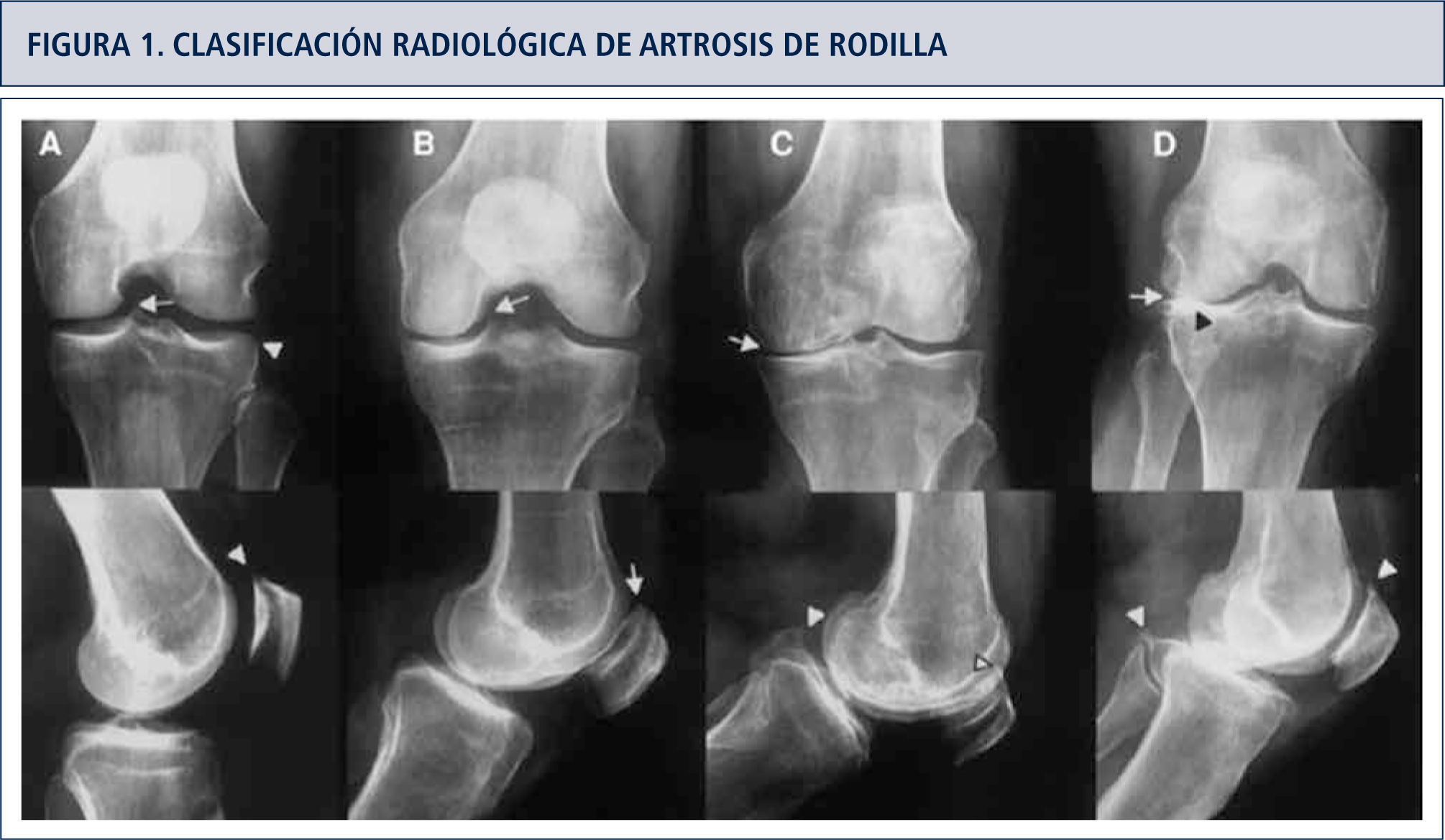
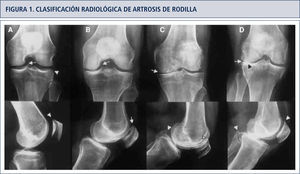
A diferencia de los pacientes con cuadro clínico de OA avanzada -con dolor, rigidez, inflamación e incapacidad constantes, típicamente sobre 50 años y con cambios radiológicos II a IV de Kellgren y Lawrence (KL) (tabla 1, figura 1)- los pacientes que presentan OA temprana con cambios radiológicos tipo KL I (sólo osteofitos, sin reducción de espacio articular) con riesgo de progresar a una OA avanzada, tienen manifestaciones clínicas de menor intensidad, con episodios de incapacidad esporádicos, relacionados con la actividad física y/o sobrecarga por períodos prolongados, lo que les impide llevar una vida activa.
Clasificación de kellgren-lawrence de cambios radiológicos
| grado 0 | Sin cambios |
| grado 1 | Dudosa disminución espacio articular Aparición de osteofitos |
| grado 2 | Osteofitos y posible disminución de espacio |
| grado 3 | Múltiples osteofitos y clara disminución de espacio |
| grado 4 | Gran cantidad osteofitos, marcada disminución de espacio articular, esclerosis y daño subcondral |
Los pacientes menores de 50 años, que son el foco de este artículo, presentan daño focal de cartílago en articulaciones con frecuencia asociadas a mal-alineamiento, inestabilidad, alteraciones de la articulación pátelo-femoral o antecedentes de menisectomías parciales o completas. Las rx. sólo muestran cambios KL tipo I. El cuadro clínico habitual es de episodios de dolor, inflamación y síntomas mecánicos, desencadenado por actividad física. El estudio con resonancia magnética y técnicas más avanzadas (35) de T2 maping detectan los cambios iniciales de la estructura del cartílago y el edema y esclerosis del hueso subcondral así como también las lesiones meniscales; cambios que son los que revelan el riesgo de progresar a una OA establecida.
El criterio diagnóstico de OA temprana fue definido por Engelbrtsen y colaboradores (1), quienes propusieron un estudio clínico apoyado por radiografías (tabla 2), resonancia magnética (tabla 3) y observación ar-troscópica de la rodilla (tabla 4).
Criterio diagnóstico de artrosis temprana (engelbrtsen, lars m.d.)
| dolor Rodilla | Al menos 2 episodios de dolor por más de 10 días en 1 año |
| evaluación Radiológica Al Menos 1 | Kellgren-Lawrence 1-2 (sólo osteofitos) |
| Artroscopia | DañoICRS1 a 4 en 2 compartimentos |
| Resonancia Magnética Al Menos 2 | Morfología cartílago WORMS 3 a 6 Cartílago BLOKS 2 y 3 Meniscos BLOKS 3 a 4 Médula ósea 2 a 3 |
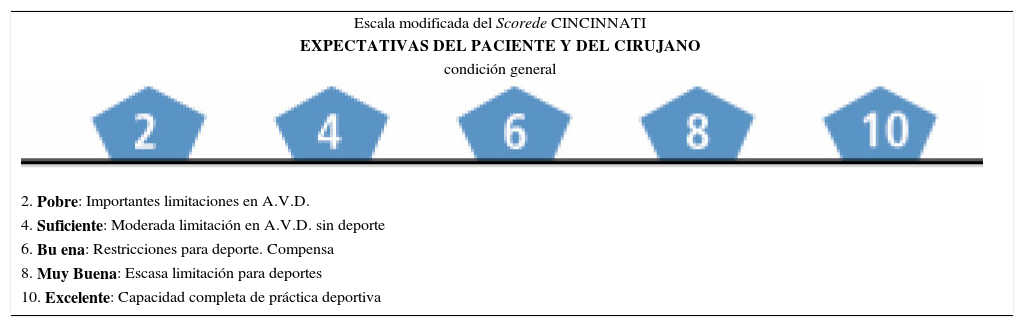
Es importante determinar en conjunto con el paciente, el grado de incapacidad actual y convenir las posibilidades de mejoría con el tratamiento, para evitar falsas expectativas en cuanto a la condición final y su duración en el tiempo. Para cumplir adecuadamente este objetivo, han sido validados varios scores de clasificación (tabla 5). Este concepto de artrosis temprana ha sido recogido por gran parte de los especialistas y numerosas publicaciones han aparecido, a pesar de las limitaciones de los estudios publicados (43).
Score de cincinnati para que el paciente se autoevalúe
| Escala modificada del Scorede CINCINNATI |
| EXPECTATIVAS DEL PACIENTE Y DEL CIRUJANO |
| condición general |
| 2. Pobre: Importantes limitaciones en A.V.D. |
| 4. Suficiente: Moderada limitación en A.V.D. sin deporte |
| 6. Bu ena: Restricciones para deporte. Compensa |
| 8. Muy Buena: Escasa limitación para deportes |
| 10. Excelente: Capacidad completa de práctica deportiva |
Estos son pacientes en general, bajo 45 años, con lesiones traumáticas en rodilla sin las condiciones mecánicas desfavorables antes mencionadas, o asociadas a éstas, lo que aumenta el riesgo de progreso a una OA más avanzada.
No todas las lesiones focales de cartílago son sintomáticas por lo tanto, un estudio adecuado es imprescindible para indicar la cirugía, que también debe considerar el manejo de estas condiciones mecánicas desfavorables.
Prácticamente todas las revisiones sistemáticas de la literatura en el tema de resultados de técnicas de reparación del cartílago, apuntan a la necesidad de estandarizar el adecuado diagnóstico de pacientes con OA temprana, factor fundamental en la estrategia de estudios clínicos que sean útiles para avanzar en el conocimiento de los distintos factores del paciente; del momento de aplicación de la cirugía; y del tipo de cirugía aplicable a cada paciente, que conduzca al éxito en prolongar la vida útil de la articulación nativa en pacientes activos menores de 45 a 50 años (17).
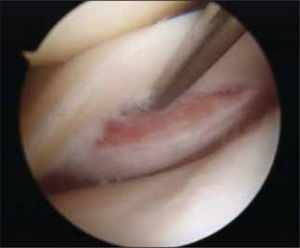
Pacientes con pérdida de tejido meniscalLa gran mayoría de las cirugías artroscópicas de rodilla en todo el mundo, se realizan para tratar lesiones meniscales (36) (figuras 2 y 3). A pesar del progreso en técnicas de reparación, este procedimiento tiene una alta tasa de falla (20 a 30%) (36). Las secuelas por la pérdida de una parte o toda esta estructura han sido estudiadas (38) y son factor de riesgo que aumentan 10 a 20 veces esta condición en daño del cartílago articular. El peor escenario se presenta en pacientes muy jóvenes y particularmente más rápido en el caso del menisco externo.
Algoritmo de tratamientoNo todos los pacientes con OA temprana o lesiones de cartílago en la rodilla requieren cirugía, a excepción de lesiones focales grandes en pacientes muy jóvenes. El manejo conservador inicial con AINES, baja de peso y modificación de actividades y fisioterapia se sugiere por tres a seis meses.También se incluye en el concepto de manejo conservador, el aseo artroscópico articular para eliminar cuerpos libres o fragmentos meniscales o de cartílago inestable; especialmente en pacientes de baja demanda física o cercanos a la edad de una prótesis, como manera de ganar tiempo. Si el cuadro clínico no responde al tratamiento, el estudio de las lesiones focales y daño precoz del cartílago y las condiciones biomecánicas desfavorables, es básico para una estrategia de cirugía. Es necesaria la discusión con el paciente, considerando que el estado actual de los resultados de las técnicas de reparación son percibidas aún con incertidumbre por parte de un importante número de especialistas (4).
Hay que tener en cuenta que las lesiones de cartílago no sanan y progresan y que lesiones precoces y de menor tamaño tienen mejor pronóstico, por lo que lesiones asintomáticas en pacientes jóvenes en las cuales se decide tratamiento conservador deben ser observadas.
En cuanto a la selección de la técnica de reparación del cartílago a utilizar, está fuertemente ligada al tamaño y ubicación de la o las lesiones; al impacto del cuadro clínico en la calidad de vida; y a la edad del paciente, especialmente en pacientes con OA temprana, más que en pacientes con lesiones focales (3).
La respuesta difiere en el compartimento fémoro-patelar de la respuesta en el tibio-femoral, como también lesiones de más de 2 a 4cm2 en las distintas técnicas de reparación.
Todas las técnicas requieren asociación con los procedimientos necesarios para solución de las condiciones mecánicas desfavorables antes mencionadas, sean éstas reconstrucción o reparación de lesiones ligamentosas, mal-alineamiento fémoro-tibial, maltraking patelar y ausencia de meniscos (9).
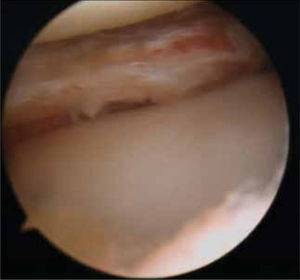
Técnicas de reparación del cartílago actualmente en usoEstimulación de médula ósea (MO)Popularizada por Steadman (3) consiste en perforaciones del hueso sub-condral de 2 a 3mm de profundidad y 5mm de separación entre ellas, previo aseo del cartílago inestable o de mala calidad de la periferia de la lesión y resección de la capa de cartílago calcificada. Fundamental consiste en no dañar la placa subcondral para estabilizar el coágulo de sangre proveniente de los vasos sanguíneos de la MO (figuras 4 y 5) portador de células pluripotenciales. El manejo postoperatorio es con carga restringida por seis a ocho semanas, movilidad pasiva a tolerancia desde el mismo día y suspensión de práctica deportiva por seis meses. Las ventajas son su fácil aplicación, disponibilidad permanente, bajo costo, procedimiento único en lo referido a reparación del cartílago y que deja espacio para otros procedimientos posteriores a excepción del implante autólogo de condrocitos, que se asocia a un aumento de tres veces el porcentaje de falla cuando es realizado después de microfracturas. A pesar de los buenos resultados publicados (5,6) el fibrocartílago resultante (figura 6) contiene mayor cantidad de colágeno I y por lo tanto, características biomecánicas inferiores con menos resistencia al roce y menor calidad que el tejido nativo, como también largo plazo en reversión de síntomas. Vaisman A. y colaboradores (16) han estudiado también la posibilidad de potenciar la calidad del tejido de reparación de esta técnica con esteroides, Plasma Rico en Plaquetas (PRP). En un estudio en rodillas de conejo neozelandés no encontraron mejor calidad del fibrocartílago, luego de inyección de Betametasona o PRP en conjunto con esta técnica. Tampoco el uso de membranas tridimensionales en conjunto con esta técnica han mostrado mejorar la calidad del tejido de reparación (31). Otros estudios con PRP o membranas acelulares reportan mejor calidad histológica del neotejido obtenido al adicionarlas a este procedimiento.
Es típicamente indicado en pacientes de baja demanda con lesiones tibio-femorales, en zona de carga, menores de 2cm2, sin daño de placa sub-condral e indemnidad del cartílago en la periferia de la lesión.
implante de condrocitos autólogos (ica)Presentada en 1994 por Brittberg y colaboradores (7) como alternativa al parche de periostio sin aporte celular en lesiones condrales, consta de dos procedimientos: el primero tomar una o dos muestras de 5x8 mm de cartílago para cultivar y amplificar en laboratorio el número de células para luego, en un segundo procedimiento abierto, colocarlas en líquido bajo el parche de periostio (P-ICA) suturado en la lesión. Esta técnica ha evolucionado a 2a generación asociado a parches de Colágeno (C-ICA) o membranas (M-ICA) y a 3a generación sembrados en membranas luego de la toma de muestra, colocados en esta última por vía artroscópica sin sutura o abiertos suturado, dependiendo del tamaño de la lesión y la membrana usada.
En una revisión sistemática Deepak Goyal, M.B.B.S., M.S.(Orthop) (8) comparó las tres técnicas, con scores de Tegner, IKDC y KOOS. Hay débil recomendación a favor de C-ICA y M-ICA sobre P-ICA, con fuerte recomendación de M-ICA a favor de carga más temprana y menos procedimientos debido a hipertrofia de la membrana que el parche periostal; y sin recomendación a favor de sembrados en membrana o implantación artroscópica por falta de evidencia publicada. Ninguno de estos estudios especifica el tamaño de las lesiones ni compara el retorno deportivo, a pesar de tratarse de pacientes jóvenes de alta demanda deportiva o diferencias entre pacientes menores de 40 años y mayores.
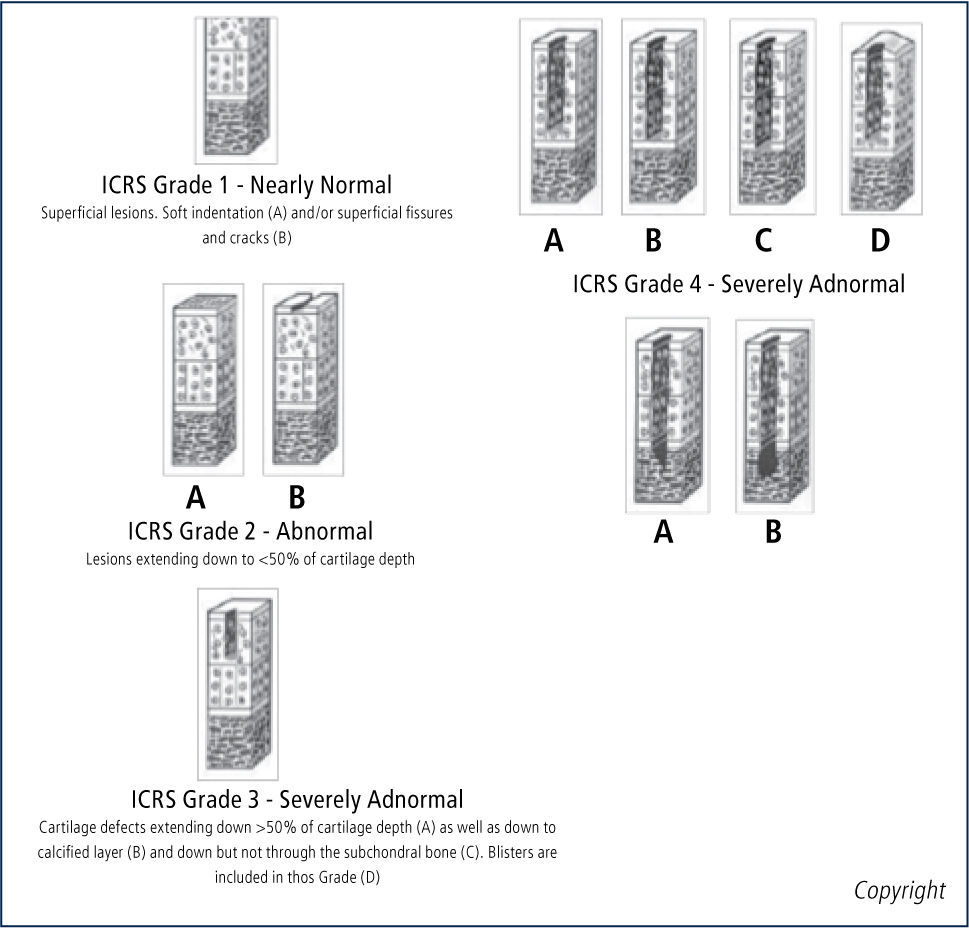
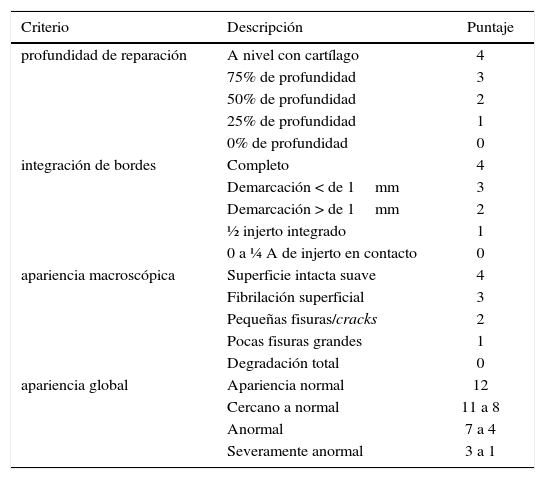
La 1a y 2a generación de esta técnica comparten la dificultad de la inyección de líquido bajo los parches, debido a la tendencia de los condrocitos a des-diferenciarse en fibro-condrocitos y producir una matriz celular con mayor cantidad de colágeno tipo I (factor que no ocurre cuando son sembrados en laboratorio); menor potencial de migración de los condrocitos; formación de bolsones líquidos; y evolución impre-decible de hipertrofia de las membranas, que motiva procedimientos extra para regularización y estudios con períodos cortos de seguimiento de dos años. Existe preocupación también por la calidad del tejido de reparación. En un estudio de Henderson y colaboradores (15) a 20 pacientes con 2ndlook artroscópico por persistencia de síntomas mecánicos, todos con calificación visual normal según escala visual ICRS (tabla 6), la biopsia mostró tejido similar a cartílago normal en 65% y tejido fibrocartilaginoso en 35%.
Score de eScala ViSual análoga (VaS) de icrS para reparación de carTílago.
| Criterio | Descripción | Puntaje |
|---|---|---|
| profundidad de reparación | A nivel con cartílago | 4 |
| 75% de profundidad | 3 | |
| 50% de profundidad | 2 | |
| 25% de profundidad | 1 | |
| 0% de profundidad | 0 | |
| integración de bordes | Completo | 4 |
| Demarcación < de 1mm | 3 | |
| Demarcación > de 1mm | 2 | |
| ½ injerto integrado | 1 | |
| 0 a ¼ A de injerto en contacto | 0 | |
| apariencia macroscópica | Superficie intacta suave | 4 |
| Fibrilación superficial | 3 | |
| Pequeñas fisuras/cracks | 2 | |
| Pocas fisuras grandes | 1 | |
| Degradación total | 0 | |
| apariencia global | Apariencia normal | 12 |
| Cercano a normal | 11 a 8 | |
| Anormal | 7 a 4 | |
| Severamente anormal | 3 a 1 |
Típicamente indicado en pacientes más jóvenes, lesiones de más de 2cm2, requieren indemnidad de placa subcondral, contempla dos procedimientos, requiere laboratorio para cultivo y expansión, alto costo y duración no conocida del tejido de reparación. Considerando que la maduración del tejido de reparación puede demorar uno a dos años, la restricción de práctica deportiva puede tomar largo tiempo (14).
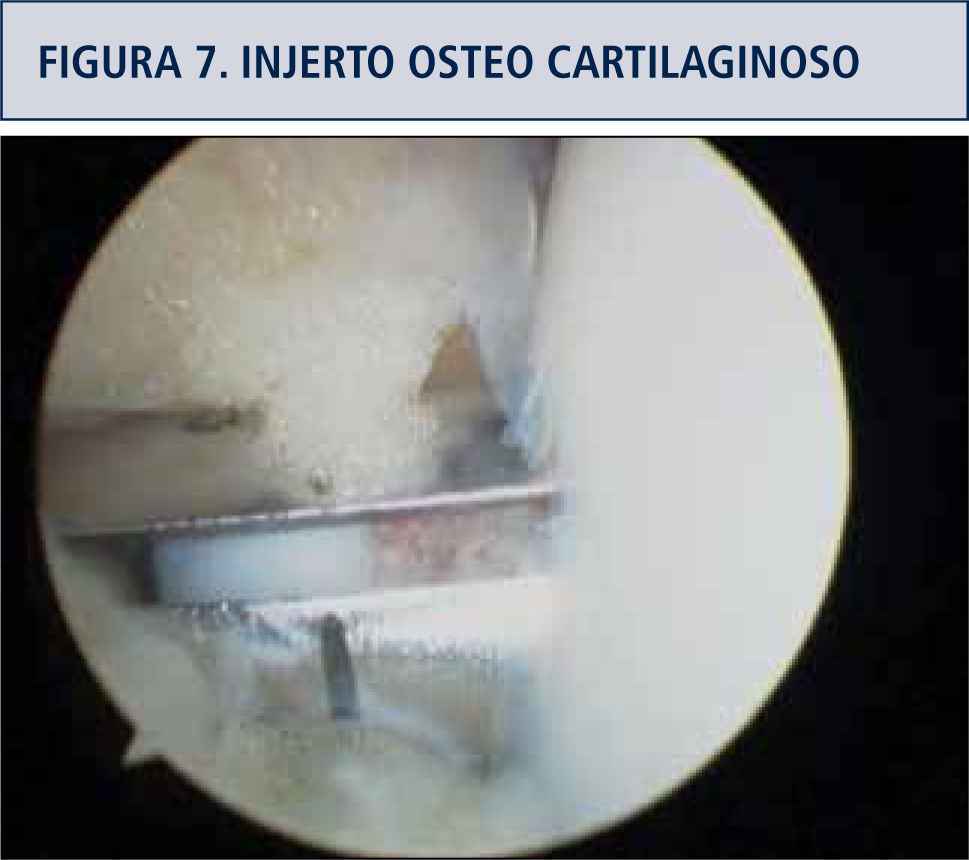
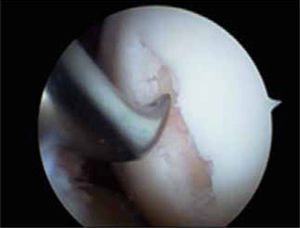
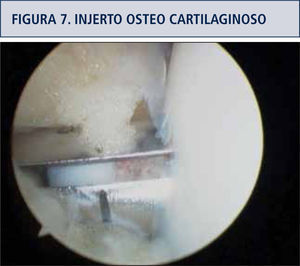
Transferencia de injertos osteocondrales autólogos (Toca) (figura 7)Preconizada por Hangody L. (10) consiste en tomar tarugos óseos con su cubierta de cartílago, de diámetros entre 2,7 y 10mm y de profundidad 15 a 25mm; estos últimos usados cuando hay daño de la placa subcondral. La toma del injerto se realiza en zonas más alejadas de la superficie de carga en la misma rodilla, con instrumental adecuado para esta toma y para preparar la zona a injertar. El manejo del injerto se hace con precaución de no golpear con fuerza durante la introducción del tarugo en la zona preparada, dada la escasa tolerancia del cartílago al impacto. El sitio de la toma se puede rellenar con tarugos sintéticos o dejarse descubiertos. La técnica es posible de realizar por vía artroscópica y tiene la ventaja de ser un procedimiento único. Se pueden colocar múltiples tarugos para cubrir lesiones de hasta 5cm2 aunque algunas publicaciones llaman a precaución respecto del número de tarugos sugeridos y el tamaño de la zona de lesión.
En 1990 Hangody y colaboradores 1990 publicó buenos resultados en largo plazo con esta técnica (11), con buenos y excelentes de 92% en cóndilo femoral, 87% en tibia y 79% en tróclea femoral. Horas y colaboradores (13), en un estudio comparativo con ICA encontraron superiores resultados con significancia estadística pero de escasa significación clínica.
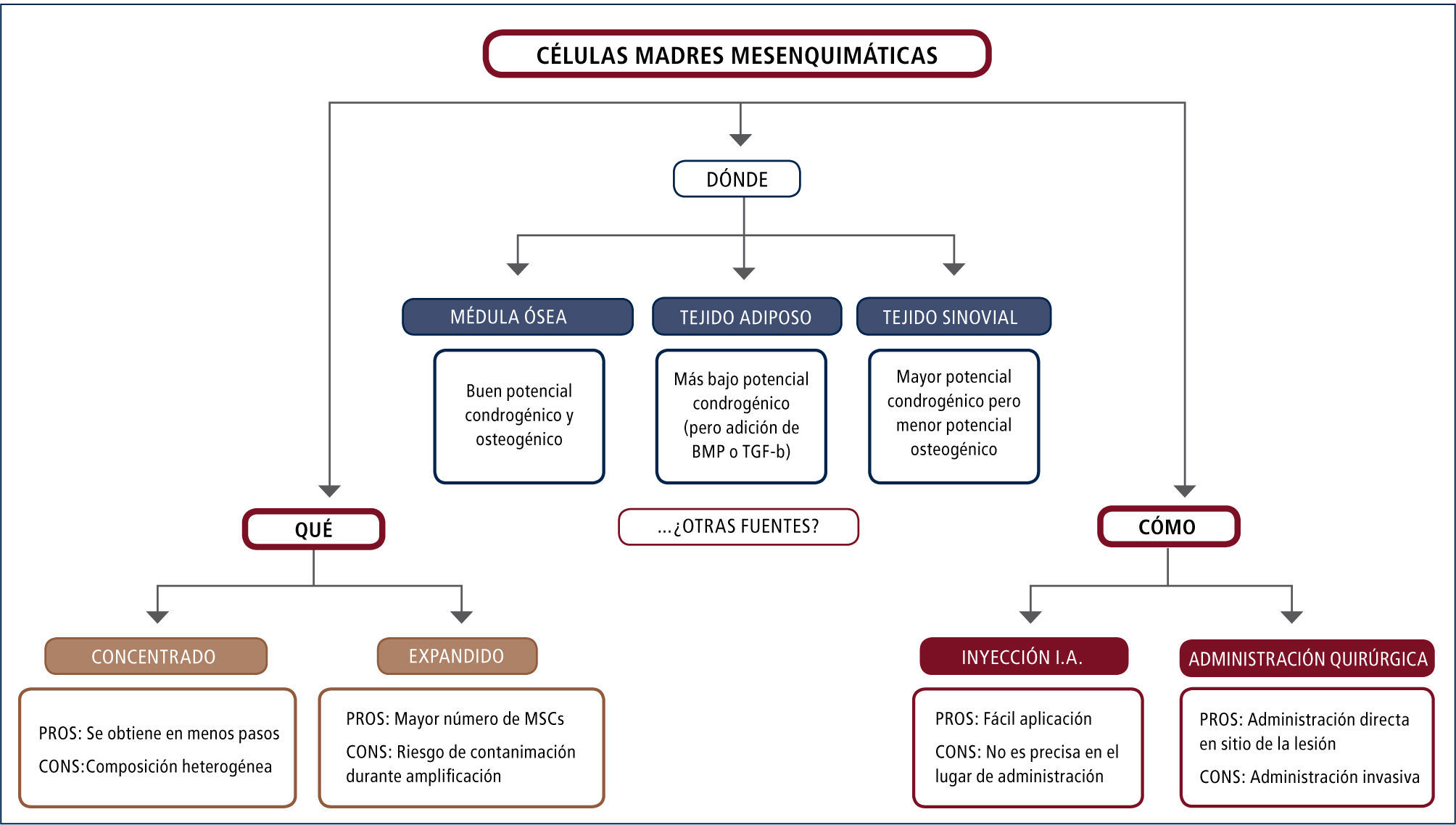
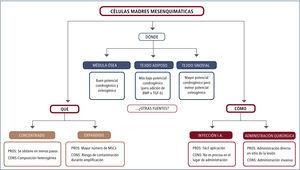
Uso de células madreLas células madre mesenquimales (MSCs, Mesenchymal Stem Cells) fueron identificadas en 1996 por Friedenstein y colaboradores (18) en la médula ósea (BM). En 1973 Caplan AI mostró su aplicación como regeneradoras de tejido (19); en 1994 Wakitani y colaboradores (20) registraron su uso para reparar defectos de cartílago en conejo y en 2001, Quartoy colaboradores (21) mostraron su potencial generador de tejido óseo en humanos.
Aunque hoy en día pueden ser aisladas en múltiples tejidos (45) (piel, tejido adiposo, líquido y membrana sinovial, sangre de cordón umbilical, hueso trabecular, periostio y músculo), presentando distintas potencialidades de proliferación y diferenciación, en cada caso, el uso más frecuente es derivado de médula ósea, tejido adiposo y sinovial. Pueden ser también aisladas en sangre periférica pero están en menor cantidad en adultos, son más difíciles de aislar y se requiere estimular la MO en forma previa para aumentar el número circulante.
Las MCSs tienen capacidad de auto-renovarse, mantenerse como células troncales y diferenciarse en variadas líneas celulares mesenquimales (22). Muestran además capacidad de migrar y alojarse en tejidos dañados, desarrollando efectos tróficos locales, inmuno-moduladores, antiinflamatorios por interacción directa célula a célula o secreción de moléculas bio-activas (35), con potencial de adherirse y diferenciarse a línea condrocítica, ósea y tejido adiposo, entre otros.
La aplicación se ha estudiado en infiltraciones de tejidos e intraarti-culares (22), éstas últimas asociadas a un aseo articular artroscópico en pacientes cercanos a requerir una prótesis de rodilla, o asociadas a distintos tipos de scaffolds (23,44) (membrana), en conjunto con PRP y en algunos centros, con pre-diferenciación a la línea condroídea previo al implante (24). Se utilizan como concentrados de MO o con expansión de células cultivadas en laboratorio (figura 8).
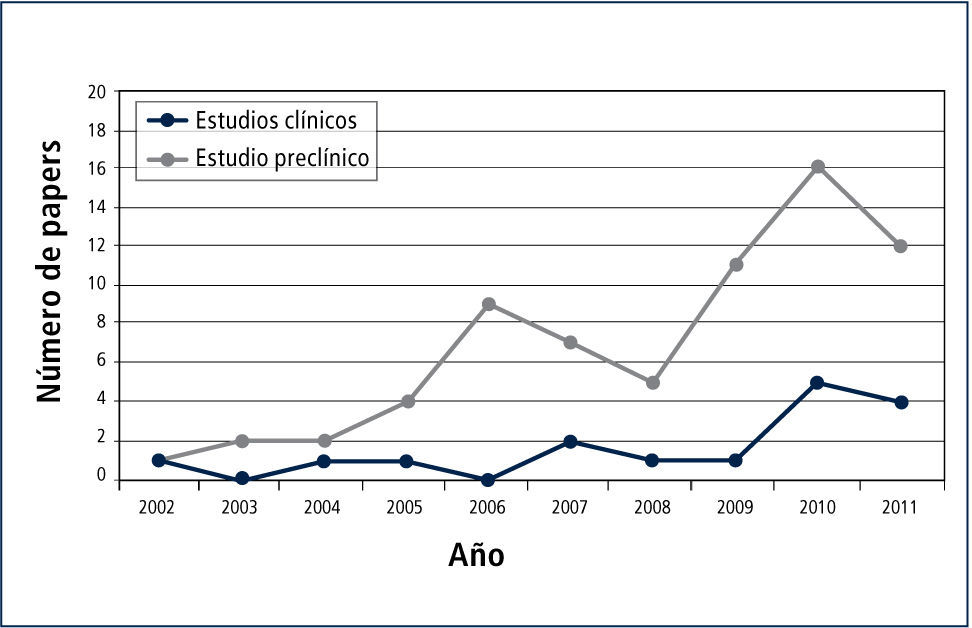
En revisiones sistemáticas de literatura sobre tratamientos con MSCs (22), es evidente que el conocimiento en esta técnica es aún preliminar si se considera la prevalencia de estudios preclínicos sobre estudios clínicos (tabla 7), aunque esa situación ha ido cambiando rápidamente en los últimos tres años.
Aún hay controversia sobre cuál es la mejor fuente de MSCs, siendo la MO la que aporta mayor número de células, de fácil acceso y toma de muestra para concentrar y amplificar. En 2009 Jakobsen y colaboradores (29) compararon la condrogénesis de MSCs proveniente de MO y de tejido adiposo sembrados en membrana de Á cido Hialurónico, obteniendo mejor resultado con la MO. Tampoco se ha clarificado cuál es la cantidad necesaria de células para asegurar éxito en la reparación o regeneración de cartílago. Existe preocupación por la manipulación de la muestra de MSCsy la posibilidad de contaminación de la siembra. Por último todavía se investiga cuál es la mejor técnica de entrega de las MSCs a la zona de lesión y qué membrana es más efectiva y cuál puede realizarse por vía artroscópica o abierta.
En un estudio experimental en conejos, Ole Moller Hansen y colaboradores (25) no encontraron diferencias en la calidad del tejido reparativo con cuatro distintas densidades (desde 1,2x106 a 2.0x107 células por cm3) células sembradas en membrana porosa ASEEDTM. En 2013 en Izmir, sede del congreso anual de la ICRS, un estudio publicado en poster por miembros de Laboratorio de Ingeniería de Tejidos (LIT.) de Clínica Las Condes, Mardones R. y colaboradores (26), al aumentar la densidad de la siembra de MSCs de MO, diferenciadas a condrocitos y/o cambiar el momento de la siembra, no encontraron aumento del número de condrocitos después de 21 días de sembrados antes de ser implantados; y después de cuatro semanas de siembra la cantidad de células vivas comienza a disminuir. Cabe destacar que el LIT de Clínica Las Condes al momento de entregar la siembra o las amplificaciones de MSCs emite un informe de la densidad del tejido obtenido y de sus correspondientes cultivos.
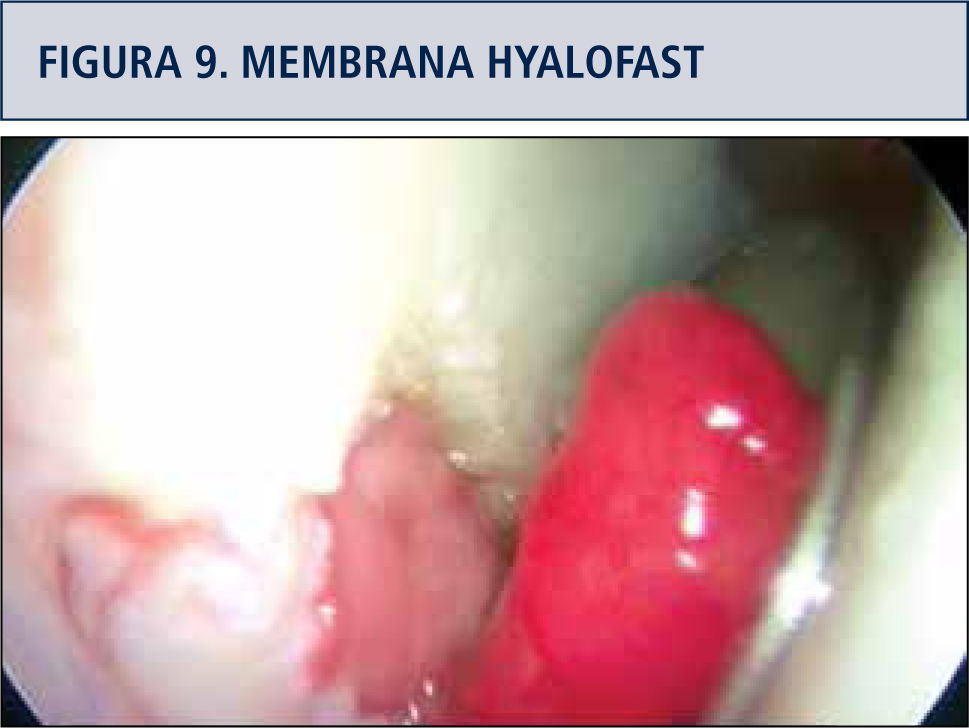
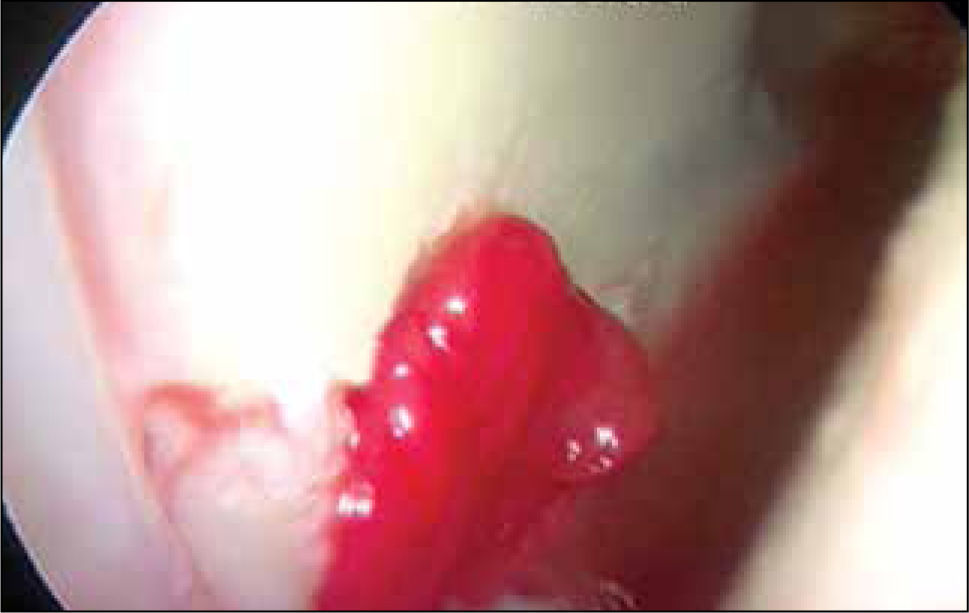
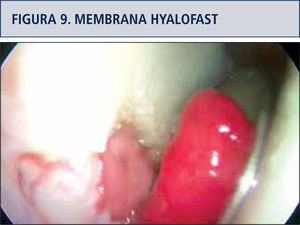
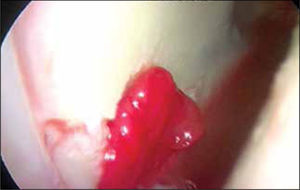
Muchos estudios se han publicado con distintas membranas como Chondro-GideR (colágeno II y III) (27), Poly-caprolactona con Ácido Hialurónico (28,30) y Hyalofasttm (34) Membrana, ésta última, semi-sintética de Ácido Hialurónico biodegradable, con el objetivo de ser sembrada con MSCs cultivadas y diferenciadas a condrocitos o acelula-res para inducir migración de células en el sitio de la lesión en casos de estimulación de MO, implantable por vía artroscópica (figuras 9 y 10), dependiendo del tamaño y ubicación de la lesión. Otro tipo de membranas, las biotridimensionales, con capacidad de regenerar los defectos osteocondrales también se han estudiado (34).
La literatura actual explora una variedad de estrategias para combinar las distintas membranas y técnicas de terapia celular de reparación de cartílago, basada en los tres procedimientos antes descritos. Últimamente se han publicado series con el uso de células madre halogénicas, sin reportarse daño inmunológico y evidencia de regeneración de tejido cartilagíneo y meniscal, aún en procedimientos de infiltración articular de la rodilla (42).
Técnica quirúrgicaSea por vía artroscópica o abierta, las bases técnicas de la cirugía son:
- a)
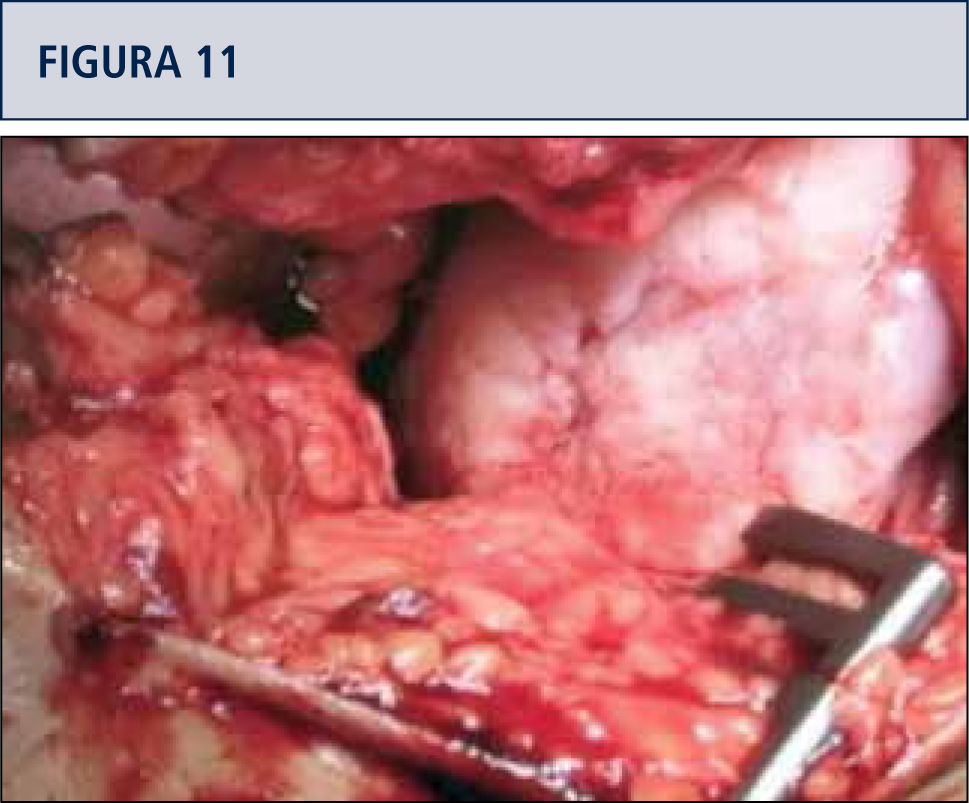
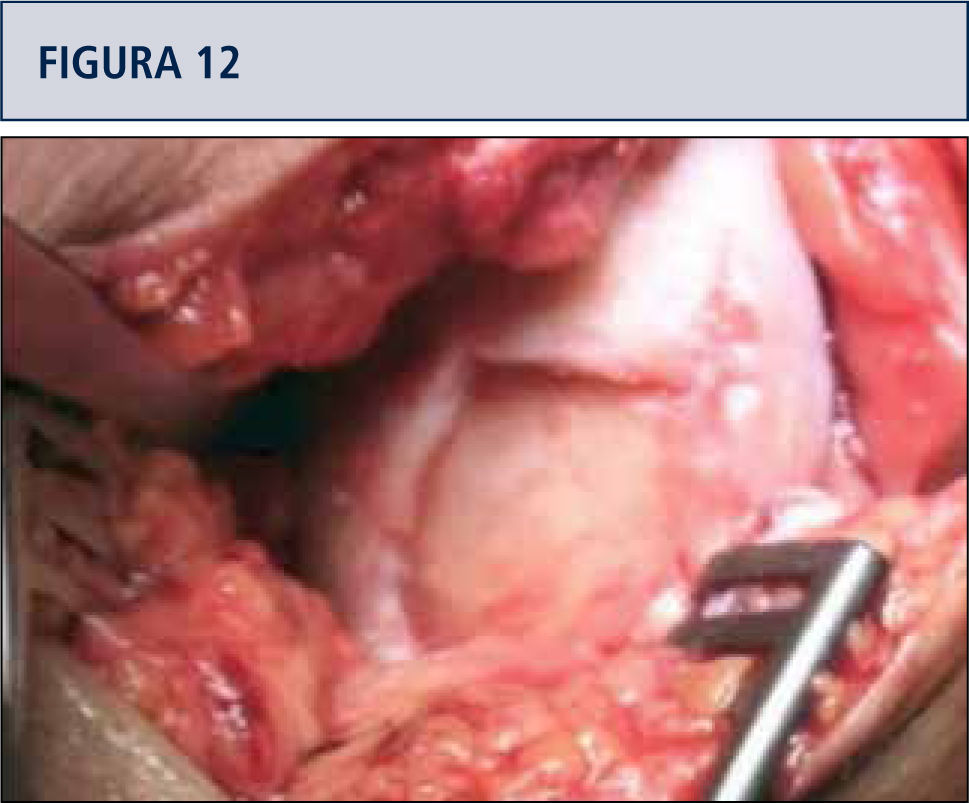
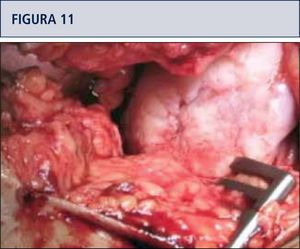
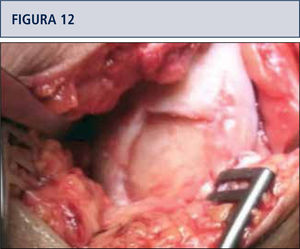
Medición y preparación de la zona de daño resecando los bordes en mal estado y eliminación de la capa de cartílago calcificado sin dañar la placa subcondral (figuras 11 y 12).
- b)
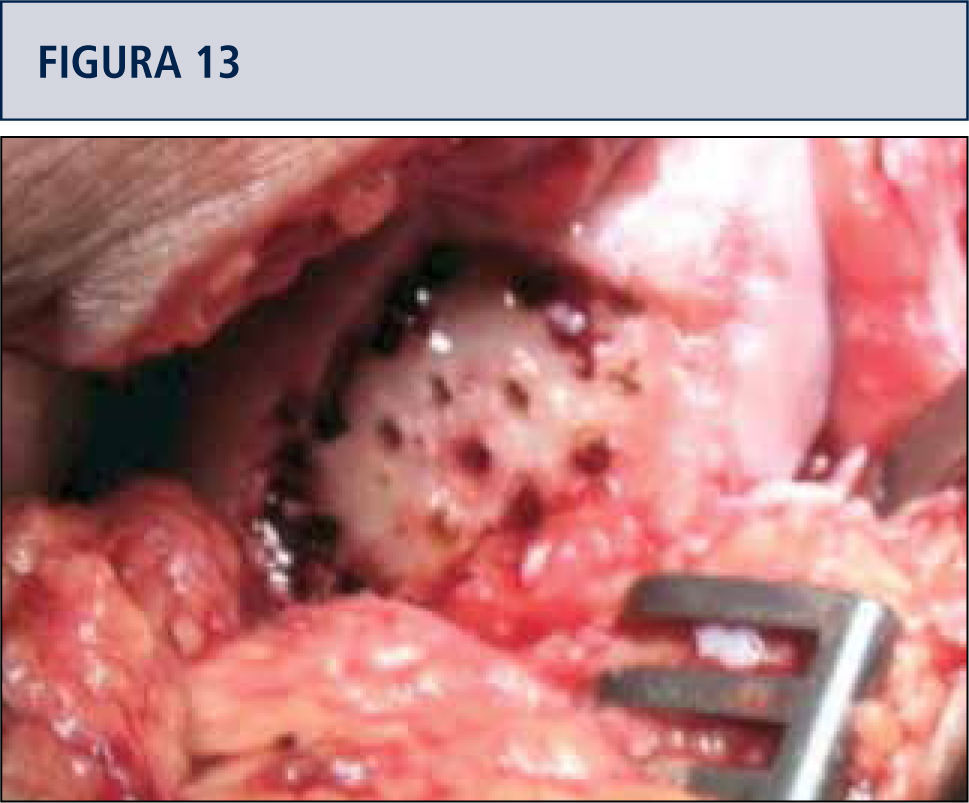
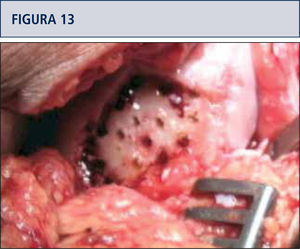
Estimulación de la MO por la vía de abrasión, perforación o punción de hueso subcondral, con orificios de 2mm separados por 3 a 4mm cada uno (figura 13).
- c)
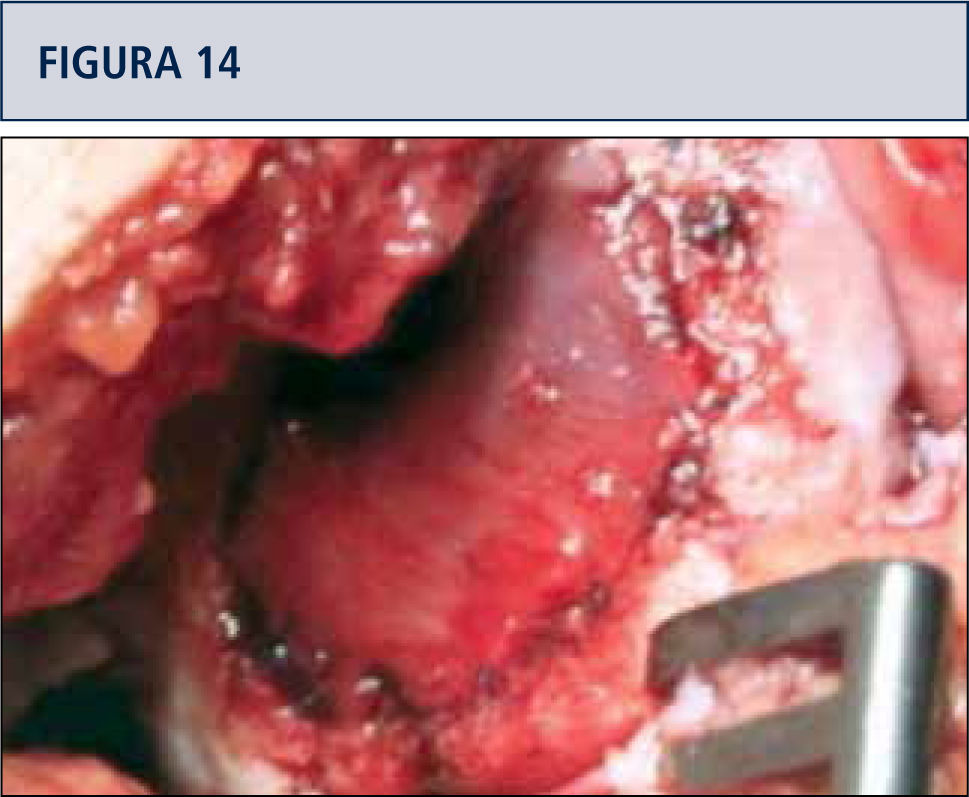
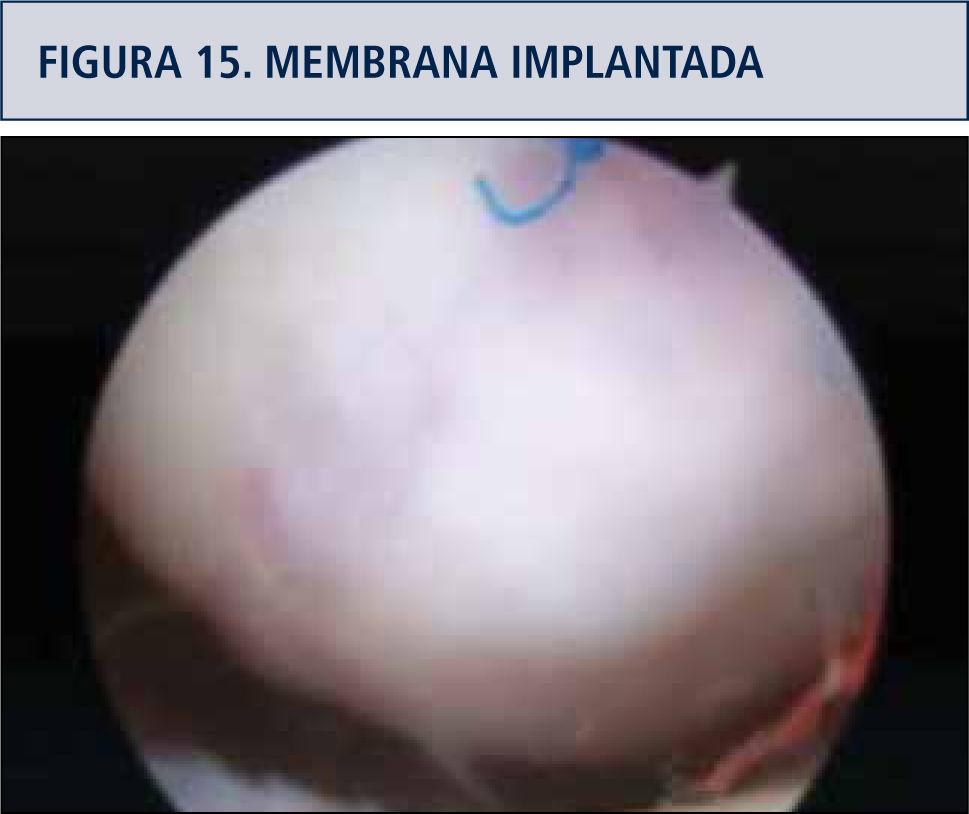
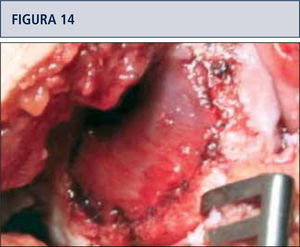
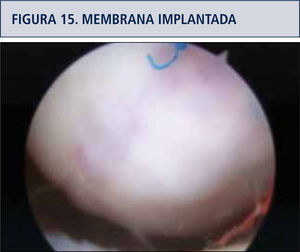
Colocación de la membrana sembrada y estabilización de ésta por medio de suturas o compresión instrumental (figuras 14 y 15).
- d)
Sellado e infiltración de las células cultivadas bajo la membrana, si están en estado líquido.
Actualmente disponibles para la reposición de meniscectomías totales, el transplante meniscal de banco de tejidos halogénicos, cuenta con seguimiento adecuado y resultados aceptables de 77 a 82%, dependiendo del tiempo de seguimiento de las series publicadas (39,40) con algunas series de sobrevida de 70% a 10 años.
Las dificultades de esta técnica son el tamaño del injerto adecuado para cada paciente y la validación de los métodos de medición de la incorporación del injerto, proceso muy lento en su evolución.
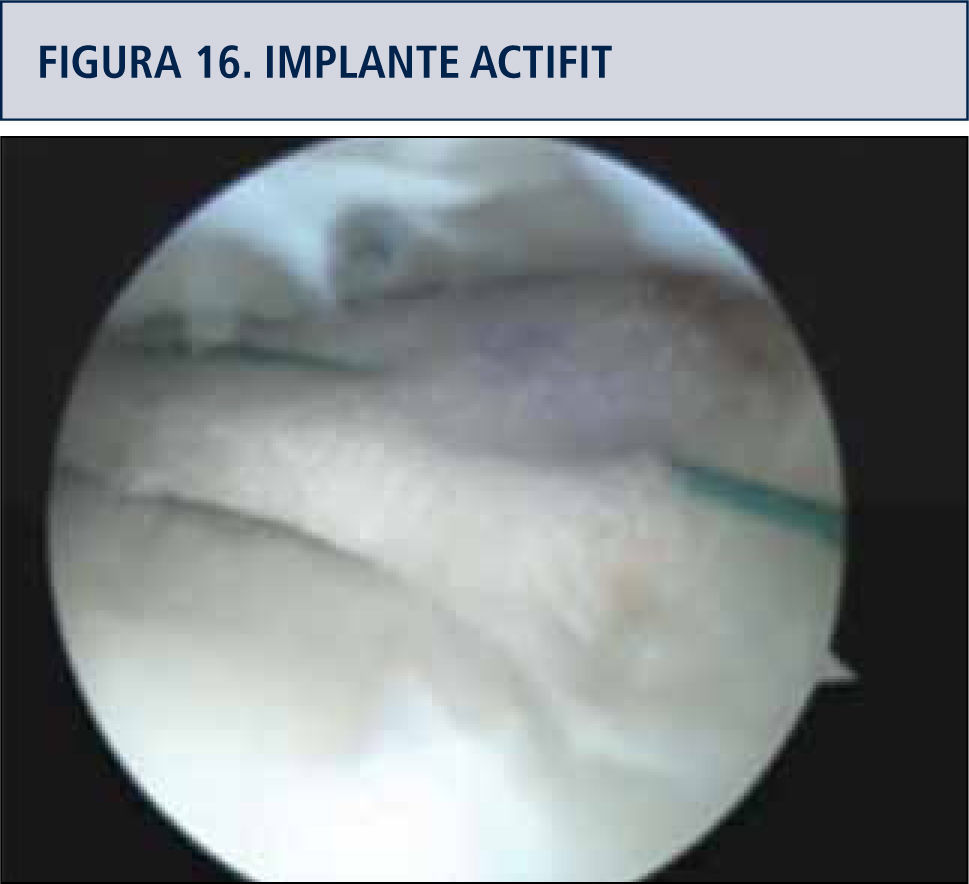
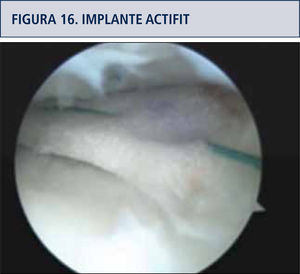
Membranas meniscalesTambién disponibles hoy, implantes derivados de colágeno animal (CMI Collagen meniscus implant, Re.Gen Biologics N.J. USA) y poliuretanos porosos sintéticos (Actífít TM Orteq Bioengineering), destinados a reponer tejido en meniscectomías parciales, este último particularmente usado como implante sembrado con células madre, con buenos resultados en seguimiento a dos años (41). Durante su implantación se di-mensionan al tamaño del defecto del menisco y se suturan al remanente meniscal (figura 16).
Cirugía biológica en clínica las condesEn la actualidad Clínica Las Condes cuenta con el Laboratorio de Ingeniería de Tejidos (LIT) lo que permite:
- a)
Concentrar células madres de MO en pabellón para uso inmediato.
- b)
Enviar concentrado obtenido en pabellón para expansión de número de células madre adecuado a los procedimientos antes descritos.
- c)
Sembrar células madre expandidas en membranas para cartílago y membranas meniscales.
- d)
Realizar infiltración articular de células madre expandidas en estado líquido.
- e)
Descelularización de tejidos de donantes halogénicos para ser transplantados.
- 1
Infiltración articular líquida de 5cc con 20 millones de células madre no diferenciadas
Se realizan tres infiltraciones ambulatorias (una por semana) en pacientes con artrosis KL 2 o más, mayores de 50 años, luego de aseo artroscópico de rodilla y toma de muestra de MO de cresta ilíaca para expansión. Reservado para pacientes con crisis frecuentes de episodios de inflamación articular que aún no tienen indicación de prótesis, o no quieren hacerla todavía.
- 2
Implantación de membrana Chondro-Guidetm sembrada con células madre prediferenciadas a condrocitos.
Reservada para pacientes menores de 45 años, activos, con lesiones de a 4cm2 o más, requiere dos procedimientos: toma de muestra de MO y posterior implante en cirugía abierta para sutura de la membrana. Requiere solución de los factores de riesgo como defectos de alineamiento, inestabilidad tibio-femoral o pátelo-femoral.
- 3
Implantación de membrana Hyalofastttm por vía artroscópica con concentrado de células madre inmediato, obtenido de toma de muestra simultánea para expansión, seguida de tres infiltraciones ambulatorias (una por semana) de 20 millones de células en 5cc de líquido.
Reservado para pacientes menores de 45 años, activos, con lesiones de hasta 2cm2, KL 0 o I, con ICRS 3 a 4, con cuadro clínico refractario a tratamiento conservador y crisis de inflamación frecuentes, desencadenadas por actividad física. Requiere solución de los factores de riesgo si los hubiere.
- 4
Sustitución meniscal con Actifittm sembrado con células madre expandidas no diferenciadas.
Reservado para pacientes con meniscectomías parciales previas, con cuadro clínico refractario a tratamiento conservador, factible de realizar por vía artroscópica. Requiere solución de factores de riesgo mencionados.
Hasta abril de 2014 el Departamento de Traumatología y Ortopedia ha realizado en rodilla:
Los casos de CLC están aun en seguimiento, sin reportarse efectos adversos, con evolución comparable a la evidencia de la literatura mundial.
ConclusionesLa evolución natural de las lesiones condrales, es hacia el establecimiento de un artrosis de la rodilla. El diagnóstico adecuado de estas lesiones de cartílago realizado con tecnología de avanzada de imágenes abre posibilidades de detección precoz de la artrosis de rodilla. Nuevas técnicas de ingeniería de tejidos prometen reparación de lesiones condrales con resultados de corto y mediano plazo buenos, sin efectos nocivos para la articulación, pero deben superar la prueba del tiempo para mostrar que pueden retrasar la necesidad de una prótesis de rodilla. Los actuales protocolos de tratamiento están basados en el adecuado diagnóstico de la artrosis temprana y la aplicación de tecnología aprobada en el uso clínico de biomateriales hoy disponibles.
La evidencia científica actual muestra que no sólo se trata de restablecer la superficie articular, sino también de solucionar los factores de riesgo del paciente, que lo llevan a una artrosis, como son la inestabilidad tibio-femoral, los defectos de alineamiento, el déficit de tejido meniscal y la inestabilidad pátelo-femoral. Esto lleva a mejorar también las técnicas de tratamiento de estas condiciones mecánicas desfavorables como requisito sine qua non del éxito de la cirugía biológica pre-protésica.
El autor declara tener conflicto de interés en el tema. Posee acciones de CLC SA y Bioscell, empresa que realiza criopreservación de células troncales.