El nacimiento de un hijo es una experiencia maravillosa y dolorosa. Los mitos que rodean a la anestesia del trabajo de parto surgen tanto desde la ciencia y la sociedad como de las personas. En el presente artículo se revisa el estado actual del conocimiento sobre el efecto de la anestesia en el trabajo de parto, tomando alguno de sus aspectos más relevantes. Aunque la anestesia epidural estándar tiene algunos efectos negativos (partos instrumentales, paresia, retención de orina), las técnicas modernas (combinada espinal-epidural o epidural dosis bajas) han mejorado mucho estos aspectos. Por ello, la anestesia neuroaxial es la mejor alternativa en analgesia para parto. Sin embargo, a pesar de todo este avance poco ha cambiado la satisfacción materna, indicando que el dolor es sólo una parte de algo mucho más complejo.
The birth of a child is a wonderful and painful experience. The myths surrounding anesthesia for the labor arise from science, society and patients. We review the state of the art of the effects of anesthesia in labor, taking some of its most relevant aspects. Although the standard epidural anesthesia has some negative effects (instrumental deliveries, paresia, urinary retention), modern techniques (combined spinalepidural or low doses epidural anesthesia) have importantly improved these aspects. Therefore, neuraxial anesthesia is the best alternative for labor analgesia. However, despite all these progress, there is little change in maternal perception and satisfaction, indicating that pain is just a part of a much more complex event.
El nacimiento de un hijo es quizás la experiencia más maravillosa del ser humano y también, para la madre, una de las más dolorosas (1) ¿Será posible separar ambas experiencias? ¿Se puede dar bienestar materno y fetal sin interferir con el progreso del parto y su resultado? ¿Cuándo debe comenzar una anestesia? ¿Cuándo termina?
Estas y muchas otras preguntas han surgido desde hace más de un siglo. Diversas respuestas han venido desde la ciencia, pero muchas otras desde la sociedad y mayormente desde los individuos (experiencia personal y su transmisión oral). El resultado ha sido una gran cantidad de mitos que rodean nuestro quehacer.
La anestesia es uno de los descubrimientos más importantes en la historia de la humanidad. Esta fue el motor del avance de la medicina en los siglos pasados. Sin embargo, en nuestro afán de abarcarlo todo, intervenimos un proceso natural y maravilloso, el parto.
Aunque se ha avanzado en distintas direcciones para restaurar el status “natural” del parto (la pediatría le devolvió el recién nacido a la madre y la obstetricia le devolvió la madre a la familia), aún se debate sobre si la analgesia para el trabajo de parto afecta negativamente este proceso.
De más está decir, para empezar con la defensa de la anestesia, que muchos de los factores que conducen a un parto difícil y doloroso, como mal posición fetal, macrosomía y anormalidades uterinas, también conducen a solicitar anestesia.
En esta revisión se analiza, desde el punto de vista de la evidencia científica, cuáles son los efectos de la analgesia neuroaxial en la duración y resultado del trabajo de parto; qué técnicas son mejores y cuáles son sus diferencias. Se verá también, qué tan precoz se puede comenzar una anestesia sin afectar el resultado obstétrico. Finalmente se revisarán los efectos de la anestesia sobre el bloqueo motor y la deambulación.
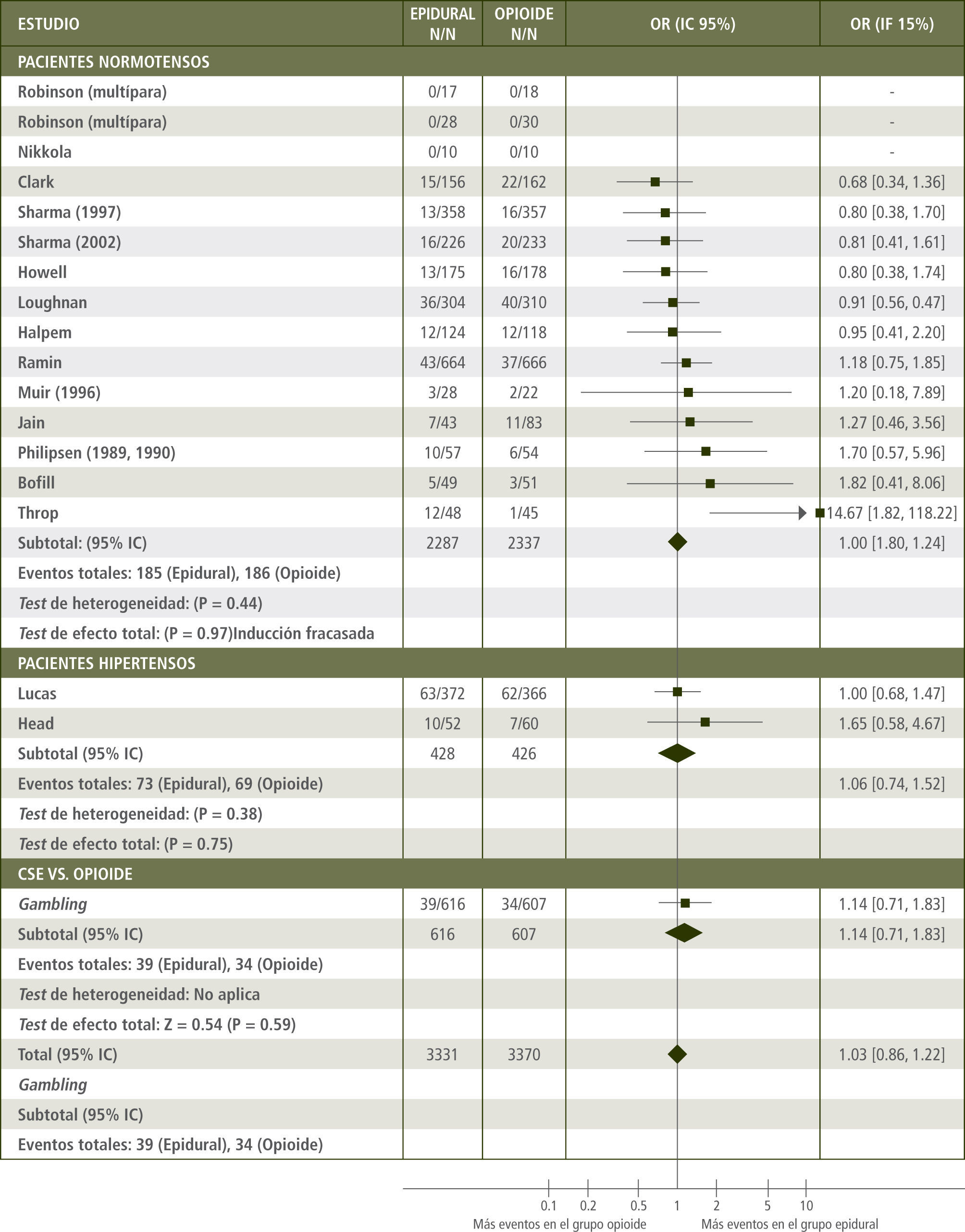
Efectos sobre la vía de partoMúltiples estudios observacionales han mostrado una fuerte asociación entre analgesia neuroaxial y parto quirúrgico (2). Estos trabajos se han basado en dividir a las pacientes en grupos según la elección hecha por la propia paciente en cuanto al método de analgesia. Aquellas que eligieron la analgesia epidural registraron una mayor incidencia de parto instrumental y cesáreas en comparación a aquellas que escogieron otros métodos analgésicos (por ejemplo vía parenteral). Sin embargo, al analizar estos datos, el grupo con anestesia neuroaxial tuvo otras condicionantes para tener un mayor riesgo de parto operatorio: mayor número de nulípara (3), desequilibrios demográficos (peso materno, talla, peso fetal y dilatación al inicio) (4) y trabajos de parto disfuncionales (5). Leigthton y colaboradores (6) realizó un metaanálisis de 18 ensayos clínicos controlados y aleatorios, en el cual compararon analgesia neuroaxial y opiáceos parenterales. La incidencia de cesáreas fue la misma en ambos grupos (OR 1.03 IC95% 0.86–1.22) (figura 1). Sin embargo, la incidencia de parto vaginal instrumental fue mayor en el grupo neuroaxial (OR 1.92 IC95% 1.52–2.42). No se registraron diferencias en la duración de la primera etapa del trabajo de parto, pero la segunda etapa se prolongó en promedio 16 min. (IC95% 10–23min, p<0.05). Esto último, si bien es estadísticamente significativo, es clínicamente irrelevante.
La revisión realizada por Anim-Somuah (7), que incluyó 38 estudios (9.658 mujeres), mostró que la analgesia epidural era mejor que la analgesia con opiáceos en cuanto a:
- •
Alivio del dolor (Mean Difference, MD,-3.36, 95%, CI -5.41 a -1.31)
- •
Reducción en la necesidad de analgesia adicional (RR 0.05, 95% CI 0.02 a 0.17),
- •
Reducción de riesgo de acidosis (RR 0.80, 95% CI 0.68 a 0.94)
- •
Reducción del uso de naloxona (RR 0.15, 95% CI 0.10 a 0.23)
Sin embargo la analgesia regional se asoció a:
- •
Aumento del parto vaginal instrumental (RR 1.42,95% CI 1.28 a 1.57)
- •
Hipotensión materna (RR 18.23, 95% CI 5.09 a 65.35)
- •
Bloqueo motor (RR 31.67, 95% CI 4.33 a 231.51)
- •
Fiebre materna (RR 3.34, 95% CI 2.63 a 4.23)
- •
Retención urinaria (RR 17.05, 95% CI 4.82 a 60.39)
- •
Prolongación de segunda etapa del parto (MD 13.66 minutes, 95% CI 6.67 a 20.66)
- •
Aumento del riesgo de cesáreas por registro fetal no tranquilizador (RR 1.43, 95% CI 1.03 a 1.97).
- •
No hubo diferencia en el riesgo de cesáreas de cualquier causa (RR 1.10, 95% CI0.97 a 1.25),
- •
Apgar menor de 7 a los 5 min. (RR 0.80, 95% CI 0.54 a 1.20) ni en la satisfacción materna (RR 1.31, 95% CI 0.84 a 2.05).
Cabe señalar que estos trabajos adolecen de errores difíciles de resolver. No es posible ser “ciego” a la mejor calidad en la analgesia neuroaxial y, por otro lado, un número significativo de pacientes se cambiaban de grupo (principalmente desde el grupo de opiáceos parenterales al de anestesia neuroaxial) luego de ser distribuidos al azar.
En suma, la analgesia neuroaxial no se asocia a un aumento de la incidencia de cesáreas en comparación a opiáceos parenterales pero sí a un aumento de los partos vaginales instrumentales. La razón podría radicar en el efecto de la analgesia sobre el piso pélvico o también en cambios en el comportamiento del médico (por ejemplo, decidir usar fórceps porque la paciente tiene buena analgesia). La prolongación sólo de la segunda etapa del trabajo de parto tiene poca relevancia clínica.
Es destacable que métodos de analgesia de parto con efectividad muy dispar produzcan niveles de satisfacción materna similares. Parte de este hallazgo se debe a que la forma de medir esta satisfacción en la literatura ha sido diversa (8) y sus resultados, aún mas. Se requiere de más investigación clínica para llegar a tener herramientas objetivas de medición de esta variable.
Técnicas de analgesia neuroaxialLa técnica Combinada Espinal-Epidural (CEE) se introdujo en la práctica clínica en 1984 (9). Presenta la ventaja de un rápido inicio de acción con poco o ningún efecto sobre la deambulación. Estudios iniciales que la compararon con Analgesia Epidural (AE) sugirieron que la CEE podría reducir la duración del trabajo de parto (10). Gambling y colaboradores (11) mostró un aumento en la incidencia de bradicardia fetal grave con CEE, lo que llevó a un aumento en cesáreas de urgencia. A continuación se analizan tres trabajos (12–14) que compararon CEE y AE y su impacto en el trabajo de parto.
Norrisy colaboradores (12) estudió 2.183 pacientes comparando ambas técnicas. El grupo CEE recibió 10 ug de sufentanilo, con o sin 2mg de bupivacaína, dependiendo de la etapa del parto. Esto fue seguido por 3ml de lidocaína al 1,5% por catéter epidural. El grupo epidural recibió 3mlde lidocaína al 1,5% seguido de 10 a 20ml de bupivacaína al 0,125% con 10 ug de sufentanilo por catéter epidural. No se encontraron diferencias en la forma de parto, incidencia de cesáreas de emergencia, duración de la primera y segunda etapa del trabajo de parto.
El estudio Comparative Obstetric Mobile Epidural Trial (COMET) (13,14) se llevó a cabo en Reino Unido y asignó 1.054 pacientes a uno de tres grupos: Analgesia Epidural Estándar (AEE) con bupivacaína 0,25%; Combinada Espinal-Epidural (CEE) con dosis espinal de 2,5mg de bupivacaína más fentanilo 25 ug seguidos de bolos epidurales de bupivacaína 0,1% más fentanilo (2ug/ml); y Analgesia Epidural Dosis Bajas (AEDB) usando al inicio y en los bolos posteriores, bupivacaína 0,1% más fentanilo (2ug/ml). Se encontró una mayor tasa de partos vaginales y disminución de partos vaginales instrumentales con CEE y AEDB comparados con AEE (13), sin diferencias entre las dos primeras. La incidencia de cesáreas fue igual en los tres grupos. Tampoco se encontraron diferencias en sufrimiento fetal ni duración de la primera y segunda etapa del parto (14).
Posteriormente, se comparó CEE con AEE y AEDB en una revisión sistemática de la base de datos Cochrane (15) que incluyó 27 ensayos clínicos aleatorios (3.274 pacientes). En cinco variables evaluadas, CEE resultó superior a AEE: inicio de acción (MD -2.87 m ; 95% CI -5.07 a -0.67), necesidad de analgésicos de rescate (RR 0.31; 95% CI 0.14 a 0.70), retención urinaria (RR 0.86; 95% CI 0.79 a 0.95) y tasa de parto instrumental (RR 0.81; 95% CI 0.67 a 0.97). AEE fue superior a CEE en pH vena umbilical (MD -0.03; 95% CI -0.06 a -0.00). No hubo diferencias en movilización durante el parto, uso de oxitocina, cesáreas, hipotensión o Apgar del recién nacido. Cuando se comparó CEE con AEDB, la primera tuvo un inicio de acción mas rápido pero con más prurito (RR 1.80; 95% CI 1.22 a 2.65). No hubo diferencias significativas en satisfacción materna, necesidad de rescate analgésico, movilización durante el parto, cefalea postpunción de duramadre, necesidad de parche de sangre, retención de orina, hipotensión, nausea, vómito, uso de oxitocina, modo de parto, pH umbilical oApgar.
En suma, los datos actuales concluyen que hay pocas diferencias entre CEE y AEDB. Sin embargo, la CEE tiene un lugar desde hace más de 20 años en muchos centros y es aún la técnica de elección en muchas situaciones clínicas específicas. Ventajas, como su rápido inicio, poco efecto motor y mayor seguridad en la posición del catéter dentro del espacio epidural (16) superaron por ahora a problemas como el prurito y la cefalea postpunción de duramadre, hicieron que fuera la técnica de elección en analgesia para trabajo de parto. No obstante, nuevas formas de administración de analgésicos vía epidural (por ejemplo analgesia epidural controlada por paciente+bolos automáticos mandatorios) y el desarrollo de nuevos y mejores coadyuvantes podrían inclinar nuevamente la balanza a favor de la Analgesia Epidural.
Analgesia precoz o tardíaMuchas madres quieren saber cuál es el mejor momento para solicitar la analgesia sin que tenga un impacto negativo sobre el resultado o duración del parto. Guías de práctica clínica antiguas, sugerían esperar una dilatación cervical de al menos 4cm antes de iniciar la analgesia, para reducir la posibilidad de una cesárea (17). La colocación de analgesia regional precoz ha sido abordada por cuatro grandes ensayos clínicos controlados aleatorios. En el primer estudio (18) 449 pacientes nulíparas fueron asignadas a recibir AE o meperidina parenteral. El grupo precoz (2,4cm de dilatación) recibieron una AE con ropivacaína 0,1% + 2ug/ml de fentanilo al primer requerimiento. El grupo tardío recibió meperidina hasta que la dilatación fue mayor a 4cm (4,6cm en promedio). No hubo diferencias en la forma de parto. La duración de la primera etapa del parto fue ligeramente más corto en el grupo precoz (9,4 vs 10,3 horas, p=0,04), sin diferencias en la segunda etapa del parto.
Wong y colaboradores (19) estudió a nulíparas en trabajo de parto espontáneo con dilatación menor de 4cm. Las pacientes fueron asignadas al azar a dos grupos. Un grupo recibió fentanilo epidural mientras el otro recibió hidromorfona parenteral hasta que la dilatación fue mayor de 4cm. No se encontraron diferencias en la incidencia de cesárea o parto vaginal instrumental. También encontraron que el grupo de anestesia precoz tenía una primera etapa del parto más corta. La misma Dra. Wong (20) replicó el trabajo pero esta vez en nulíparas sometidas a inducción. La dilatación promedio fue 2cm en el grupo precoz y 4cm en el tardío. Tampoco hubo diferencias en cesáreas o parto vaginal instrumental.
Wang y colaboradores (21) estudió 12.693 pacientes nulíparas asignadas a recibir AE precoz (1,6cm, rango 1,1 a 2,8cm) o tardía (5,1cm, rango 4,2 a 5,7). Se utilizó una dosis inicial de ropivacaína 0.125% más sufentanilo 0.3 ug/ml en bolo inicial más bolos controlados por paciente. No hubo diferencias en incidencia de cesáreas, partos instrumentales ni duración de la primera y segunda etapa del parto.
Por último, en una revisión sistemática de la literatura hecha porWassen (22), que incluyó AE y CEE, se concluyó que el riesgo de cesárea (RR 1.02,95% CI 0.96–1.08) y de parto vaginal instrumental (RR 0.96,95% CI 0.89–1.05) fue igual en analgesia precoz como tardía.
Se concluye entonces, que la analgesia neuroaxial precoz no influye en la incidencia de partos instrumentales ni cesáreas. Aunque algunos de los trabajos mostraron acortamiento de la primera etapa del parto con AE precoz, estos resultados no son consistentes ni clínicamente significativos.
Bloqueo motorUna causa frecuente de insatisfacción materna es el bloqueo motor producido por la analgesia regional y su consecuencia sobre la deambulación, la micción y el pujo materno. La analgesia epidural convencional (bupivacaína 0.25%) se asocia a mayor bloqueo motor, necesidad de monitorización y cateterización vesical (23). Esto lleva, como hemos visto, a un aumento del parto instrumental, prolongación de la segunda etapa del trabajo de parto y necesidad de uso de oxitocina (24). Por esta razón, uno de los objetivos principales de la anestesia obstétrica es intentar disminuir el bloqueo motor de las pacientes.
Los primeros intentos serios orientados en este sentido surgieron a principios de la década de los 90, con la llegada de la Combinada Espinal Epidural (CEE) que inicialmente fue sólo con opiáceos intratecales (25,26). Se ha avanzado mucho desde esos primeros trabajos en disminuir el bloqueo motor.
Inicialmente se le dio importancia a la elección del anestésico local. Tanto la concentración efectiva media (ED50) como la potencia relativa para bloqueo motor (27,28) favorecen a ropivacaína sobre levobupivacaína y bupivacaína. Sin embargo, más importante que el anestésico local elegido resulta fundamental la concentración de la droga. El uso de concentraciones menores a 0.07% de ropivacaína o 0.125% de bupivacaína se asocia a efectiva analgesia con preservación de funciones motoras (29).
El empleo de coadyuvantes ayudan a reducir la concentración de anestésicos locales necesaria para alcanzar analgesia de parto, aumentar la duración y reducir el bloqueo motor. Los opiáceos (fentanilo y sufentanilo) son los más ampliamente usados por su acción sinérgica en analgesia con mínimo bloqueo motor. A pesar de sus efectos colaterales indeseados (30), como prurito, sedación y retención de orina, su uso está ampliamente difundido y validado. Otras drogas como adrenalina, clonidina, neostigmina, midazolam o ketamina han mostrado utilidad pero con un beneficio que no compensa sus efectos deletéreos (31).
En el último tiempo, ha adquirido relevancia el método usado para administrar las soluciones epidurales, el que se puede dividir en dos categorías. El primero es a través de bolos de solución analgésica dados a intervalos irregulares y que responden a la reaparición del dolor. Estos bolos pueden ser proporcionados en forma manual por un anestesiólogo o automáticos (PCEA). Una segunda categoría son las técnicas que previenen la reaparición del dolor. Aquí se incluyen la Infusión Epidural Continua (IEC), la PCEA+IEC, Bolos Intermitentes Automáticos (BIA), Bolos Intermitentes Continuos (BIC), Bolos Epidurales Intermitentes Programados (BEIP) y PCEA integrada por computador.
La mantención de analgesia con IEC resulta en uso frecuente de bolos de rescate y mayor bloqueo motor (32,33). La PCEA se asocia con menor consumo de anestésicos locales y bloqueo motor (34,35) sin embargo, la paciente experimenta cortos episodios de dolor antes que se reestablezca la analgesia. Esto puede ser perjudicial al momento de evaluar la calidad de la analgesia y la satisfacción materna. Para solucionarlo, se agregó una infusión basal a la PCEA. Halpern y Carvalho (35) compararon siete estudios controlados aleatorios de PCEA con y sin infusión continua. Aunque estos últimos mostraron menos consumo de anestésicos locales, el resto de las variables (bloqueo motor, analgesia materna, satisfacción) fueron similares en ambos grupos. Guías practicas de la Sociedad de Anestesiología Americana, basadas en un metaanálisis (36), indican que la PCEA + IEC provee mejor analgesia que PCEA sola.
Recientemente se han introducido sistemas automatizados para administrar bolos epidurales a intervalos programables. Chua y Sia (37) asignaron en forma aleatoria a 42 pacientes a recibir una IEC de 5ml/h de ropivacaína 0.1%+2ug fentanilo/ml o Bolos Intermitentes Automáticos (BIA) de la misma solución cada hora. Los pacientes con BIA, tenían una duración mas larga de la analgesia, niveles de dolor más bajos y mayor bloqueo sensitivo que el grupo con infusión continua. Otros estudios comparando infusiones continuas versus bolos intermitentes automáticos, han mostrado resultados similares (38–41).
Wong y colaboradores (42) asignó a nulíparas a recibir Bolos Epidurales Intermitentes Programados (BEIP) de 6ml cada 30 m de bupivacaína 0.625mg/ml y fentanilo 2 ug/ml o IEC de 12ml/h. Ambos grupos tenían una PCEA de la misma solución. Mientras la analgesia durante el trabajo de parto fue similar en los dos grupos, las pacientes con BEIP + PCEA usaron menos dosis de bupivacaína, menos dosis de rescate y tuvieron mayor satisfacción. Capogna y colaboradores (43), usando un esquema similar (pero con levobupivacaína), mostró que los pacientes con BEIP+PCEA tenían menor bloqueo motor y menos partos instrumentales que aquellos tratados con IEC+PCEA. Finalmente George y colaboradores (44) comparó IEC y BEIP en nueve estudios controlados y aleatorios. Los pacientes que recibieron bolos epidurales intermitentes programados tuvieron un menor consumo de anestésicos locales, acortamiento de la segunda etapa del parto y mayor satisfacción materna.
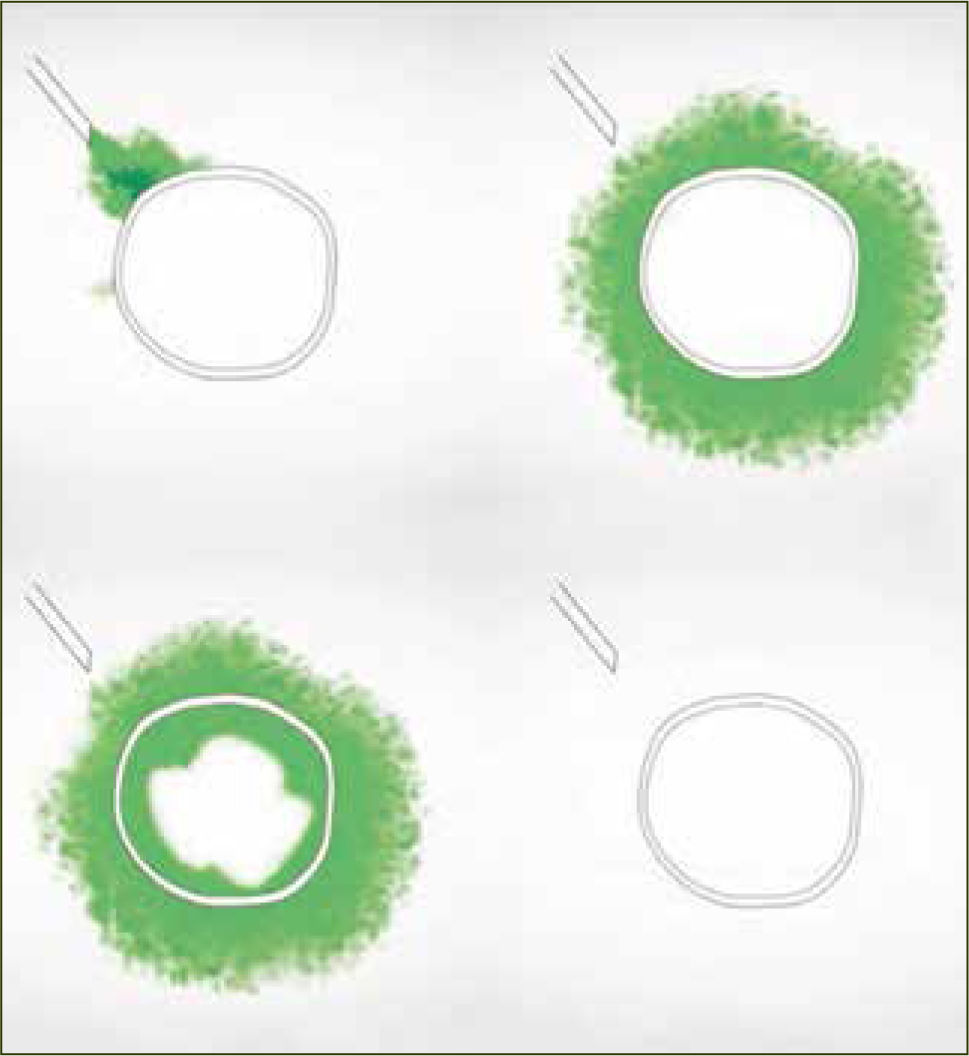
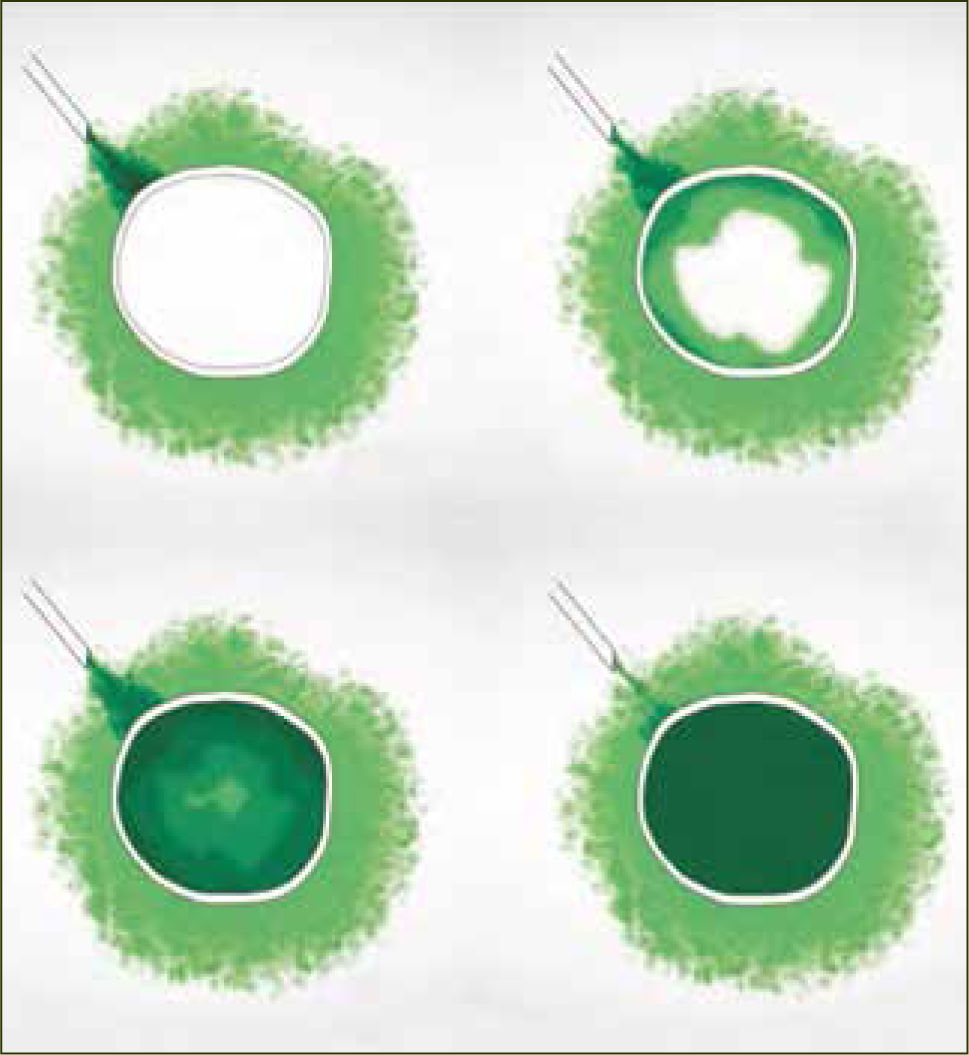
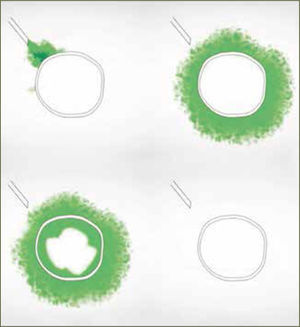
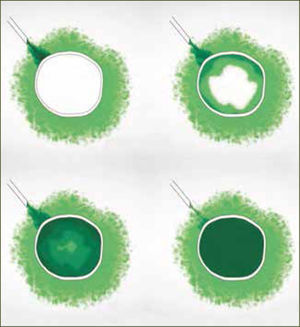
Dos razones explican el mejor desempeño de los bolos sobre la infusión continua. La primera es mecánica. Hay una mayor difusión y ésta es más uniforme cuando existe un aumento agudo de presión (bolo) en la administración del anestésico. La segunda es farmacodinámica y se explica por el movimiento de los anestésicos al interior del nervio, según gradientes de concentración. La analgesia y el bloqueo motor son producidos por el movimiento de anestésicos desde el espacio extraneural hacia el espacio intraneural (nervio) por gradiente de difusión, llegando después de un tiempo, a un equilibrio. El bloqueo revierte cuando la concentración intraneural excede la extraneural y el gradiente de difusión se invierte. Si se dan bajas concentraciones de anestésico local en bolos intermitentes, el bloqueo de fibras motoras es poco probable, ya que la cantidad total de anestésico local en el interior del nervio es insuficiente (figura 2). En el caso de la infusión continua, la concentración extraneural de anestésico local es persistentemente mayor que en el espacio intraneural y la concentración en el interior del nervio aumenta hasta alcanzar el umbral para el bloque de fibra motor (figura 3). Para minimizar el bloqueo motor de las pacientes, se debe usar anestesia combinada o epidural a bajas concentraciones de anestésicos locales, con opiáceos como coadyuvantes y con sistemas de infusión epidural en bolos. Si no se obtiene capacidad de respuesta rápida a la reaparición de dolor en las pacientes, los sistemas automáticos son probablemente la mejor elección.
El efecto de la deambulación sobre el trabajo de parto es controvertido. Una revisión de Cochrane de 2009 (45), encontró que las pacientes que deambulaban tenían un parto más corto (una hora menos en promedio) pero en este grupo utilizaron menos anestesia epidural. De aquellas pacientes que recibieron analgesia epidural, la duración de la primera etapa del trabajo de parto no mostró diferencias entre las que caminaban o no lo hacían. Collis y colaboradores (46) utilizando CEE, no encontró diferencias en requerimientos de analgesia, modo de parto ni duración de la primera etapa del trabajo de parto entre aquellas que deambulaban y las que no lo hacían. Otros estudios (47–49) han mostrado que no hay asociación entre caminar y partos instrumentales o duración del trabajo de parto. Finalmente, Wilson y colaboradores (31), reportó un resultado secundario del estudio COMET. Este vio el efecto de diferentes técnicas a bajas dosis sobre la fuerza, la deambulación y su relación con el modo del parto. Al comparar la fuerza de las extremidades inferiores, todos los índices de función motora fueron mejor mantenidos con CEE. Sin embargo, el porcentaje de mujeres que deambulaban fue el mismo en todos los grupos. A pesar de recibir anestesias “caminantes”, la mayoría de las mujeres preferían quedarse acostadas e independiente del nivel de deambulación no hubo beneficio sobre el modo del parto.
A pesar de estos resultados “no positivos” asociados con la deambulación, aún hay muchas ventajas de una anestesia “caminante”. Aumento en la satisfacción materna, menor densidad del bloqueo motor y sensitivo y reducción en la necesidad de cateterización vesical (50) son algunos hechos positivos al usar menos anestésicos locales (o de manera correcta). Por lo tanto, el objetivo no será que la paciente en trabajo de parto camine. El objetivo es que pueda hacerlo si quiere.
SíntesisLa analgesia para el parto no es fácil. Su complejidad radica en que el resultado es multifactorial. Una buena analgesia sólo será un elemento en la satisfacción materna. Manejar las expectativas de la paciente es un trabajo de equipo, en que matronas, obstetras, neonatólogos y anestesiólogos tienen mucho que decir. La anestesia no juega ningún rol en el alarmante aumento en el número de cesáreas en Chile y en el mundo. Es la obstetricia la llamada a buscar la causa de esto.
La evidencia apoya el hecho de que la anestesia puede comenzar en cualquier momento del trabajo de parto. Lo importante no es la dilatación ni la presentación sino el dolor. Es la madre quien decide cuánto dolor desea sentir y cuándo comenzará la anestesia.
A la paciente que está “sufriendo” por el dolor, siempre se le debe ofrecer la mejor alternativa, que es, sin lugar a dudas, la anestesia regional. Es fundamental explicar que, independiente de la técnica analgésica empleada, será la paciente quien tenga el control. Es ella quien decide cuánto va a sentir, cuánto va a sufrir y lo que eso significa. Hay que otorgarle a la expectativa de la paciente, un lugar importante en la toma de decisiones. Hay que informarle lo que se puede hacer, lo que no se puede y los riesgos. Si a pesar de todo el esfuerzo en explicar las ventajas de la anestesia regional, la paciente tiene dudas o simplemente no la quiere, entonces hay que ofrecerle la mejor alternativa al alcance.
Por otro lado, si la paciente opta por la analgesia regional, se utilizará siempre la menor cantidad de anestésicos, en la mejor forma, con el menor efecto motor y que tenga la menor incidencia de efectos secundarios. Es importante recordar que un leve prurito puede afectar tan negativamente la satisfacción materna tanto como el dolor de un parto sin anestesia. Siempre hay que intentar que la paciente mantenga el control sobre lo que está pasando y responder a sus expectativas, no a la de los médicos. Es importante recordar que todos quienes participan de un parto, incluyendo al anestesiólogo, son simples observadores del evento más maravilloso en la historia de una familia, el nacimiento de un hijo.
Los autores declaran no tener conflictos de interés, en relación a este artículo.