Aproximadamente 1–3% de parejas en edad reproductiva experimentan 3 ó más abortos espontáneos consecutivos, lo que se define como aborto recurrente. La evaluación debe incluir una detallada historia clínica y examen físico, seguida de una serie de exámenes protocolizados destinados a detectar los factores más frecuentemente involucrados en esta patología (anatómico, cromosómico, inmunológico, endocrinológico y trombofílico). El manejo debe basarse en evidencias, evitando tratamientos experimentales o sin sustento científico, e incluyendo siempre un adecuado soporte emocional, tan necesario en estas parejas. A pesar de los esfuerzos por dilucidar los orígenes del aborto recurrente, sigue existiendo un 50% de casos sin causa aparente, los cuales suelen lograr tasas de embarazo exitoso de hasta 70% sin mediar tratamiento médico alguno.
Approximately 1-3% of reproductive age couples experience 3 or more consecutive pregnancy losses, which is known as recurrent pregnancy loss. The evaluation must include a detailed clinical history and physical examination, followed by a diagnostic screening protocol in order to detect the most frequent factors involved in this disorder (anatomic, chromosomic, immunologic endocrinologic and thrombophilic). Management must be evidenced based, avoiding experimental or unproven treatments, and always including an adequate emotional support, so necessary for these couples. In spite of every effort made to find out the origins of recurrent pregnancy loss, 50% of couples remain with unknown diagnosis, however, they may reach up to 70% of successful future pregnancies even without medical treatment.
Se denomina aborto recurrente a cualquier pareja que ha experimentado 3 ó más abortos espontáneos consecutivos antes de las 20 semanas de gestación, utilizándose el término de abortadora recurrente primaria si la pareja no ha tenido embarazos viables entre sí, y abortadora secundaria, si ha existido al menos uno viable previo. Esta definición no es meramente semántica, ya que como veremos más adelante, puede orientar tanto en el estudio como en el pronóstico de fertilidad.
El aborto espontáneo es sin duda la complicación más frecuente de cualquier embarazo, estimándose que un 15% de las gestaciones reconocidas (embarazos clínicos) terminan en aborto, y que aproximadamente el 25% de las mujeres experimentarán un aborto clínico a lo largo de su vida reproductiva (1). Esta cifra aparece subvalorada si consideramos que entre un 30 y 50% de embarazos se detienen precozmente en su desarrollo, los llamados embarazos bioquímicos o subclínicos, que en su mayoría, la mujer no alcanza a reconocer por presentar escaso o ningún atraso menstrual (2). Dichos abortos obedecen principalmente a un desorden cromosómico esporádico de esa gestación en particular y no constituyen un factor de riesgo para embarazos futuros (3). Afortunadamente, sólo el 5% de las parejas en edad reproductiva experimenta 2 abortos espontáneos clínicos consecutivos, y entre 1–3% sufren 3 o más abortos. Esta última cifra es superior a la esperada estadísticamente por azar (0.5%), de lo que se desprende que existe un grupo de parejas más proclives a abortar y que merecen nuestros máximos esfuerzos así como la mayor comprensión para lidiar con el sentimiento de frustración que frecuentemente comparten tanto pacientes como sus médicos tratantes.
La importancia de distinguir entre aborto esporádico y recurrente radica tanto en el pronóstico como en la necesidad de realizar estudios en la pareja. Aquéllas con aborto esporádico tendrán un 80% de éxito en su siguiente embarazo sin mediar tratamiento alguno, no justificándose en general la solicitud de exámenes complementarios. Por el contrario, las parejas con aborto recurrente tendrán sólo 50–60% de éxito global en su siguiente embarazo no tratado, siendo múltiples los factores que pudieran condicionar el mal resultado reproductivo, y que es preciso investigar (4).
Factores asociadosExisten factores generales que aumentan el riesgo de aborto en cualquier gestación y al menos 5 grupos de factores específicos asociados a aborto recurrente. El peso porcentual de cada uno de ellos en el universo de abortos recurrentes es difícil de establecer con precisión dado el sesgo que representan las distintas líneas de investigación de las experiencias publicadas.
Dentro de los factores generales destacan la exposición a tabaco y otros tóxicos ambientales, la obesidad materna, la edad materna, el pasado reproductivo y la edad gestacional (5). La exposición a tabaco eleva el riesgo de aborto en 1.4 a 1.8 veces (6) e incluye a las fumadoras pasivas, que ven su riesgo aumentado en 1.52 a 2.18 veces (7). Por otro lado, el consumo de más de un trago de alcohol al día o la ingesta de más de 375mg diarios de cafeína, equivalentes a 3 tazas de café, se asocia a riesgos ajustados de aborto de 4.84 (2.87 – 8.16) y 2.21 (1.53 – 3.18), respectivamente (8).
Una clara asociación han descrito diversos autores entre obesidad materna y el riesgo de aborto (9) tanto esporádico (1.2; 1.01–1.46) como recurrente (3.5; 1.03–12.01). Esto se respalda a su vez en la conocida mayor probabilidad de aborto que tienen las mujeres portadoras de síndrome de ovario poliquístico, sobre todo aquellas con sobrepeso e insulino resistencia (10).
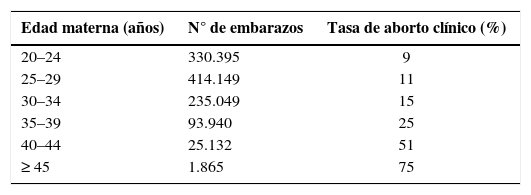
La edad materna es sin duda el factor de riesgo de mayor peso para aborto hasta ahora conocido. Existe una fuerte relación entre mayor edad y deterioro de la calidad ovocitaria, lo que determina una mayor predisposición al establecimiento de gestaciones aneuploides que evolucionan, las más de las veces, hacia el aborto espontáneo (11). A modo de ejemplo, se describen tasas de aborto clínico de 9–15% en mujeres menores de 35 años y de 51–75% en las mayores de 40 años, como aparece representado en la Tabla 1 (12). Si se incluyen los abortos subclínicos, las tasas son aún superiores, fluctuando entre 22% y 57% para el grupo etáreo menor a 35 años (3).
Edad materna y tasa de aborto clínico (12)
| Edad materna (años) | N° de embarazos | Tasa de aborto clínico (%) |
|---|---|---|
| 20–24 | 330.395 | 9 |
| 25–29 | 414.149 | 11 |
| 30–34 | 235.049 | 15 |
| 35–39 | 93.940 | 25 |
| 40–44 | 25.132 | 51 |
| ≥ 45 | 1.865 | 75 |
El pasado reproductivo también debe ser tomado en consideración al momento de estudiar y tratar a una pareja que consulta por aborto recurrente. Un gran estudio prospectivo realizado en mujeres fértiles mostró una tasa global de aborto clínico espontáneo de 12%, sin embargo dicha tasa fue de 24% en mujeres que sólo habían experimentado abortos y tan baja como 4% o 5% en primigestas y multíparas, respectivamente (13). A medida que aumenta el número de abortos previos, mayor es la probabilidad de presentar un nuevo aborto, no obstante, el haber tenido uno o más hijos vivos disminuye dicho riesgo en pacientes con 2 o más abortos, como se grafica en la Tabla 2 (14)
Tasa de aborto clínico espontáneo según el número de abortos previos y la presencia o no de nacidos vivos previos (14)
| N° de abortos previos | Tasa de aborto clínico % (sin nacidos vivos) | Tasa de aborto clínico (%) (con nacidos vivos) |
|---|---|---|
| 0 | 12.3 | 12.3 |
| 1 | 19 | 23.7 |
| 2 | 35 | 26.2 |
| 3 | 47 | 32.2 |
Cabe destacar que la mayoría de los abortos clínicos espontáneos ocurren en las primeras semanas de embarazo (5 a 8 semanas de gestación) siendo mayor la probabilidad de aberraciones cromosómicas cuanto más precoz se presente el aborto (15). Se estima que 56% de dichas anormalidades corresponden a trisomías (principalmente 13, 15, 16, 21 y 22), 20% a poliploidías, 18% a monosomías X y 4% a translocaciones no balanceadas. Por el contrario, la frecuencia de anomalías cromosómicas en abortos de segundo trimestre representa sólo el 5.6% (16). Es deseable por ende, contar con análisis citogenético del tejido abortado, particularmente a partir del segundo aborto. Reconociendo que el estudio puede tener limitaciones como fallas de cultivo o contaminación con células maternas, si el resultado arroja una trisomía, no se requiere mayor investigación en la pareja y se considera que el aborto ocurrió por azar, sobre todo en mujeres de avanzada edad reproductiva. Por el contrario, se hace imprescindible estudiar a parejas con abortos euploides o con traslocaciones desbalanceadas ya que en ellas podría estar presente alguno de los factores específicos asociados con aborto a repetición y cuya incidencia se estima en:
Pese a los grandes avances en medicina reproductiva, el aborto recurrente sigue siendo un frecuente dolor de cabeza para los equipos tratantes, siendo numerosas las parejas estudiadas a quienes no se les encuentra ningún factor reconocible. Este grupo, llamado abortadoras recurrentes idiopáticas, tiene sin embargo un excelente pronóstico, exhibiendo una probabilidad de embarazo que bordea el 70% en un futuro cercano (17). En ese sentido, es preciso reforzar en la pareja la necesidad de identificar factores susceptibles de modificar, pero a su vez, entregarle un mensaje positivo cuando éstos no se encuentran (“No news is good news”).
a)Factores GenéticosLa necesidad de solicitar cariotipo de ambos progenitores en parejas con aborto recurrente radica en que 2.5 a 8% son portadores de un desorden genético estructural, especialmente translocaciones balanceadas o Robertsonianas (18). Esto es especialmente válido en parejas con aborto recurrente primario y en aquéllas en que el estudio citogenético del tejido abortado evidenció una traslocación desbalanceada. Característicamente, dichos individuos son fenotípicamente normales y pueden manifestarse exclusivamente con infertilidad, aborto esporádico o recurrente, muerte fetal o antecedente de feto/recién nacido polimalformado. El consejo genético es imprescindible en estos casos dado la alta probabilidad de aborto en las siguientes gestaciones, que alcanza 72.4% en el caso de mujeres afectadas y 61.1% cuando el hombre es el portador (19). El uso de fertilización in vitro con diagnóstico genético preimplantacional (PGD) puede constituir una herramienta útil en el manejo de parejas portadoras de translocaciones balanceadas con fallas repetidas de implantación o aborto recurrente (20, 21). No obstante, más allá del dilema ético que representa no transferir embriones portadores de translocaciones potencialmente viables, está el hecho que estas parejas no necesitan recurrir a fertilización in vitro para concebir, que su tasa de embarazo viable espontáneo puede ser superior a la alcanzada con fertilización in vitro y que la técnica de PGD no está exenta de riesgos para el embrión (22).
b)Factores AnatómicosLa incompetencia cervical y algunas malformaciones uterinas representan causas congénitas o adquiridas corregibles de aborto a repetición. La historia de aborto en bloque de segundo trimestre sin trabajo de aborto reconocido es altamente sugerente de incompetencia cervical, como lo son también, el hallazgo de herniación pasiva de membranas ovulares al ultrasonido (“funneling”) y el endocérvix dilatado en situación no gestante que permite el paso de un dilatador de Hegar N° 8 sin esfuerzo (23). Las pacientes pueden presentar esta condición secundaria a traumatismos cervicales, como desgarros post parto y conización, o como ocurre en la mayoría de los casos, corresponder a una alteración primaria cervical que se descubre en el primer embarazo. Una forma factible de detectar esta anomalía es mediante histerosalpingografía, en la cual se observa un canal endocervical muy amplio y con abundante reflujo del medio de contraste. En cualquier caso, es la sospecha clínica ante una historia sugerente la que más pesa al momento de decidir si realizar o no un cerclaje. Las técnicas más usadas para cerclajes electivos son las vaginales de McDonald y de Shirodkar, siendo el primero el más empleado por su simpleza y buenos resultados (24). Para cerclajes de emergencia, en pacientes con modificaciones cervicales y herniación de membranas, la vía abdominal está también descrita, requiriendo sin embargo, un operador experimentado dado su mayor riesgo y técnica más compleja (25). Ante diagnósticos dudosos se recomienda optar por un cerclaje entre las 12 y 16 semanas de gestación, considerando el riesgo cercano al 100% de pérdida fetal en casos de incompetencia cervical no tratados. Este margen para la realización de la cirugía ofrece las ventajas de haber seleccionado ya un feto viable y encontrarse aún con un cérvix fácil de maniobrar. En cualquier forma, el cerclaje debe ser retirado cumplidas las 36 semanas, ante trabajo de parto y ante sospecha de infección intrauterina (24).
Las malformaciones müllerianas que pueden asociarse a fallas reproductivas son las anomalías mayores producidas por defecto en la reabsorción septal, conocido como útero septado, y los defectos en la fusión de los conductos de Müller, como el útero didelfo, si es completo, o el útero bicorne o unicorne, si hubo fusión parcial. Al respecto, es reconocido que sólo el útero septado se correlaciona con aborto recurrente, mientras que los úteros didelfo, bicorne y unicorne se asocian a parto prematuro y menos frecuentemente a abortos de segundo trimestre (26). Esta última asociación ha sido también descrita para el grado menor de defecto de reabsorción septal denominado útero arcuato, sin embargo se sustenta en un sólo trabajo hasta ahora publicado (27). Se calcula que 2.3% de las mujeres en edad fértil son portadoras de alguna de estas anomalías, siendo el útero septado la más frecuente (1.6%), seguida del bicorne (0.4%).No obstante, estas cifras pueden ser muy superiores en grupos seleccionados de mujeres con falla reproductiva o si se incluye el útero arcuato, que para muchos, sólo constituye una variante anatómica normal. Para su diagnóstico, sigue siendo útil la histerosalpingografía que mostrará una cavidad uterina dividida con dos cuellos independientes en el caso del útero didelfo, una cavidad elongada y lateralizada en los úteros unicornes o una cavidad indentada con forma de V en los úteros bicornes y septados. En estos últimos, el diagnóstico diferencial se realiza mediante laparoscopía, que confirmará un fondo uterino con una depresión central en el útero bicorne y que le da un aspecto típicamente acorazonado, en oposición al útero septado, que tendrá una configuración externa normal. En el mismo acto quirúrgico se procederá a la remoción del séptum mediante técnica histeroscópica (resectoscopía). Los defectos de fusión no deben ser corregidos pues las secuelas post metroplastía suelen ser peores que la evolución espontánea de la malformación. Recientemente, la utilización del ultrasonido tridimensional y la resonancia nuclear magnétcia han ido desplazando rápidamente a la histerosalpingografía como método diagnóstico de anomalías müllerianas en países desarrollados (28). Estos exámenes ofrecen la ventaja de ser menos invasivos y más cómodos para la paciente, sin embargo, su alto costo es todavía una limitante para su uso masivo en nuestro medio.
Un grupo de defectos anatómicos adquiridos corregibles que pueden asociarse a aborto y fallas de implantación recurrentes son las sinequias uterinas, los miomas submucosos y los pólipos endometriales. La remoción histeroscópica de dichas lesiones podría mejorar el pronóstico de parejas con aborto recurrente basado en escasos trabajos no controlados con placebo (5, 29).
Finalmente, un defecto congénito afortunadamente en extinción, es el útero hipoplástico en forma de T ocasionado por la exposición in útero a dietilestilbestrol. Dicha anomalía se asociaba a aborto a repetición y mal resultado reproductivo, recomendándose cerclaje profiláctico con regulares resultados (30).
c)Factores EndocrinológicosPor mucho tiempo se han atribuido los abortos como secundarios a un déficit de progesterona, conocido como defecto de fase lútea o cuerpo lúteo insuficiente. Hasta la fecha, son controversiales los estudios que apoyan la existencia de un defecto primario del cuerpo lúteo como causa de aborto a repetición, estimándose más bien que la baja producción de progesterona es la consecuencia y no la causa del aborto (31). Tradicionalmente, se ha considerado sospechoso de insuficiencia lútea una duración de dicha fase inferior a 12 días, una medición de progesterona plasmática en fase lútea media menor a 10ng/ml o la sumatoria de 3 mediciones inferior a 30ng/dl, fijándose como gold standard la biopsia endometrial en fase lútea media desfasada por más de 2 días (32). No obstante, siguiendo ese criterio, hasta 31% de pacientes fértiles pueden tener una fase lútea desfasada, y hasta 50% de mujeres con criterios histológicos de defecto de fase lútea tienen simultáneamente niveles normales de progesterona plasmática, lo que pone en duda el real significado del hallazgo (31, 33). La mayoría de las veces, el defecto de fase lútea es consecuencia de una fase folicular insuficiente, secundaria a una hiperprolactinemia, una disfunción tiroídea o anovulación crónica, que al ser corregidas, normalizarán la función lútea (32). Hasta ahora el apoyo de fase lútea con progesterona oral, vaginal o intramuscular ha resultado equivalente a la estimulación lútea con hCG en bajas dosis (34) y sólo ha demostrado utilidad en mujeres con aborto recurrente idiopático según la reciente revisión Cochrane (35). En los casos indicados, se recomienda iniciar precozmente el apoyo de fase lútea y mantenerlo hasta la octava semana de gestación (décima de amenorrea) cuando se trata de embarazos viables.
El hipotiroidismo no tratado puede elevar el riesgo de aborto, razón por la cual resulta de suma utilidad solicitar estudio de TSH en toda paciente con historia de aborto recurrente (36). Pese a la mayor frecuencia reportada en algunos estudios de anticuerpos antitiroideos antimicrosomales y antitiroglobulina en mujeres con aborto a repetición (37), se recomienda tratar sólo a mujeres hipotiroideas, no existiendo evidencia de beneficio para pacientes eutiroideas (29, 38). Estas últimas, sin embargo, tienen mayor riesgo de desarrollar hipotiroidismo durante el embarazo por lo que es recomendable monitorizar con TSH en cada trimestre de la gestación.
La hiperprolactinemia es otra patología endocrina corregible de aborto a repetición, que provoca alteración del eje hipotálamo-hipofisiario-gonadal y por ende, tanto foliculogénesis como fase lútea insuficiente. La medición de prolactina en ayunas al inicio del ciclo menstrual y el uso de bromocriptina o cabergolina en pacientes con resultados elevados ha demostrado un beneficio en mujeres con aborto a repetición (39).
La diabetes mellitus constituye un factor de riesgo para aborto y malformaciones fetales sólo cuando existe un mal control metabólico, por lo que no se justifica el screening con hemoglobina glicosilada en pacientes asintomáticas o con glicemias basales normales (40). A su vez, se recomienda lograr euglicemia en aquéllas afectadas, antes de exponerse a embarazo (41).
Por último, mujeres portadoras de síndrome de ovario poliquístico, especialmente con insulino resitencia, también pueden ver aumentado su riesgo de padecer aborto a repetición (42). Por esta razón, el uso de insulino sensibilizadores asociado a dieta y mantención del peso corporal resultan de suma utilidad en pacientes con esta condición (43).
d)Factores InmunológicosDurante el embarazo son numerosos los cambios en la respuesta inmune que experimenta la mujer ante la presencia del embrión. Pese a que éste hereda antígenos de ambos progenitores, normalmente no es rechazado por la madre debido a una modulación de la inmunidad, más que a una supresión propiamente tal (44, 45). Al respecto, se han descrito múltiples mecanismos por los cuales el embrión podría estar protegido durante el embarazo, como la falta de expresión trofoblástica de antígenos del complejo mayor de histocompatibilidad (CMH la), la respuesta inmune humoral con predominio de expresión de citokinas del tipo Th2 (interleukinas 3, 4, 5, 10 y 13) en lugar de una respuesta citotóxica del tipo TH1 (interleukina 2, factor de necrosis tumoral alfa y beta, interferon gamma), la disminución de expresión de céulas NK a nivel endometrial, la producción de ligandos apoptóticos como el sistema Fas/FasL que impedirían la acción citotóxica de células inmunes activadas, la presencia de anticuerpos bloqueadores, etc. Desgraciadamente, no se dispone de suficiente evidencia para solicitar el estudio rutinario de factores inmunológicos en parejas con aborto recurrente, mucho menos para recomendar tratamientos, como la inmunización con leucocitos paternos, con linfocitos de donante o con membranas trofoblásticas, o el uso de inmunoglobulina intravenosa, pues su eficacia todavía no ha sido probada (46, 47). El uso de corticoesteroides tampoco está indicado en pacientes con aborto recurrente y anticuerpos antinucleares positivos, a menos que existan criterios clínicos de actividad de artritis reumatoidea. De hecho, su uso se ha asociado a un aumento de complicaciones maternas y fetales, sin demostrarse efecto positivo en las tasas de recién nacido vivo (48).
Donde sí existe suficiente evidencia para sustentar el estudio y tratamiento de causas autoinmunes de aborto recurrente es en el síndrome antifosfolípido (SAF) (29). Esta condición podrían presentarla cerca del 15% de las parejas con aborto recurrente, existiendo consenso que para su diagnóstico es necesario reconocer al menos un criterio clínico y uno de laboratorio, resumidos en la tabla 3 (49).
Diagnóstico de síndrome antifosfolípido (49)
Criterios Clínicos
|
Criterios de Laboratorio
|
Los mecanismos por los cuales el SAF se asocia a pérdidas embrionarias y fetales incluyen una disminución de la fusión, diferenciación e invasión trofoblástica así como trombosis progresiva e infartos placentarios (50, 51). El tratamiento que ha evidenciado hasta ahora una mayor tasa de recién nacidos vivos en pacientes con aborto recurrente y SAF es la combinación de ácido acetilsalicílico en bajas dosis más heparina no fraccionada, con la que se reporta una disminución de 54% en la tasa de abortos (52). El uso de heparina de bajo peso molecular ha demostrado hasta la fecha, ser equivalente pero no superior, a la heparina no fraccionada (53, 54). Se estima que hasta un 90% de las gestaciones con síndrome antifosfolípidos no tratadas terminará en aborto, por lo que se recomienda sólo suspender la terapia periparto y restablecerla en el puerperio inmediato (55). Un comentario aparte merecen las pacientes portadoras de lupus eritematoso sistémico, dado su elevado riesgo de aborto espontáneo y recurrente, particularmente aquéllas con anticuerpos antifosfolípidos positivos, marcador que se encuentra presente en 37% de ellas (56).
e)Factores TrombofílicosRecientemente han acaparado la atención un grupo de factores congénitos o adquiridos conocidos como trombofilias que aumentan el riesgo de desarrollar fenómenos trombóticos y de producir abortos secundarios a un estado de hipercoagulabilidad (57). Este tema está tocado in extenso en otro capítulo de esta revista por lo que me remitiré a mencionar que hasta 8% de abortos recurrentes podrían asociarse a una trombofilia, siendo las más frecuentes la hiperhomocisteinemia, el Factor V de Leiden y la resistencia a la proteína C activada. El uso de ácido fólico en altas dosis junto a vitamina B6 y B12 es el tratamiento de elección para la hiperhomocisteinemia (58), mientras que la tromboprofilaxis con heparina es lo propuesto para las otras trombofilias, no obstante se requieren aún más estudios prospectivos randomizados para sustentar su real beneficio (59)
e)OtrosSi bien algunos cuadros infecciosos genitales o sistémicos pueden producir aborto esporádico, no existen evidencias para vincular a infecciones vaginales, virales ni parasitarias como la causa de abortos a repetición (60).
También es discutible la asociación entre factor masculino y aborto recurrente, sin embargo algunos autores han mostrado una mayor prevalencia de abortos a repetición en casos de teratospermia, lo que justificaría solicitar un espermiograma dentro del estudio de estas parejas (61).
Hay numerosos trabajos de investigación en curso que pretenden responder la incógnita de los abortos recurrentes idiopáticos, con líneas tan interesantes como el déficit de expresión de moléculas necesarias para la implantación a nivel endometrial (62) y la disminución en la perfusión uterina peri y post implantación (63). El problema principal que plantean los grupos estudiados es la dificultad en seleccionar pacientes que compartan similares condiciones y la alta tasa de éxito espontáneo en las pacientes con aborto recurrente idiopático (50–60%), lo que hace cuestionable el éxito atribuido a los tratamientos propuestos muchas veces como efectivos.
Estudio Sugerido para Parejas con Aborto Recurrentea)Si es abortadora primaria, solicitar–Cariotipo de ambos miembros de la pareja.
–Histerosalpingografía.
–Estudio de ciclo con biopsia endometrial o progesterona en fase lútea media.
–Prolactina, TSH.
–Anticuerpos antcardiolipinas y anticoagulante lúpico.
–Homocisteina.
–Espermiograma.
–Histerosalpingografía sólo si ha existido parto prematuro previo o traumatismos endometriales (legrados, cirugías).
–Cariotipo sólo si ha existido un niño malformado o portador de anomalías cromosómicas.
–Los otros estudios de abortadora primaria aplican por igual.
–Estudio de trombofilia (proteína C, factor V Leiden, Antitrombina III).
–Anti β2GP1IgG e IgM.
–Estudio de insulino resistencia en el contexto de ovario poliquístico.
Apoyo emociona
He dejado a propósito para el final un aspecto que debe tenerse siempre en consideración, y es el hecho de que estas parejas están viviendo una situación extremadamente estresante. Cada embarazo representa una nueva esperanza, una nueva posibilidad de cumplir sus sueños, pero por sobre todo, un enorme temor a volver a fracasar. Los abortos son vividos como un duelo, que no podemos minimizar, pues no existe proporcionalidad entre la edad gestacional de la pérdida y la magnitud del dolor humano. Por otro lado, es frecuente que se subvalore el sufrimiento del otro miembro de la pareja, quien suele adoptar la posición de fuerte para sostener al que está aparentemente más afectado. Un apoyo emocional brindado por especialistas en el tema (psicólogos, terapeutas familiares) es altamente recomendable para ambos.
El médico tratante debe tener presente todos estos aspectos para desarrollar una relación empática con la pareja, facilitándoles avanzar en el estudio de los factores asociados, brindándoles confianza para aventurarse en otro embarazo, o en casos de mal pronóstico, ayudándolos a desistir de la idea como una decisión madura. Es importante reforzarle a las parejas que el tiempo empleado no ha sido en vano, como tampoco la experiencia vivida, por dura que parezca, que el futuro es promisorio en la mayoría de los casos, y que probablemente habrá contribuido en su aprendizaje como padres.
El autor declara no tener conflictos de interés, en relación a este artículo.