Las micosis invasivas causadas por hongos filamentosos afectan principalmente a pacientes que presentan alteraciones de la inmunidad. Esta revisión se centra en la patogenia de tales micosis causadas por los principales hongos filamentosos productores de infecciones fúngicas invasivas en el ser humano (mucorales y especies de Aspergillus, Fusarium y Scedosporium). Para ello se detallan procesos clave como el contacto inicial entre el huésped y el hongo, la interacción del hongo con las mucosas, la activación del sistema inmune innato y adaptativo, el papel de los receptores más importantes de la respuesta inmune, los factores genéticos del huésped y otros como los determinantes de virulencia de las diferentes especies fúngicas.
Invasive fungal infections caused by filamentous fungi are devastating diseases that occur in patients with a variety of immunosuppressive conditions. This review focuses on the pathogenesis of the most important invasive mycosis in the human being caused by the filamentous fungi Aspergillus, Fusarium, Scedosporium and mucorales. The first contact between the mould and the patient, the host defense to different fungi, including the role of mucosa in the innate immune system, the whole innate immune recognition receptors, and the pathways connecting innate and adaptive immunity, as well as the virulence factors of fungi, are discussed in this paper.
Los hongos filamentosos son ubicuos en la naturaleza. A pesar de ello, el riesgo de padecer una infección fúngica invasiva (IFI) causada por un hongo filamentoso es prácticamente inexistente en la población sana. Esto se debe a que el sistema inmune protege frente al desarrollo de estas micosis invasivas. Sin embargo, las IFI son frecuentes en los pacientes inmunodeprimidos17,21,23,41,48,67. De hecho, el aumento de la incidencia de micosis invasivas en los últimos años está relacionado con el incremento de la población inmunodeprimida en los países desarrollados, especialmente en pacientes neutropénicos con cáncer y en pacientes que han recibido un trasplante de órgano sólido o de progenitores hematopoyéticos.
Las micosis causadas por hongos filamentosos ocasionan una elevada morbimortalidad en la población inmunodeprimida42,48, así como un consumo elevado de recursos para su prevención, diagnóstico y tratamiento: en los pacientes que padecen una IFI la estancia hospitalaria se alarga y el gasto sanitario se multiplica en casi 3 veces44. El conocimiento de la patogenia de los hongos filamentosos, así como de la respuesta inmunitaria del huésped frente a la agresión, se postula como una herramienta imprescindible para optimizar el manejo de estas infecciones.
Solo una mínima proporción de hongos filamentosos tienen capacidad para ser patógenos en el ser humano. En la actualidad, las micosis invasivas más frecuentes son aquellas causadas por las especies de Aspergillus, principalmente Aspergillus fumigatus, y con menor frecuencia Aspergillus flavus, Aspergillus niger y Aspergillus terreus16,23,58. En los últimos años parece existir un aumento de las infecciones por otros hongos filamentosos, en especial los mucorales, especies de Fusarium y de Scedosporium. Los hongos del orden Mucorales clínicamente más relevantes son los pertenecientes a los géneros Rhizopus, Mucor, Rhizomucor y Absidia; son más raras y excepcionales las IFI causadas por los géneros Cunninghamella, Saksenaea y Syncephalastrum36.
El objeto de esta revisión es detallar la patogénesis de las micosis invasivas causadas por estos hongos filamentosos y la respuesta inmunitaria del huésped frente a tales infecciones, así como describir las peculiaridades del huésped y los factores de virulencia de los hongos que facilitan la infección. Para ello, describiremos los procesos que acontecen según este orden: 1) contacto inicial entre el huésped y el hongo; 2) interacción del hongo con el primer mecanismo de defensa del huésped: las mucosas; 3) activación de la primera respuesta inmunitaria: la respuesta del sistema inmune innato; 4) detalle de los receptores más importantes que activan la respuesta inmune; 5) activación de la respuesta inmune adaptativa; 6) lisis del hongo; 7) factores genéticos del huésped predisponentes a las IFI, y 8) mecanismos de virulencia de los diferentes hongos filamentosos.
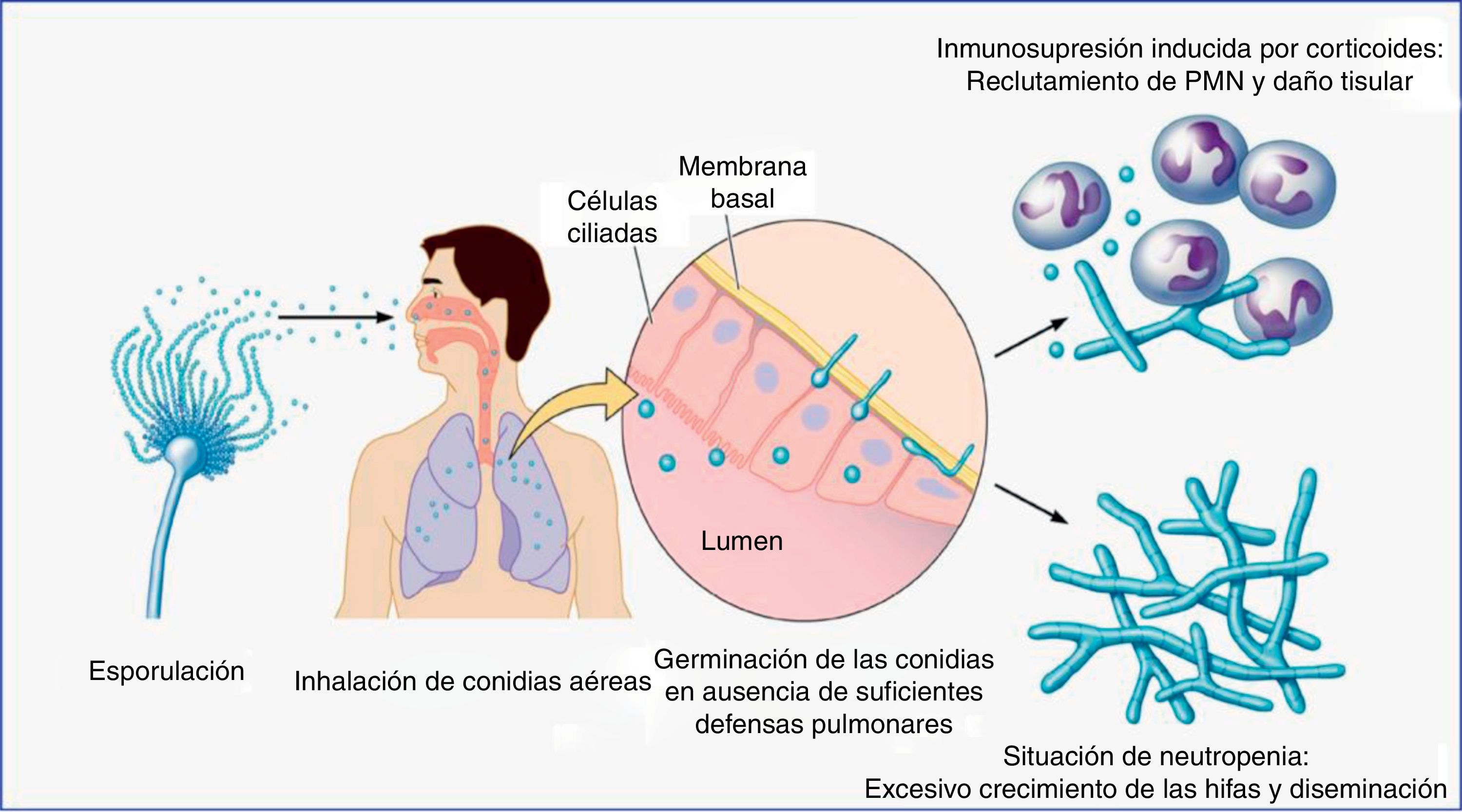
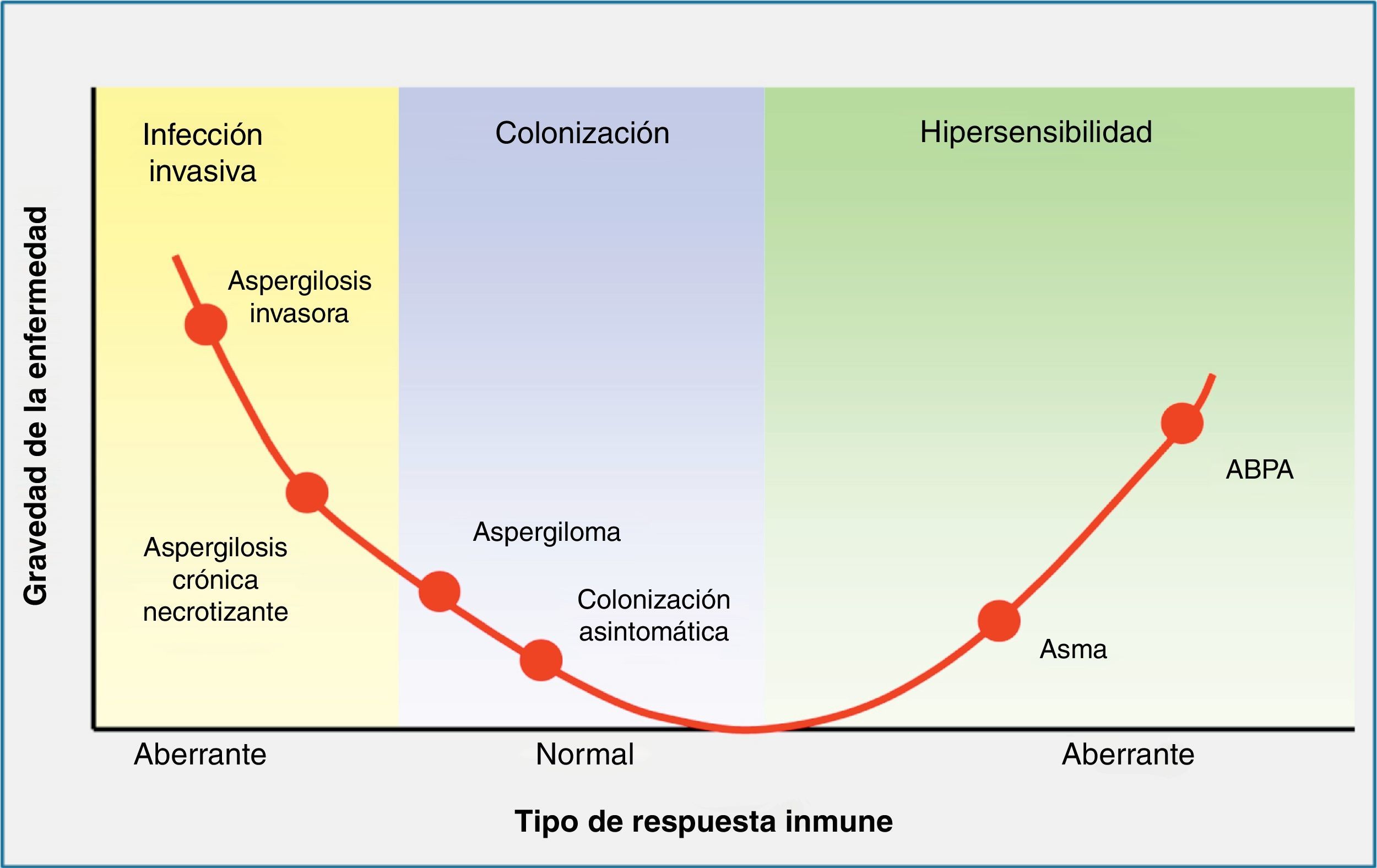
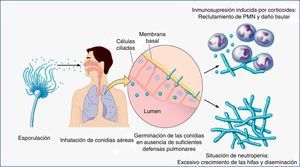
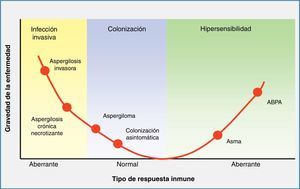
Contacto entre el huésped y los hongos filamentososEl principal nicho ecológico del género Aspergillus es la tierra, el agua, las hojas, las semillas y el abono. Este hongo tiene un ciclo biológico muy simple, en el cual se forman esporas para su reproducción, y tras la germinación de las mismas se forman las hifas, que serán las formas invasivas del hongo. En la fase inicial de la patogenia de Aspergillus participan las esporas (fig. 1). La simplicidad del ciclo biológico confiere al hongo una alta capacidad de esporulación y, como consecuencia, la presencia de concentraciones altas de esporas en el aire. En un ambiente en el cual se remueve el hábitat de Aspergillus, como pueden ser obras de construcción o de remodelación, se elevará considerablemente el número de esporas por metro cúbico en el ambiente. La inhalación de estas esporas constituye la vía más frecuente de infección24. Aunque la inhalación de estas esporas por el ser humano es muy frecuente, habitualmente no producen ninguna enfermedad, al ser eliminadas eficientemente por el sistema inmunitario. Sin embargo, en algunos huéspedes, las esporas tienen mayor facilidad para alcanzar el tracto respiratorio inferior y, entonces, su tamaño reducido permite que se depositen en el alvéolo. Una vez acumuladas, y, de nuevo, dependiendo de la respuesta inmune del huésped, se puede producir un amplio espectro de enfermedades, tales como manifestaciones alérgicas (aspergilosis broncopulmonar alérgica), más frecuentes en el huésped inmunocompetente, la formación de masas fúngicas (aspergilomas) que observaremos en pacientes con cavidades pulmonares preexistentes, y la enfermedad invasiva, característica del huésped inmunodeprimido (fig. 2).
Ciclo de vida infeccioso del género Aspergillus en su interacción con los principales tipos de pacientes inmunodeprimidos (neutropénicos y trasplantados en terapia con corticoides u otros inmunosupresores).
PMN: leucocitos polimorfonucleares.
Figura adaptada de Dagenais y Keller16.
Los hongos mucorales suelen crecer en sustratos orgánicos (frutas, suelo, estiércol, etc.). En ocasiones contaminan superficies de materiales inertes31. El espectro de enfermedades asociadas a estos hongos es muy heterogéneo. Según la puerta de entrada pueden causar infecciones respiratorias invasivas graves, tras la inhalación de pequeñas esporas por la vía respiratoria, o lesiones cutáneas o mucocutáneas necrosantes extensas tras la inoculación directa en piel o mucosas alteradas (caso de la mucormicosis en heridas de grandes quemados, y las formas palatorrinosinusales). Desde aquí pueden extenderse por contigüidad causando invasión de estructuras orgánicas parenquimatosas o viscerales (corazón, ojo, cerebro, etc.). En ocasiones, las esporangiosporas acceden a las mucosas del tracto digestivo inferior produciendo formas de mucormicosis intraabdominales. Los géneros Fusarium y Scedosporium se encuentran habitualmente en el suelo y la materia orgánica, pudiendo causar enfermedad en los pacientes más inmunodeprimidos tras inoculación directa o inhalación de sus esporas14.
Respuesta inicial del huésped: el papel de las mucosasLa barrera anatómica que constituyen el epitelio respiratorio y la piel es el primer mecanismo de defensa frente a la infección fúngica por hongos filamentosos. Las defensas mucociliares, en especial los macrófagos alveolares, son la primera línea de defensa fagocítica frente a las esporas inhaladas. Estudios recientes enfatizan el importante papel que juega el surfactante pulmonar frente a la infección por Aspergillus al disminuir la interacción del hongo con el huésped y reducir la inflamación consecuente18. Las células del epitelio respiratorio son las primeras en activar directamente la respuesta inmune innata tras el contacto con las esporas de Aspergillus a través de la secreción de interferón-β6.
La respuesta de las mucosas frente a otros hongos filamentosos ha sido menos estudiada. Los macrófagos de los alvéolos pulmonares son las células básicas para la respuesta del huésped frente a los mucorales. Tal es su importancia que los huéspedes con gran inmunosupresión pero con conservación de la función de los macrófagos alveolares, como pueden ser los pacientes con infección avanzada por el VIH, no suelen padecer mucormicosis pulmonar. No obstante, en pacientes infectados por el VIH con adicción a drogas por vía parenteral se han descrito formas de mucormicosis cerebral sin afectación pulmonar clínica, pero en estos casos constituye un factor de riesgo mayor la metodología de la drogadicción que la propia inmunodepresión. Por otro lado, aunque los mucorales son incapaces de penetrar a través de la piel sana, atraviesan con facilidad los tegumentos en pacientes con disrupciones cutáneas tales como grandes quemaduras, traumatismos o maceraciones, incluso en pacientes inmunocompetentes. Ante un inóculo especialmente elevado de estos hongos, como puede acontecer en situaciones extremas de grandes catástrofes medioambientales (tsunamis, tornados, inundaciones, etc.), las infecciones cutáneas necrosantes por mucorales son posiblemente esperadas y relativamente frecuentes, incluso en pacientes inmunocompetentes25,43.
Aunque las fases iniciales de la interacción de especies de Fusarium y Scedosporium con el huésped son poco conocidas, se sabe que la fagocitosis inicial de estos hongos es muy parecida a la respuesta ofrecida frente a la infección por Aspergillus14.
Respuesta inmune innata del huésped frente a la infección por hongos filamentososCuando el hongo es capaz de invadir las mucosas, se activa la respuesta del huésped mediada por las células del sistema inmune innato, en concreto las células dendríticas, los monocitos, los neutrófilos y los mediadores solubles, tales como el complemento o diferentes grupos de péptidos. Todas estas moléculas juegan un papel primordial tanto en la destrucción inicial del hongo como en la activación de las posteriores etapas de la respuesta inmunitaria. Los macrófagos y los monocitos tienen una acción esencial en la fagocitación y la muerte de las esporas, impidiendo así su transición a las formas invasivas de las hifas. Los neutrófilos son imprescindibles en la respuesta del huésped frente a aquellas formas del moho que ya han iniciado el proceso de germinación y frente a las hifas.
Hoy en día se conoce que la respuesta inmune innata es muy específica46. Esta respuesta se activa por un conjunto limitado de receptores solubles y celulares denominados receptores reconocedores de patrones (RRP). Estos receptores reconocen una serie de patrones moleculares comunes y constantes presentes en los microorganismos patógenos conocidos con el nombre de patrones moleculares asociados a patógenos (PMAP). Los PMAP presentan una serie de propiedades muy características: son específicos del microorganismo y no se encuentran presentes en las células del huésped, son invariables entre diferentes especies, lo que permite que con un número limitado de RRP se detecte la presencia de cualquier patógeno, y, por último, son esenciales para la supervivencia o patogenicidad del microorganismo, por lo que permanecen inquebrantables, pudiendo ser reconocidos por los RRP. La activación de los RRP conlleva una doble función: 1) se impulsan distintos procesos característicos del sistema inmune innato, como pueden ser la fagocitosis o la opsonización, y 2) se establece una conexión entre la inmunidad innata y la adquirida.
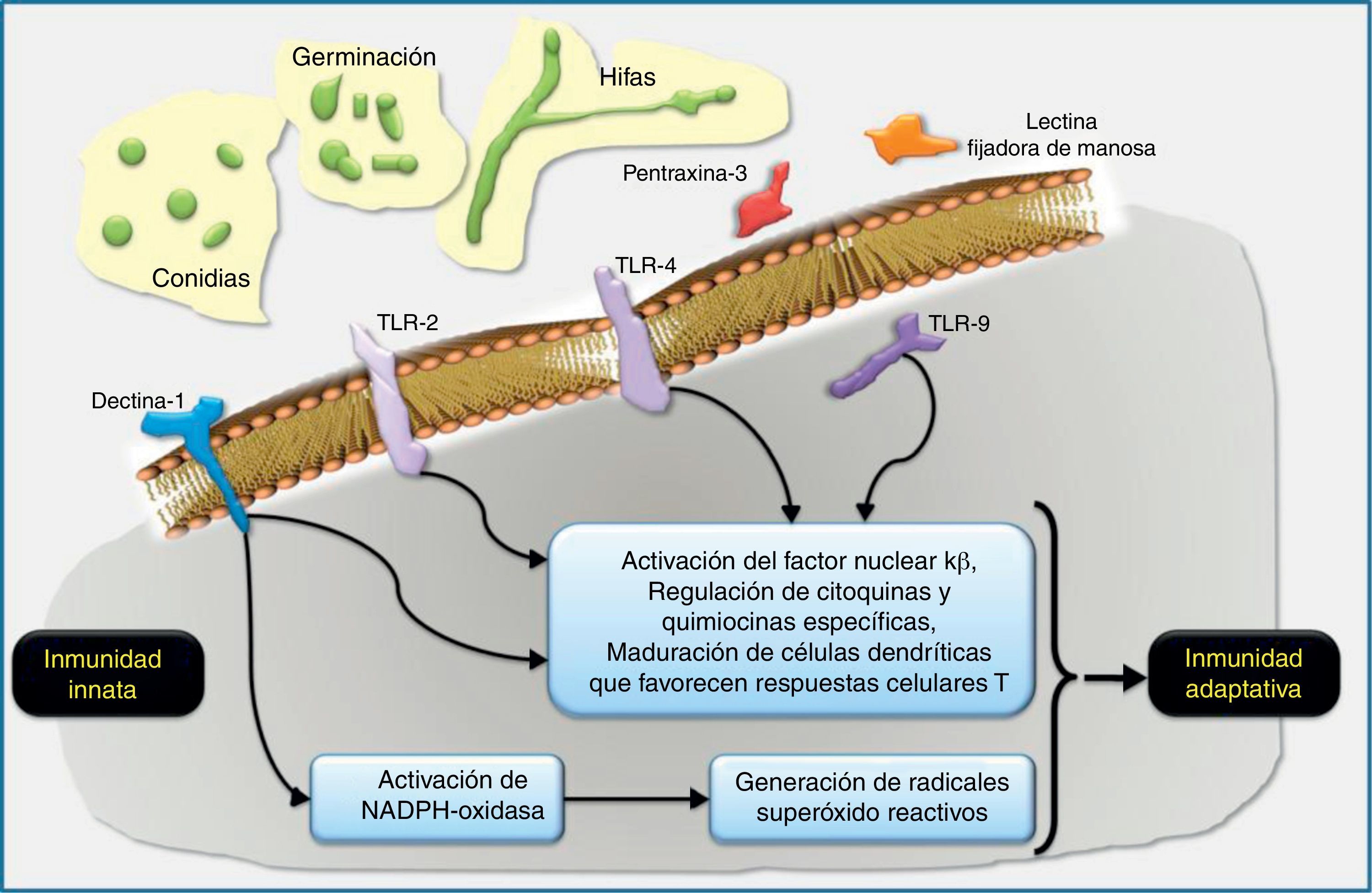
Los PMAP más importantes de los hongos filamentosos son el manano, el β-glucano y la quitina. El RRP soluble más importante en la respuesta del huésped frente a los hongos filamentosos es la pentraxina-3, mientras que los RRP celulares más importantes son las lectinas (en especial la dectina-1), los Toll-like receptors (TLR, «receptores tipo Toll») y los receptores tipo NOD, incluyendo el complejo del inflamasoma46.
Receptores reconocedores de patrones de los hongos filamentososLas lectinas son una familia de receptores solubles o transmembranarios que reconocen mayoritariamente el manano y el glucano49. La lectina más importantes en la defensa del huésped frente a los hongos filamentosos es la dectina-119,49, la cual es específica para los β-glucanos presentes en la pared celular de los hongos. Este receptor aumenta de manera considerable su expresión cuando el huésped está continuamente expuesto a los hongos filamentosos11. La activación de la dectina-1 favorece la fagocitosis del hongo por las células del sistema inmune, inicia la cascada inflamatoria de citocinas, juega un papel clave en el balance de la respuesta del linfocito T helper (Th)1/Th1754 y activa procesos oxidativos, como, por ejemplo, los mediados por la NADPH-oxidasa11,62. Las respuestas inmunitarias tipo Th1 se encargan fundamentalmente de intentar disminuir la carga fúngica, por diversos mecanismos y a través de citocinas de señalización como el interferón-γ, mientras que las respuestas Th17 son necesarias para incrementar la expresión de mediadores favorecedores del reclutamiento de neutrófilos.
La pentraxina-3 es secretada por macrófagos y células epiteliales durante la infección por Aspergillus; se une al galactomanano y causa la fijación de las conidias. Este paso es muy importante debido a que los neutrófilos tienen mayor capacidad para eliminar los complejos conidia-pentraxina-3 que para destruir las conidias por sí solas45.
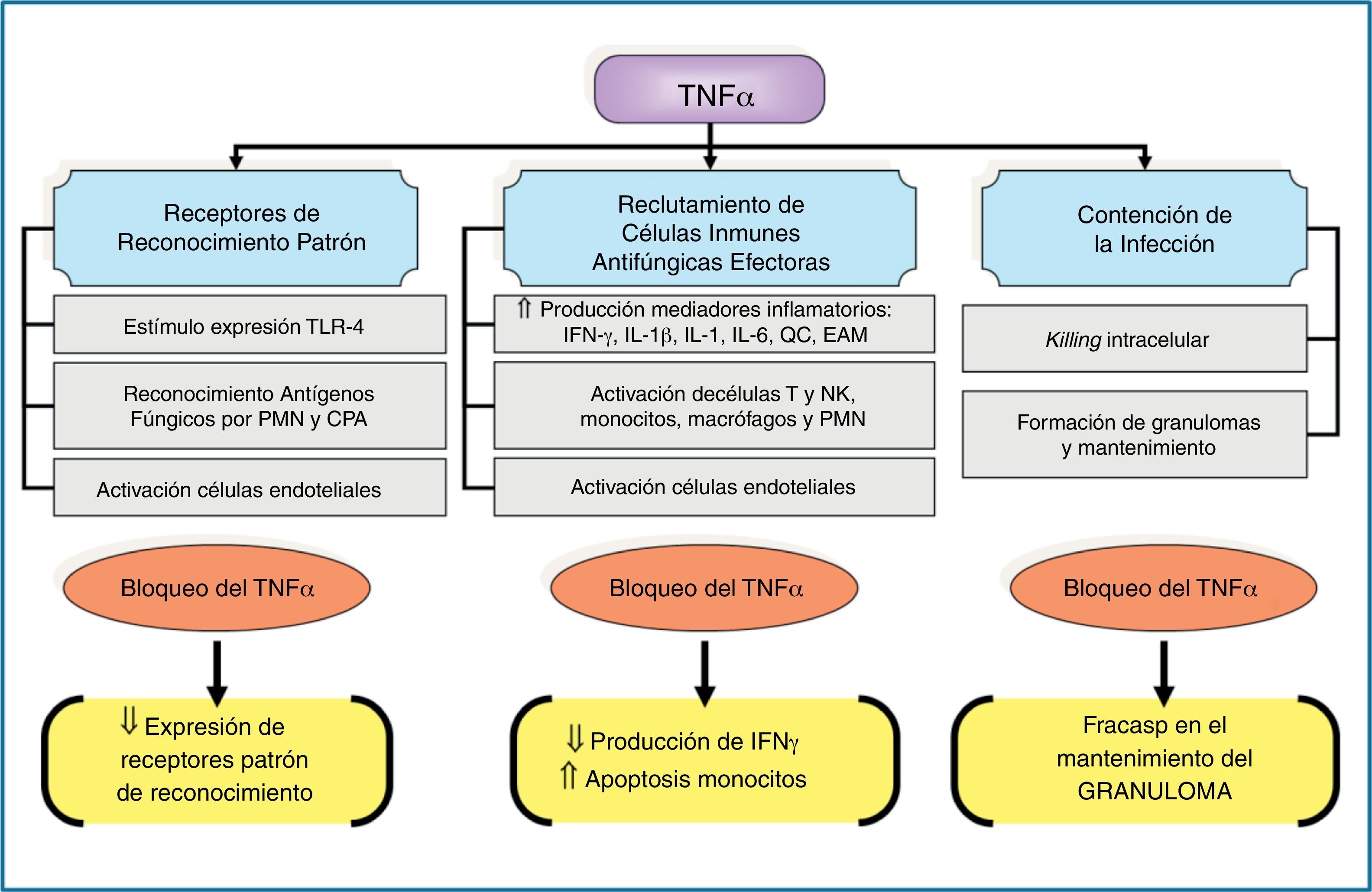
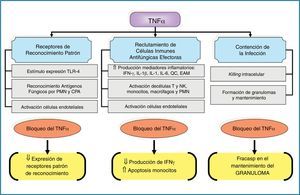
Los TLR son un conjunto de proteínas transmembranarias de tipo i que presentan un dominio extracelular que se une al patógeno y un dominio citoplasmático que será el encargado de detonar la respuesta de activación del receptor. Estos receptores interaccionan con diferentes proteínas, entre las que destaca por su papel regulador la MyD88, un adaptador de señalización de los TLR hacia la promoción de las respuestas incentivadoras de citocinas proinflamatorias. El papel de estos receptores en la defensa del huésped frente a la infección fúngica se conoce desde hace muchos años22, y algunos polimorfismos genéticos se han asociado a tener un mayor riesgo de aspergilosis invasiva9,12. Hasta el momento se conocen diferentes tipos de TLR. Aquellos más vinculados a la respuesta del huésped frente a la infección por hongos filamentosos son el TLR2/6, el TLR4, el TLR3 y el TLR99,60,68. La activación de cada receptor mediará en respuestas totalmente diferentes, aunque, por ahora, no queda muy claro qué PMAP de los diferentes hongos filamentosos son los reconocidos por cada tipo de TLR. Algunos estudios, en su mayoría in vitro, evidencian que la activación del TLR4 por Aspergillus genera una respuesta de citocinas proinflamatorias (factor de necrosis tumoral-α, interleucina [IL]-1, IL-12, IL-15, e interferón-γ) que se asocian a un efecto de protección frente a la infección. Los efectos inmunomoduladores del factor de necrosis tumoral-α son claves en la inmunidad antifúngica y los resumimos en la figura 3. De esta respuesta de citocinas se generará una respuesta adaptativa mediada por los linfocitos Th1. Por el contrario, la activación del TLR2 favorece una respuesta de citocinas predominantemente antiinflamatoria, mediada por IL-10 e IL-4 y, como consecuencia, promueve una respuesta del sistema inmune adaptativo mediada por los linfocitos Th2, relacionados con una mayor susceptibilidad a padecer IFI. Se cree que los mucorales solo son reconocidos por los TLR de tipo 213.
Principales efectos inmunomoduladores del factor de necrosis tumoral-α asociados a los mecanismos innatos de inmunidad antifúngica.
CPA: células presentadoras de antígenos; EAM: moléculas de adhesión endotelial; IFN-γ: interferón-γ; IL: interleucina; NK: células natural killer; PMN: leucocitos polimorfonucleares; QC: quórum control; TLR: receptores tipo Toll; TNF-α: factor de necrosis tumoral-α; ⇓: disminución; ⇑: incremento.
Finalmente, los receptores tipo NOD activan la vía de las caspasas. El receptor NOD-2 se ha vinculado recientemente con la respuesta del huésped frente a Aspergillus39. Los inflamasomas intracelulares son un complejo molecular que incluye el receptor NOD tipo NLRP1, que se postula como uno de los receptores más importantes en la defensa del huésped frente a la infección fúngica28,61,63,64.
El reconocimiento de los hongos filamentosos por los RRP es un proceso muy complejo y dinámico en el cual diferentes moléculas interaccionan entre ellas de forma simultánea. Los estudios más recientes evidencian que todos estos receptores se comunican entre sí y optimizan su función según las indicaciones de los receptores contiguos20,40. El reto en la investigación de IFI de los próximos años será poder extrapolar todo el conocimiento que adquirimos en el laboratorio, en su mayoría desde procesos purificados, a lo que puede ocurrir en tiempo real en un paciente determinado, en el cual una importante red de respuestas bioquímicas y de señalización molecular se mezclan entre sí para combatir conjuntamente y defenderse frente a la infección causada por hongos filamentosos.
Una vez reconocidos los hongos filamentosos por los diferentes receptores se promueven dos importantes fenómenos. El primero es la producción de citocinas, con el fin de activar la respuesta inmune adaptativa, que origina una respuesta inmunitaria más contundente y el establecimiento de la denominada memoria inmunológica. El segundo es el inicio de diferentes procesos perniciosos que tienen como objetivo la muerte directa del hongo.
Activación de la respuesta inmune adaptativaLas células del sistema inmune adaptativo son los linfocitos T, que generan la respuesta inmunitaria mediada por células, y las células linfocitarias B, encargadas de la respuesta inmune humoral mediada por anticuerpos. En la aspergilosis invasiva la inmunidad celular es clave, mientras que el papel de la inmunidad humoral es menos conocido y, por ahora, secundario, siendo tal vez más relevante su función en el caso de algunos hongos levaduriformes (como Candida) con afectación de mucosas.
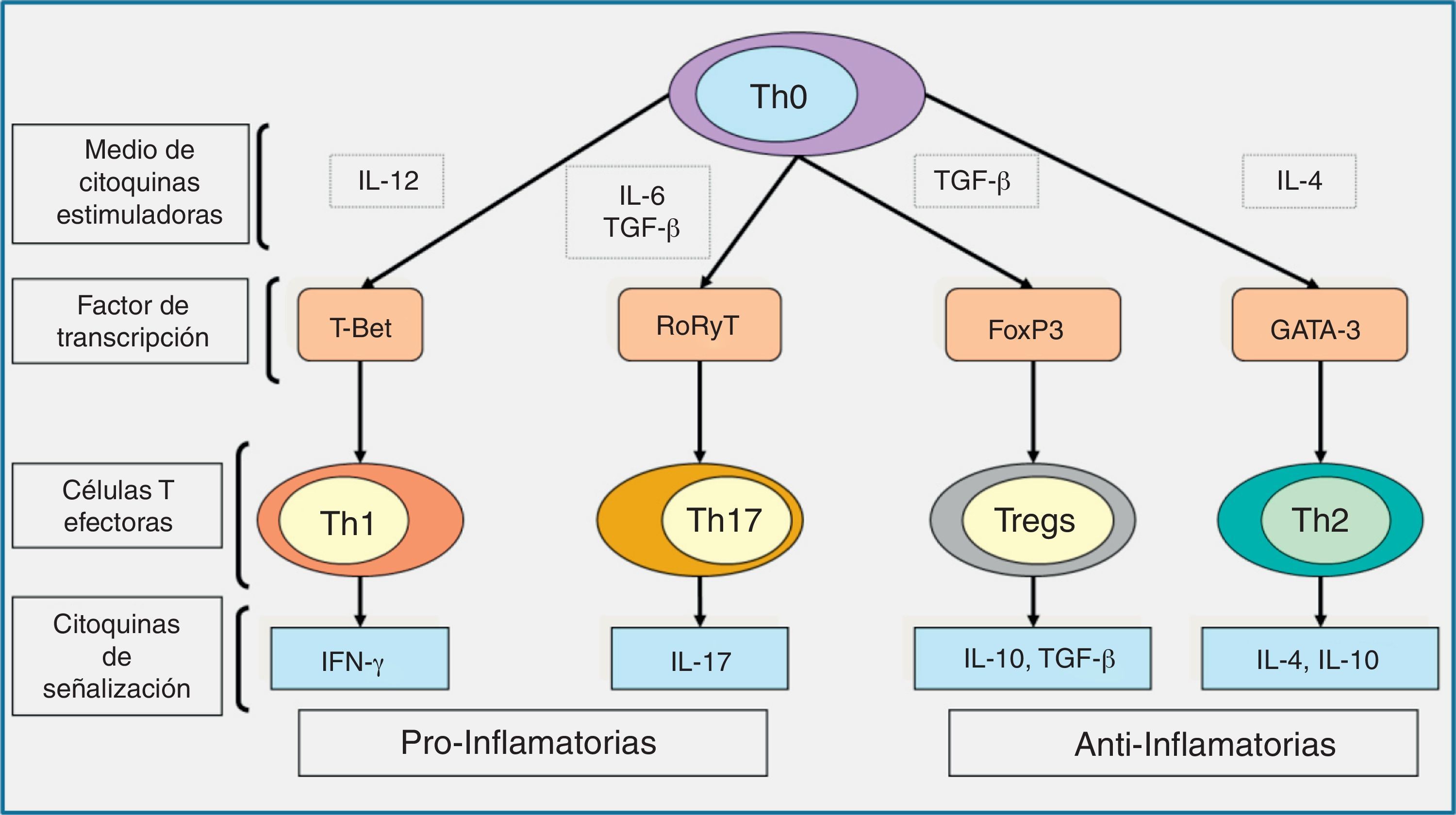
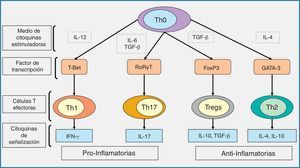
La respuesta inmune adaptativa se inicia con el reconocimiento de antígenos que pertenecen al microorganismo invasivo durante un proceso llamado «presentación de los antígenos». En este proceso es básica la acción de las células dendríticas10,24,60. Las células dendríticas detectan, reconocen y procesan el antígeno. Como consecuencia de estos procesos se activa la secreción de diferentes citocinas que inician la respuesta mediada por los linfocitos T. Estos se encargan de regular y amplificar la respuesta del huésped frente a la infección causada por los hongos filamentosos. De esta manera se enlaza la respuesta del sistema inmune innato y el adaptativo. Dependiendo del antígeno presentado, las células dendríticas promueven la diferenciación de los linfocitos Th en distintas líneas de respuesta linfocitaria, como son los Th1, Th2, Th17 o T reguladores. La respuesta mediada por las células Th1 se asocia con la producción de citocinas proinflamatorias, interferón-γ, IL-6, e IL-12, que son esenciales para la protección frente a la infección fúngica16,22,58–60 y de otros microorganismos oportunistas capaces de inducir la formación de respuestas granulomatosas (como las micobacterias, especialmente). La respuesta Th2 se asocia a la secreción de citocinas antiinflamatorias, como IL-4, IL-5 e IL-10, que clásicamente se ha relacionado con una respuesta inadecuada del huésped frente a la infección (fig. 4). Sin embargo, estudios recientes han demostrado que la respuesta Th2 también se asocia a una secreción de IL-33, que optimiza la capacidad fungicida de los neutrófilos colaborando en la expresión de diferentes RRP38.
Diagrama esquemático representando las líneas de diferenciación de las células T y las citocinas de señalización que promueven.Dependiendo del entorno de las citocinas estimuladoras (IL-12, TGF-β más IL-6, TGF-β, o IL-4), las células T cooperadoras naives o precursoras (Th0) se desarrollan en respuestas linfocitarias de tipo Th1, Th17, Treg o células Th2, respectivamente, a través de la expresión de sus factores de transcripción específicos, como son T-Bet, RoRyT, FoxP3 y la GATA-3, respectivamente; IFN-γ e IL-17 son las citocinas de señalización de las células Th1 y Th17, respectivamente, y median las respuestas proinflamatorias, mientras que la producción de TGF-β y las IL-10 e IL-4 por las células Treg y Th2 median las respuestas antiinflamatorias.
FoxP3: foxhead box protein; GATA-3: GATA binding protein; IFN-γ: interferón-γ; IL: interleucina; RoR: retinoid orphan receptor; TGF: factor de crecimiento transformante; Th: linfocito T helper; Treg: células T reguladoras.
El equilibrio entre las respuestas Th1/Th2, actualmente de forma mucho más compleja con el balance global de Th1-Th17 versus Th2-T reguladores, es un proceso dinámico del que depende la resistencia a la infección que es capaz de ofrecer el huésped, pero también del que depende la respuesta inflamatoria colateral de los tejidos. Esta actividad es particularmente importante ya que la inflamación de los tejidos del huésped juega un papel clave en la patogenia de los hongos50. En esta línea de investigación algunos estudios demuestran que la respuesta inflamatoria mediada por la IL-6 y el factor de necrosis tumoral-α es mayor como respuesta a Rhizopus oryzae o a diferentes especies de Scedosporium, que como respuesta a las diferentes especies de Aspergillus65.
Como ya hemos comentado, además de los linfocitos Th1 y Th2, en los últimos años se ha descubierto la importancia de la respuesta mediada por los linfocitos Th17 en la defensa del huésped frente a la infección fúngica. Esta expresión es muy importante en las mucosas, y en especial en la defensa frente a la infección por levaduras del género Candida. La información disponible en el momento actual sobre la relación entre los linfocitos Th17 y la respuesta frente a la infección fúngica por hongos filamentosos es escasa. Finalmente, el papel de la inmunidad adquirida de tipo humoral en la defensa frente a hongos filamentosos no está bien establecido.
Lisis del hongoLa eliminación del hongo se produce tanto por la acción del sistema inmune innato como del adaptativo (fig. 5). Como se ha explicado previamente, las células del sistema inmune innato fagocitan las diferentes formas fúngicas y, según se trate de una espora o de una hifa, se activan diferentes procesos70. Los macrófagos destruyen las esporas principalmente mediante procesos de oxidación o de acidificación32,51,66. En los neutrófilos, los procesos de oxidación son los que tienen una mayor relevancia. Dentro de los procesos oxidativos destacan, por la importancia que tienen frente a la infección por Aspergillus, aquellos que son mediados por la NADPH-oxidasa53. Con la activación de esta enzima se producen diferentes reacciones en cadena que finalizan en la formación de radicales libres con capacidad antimicrobiana. De hecho, la carencia de esta enzima, como es el déficit congénito que presentan los pacientes con enfermedad granulomatosa crónica, se asocia a un elevado riesgo de padecer aspergilosis invasiva. La acción de la NADPH-oxidasa acontece especialmente en los neutrófilos y frente a las hifas. La NADPH-oxidasa tiene también otras funciones periféricas, como la inhibición de la respuesta inflamatoria inducida por los componentes de la pared celular del hongo47,56. Además de la acción de la NADPH-oxidasa, los neutrófilos utilizan otros mecanismos oxidativos para eliminar las partículas fúngicas. En la destrucción de los mucorales son de especial importancia aquellos procesos mediados por la producción del anión superóxido4,30.
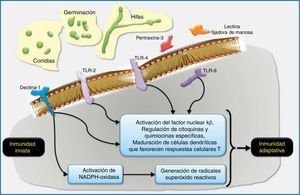
Esquema de la respuesta inmune innata a los géneros de hongos filamentosos inhalados, especialmente Aspergillus.
Los macrófagos alveolares y las células epiteliales respiratorias son las primeras células del huésped en el pulmón que interaccionan con las conidias de Aspergillus. Los receptores reconocedores de patrones (RRP) localizados sobre las células huésped, como son la dectina-1 y los Toll-like receptors (TLR, «receptores tipo Toll»), y algunos RRP solubles, como la pentraxina-3 y las lectinas fijadoras de manosa, reconocen dianas fúngicas específicas. Por ejemplo, los β-glucanos de la pared celular fúngica son fijados por el TLR2 y la dectina-1, y el ADN de Aspergillus contiene secuencias CpG no metiladas que son fijadas por el TLR9. El reconocimiento y fijación de los RRP conduce generalmente a la inducción de quimiocinas que activarían y seleccionarían neutrófilos y otras células inflamatorias. La NADPH-oxidasa puede ser activada por la dectina-1 y potencialmente primada por otros RRP como el TLR4. La activación de la NADPH-oxidasa conllevaría la generación de radicales óxido reactivos intermediarios que en los neutrófilos se acoplarían a la activación de proteasas granulocíticas antimicrobianas. Las células dendríticas también reconocerían los patrones característicos de Aspergillus a través de RRP y estimularían respuestas dependientes de antígenos en las células T helpers (Th) y en las células T reguladoras (Treg). El diálogo cruzado entre células dendríticas y células T en la regulación del desarrollo de las células T es un área de investigación intensa muy interesante que es ampliamente relevante en la defensa del huésped, en la alergia y en el desarrollo de vacunas.
Algunos factores humorales también participan en la respuesta inmune innata del huésped frente a los hongos filamentosos52,69. El sistema del complemento actúa frente a las diferentes formas y estados del hongo, ya sea por su vía alterna (que reconoce y elimina esporas) o por la clásica (que reconoce las formas en germinación y las hifas)34. A pesar de la importancia de estos constituyentes humorales, los factores predisponentes de micosis invasivas suelen estar en relación con una disfunción del sistema inmunitario de fagocitosis y no en relación con defectos de la inmunidad humoral.
Factores genéticos del huéspedPreviamente ha sido comentado que diferentes polimorfismos genéticos de los RRP se asocian con un mayor o menor riesgo de padecer micosis invasivas. Los TLR2 (en cooperación con TLR1 y TLR6), TLR3, TLR4 y TLR9, junto con los receptores de lectinas de tipo C y las moléculas de adhesión intercelulares específicas de células dendríticas, los receptores de manosa y la dectina-1, se encuentran entre los RRP que reconocen los PMAP fúngicos como el manano, el β-glucano y los ácidos nucleicos. Este reconocimiento fúngico es posteriormente asistido por la acción de colectinas, ficolinas, pentraxinas y componentes del complemento que actúan como opsoninas y facilitan la interacción de los fagocitos con el hongo. Los RRP de mamíferos son también capaces de responder a productos liberados de las células dañadas del huésped, incluyendo ácidos nucleicos y un tipo especial de proteínas, denominadas alarminas, lo que colectivamente se ha denominado patrones moleculares asociados a daño o peligro. La inesperada convergencia de las vías moleculares mediadas por los PMAP y los patrones moleculares asociados a daño o peligro eleva la pregunta de cuándo y cómo el huésped discriminaría entre ellos y la implicación relativa de cada uno sobre la inflamación, la homeostasis inmune y los mecanismos de reparación durante la infección. Recientes evidencias han demostrado que el sistema inmune distingue respuestas inmunes inducidas por los hongos o por los peligros, un mecanismo dependiente de la regulación temporoespacial de los TLR y del receptor para la glicación avanzada de productos terminales (RAGE) por la alarmina S100B.
Por consiguiente, los genes que participan en la respuesta inmunitaria del huésped frente a las infecciones fúngicas son múltiples y afectan a diferentes niveles de acción15. El uso de la tecnología de microarray ha permitido identificar los genes que regulan la respuesta frente a especies de Aspergillus y mucorales en voluntarios sanos. La mayoría de los genes identificados se corresponden con proteínas básicas para la formación de citocinas. Por ello, muchas de las variantes genéticas descritas que se han asociado con un riesgo incrementado de padecer aspergilosis invasiva u otra IFI por hongos filamentosos en determinados tipos de pacientes (oncohematológicos, trasplantados con progenitores hematopoyéticos), asientan sobre los polimorfismos de un solo nucleótico de genes ya conocidos, habiéndose llegado a determinar en algunas de ellas el cambio de aminoácidos subyacente y el mecanismo más probable.
La respuesta inmunitaria frente a Aspergillus genera la activación de cuatro veces más genes que la respuesta frente a los mucorales55. También se ha documentado que solo un 5% de la activación de genes en la respuesta frente a estas dos especies de hongos filamentosos es compartida, mientras que el resto es activación genética específica de género o especie. Uno de los retos de investigación más importantes para el futuro será determinar la correlación entre estas diferencias observadas a nivel genético, la respuesta inmunitaria que ocurre en nuestros pacientes in vivo, y cómo todo ello nos puede ayudar en el diagnóstico y tratamiento de estas IFI.
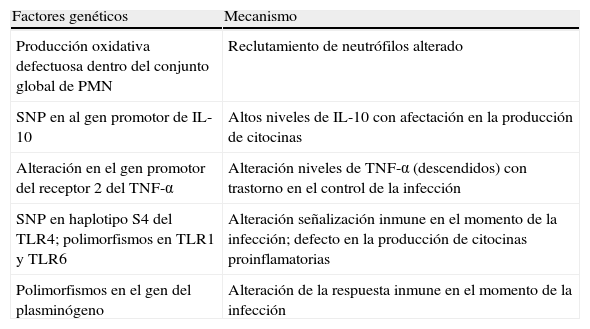
En la tabla 1 se exponen algunos de los factores genéticos relacionados con el huésped que tienen influencia en la susceptibilidad a padecer IFI y sus posibles mecanismos subyacentes.
Factores genéticos relacionados con el huésped que influyen sobre la susceptibilidad a padecer infecciones fúngicas invasivas y sus posibles mecanismos subyacentes
| Factores genéticos | Mecanismo |
| Producción oxidativa defectuosa dentro del conjunto global de PMN | Reclutamiento de neutrófilos alterado |
| SNP en al gen promotor de IL-10 | Altos niveles de IL-10 con afectación en la producción de citocinas |
| Alteración en el gen promotor del receptor 2 del TNF-α | Alteración niveles de TNF-α (descendidos) con trastorno en el control de la infección |
| SNP en haplotipo S4 del TLR4; polimorfismos en TLR1 y TLR6 | Alteración señalización inmune en el momento de la infección; defecto en la producción de citocinas proinflamatorias |
| Polimorfismos en el gen del plasminógeno | Alteración de la respuesta inmune en el momento de la infección |
IL: interleucina; PMN: leucocitos polimorfonucleares; SNP: polimorfismos de un solo nucleótido; TLR: Toll-like receptors («receptores tipo Toll»); TNF-α: factor de necrosis tumoral-α.
La patogenia de las IFI por hongos filamentosos también está condicionada por diferentes factores de virulencia directamente relacionados con el hongo1. Algunos factores de virulencia son comunes, pero otros son específicos de orden o género, por ello, según la morfología, la especie o el estado de crecimiento, la activación del sistema inmune será diferente37.
En el género Aspergillus, A. fumigatus presenta unas características especiales que optimizan su capacidad para producir IFI en el ser humano, causando cerca del 90% de las aspergilosis invasivas, con un 45-90% de mortalidad. Se ha postulado la existencia de factores de virulencia característicos, pero en A. fumigatus existe una gran variabilidad de factores de virulencia «no clásicos». Todos los estudios han demostrado que la virulencia de este hongo es multifactorial, asociada a su estructura, su capacidad de crecimiento y adaptación a condiciones de estrés, sus mecanismos de evasión del sistema inmune y su capacidad de causar daños en un huésped. Son varios los genes y moléculas que intervienen en el desarrollo de la aspergilosis invasiva. Entre estas características destaca que el tamaño de las esporas (de 2 a 3μm) es ideal para profundizar en la vía respiratoria y alcanzar los alvéolos pulmonares, mientras que el mayor tamaño de las esporas del resto de las especies facilita su eliminación por parte de los cilios de la mucosa del epitelio respiratorio. Además, A. fumigatus es más termotolerante que otras especies, y puede crecer a temperaturas que oscilan entre los 37 y los 50°C, lo que le permite desarrollarse en condiciones medioambientales muy extremas. De hecho, se ha especulado con que el desarrollo a altas temperaturas de A. fumigatus puede inducir la expresión de genes que confieren especial virulencia a las cepas. El grupo de la termotolerancia incluye cinco genes relacionados con la capacidad de que el hongo crezca a más de 30°C (thtA, cgrA, afpmt1, kre2/afmnt1 y hsp1/asp f12). De todas maneras, aún hoy no existe una clara evidencia científica que sustente esta teoría. Otra característica de A. fumigatus que le confiere una mayor facultad de producir infección invasiva, comparada con otras especies de Aspergillus, es la capacidad de germinación del hongo. Esta capacidad germinativa es similar a 30°C en las diferentes especies de Aspergillus, pero entre 37 y 40°C es mucho mayor en la especie A. fumigatus4.
Existen otros factores de virulencia comunes del género Aspergillus que facilitan la invasión del huésped. Aspergillus puede secretar toxinas (gliotoxina) que son capaces de actuar en el momento crucial de la patogénesis, cuando el hongo coloniza el epitelio mucoso e interacciona con el huésped5. Estas toxinas tienen la capacidad de ralentizar el movimiento ciliar y lesionar el epitelio del tracto respiratorio. Otros factores de virulencia, tales como las elastasas, las catalasas, las hemolisinas o las proteasas, actúan en etapas posteriores de la interacción entre microorganismo y huésped, interfiriendo en la capacidad de defensa del sistema inmune de este29.
Entre aquellas moléculas y genes que se asocian a la interacción entre A. fumigatus y el huésped y su respuesta inmune se incluyen el β-glucano, el α-glucano, la quitina, el galactomanano, galactomanoproteínas (afmp1/asp f17 y afmp2), hidrofobinas (rodA/hyp1 y rodB), la DHN-melanina, sus respectivas enzimas sintasas (fks1, rho1-4, ags1-3, chsA-G, och1-4, mnn9, van1, anp1, glfA, pksP/alb1, arp1, arp2, abr1, abr2 y ayg1) y enzimas modificantes (gel1-7, bgt1, eng1, ecm33, afpigA, afpmt1-2, afpmt4, kre2/afmnt1, afmnt2-3, afcwh41 y pmi), varias enzimas relacionadas con la protección del estrés oxidativo como catalasas (catA, cat1/catB, cat2/katG, catC y catE), superóxido-dismutasas (sod1-2, sod3/asp f6 y sod4), oxigenasas de ácidos grasos (ppoA-C), glutatión-transferasas (gstA-E) y otras (afyap1, skn7 y pes1), además de los transportadores de moléculas (mdr1-4, atrF, abcA-E y msfA-E).
Como se ha comentado, Aspergillus también exhibe y disfruta de toxinas y de los genes relacionados, como la sustancia difusible de conidios, la gliotoxina (gliP y gliZ), la mitogilina (asp f1/mitF/res), la hemolisina (aspHS), la festuclavina y la fumigaclavina A-C, la fumitremorgina, el verruculógeno, la fumagilina, el ácido helvólico, las aflatoxinas B1 y G1, y la eA. No se pueden olvidar los genes y moléculas relacionados con la absorción de nutrientes, la señalización y las regulaciones metabólicas implicadas en la virulencia, incluyendo enzimas, como las serín-proteasas (alp/aspf13, alp2 y asp f18), metaloproteasas (mep/asp f5, mepB y mep20), asparticoproteasas (pep/asp f10, pep2 y ctsD), dipeptidilpeptidasas (dppIV y dppV) y fosfolipasas (plb1-3 y fosfolipasaC); sideróforos y la adquisición de hierro (sidA-GsreA, ftrA, fetC, mirB-C y amcA), que a continuación será comentado; adquisición de cinc (zrfA-H, zafA y pacC); biosíntesis de aminoácidos, absorción de nitrógeno y regulación por cross-pathway control (areA, rhbA, mcsA, lysF, cpcA/gcn4p y cpcC/gcn2p); vías de biosíntesis generales (pyrG, hcsA y pabaA) y biosíntesis de trehalosa (tpsA y tpsB); otras vías de regulación, como MAP-cinasas (sakA/hogA, mpkA-C, ste7, pbs2, mkk2, steC/ste11, bck1, ssk2 y sho1), proteínas G (gpaA, sfaD y cpgA), AMPc-PKA (acyA, gpaB, pkaC1 y pkaR), histidincinasas (fos1 y tcsB), señalización de Ca2+ (calA/cnaA, crzA, gprC y gprD), familia Ras (rasA, rasB y rhbA), y otros (ace2, medA y srbA). También los efectos de los alérgenos de A. fumigatus (Aspf1 y Aspf34) podrían tener un papel en las formas de aspergilosis invasivas.
El hierro es un nutriente esencial para el crecimiento y la virulencia de muchos microorganismos, incluidos los hongos filamentosos. Dentro de los mecanismos de inmunidad innata los mamíferos han desarrollado diferentes estrategias para el transporte y almacenamiento del hierro, limitando así la disponibilidad de hierro libre en el medio. Para poder sobrevivir en este entorno hostil los hongos potencialmente patógenos disponen de mecanismos específicos para la captación de hierro, entre los que destaca la síntesis de sideróforos, moléculas solubles de bajo peso molecular con elevada capacidad de quelación. Para su regulación como nutriente, los mohos utilizan estos sideróforos, que tienen a su vez una importancia vital en la virulencia de Aspergillus y de los mucorales29. El hierro es básico para la síntesis de ergosterol, los procesos de resistencia a los azoles, la adaptación a la hipoxia y la interacción directa con el sistema inmunitario7,8,33,57. La sobrecarga férrica y el consiguiente aumento de la concentración de hierro libre son factores de riesgo para el desarrollo de IFI por mucorales y Aspergillus. Por tanto, la reducción del hierro libre circulante mediante el uso de quelantes constituye un abordaje terapéutico atractivo. El primer quelante del hierro autorizado (deferoxamina) se reveló, paradójicamente, como un factor de riesgo para el desarrollo de IFI al actuar como un xenosideróforo para los mucorales. Por el contrario, los quelantes orales de nueva generación (deferiprona y deferasirox) han demostrado inhibir el crecimiento fúngico in vitro y en modelos animales. Una reciente revisión analiza el papel del metabolismo férrico en la patogenia de la IFI, así como los datos preclínicos disponibles y la, hasta la fecha, limitada experiencia clínica que respalda el empleo de los nuevos quelantes del hierro en el tratamiento de la mucormicosis y de la aspergilosis invasiva3.
Se ha descrito recientemente la atractiva posibilidad de que la existencia de una respuesta a proteínas desplegadas fúngica pueda actuar como centro de regulación de los múltiples determinantes de virulencia de A. fumigatus. Esta respuesta constituiría una red de señalización intracelular que ayudaría al hongo a cumplir con la demanda de las funciones secretoras en el entorno del huésped35. Su principal función sería mitigar el estrés del retículo endoplásmico, manteniendo un equilibrio entre la carga de proteínas «clientes» que entrarían en el retículo endoplásmico y la proteína con capacidad de plegamiento de las organelas. Sin embargo, los recientes hallazgos demuestran que A. fumigatus, así como otros hongos filamentosos patógenos, también dependen de esta vía para la expresión de la virulencia. La respuesta a proteínas desplegadas fúngica se constituiría, por tanto, como el nexo de un gran número de funciones fisiológicas que son vitales para la virulencia del hongo, lo cual también evidenciaría excitantes posibilidades de encontrar futuras dianas terapéuticas en esta misma vía de regulación para el tratamiento de la aspergilosis.
La angioinvasión es el elemento clave de la virulencia en la mucormicosis. Gebremariam et al.26 han determinado que las proteínas spore coat homolog (CotH), prácticamente únicas en el orden Mucorales, son necesarias para este fenómeno de invasividad vascular. Los autores habían identificado previamente la proteína reguladora de glucosa 78 en la célula endotelial (GRP78) como un receptor de los mucorales que mediaba en la invasión de las células del huésped. A partir de aquí han determinado que los homólogos proteicos de cubierta de las esporas (CotH) en los mucorales actúan como ligandos fúngicos de la GRP78. Estas proteínas CotH están presentes ampliamente en los mucorales y ausentes en otros patógenos fúngicos no angioinvasivos. De forma experimental, la expresión heteróloga de CotH3 y CotH2 en Saccharomyces cerevisiae confiere a esta levadura la capacidad de invadir las células huésped a través de la vía de fijación de GRP78. Por otro lado, un mutante de R. oryzae, una de las especies más frecuentes que causan mucormicosis, con expresión reducida de CotH, se mostró alterada en su capacidad de invasión y de daño de las células endoteliales. Esta cepa también exhibió una virulencia disminuida en el seno de la cetoacidosis diabética experimental del modelo de ratón con mucormicosis. El tratamiento con anticuerpos anti-CotH abolió la capacidad de R. oryzae para invadir las células del huésped y protegió a los ratones con cetoacidosis diabética de la mucormicosis. La presencia de CotH en los mucorales explicaría así la susceptibilidad específica de los pacientes con cetoacidosis diabética a la mucormicosis, los cuales tienen incrementados los niveles de GRP78. Hasta el momento, estos datos indicarían que la función de CotH3 y CotH2 sería la de invasinas que interaccionan con la GRP78 de las células huésped mediando las interacciones patogénicas. Estos hallazgos también aportan la identificación de una diana terapéutica potencial en la prevención y tratamiento de la mucormicosis2.
Finalmente, la habilidad que poseen Aspergillus, los mucorales, Scedosporium y Fusarium para adaptarse a ambientes bajos en oxígeno es importante en el condicionamiento de su virulencia. En situaciones de hipoxia se activan procesos de glucólisis y fosforilación oxidativa que causan inflamación pulmonar y favorecen la patogenia de la infección5,27.
Por todo ello, con los factores de virulencia enumerados se genera un complejo rompecabezas cuyas piezas serían los factores de virulencia o las diferentes actividades del hongo, que reunidas muestran una visión de la virulencia en su conjunto, especialmente aquella de A. fumigatus. Los estudios de expresión mediante microarrays de ADN podrían ser útiles para entender esta compleja virulencia y para detectar dianas con el fin de desarrollar métodos rápidos de diagnóstico y nuevos agentes antifúngicos.
ConclusionesEl desarrollo de las micosis invasivas por hongos filamentosos se relaciona con una disfunción del sistema inmunitario. La capacidad del hongo de producir infección dependerá en muchas ocasiones de la aptitud, o de las carencias, del huésped para crear una buena respuesta inmunológica. Algunos factores intrínsecos del huésped, como los diferentes polimorfismos de los RRP, y otros factores estrechamente vinculados a la virulencia del hongo, como la especie o la termorregulación, se asocian a un mayor riesgo de micosis invasivas. El gran reto del futuro es incorporar progresivamente esta información en el día a día de la asistencia clínica a los pacientes para establecer los grupos de enfermos con mayor riesgo de padecer estas IFI, al mismo tiempo que dilucidar nuevas dianas de tratamiento y mejorar las técnicas diagnósticas.
FinanciaciónEsta revisión ha sido realizada en parte gracias a las ayudas de la Red de Investigación de Enfermedades Infecciosas (REIPI RD06/0008), al programa Juan de la Cierva, y a las becas del Fondo de Investigación Sanitaria (FIS 10/01318) del Instituto de Salud Carlos III (Madrid) y del ESCMID Research Grant 2013.
Conflicto de interesesLos autores no tienen conflictos de intereses que declarar.