Los macromicetos han sido parte de la cultura humana desde hace miles de años y aparecen descritos como alimento humano en las más importantes civilizaciones de la historia. Se han descrito muchísimas propiedades nutricéuticas de los macromicetos, como sus propiedades anticancerígenas y antitumorales, hipocolesterolémicas, antivirales, antibacterianas, o inmunomoduladoras, entre otras. Dado que la producción de hongos por cultivo tradicional y la extracción de los metabolitos bioactivos en algunos casos son muy dispendiosas, la biotecnología es fundamental para el desarrollo de técnicas rentables y productivas para la obtención de estos metabolitos. Es el desarrollo de esta tecnología y la facilidad que proporciona en cuanto al manejo de sus variables, lo que ha permitido realizar el cultivo en medio líquido del micelio de macrohongos con significativa reducción de tiempo y aumento en la producción de sus metabolitos, lo que ha impulsado aún más su obtención y el estudio de compuestos con potencial como medicamentos, nutricéuticos y cuasifarmacéuticos tanto del medio agotado como del micelio. El objetivo de esta revisión es el de ofrecer una visión general de la utilización de la fermentación en estado líquido como herramienta tecnológica para la obtención de hongos comestibles, su estudio y el de sus bioactivos, mediante la descripción de las diferentes condiciones de cultivo que en los últimos años se han empleado, así como los resultados obtenidos. Se discutirá lo correspondiente a los géneros Agaricus, Flammulina, Grifola, Pleurotus y Lentinula, con énfasis en este último, dado que el Shiitake ha sido considerado desde siempre como el hongo medicinal por excelencia.
Macromycetes have been part of the human culture for thousand years, and have been reported as food in the most important civilizations in history. Many nutraceutical properties of macromycetes have been described, such as anti-cancer, anti-tumour, cholesterol lowering, antiviral, antibacterial, or immunomodulatory, among others. Given that production of mushrooms by traditional cultivation and extraction of bioactive metabolites is very difficult in some cases, biotechnology is essential for the development of profitable and productive techniques for obtaining these metabolites. It is the development of this technology, and the ease in which it enables the use of its variables that has allowed mycelium to be cultivated in liquid medium of macrofungi, with a significant reduction in time and an increased production of metabolites. This increased production has led to the study of compounds that have medicinal, nutriceutical and quasi-farmaceutical potential, in the exhausted media and the mycelium. The aim of this review is to provide an overview of the use of liquid-state fermentation as a technological tool for obtaining edible fungi, and the study of these and their metabolites, by describing the different cultivation conditions used in recent years, as well as the results obtained. The relevance of Agaricus, Flammulina, Grifola, Pleurotus and Lentinula genera, will also be discussed, with emphasis on the last one, since Shiitake has been always considered as the ultimate medicinal mushroom.
Las setas han sido empleadas por el hombre desde hace milenios tanto para la alimentación, como para el tratamiento de diferentes enfermedades, siendo los países del lejano oriente, como Japón, China y Corea, los consumidores más habituales75. En las últimas décadas, y debido a la comprobación de las diversas actividades biológicas exhibidas por sus metabolitos secundarios, entre las que se encuentran actividades antioxidante, hipocolesterolémica, hipoglucémica, antibacteriana, antiviral, reguladora del sistema cardiovascular, anticancerígena e inmunomoduladora53, se ha intensificado a nivel mundial no solo el cultivo, sino el consumo de este tipo de hongos y el estudio de sus bioactivos.
Todos los metabolitos secundarios que producen los macromicetos y que les dan características nutracéuticas especiales han sido en su mayoría aislados del carpóforo y en la actualidad algunos de estos compuestos se extraen para ser empleados en la producción de medicamentos comerciales75. Investigaciones preliminares realizadas sobre basidiomicetos8 han puesto de manifiesto que la proporción de estos compuestos varía tanto con el estadio del hongo como con el medio en que es cultivado.
Si bien es cierto que la obtención de cuerpos fructíferos es sencilla debido a que se pueden usar diferentes sustratos baratos y accesibles, el cultivo tradicional no permite obtener los bioactivos en breves periodos de tiempo (días) y con procesos de purificación sencillos56,76. Es aquí donde el desarrollo de la biotecnología, por la facilidad en el manejo de sus variables, ha permitido realizar el cultivo en medio líquido del micelio de macrohongos con aumento en la producción de sus metabolitos, lo que ha impulsado considerablemente la obtención y determinación estructural de compuestos con potencial como medicamentos. Cabe anotar aquí que dichos compuestos se encuentran tanto en el micelio como en el medio agotado, lo que proporciona un mayor valor al empleo de la fermentación en estado líquido (FEL) o fermentación sumergida, como igualmente se la conoce, para la producción de macromicetos.
El objetivo de esta revisión es el de ofrecer una visión actualizada de la utilización de la FEL como herramienta tecnológica en la obtención de los hongos comestibles más conocidos, con especial énfasis en Lentinula edodes, y una descripción de las investigaciones realizadas sobre condiciones de cultivo para la obtención de compuestos bioactivos de interés farmacológico y alimenticio.
Fermentación en estado líquidoDesde el punto de vista biotecnológico, la fermentación se entiende como el proceso en que los microorganismos producen biomasa y metabolitos a partir de la utilización de sustancias orgánicas, en ausencia o presencia de oxígeno. La descomposición de los sustratos es llevada a cabo por enzimas producidas para tal fin por los microorganismos28. Desde el enfoque bioquímico, la fermentación es definida como un conjunto de reacciones catabólicas que producen adenosín trifosfato (ATP), en las cuales los compuestos orgánicos sirven tanto de donadores primarios como de aceptores finales de electrones, produciendo el ATP por fosforilación a nivel sustrato50. Se trata de un proceso intracelular, catabólico de oxidación incompleta, siendo el producto final un compuesto orgánico29. Las fermentaciones pueden clasificarse como naturales o artificiales, según haya o no intervención del hombre en ellas. Asimismo pueden clasificarse también según el tipo de producto que se desea obtener, según la presencia o ausencia de oxígeno, o según el estado del sustrato28. Es este último aspecto el que permite clasificarlas en FEL y fermentaciones en estado sólido (FES).
La FEL o fermentación sumergida es aquella en la cual hay por lo menos la misma concentración de agua y de sustrato sólido (nutrientes) en el proceso, es decir, que hay una solución de los nutrientes17,68. Es el tipo de fermentación más utilizado en la industria debido a que es sencillo, pueden controlarse muchas más variables que en la FES y el producto final es mucho más fácil de recuperar11. En ella los microorganismos se desarrollan flotando en el medio de cultivo y en el caso de los hongos miceliales, estos pueden formar pequeñas esferas de micelio denominadas «pellets» cuando hay agitación, de otra forma, crecen en la superficie. En la FEL el desarrollo del microorganismo se presenta de una forma típica, dando origen a una fase de latencia, una de crecimiento (fase logarítmica), una fase estacionaria y, la última, la fase de muerte. La FEL a su vez puede dividirse en continua, por lote, y alimentada, según la entrada y salida tanto del sustrato como del producto, respectivamente11.
La principal diferencia con la FES radica en que el crecimiento de los hongos filamentosos en esta última se efectúa en un sustrato sólido cercano a la ausencia de agua, pero con la suficiente presencia de esta para soportar el crecimiento y el metabolismo17. Sin embargo, a pesar de las muchas investigaciones que se han realizado desde que se conoce este tipo de fermentación, se siguen presentando algunos problemas como son la baja ratio de transferencia de O2, CO2, remoción de calor y la contaminación bacteriana. Por otro lado, es un proceso lento para el cual muy pocos organismos se prestan debido precisamente a su baja actividad de agua, siendo además un proceso difícil de monitorizar, controlar y escalar, lo que lo convierte en un proceso de difícil implementación en la industria a pesar de que la mayoría de ella, en especial la farmacéutica, la utiliza. Es por esto que la FEL se ha convertido en el método preferido de fermentación para aplicaciones industriales dado que es menos problemática al poderse controlar la transferencia de oxígeno. Además, la homogeneidad del cultivo es muy superior, haciéndola más repetitiva, reproducible y fácil de monitorizar. En lo que respecta a las setas comestibles, solo hasta hace unos años se ha empezado a desarrollar esta tecnología.
Las setas se han empleado en la alimentación y la medicina desde hace varias centurias, produciéndose en compost, cultivos tubulares, troncos, etc., que constituyen el cultivo tradicional (una FES). Sin embargo, el mayor inconveniente del empleo de setas como productor de bioactivos es la variabilidad de los mismos debida a la composición del medio en el que se cultiva (por ejemplo, no todos los aserrines son iguales, así aunque provengan de la misma especie). En contraste con la FES, la FEL ofrece un gran potencial gracias a que es una técnica mucho más rápida donde las condiciones de cultivo son fácilmente reproducibles e independientes de las variaciones climáticas. Si bien es cierto que los macromicetos crecen mucho más despacio que las bacterias y los micromicetos, se puede aplicar esta tecnología mediante una optimización del proceso dependiendo de la cepa y los metabolitos de interés.
Metabolitos fúngicos con potencial terapéuticoLas setas comestibles son conocidas por su alto valor proteico, su considerable concentración de vitaminas, minerales, fibra dietaria, bajos niveles de sodio y grasas insaturadas56. Esto las convierte en un excelente nutracéutico ya que sus propiedades medicinales están directamente relacionadas con los compuestos que presentan acciones biológicas con potencial terapéutico. Dichos compuestos se pueden aislar tanto del micelio como del carpóforo y del medio de cultivo agotado. Dentro de estos se encuentran β-glucanos, enzimas, policétidos, ácidos grasos, polifenoles, flavonoides y terpenoides, entre otros. A continuación se describen los que se encuentran en mayor proporción en los macromicetos.
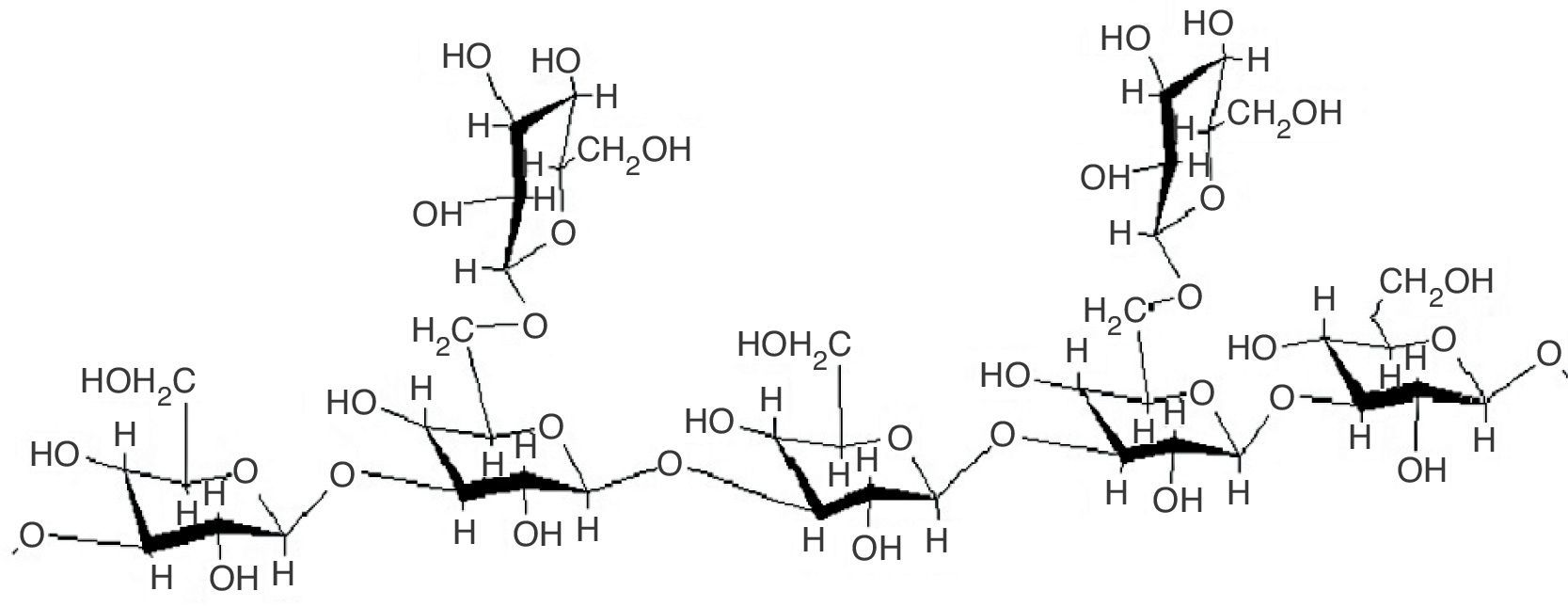
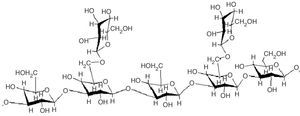
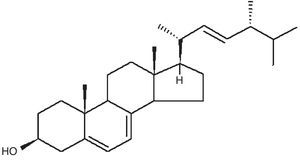
β-glucanosLos β-glucanos son polisacáridos no celulósicos constituidos por unidades de glucosa unidas por enlaces glucosídicos y con ramificaciones β-1-3 o β-1-6. Son aislados principalmente de la pared celular de las células fúngicas (aproximadamente la mitad de la biomasa de la pared celular está constituida de β-glucanos), aunque también pueden ser excretados al medio. Poseen actividades inmunoestimuladoras, anticancerígenas, antiinfecciosas, hipocolesterolémicas, hipoglucémicas, antiinflamatorias y analgésicas10,74. El β-glucano más conocido a nivel mundial es el lentinan (fig. 1), aislado de L. edodes (Shiitake), polisacárido de 27,5kDa que es utilizado en Japón como una medicina anticancerígena8,75 debido a que estimula la secreción de citocinas por células T, lo que incrementa la generación de linfocitos T citotóxicos y células NK en presencia de interleucina 252,91.
Aunque el lentinan es un agente anticancerígeno, es necesario realizarle modificaciones químicas para aumentar su actividad. Las investigaciones al respecto pusieron de manifiesto que la sulfatación puede aumentar su eficacia19,91. Aunado a lo anterior se encuentra un reporte preliminar sobre el efecto protector de este glucano frente a infecciones por Mycobacterium tuberculosis, in vitro e in vivo en ratones. El modelo in vivo demostró que la administración de lentinan antes de la infección puede movilizar las defensas potenciales del huésped y reducir la infección micobacteriana51.
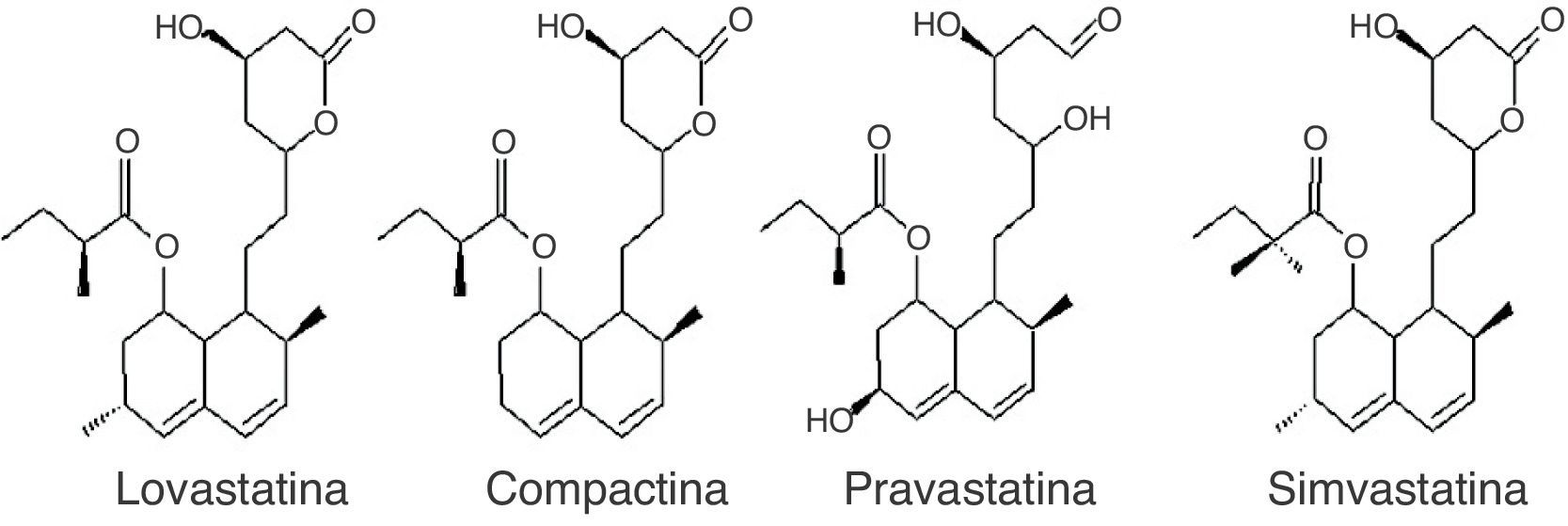
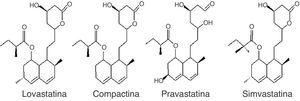
PolicétidosLos policétidos son estructuralmente una familia muy diversa de productos naturales con actividades y propiedades farmacológicas diversas, entre las que se cuentan la antibiótica, la antifúngica, la citostática, la hipocolesterolémica, la antiparasitaria, la de estimulación del crecimiento animal y la insecticida. Dentro de los policétidos, las estatinas, policétidos no aromáticos, se constituyen en la actualidad como metabolitos muy importantes de los macromicetos dado que son inhibidores de la 3-hidroxi-3-metil-glutaril coenzima A reductasa, primera enzima involucrada en la biosíntesis de colesterol. La inhibición es debida a la similaridad estructural del sustrato natural de la enzima y las formas ácidas de las estatinas. Su uso es extendido en el tratamiento de pacientes con hipercolesterolemia, enfermedades cardiovasculares, así como también para aquellos propensos a la arterioesclerosis58. Las estatinas de origen fúngico incluyen la lovastatina, la simvastatina, la pravastatina y la compactina26 (fig. 2).
Los macromicetos descritos como los mayores productores de estos inhibidores pertenecen a los géneros Pleurotus y Agaricus, y la FEL ya se está empleando por las casas comerciales farmacéuticas para la producción de este tipo de medicamentos6,60, ya que a diferencia de las sintetizadas químicamente no producen efectos secundarios indeseados en los pacientes.
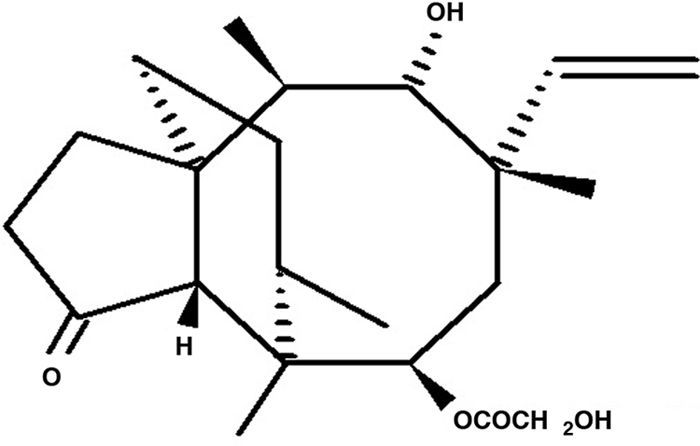
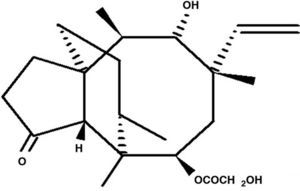
TerpenoidesCorresponden a moléculas formadas por unidades de isopreno, unidas cabeza a cola. Se clasifican como hemiterpenos, monoterpenos, sesquiterpenos, diterpenos, sesterpenos, triterpenos y tetraterpenos. Algunos de estos compuestos han mostrado actividades antiandrogénicas, antivirales y antibacterianas, entre otras37,40,47,64,75. Dentro de los diterpenos, se ha aislado la pleuromutilina (fig. 3) de Pleurotus mutilis y Clitopilus passeckerianus (antes llamado Pleurotus passeckerianus), metabolito con marcada acción antibiótica contra infecciones micoplasmáticas en animales, que ha permitido el desarrollado y la producción de este tipo de medicamento a nivel comercial4.
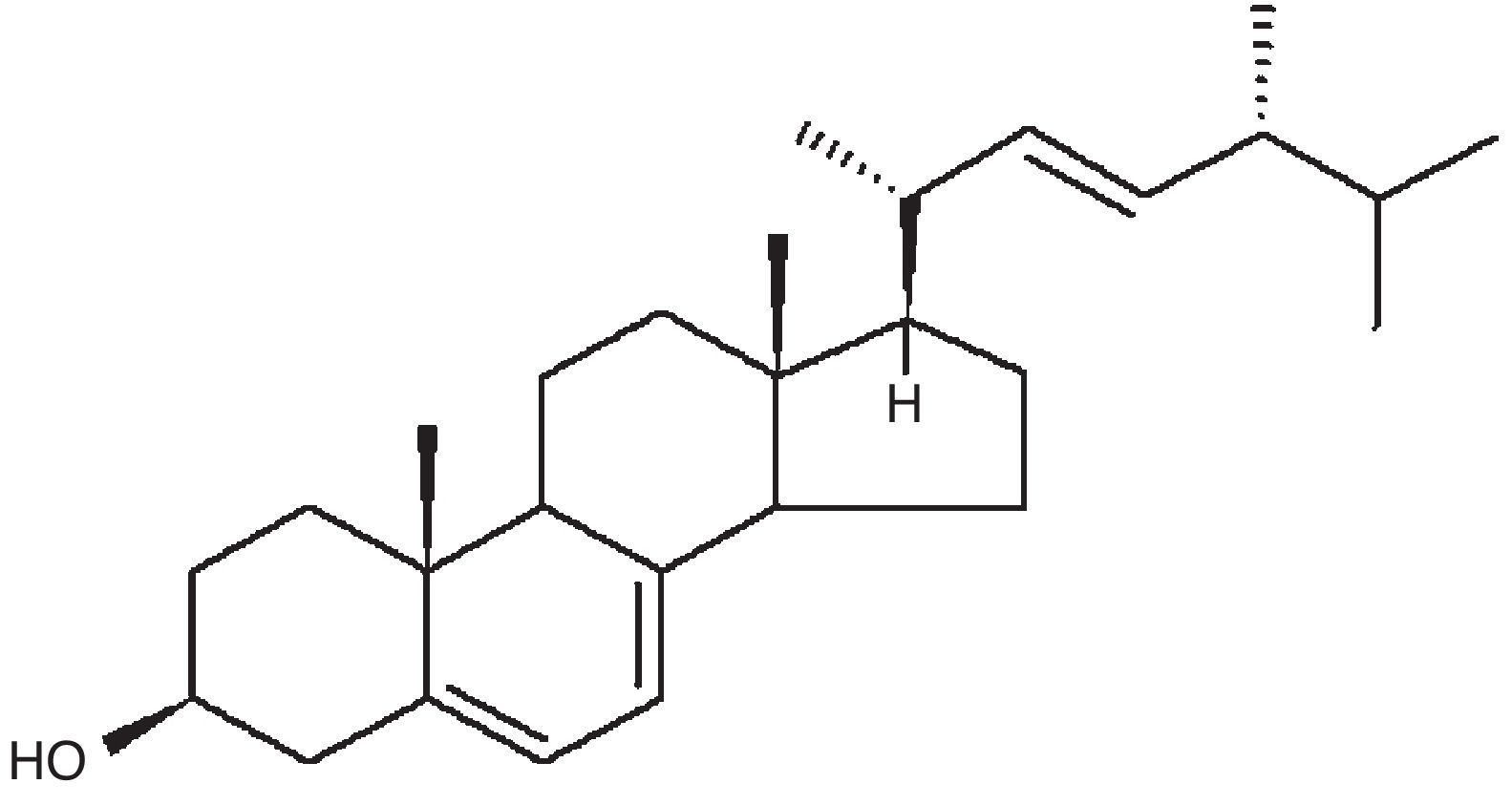
Los triterpenoides tetracíclicos tienen una gran relevancia en los macromicetos y, dentro de ellos, los esteroles son los metabolitos más abundantes. El ergosterol (fig. 4) es el principal componente triterpenoidal de los hongos. Los metabolitos secundarios de esta clase presentan interesantes propiedades de tipo farmacológico; entre ellas, la anticancerígena y la antimicrobiana57,73; algunos presentan también actividad hipocolesterolémica86, antibiótica35, antiinflamatoria44,88, antifúngica, antitumoral41 e insecticida83, entre otras.
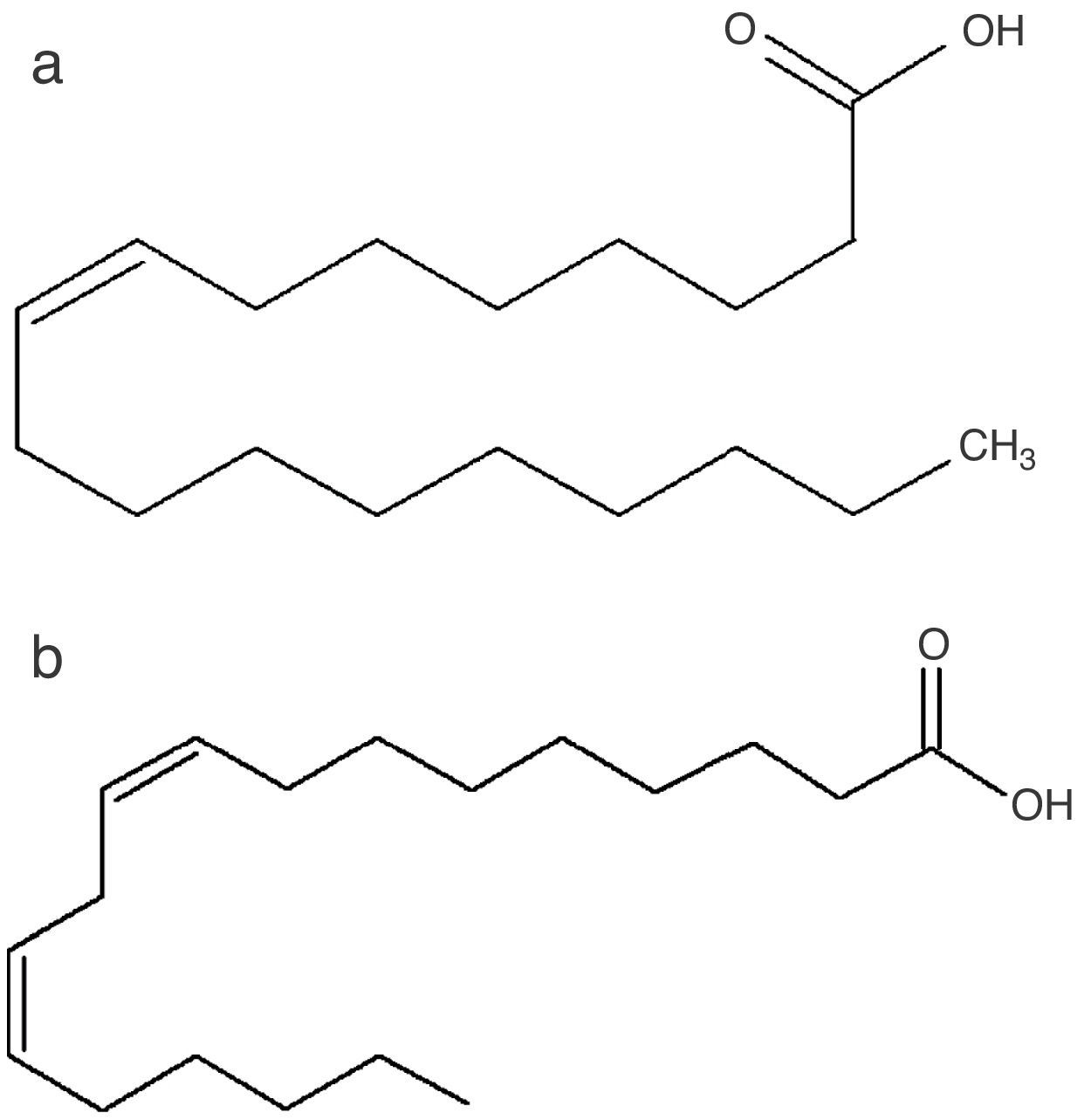
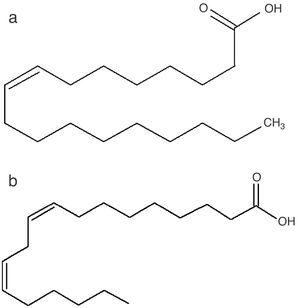
Ácidos grasosLa presencia de ácidos grasos insaturados como el ácido oleico y el linoleico (fig. 5) constituye una característica nutracéutica favorable, puesto que los ácidos grasos no saturados son esenciales en una dieta sana ya que brindan protección frente a enfermedades cardiovasculares y la arterioesclerosis producida por el colesterol54.
Cultivo de macromicetos por fermentación en estado líquidoDebido a la gran capacidad que tienen los macromicetos de crecer en diferentes sustratos y condiciones medioambientales, se ha explorado el empleo de la FEL como una herramienta para obtener el mayor provecho de su cultivo. Dentro de las variables a considerar en cultivos sumergidos de macromicetos se encuentran la temperatura, el pH, la agitación y los medios de cultivo, entre otras.
Diversas investigaciones ponen de manifiesto la capacidad de los macromicetos de crecer en un amplio rango de pH, sin embargo, recomiendan usar un pH de 5 o inferior para evitar la contaminación bacteriana. Asimismo, cuando el pH es bajo (pH 4) se incentiva la producción de biomasa y el consumo de glucosa, mientras que un pH más básico (pH 6) puede estimular la producción de exopolisacáridos17.
La temperatura es clave para la fermentación de cualquier tipo de microorganismo. Los macromicetos también poseen la habilidad de crecer en un amplio rango de temperaturas en la naturaleza76, sin embargo para las fermentaciones líquidas se ha empleado un rango entre 26 y 36°C17. Si bien se ha evidenciado que un aumento de la temperatura puede influir en el aumento del metabolismo del hongo, dicha variación disminuye la solubilidad del oxígeno disuelto en el medio, lo que conllevaría que la disponibilidad de este sea menor en el interior del medio de cultivo y por consiguiente el crecimiento y el metabolismo disminuirían, ya que los macromicetos son organismos aerobios estrictos y son muy sensibles a las bajas concentraciones de oxígeno17,76.
La aireación es otro factor importante y fácil de controlar que influye directamente en la oxigenación y la homogeneización del medio de cultivo durante la fermentación. La aireación puede darse por agitación de los caldos, lo que permite que el oxígeno del ambiente se disuelva en el medio de cultivo, o bien por inyección, donde el oxígeno es introducido en el medio de cultivo a través de tubos conectados al fermentador, con o sin agitación. Algunos investigadores establecieron que una agitación muy fuerte puede llevar al rompimiento del micelio por las fuerzas de agitación y por lo tanto la formación de pellets (y en consecuencia, la producción de biomasa) se ve reducida, así como la producción de metabolitos como los exopolisacáridos17.
Otro parámetro determinante es la composición del medio de cultivo empleado para la fermentación líquida, ya que de este depende el crecimiento micelial y, por ende, la biosíntesis de metabolitos. En la producción de macromicetos se han empleado medios sintéticos, medios complejos y sustratos constituidos por desechos. Está claro que hay tener en cuenta que un medio puede ser bueno para una especie mientras que para otra no, afectando asimismo tanto la producción como la liberación de metabolitos. También es importante definir la relación carbono-nitrógeno ya que puede influir en la eficiencia de producción de biomasa y de metabolitos17.
Principales setas comestibles cultivadas por fermentación en estado líquidoDentro de las más conocidas se encuentran Agaricus bisporus, L. edodes, Pleurotus spp. y Flammulina velutipes. Prácticamente todas estas setas han sido introducidas en la cultura occidental desde países como China y Japón, debido a la gran inmigración de habitantes de esas zonas al hemisferio occidental, y su aceptación se dio gracias a sus agradables sabores y excelente textura, lo que permitió la inclusión de las mismas en la dieta de casi todos los países del mundo. Los estudios realizados sobre los bioactivos producidos por los hongos comestibles permiten ver su potencial empleo en la farmacoterapia o en la elaboración de alimentos funcionales, haciendo necesario realizar su cultivo por técnicas biotecnológicas, a fin de obtener mayor cantidad de compuestos en menor tiempo y con procesos de purificación más sencillos.
Género AgaricusLa primera FEL de este género de macromicetos fue descrita por Humfeld en 1948 empleando Agaricus campestris. A pesar de que la especie más conocida de este género es Agaricus bisporus, comúnmente llamado champiñón de París, siendo el macromiceto comestible más cultivado a nivel mundial mediante técnica tradicional en sustratos compostados que por lo general se componen de desechos agroindustriales, el empleo de la fermentación en estado sumergido se ha realizado en su mayoría para procesos de biorremediación1,2,16, encontrándose un solo reporte del empleo de la fermentación para la bioproducción del micelio de esta especie con el propósito de obtener un análogo de la carne36.
La especie Agaricus blazei, también llamada Agaricus brasiliensis o seta del sol, es la especie más utilizada en FEL para la producción de polisacáridos y otros compuestos con acciones biológicas conocidas y posible uso farmacológico42,43. Es así como en 2008 se realizó la caracterización de exopolisacáridos producidos por la especie en fermentación sumergida43, estudios que fueron complementados en 2009 con la determinación del efecto de los polisacáridos extracelulares en la hipolipidemia y la selección de un medio de cultivo de bajo costo, con alta producción de biomasa y polisacáridos intracelulares42,46. En 2010 se utilizó A. brasiliensis para la producción de exopolisacáridos y el estudio de la influencia de los diferentes métodos de secado en la actividad antitumoral presentada por estos metabolitos20, cuya extracción también fue estandarizada en ese mismo año84. Asimismo, se estudió el efecto de la aireación en la producción de ergosterol y blazeispirol72. Agaricus novoi se utilizó para hacer un estudio comparativo entre basidiomicetos en lo relacionado con la producción de exopolisacáridos por fermentación en estado sumergido empleando diferentes fuentes de carbono y nitrógeno15.
Género Flammulina«Enokitake» es el nombre japonés con el que se conoce a este hongo; en Latinoamérica se conoce como «eñoki» y es una de las setas comestibles que presenta el carpóforo más pequeño pero con sabor muy agradable. La especie más conocida de este género es Flammulina velutipes. Los estudios desarrollados sobre ella son muy pocos a pesar de que es un hongo consumido a nivel mundial. El primer reporte hace referencia al estudio de las condiciones de cultivo del micelio para la producción de compuestos antimicrobianos66. Posteriormente se realizó una evaluación completa de las condiciones de cultivo en FEL, composición y actividad biológica del micelio37,38. En 2011 se evaluaron las peptidasas extracelulares durante la fermentación koji (fermentación del trigo o de la soya por acción de micromicetos) y se desarrolló la identificación diferencial de genes con actividad antitirosina24,37.
Género GrifolaLa especie Grifola frondosa en Japón es llamada «maitake». Su consumo también está muy difundido en los países asiáticos, sin embargo en el hemisferio occidental apenas se la conoce. Este hongo exhibe actividades biológicas muy interesantes como son la inmunoestimuladora y la hipoglucemiante. En cuanto a los estudios efectuados sobre este género que incluyen FEL, se encuentra la extracción de polisacáridos del micelio de G. frondosa45, el estudio del efecto del trigo en el cultivo sumergido de Grifola umbellata9, la determinación de la inhibición en células de cáncer de ovario producida por el extracto en acetato de etilo de G. frondosa69, el efecto de la ingesta del micelio, G. frondosa en la respuesta glucémica en ratas diabéticas49, la elucidación estructural de 1,3 β-D-glucano en G. frondosa77, el aumento en la producción de polisacáridos de G. umbellata mediante la optimización de las condiciones de cultivo en frasco agitado32,71 y el estudio del crecimiento micelial y la producción de polisacáridos bioactivos en G. frondosa en cultivos por lote y lote alimentado71.
Género PleurotusEs la segunda seta producida a nivel mundial. Es conocida en diferentes países como «hongo ostra», «gírgolas» u «orellanas». Aunque posee diferentes acciones biológicas, su mayor interés radica en la producción de polisacáridos inmunoestimuladores y estatinas naturales que son hipocolesterolémicas y que aventajan a las sintetizadas químicamente por sus pocos efectos secundarios. El género Pleurotus, debido a su gran producción de lacasas de baja especificidad y otras enzimas y a su eficiencia en la degradación de compuestos xenobióticos, ha sido estudiado ampliamente para la biorremediación de diferentes efluentes3,12,22,23,67. En lo referente a la producción de compuestos bioactivos se han realizado diversos trabajos donde se ha estudiado la producción de exopolisacáridos y xylooligosacáridos en Pleurotus citrinopileatus y Pleurotus tuber-regium87,89,90, y otros autores en Pleurotus spp. BCCB068 y Pleurotus tailandia13, respectivamente. Asimismo, se ha reportado el efecto de la soya en la producción de pleuromutilina en P. mutilis30, la formación y desarrollo de los pellets durante la fermentación, así como el estudio de la temperatura en este proceso y su influencia en la apoptosis de las células31,62, la optimización de la producción de glucanos en Pleurotus ostreatus14,61, la determinación de la actividad antioxidante del micelio de especies de Pleurotus48, de las actividades antitumorales e inmunoestimuladoras de los endopolímeros obtenidos del cultivo sumergido de Pleurotus eryngii34 y de las propiedades antiproliferativas y antiadhesivas de los polisacáridos extraídos del micelio y carpóforos de Pleurotus pulmonarius y su aplicación en el tratamiento de la caries39. Algunos de los bioactivos obtenidos a partir de Pleurotus spp. cultivados por FEL ya se producen a escala industrial75,86, sin embargo, también se hacen estudios para optimizar el proceso con nuevas tecnologías de fermentadores25.
Lentinula edodesL. edodes, conocida en Japón como «Shiitake», es la especie mejor conocida del género y la tercera seta de mayor consumo a nivel mundial. Es considerada la seta comestible más importante a nivel medicinal debido a sus comprobadas actividades farmacológicas5,7,33,55,85. Son pocos los estudios que se han realizado sobre la FEL de L. edodes, destacándose las investigaciones en donde se evalúan las diferentes variables para el cultivo sumergido de 2 cepas diferentes del hongo, en donde se encontró que si bien su crecimiento se produce en un amplio rango de pH (de 3 a 8), fue el pH 7 el que proporcionó los mejores resultados21. Sin embargo, el empleo de pH 5,5 en posteriores estudios evitó la contaminación bacteriana59. En cuanto a los medios de cultivo, se han desarrollado experimentos tanto con medios sintéticos comerciales, con propia fórmula, como con medios que incluyen materia prima o desechos industriales, siendo el concepto general el de emplear una fuente de carbono sencilla y una fuente de nitrógeno orgánica, ya que las sales de nitrógeno inorgánicas pueden producir cambios drásticos de pH que pueden inducir la apoptosis17,59. Como fuentes de carbono se han usado desde caldos simples de glucosa y otros azúcares reductores, hasta medios más complejos (licores de maíz, melazas, almidones, caldo papa dextrosa, desechos agrícolas, líquido de estilados)18,22,59,65,81,82. En cuanto a las fuentes de nitrógeno, las más empleadas en FEL han sido peptona y extracto de levadura18,59,65,82. Por otro lado, se ha discutido mucho en cuanto a la temperatura apropiada para la FEL de L. edodes. Los estudios realizados a diferentes temperaturas han arrojado como resultado que una temperatura superior a 35°C inhibe el crecimiento del hongo59. La mayoría de los estudios se han efectuado a una temperatura promedio de 26°C59,78,79. Otro punto controvertido es el de la agitación. Si bien algunas evaluaciones sobre este parámetro indican como ideal una agitación entre 100 y 150rpm, con la que se obtiene prácticamente la misma producción de biomasa y polisacáridos19, estos resultados contrastan con los encontrado por otros autores, quienes realizaron estudios con cultivos estáticos y en agitación, encontrando una gran producción de biomasa en los estáticos e inhibición del crecimiento a una velocidad de agitación de 150rpm59. Lo anterior pone de manifiesto la conveniencia de realizar más estudios sobre este factor en L. edodes.
Las fermentaciones líquidas de L. edodes se han utilizado para fines diversos como son el estudio de la morfología del hongo en la fermentación, la formación de pellets, la producción de exoproteínas, la determinación de las bioacciones del producto biotecnológico, entre las que destacan la actividad antioxidante59,62,79–81, la antimicrobiana contra fitopatógenos, la optimización de vitamina B1227,63,79,82, el desarrollo de técnicas para la alta producción de bioactivos como polisacáridos, peroxidasas, lectinas y lacasas18,70. Por otro lado, con miras a mejorar el proceso se ha explorado la utilización de compuestos que puedan aumentar la productividad, como es el caso del selenio82, así como la formulación de medios de cultivo apropiados para la producción de ergotioneína78.
De los diferentes estudios que sobre la producción de macromicetos empleando FEL se encuentran en la literatura, se puede concluir que las condiciones óptimas de cultivo son específicas y que dependen del hongo, la cepa y el metabolito de interés (tabla 1).
Condiciones empleadas en la fermentación en estado líquido de macromicetos comestibles
| Género de seta | Fuentes de carbono y nitrógeno empleadas | Temperaturas de incubación* | pH del medio de cultivo* | Agitación (rpm)* | Referencias |
| Agaricus | Caldo papa dextrosa | 25-45°C (promedio de 27°C) | 2-7 (promedio de 6) | 120-200 | 1,2,15,16,20,36,42,43,46,72,84 |
| Jugo de caña | |||||
| Licor de maíz | |||||
| Malta | |||||
| Azúcares reductores, el más usado es la glucosa | |||||
| Proteína de soya | |||||
| Extracto de levadura | |||||
| Peptona | |||||
| Flammulina | Caldo extracto de malta | 24-28°C | No se reporta | Estáticos, 150 y 750 | 24,37,38,66 |
| Extracto de levadura | |||||
| Asparginina | |||||
| Azúcares reductores, como la glucosa | |||||
| Gluten de trigo | |||||
| Peptona | |||||
| Grifola | Jugos de caña | Se usa 25°C | pH bajos, el más usado 4,5 | 100-160 | 9,32,45,49,69,71,77 |
| Melazas | |||||
| Aceites vegetales | |||||
| Licor de maíz | |||||
| Suero de leche | |||||
| Azúcares reductores como la glucosa (la de mayor producción) y maltosa | |||||
| Peptona | |||||
| Extracto de levadura | |||||
| Pleurotus | Caldo papa dextrosa | 25-30°C | 4-6 | Estáticos, 100-160 | 3,12–14,22,23,25,31,34,39,48,61,62,67,75,86,87,89,90 |
| Aminoácidos | |||||
| Licor de maíz | |||||
| Extracto de malta | |||||
| Azúcares reductores, las más utilizadas, glucosa y xilosa | |||||
| Hidrolizado de caseína | |||||
| Torta de soya | |||||
| Extracto de levadura | |||||
| Peptona | |||||
| Lentinula | Caldo papa dextrosa | 25-40°C (promedio de 26°C) | 3-10 (promedio de 6) | Estáticos, 100-150 | 17–19,21,22,27,59,62,63,65,70,78–82 |
| Melazas | |||||
| Almidón | |||||
| Licor de maíz | |||||
| Lixiviados | |||||
| Desechos industriales (sin especificar) | |||||
| Sacarosa | |||||
| Azúcares reductores, el más importante, la glucosa | |||||
| Extracto de soya | |||||
| Extracto de levadura | |||||
| Polvo de levadura | |||||
| Peptona | |||||
Los macromicetos y, entre ellos, las setas comestibles, ofrecen un sinnúmero de metabolitos con actividades biológicas reconocidas. El empleo de la biotecnología y, en especial, de la fermentación líquida por la mayor facilidad en el manejo de las variables del proceso, permitiría aprovechar al máximo la producción de bioactivos mediante la obtención de altos rendimientos de los mismos, lo que conllevaría una reducción de costes y, al final, una disminución del precio para el consumidor. Los estudios realizados hasta el presente con las principales setas comestibles ponen de manifiesto que las condiciones de crecimiento y producción de los metabolitos biológicamente activos difieren entre géneros y especies, así como también según el bioactivo que se desea obtener. De igual manera, la implementación de esta tecnología para la producción a escala industrial se encuentra apenas en desarrollo, siendo muy pocos los bioactivos producidos de esta manera. Lo anterior evidencia el hecho de que se deben realizar más estudios de este tipo con la finalidad de lograr un desarrollo concienzudo de esta tecnología, lo que traerá como consecuencia natural el mejor aprovechamiento de los beneficios que los macrohongos aportan al ser humano.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.