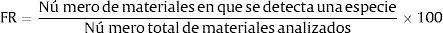La humedad relativa y las temperaturas altas existentes en los países tropicales propician condiciones favorables para el desarrollo de hongos que pueden ser perjudiciales no solo para la salud humana, sino también para los soportes documentales.
ObjetivosDeterminar la concentración fúngica en el aire de dos depósitos del Archivo Nacional de la República de Cuba y la micobiota depositada sobre diferentes soportes fotográficos y mapas conservados en estos depósitos, así como realizar la caracterización taxonómica de los hongos aislados.
MétodosEl muestreo del aire se realizó con un método de sedimentación, y los soportes (6 fotos y 7 mapas) se analizaron empleando hisopos estériles humedecidos.
ResultadosEl género que predominó fue Cladosporium, seguido por los géneros Aspergillus y Penicillium. De todas las fotos y los mapas se aislaron hongos filamentosos y solo de una técnica fotográfica y un mapa se aislaron levaduras. Se identificaron varias especies de los géneros Aspergillus y Penicillium, pero Aspergillus niger y Aspergillus flavus fueron las especies predominantes. Se aislaron cepas de levaduras de los géneros Candida y Rhodotorula.
ConclusionesLa concentración fúngica del aire puso en evidencia que los ambientes no están contaminados. De 26 hongos filamentosos aislados, solamente 5 se detectaron tanto en el aire de los depósitos como sobre uno o más de los soportes documentales analizados, lo que representa un 19,3%. Esto demuestra que existe una relación ecológica baja entre los hongos encontrados en el aire y los que se aislaron de los soportes analizados.
The high relative humidity and temperatures in tropical countries create favorable conditions for development of fungi that are not only a risk to human health but they can also colonize documentary support.
AimsTo study the concentration of the airborne fungi in two repositories of the National Archives of the Republic of Cuba, the mycobiota deposited on different photographic supports and maps preserved in these repositories, and to determine the taxonomic characterization of the fungi isolated.
MethodsThe air sampling was performed using a sedimentation method, and the supports (6 pictures and 7 maps) were analyzed using moistened sterile swabs.
ResultsThe Cladosporium genus was predominant, followed by Aspergillus and Penicillium genera. Filamentous fungi were isolated in all the photos and maps, and yeasts were only isolated from a photographic supports and a map. We identified several species of Aspergillus and Penicillium genera, but Aspergillus niger and Aspergillus flavus predominated. Candida and Rhodotorula were the yeast genera isolated.
ConclusionsThe fungal concentration of the air demonstrated that the environments were not contaminated. From the 26 species of filamentous fungi isolated only 5 were detected in the indoor air of the repositories and on one or more of the document supports analyzed (representing a 19.3%). This shows that there is a low ecological relationship between the fungi detected in the indoor air and those that were isolated from the supports studied.
Los archivos, las bibliotecas y los museos son las instituciones que conservan el legado de la humanidad. En ellos se encuentra una gran cantidad de documentos de valor patrimonial escritos en diversos soportes (papiro, pergamino, papel, etc.), y custodian otros tipos de documentos como fotografías, mapas y planos, así como documentos digitales, entre otros. Estos soportes de naturaleza orgánica o sintética se deterioran con el tiempo, pero este proceso se acelera por el efecto de agentes físicos (luz, temperatura [T], humedad relativa [HR]), químicos (contaminación atmosférica) y biológicos (microorganismos, insectos)11. Como es conocido, los hongos son potentes agentes deteriorantes de los documentos16,20,29,35,49 y pueden llegar a ellos a través del aire y junto al polvo, fundamentalmente16.
La composición de las partículas de polvo varía en cantidad y calidad según la ubicación del edificio, de las actividades que se realizan en su interior, de la estación del año y de las condiciones de conservación de los documentos, libros y objetos26. Al depositarse sobre las colecciones crean condiciones microambientales sobre sus superficies que impiden el flujo normal del aire, facilitan la absorción del agua por parte de los soportes y constituyen una fuente nutricional que propicia el desencadenamiento de plagas por microorganismos, fundamentalmente por hongos16.
Como los hongos no solo pueden ser transportados al interior de los depósitos donde se conservan los objetos y documentos de valor por el aire y las partículas de polvo, sino también a través de los sistemas de ventilación, por el personal y los visitantes32, se recomienda el estudio sistemático de la calidad del aire16,47, debido al riesgo que presupone la presencia de elevadas concentraciones fúngicas tanto para la salud humana como para la integridad del patrimonio que se conserva7,16,21,35,42,49.
Cuba, por su ubicación geográfica, se ve afectada constantemente por el polvo proveniente del desierto del Sahara3, que junto a los altos valores de HR y T propias de las condiciones climáticas imperantes, puede poseer en determinadas etapas del año concentraciones altas de conidios viables en el aire que se depositan con facilidad sobre los diferentes sustratos, facilitándose el desarrollo de los hongos. Estos, al tener una potente, versátil y adaptable maquinaria metabólica pueden degradar los materiales con facilidad, acelerándose el deterioro de los soportes documentales que se atesoran en los depósitos de archivos, bibliotecas y museos7,11,19,20,29,49,50. Por otro lado, los hongos cuentan con diferentes estructuras y mecanismos patogénicos causantes de afecciones específicas en la salud humana16,21,32,52.
Por todo ello, los objetivos de este trabajo fueron determinar la concentración fúngica en el aire de dos depósitos del Archivo Nacional de la República de Cuba y la micobiota depositada sobre diferentes técnicas fotográficas y mapas conservados en estos depósitos, así como realizar la caracterización taxonómica de los hongos aislados.
Materiales y métodosMuestreo microbiológico del aireSe llevó a cabo siguiendo el método de sedimentación descrito por Omeliansky1,5,7,19. Para ello, placas de Petri con agar extracto de malta (BioCen, Cuba) suplementado con cloranfenicol (0,1%)20 se expusieron al aire durante 10min a una altura de 1,5m del suelo, aproximadamente. Se establecieron 2 puntos de muestreo para la fototeca y 5 para la mapoteca por triplicado. La cantidad de puntos a muestrear se determinó según Sanchis44, que reporta un método sencillo para determinar puntos de muestreo de aire en locales y que toma como base la raíz cúbica del volumen del local. Posteriormente, las placas se incubaron invertidas durante 7 días a 30oC.
Medición de la temperatura y la humedad relativa en el momento del muestreo microbiológicoAunque es habitual desde hace años la medición de la T y la HR dos veces al día en todos los depósitos del Archivo (10:00 a.m. y 3:00 p.m.), durante la toma de muestras microbiológicas se realizaron mediciones en cada punto empleando un termohigrómetro digital (Bresciani, Italia).
Determinación de la distribución relativa de los géneros fúngicos detectados en el aire de los depósitosEl cálculo se realizó según Smith48, donde:
Muestreo de fotografías y mapasSe seleccionaron al azar 6 fotografías en diferentes soportes: un ferrotipo (F1); una foto sobre seda (F2); un negativo sobre placa de vidrio (F3) y 3 fotos en soporte papel (F4, F5 y F6), y 7 mapas: uno en papel (M1), uno en seda (M2), un cianotipo en papel (M3), 2 en tela de algodón (M4 y M5) y 2 en papel transparente (M6 y M7). La toma de muestra se realizó mediante la técnica del hisopado en forma aséptica34. Posteriormente, a cada hisopo se le adicionaron 5ml de solución salina estéril, se agitó bien la muestra a intervalos durante 45min y se hicieron diluciones seriadas que se sembraron en placas de Petri con agar extracto de malta (BioCen, Cuba) suplementado con cloranfenicol (0,1%)21. Finalmente, las placas fueron incubadas a 30°C durante 7 días para el recuento de colonias.
La frecuencia relativa de los hongos aislados de los soportes documentales se calculó según Esquivel et al.15.
Identificación de las cepas fúngicas aisladasSe realizó la observación de las características y morfología de cada colonia tanto en el anverso como en el reverso, así como de las estructuras microscópicas realizando preparaciones en lactofenol y microcultivos12. Para la identificación del género se siguieron los criterios de Barnett y Hunter2. Se utilizaron claves taxonómicas específicas para la identificación de especies de Aspergillus25, Penicillium17,36,43, Curvularia14,28, Cladosporium4,14 y Fusarium46. Para identificar levaduras se utilizaron los criterios de De Hoog et al.13 y Redelman-Sidi et al.39.
Se realizó la determinación cualitativa de la actividad celulolítica, amilolítica, proteolítica, la producción de pigmentos y de ácidos de los hongos aislados
En todas las cepas fúngicas aisladas tanto del aire como de los soportes analizados se determinó el poder degradativo de la celulosa7,9,38, de la gelatina7,9,18,24 y del almidón7,9,18, así como la producción de pigmentos y ácidos7,9.
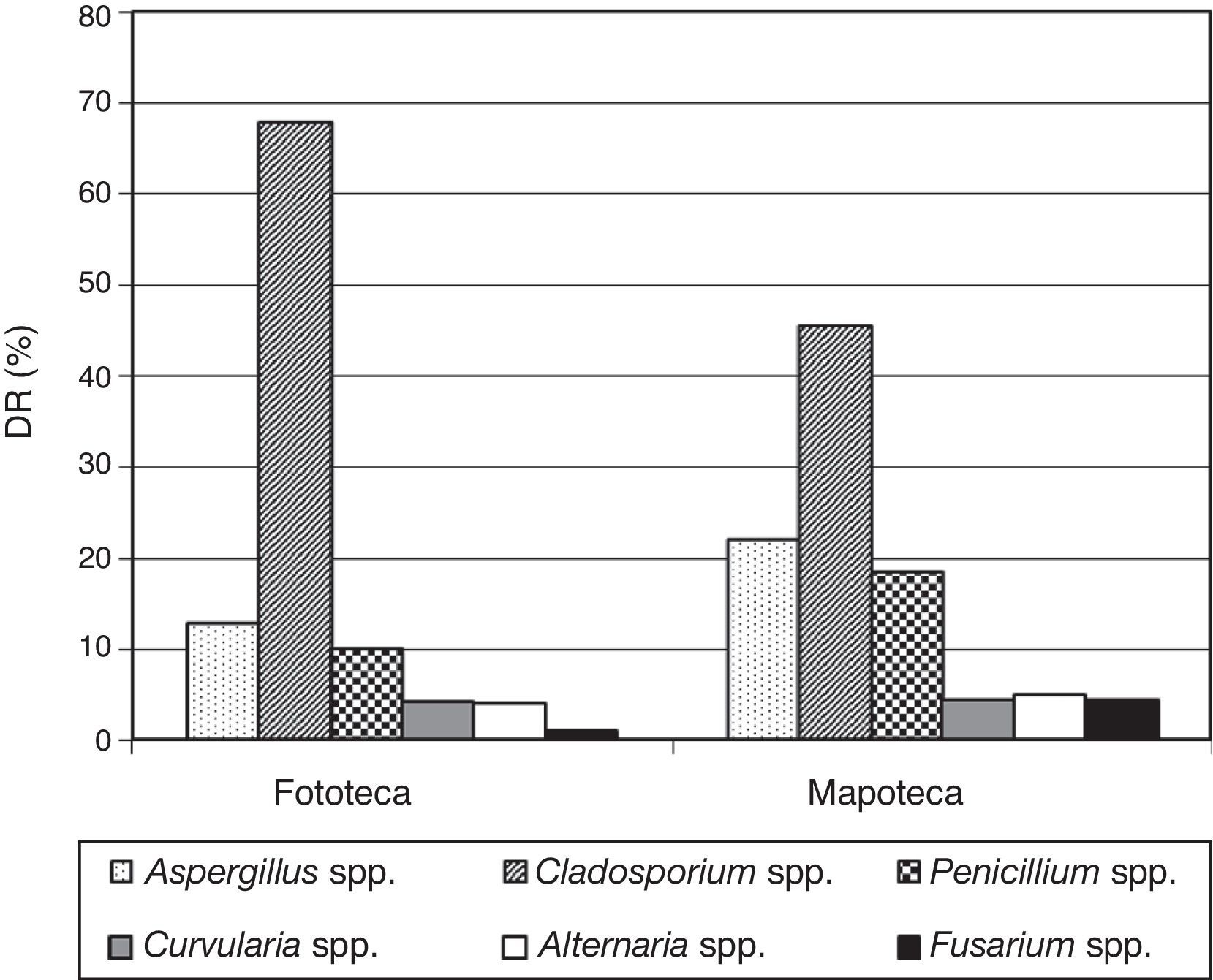
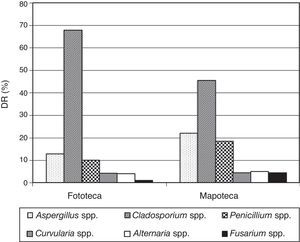
ResultadosLos valores medios de concentración fúngica aérea que se obtuvieron en los depósitos fueron de 120,2UFC/m3 para la mapoteca y de 245,6UFC/m3 para la fototeca; asimismo, los valores promedios de T y HR en el momento del muestreo fueron: Mapoteca, T=28,3°C, HR=62%, y Fototeca, T=22,5°C, HR=63%. Ambos valores de concentración fúngica resultaron inferiores a 500UFC/m3; según la escala que propuso Omeliansky1,5,7,19 para evaluar el grado de contaminación del aire, por encima de 500UFC/m3 el ambiente se considera contaminado, por tanto, los ambientes analizados se consideran no contaminados. Los géneros que predominaron fueron Cladosporium con un 67,9% en la fototeca y un 45,5% en la mapoteca, seguido por Aspergillus y Penicillium (fig. 1). Esos porcentajes del género Cladosporium se corresponden con 166,8UFC/m3 para la fototeca y 54,7UFC/m3 para la mapoteca.
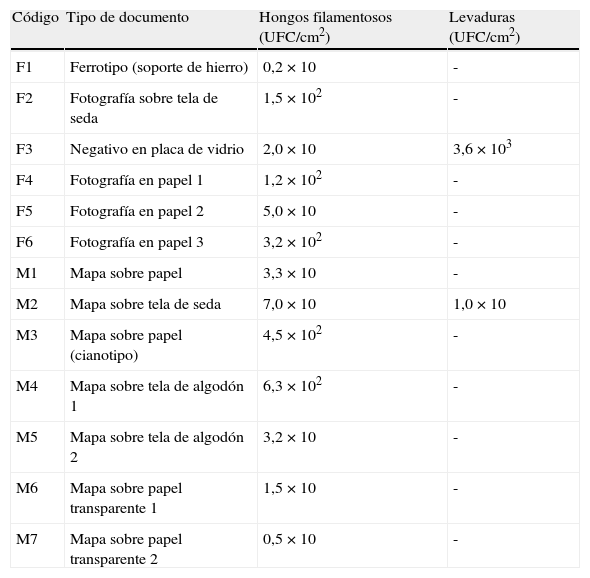
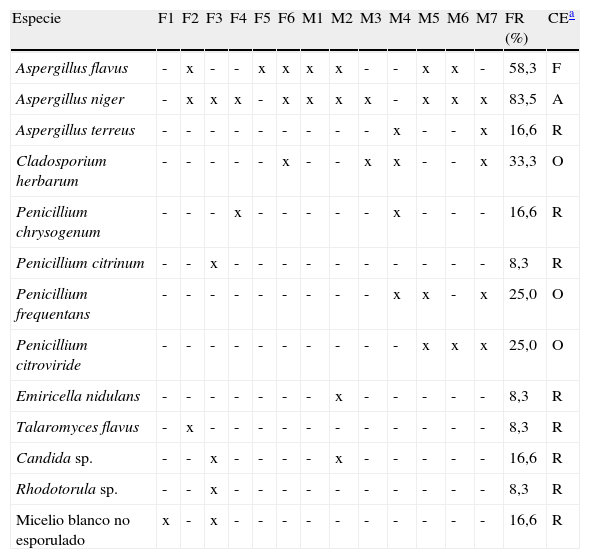
De los diferentes soportes documentales se obtuvieron concentraciones de hongos filamentosos que no superaron el orden de 6,3×102UFC/cm2 y diferentes concentraciones de levaduras solo en la placa de vidrio (F3) y en el mapa en seda (M2) (tabla 1). En la tabla 2 se pueden observar las diferentes especies fúngicas aisladas de los distintos documentos analizados. Se aprecia que las especies predominantes fueron Aspergillus niger y Aspergillus flavus, con un 83,5 y un 58,3% de frecuencia relativa de aparición, respectivamente, seguidos por especies del género Penicillium, que en su totalidad propician una preponderancia de este género (55,5%) en relación con Cladosporium herbarum (33,3%). También se observa que se pudieron aislar teleomorfos de los géneros Penicillium (Talaromyces flavus) y Aspergillus (Emericella nidulans) en una foto y un mapa, respectivamente, que tienen como soporte la seda, al igual que un pequeño porcentaje de hongos que no produjeron estructuras de reproducción en ningún medio de cultivo y, por tanto, no fue posible su identificación, denominándolos como micelio no esporulado (16,6%). Asimismo, se pudieron aislar cepas de levaduras pertenecientes a los géneros Candida y Rhodotorula con frecuencias relativas de aparición bajas (16,6 y 8,3%, respectivamente).
Concentración fúngica obtenida de varias fotografías y mapas en diferentes soportes
| Código | Tipo de documento | Hongos filamentosos (UFC/cm2) | Levaduras (UFC/cm2) |
| F1 | Ferrotipo (soporte de hierro) | 0,2×10 | - |
| F2 | Fotografía sobre tela de seda | 1,5×102 | - |
| F3 | Negativo en placa de vidrio | 2,0×10 | 3,6×103 |
| F4 | Fotografía en papel 1 | 1,2×102 | - |
| F5 | Fotografía en papel 2 | 5,0×10 | - |
| F6 | Fotografía en papel 3 | 3,2×102 | - |
| M1 | Mapa sobre papel | 3,3×10 | - |
| M2 | Mapa sobre tela de seda | 7,0×10 | 1,0×10 |
| M3 | Mapa sobre papel (cianotipo) | 4,5×102 | - |
| M4 | Mapa sobre tela de algodón 1 | 6,3×102 | - |
| M5 | Mapa sobre tela de algodón 2 | 3,2×10 | - |
| M6 | Mapa sobre papel transparente 1 | 1,5×10 | - |
| M7 | Mapa sobre papel transparente 2 | 0,5×10 | - |
Especies aisladas de los diferentes soportes fotográficos y de los mapas, así como su frecuencia relativa de aparición
| Especie | F1 | F2 | F3 | F4 | F5 | F6 | M1 | M2 | M3 | M4 | M5 | M6 | M7 | FR (%) | CEa |
| Aspergillus flavus | - | x | - | - | x | x | x | x | - | - | x | x | - | 58,3 | F |
| Aspergillus niger | - | x | x | x | - | x | x | x | x | - | x | x | x | 83,5 | A |
| Aspergillus terreus | - | - | - | - | - | - | - | - | - | x | - | - | x | 16,6 | R |
| Cladosporium herbarum | - | - | - | - | - | x | - | - | x | x | - | - | x | 33,3 | O |
| Penicillium chrysogenum | - | - | - | x | - | - | - | - | - | x | - | - | - | 16,6 | R |
| Penicillium citrinum | - | - | x | - | - | - | - | - | - | - | - | - | - | 8,3 | R |
| Penicillium frequentans | - | - | - | - | - | - | - | - | - | x | x | - | x | 25,0 | O |
| Penicillium citroviride | - | - | - | - | - | - | - | - | - | - | x | x | x | 25,0 | O |
| Emiricella nidulans | - | - | - | - | - | - | - | x | - | - | - | - | - | 8,3 | R |
| Talaromyces flavus | - | x | - | - | - | - | - | - | - | - | - | - | - | 8,3 | R |
| Candida sp. | - | - | x | - | - | - | - | x | - | - | - | - | - | 16,6 | R |
| Rhodotorula sp. | - | - | x | - | - | - | - | - | - | - | - | - | - | 8,3 | R |
| Micelio blanco no esporulado | x | - | x | - | - | - | - | - | - | - | - | - | - | 16,6 | R |
A: abundante; F: frecuente; FR: frecuencia relativa de aparición; O: ocasional; R: raro (bajo).
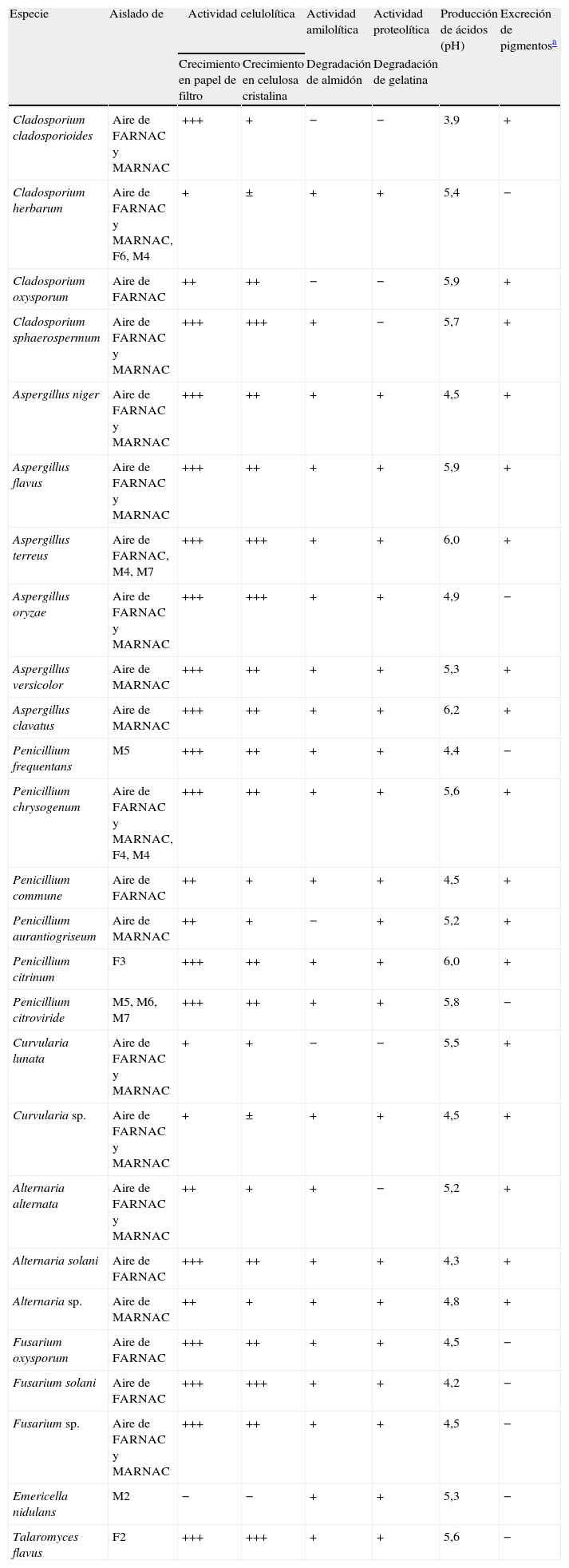
La tabla 3 muestra el comportamiento cualitativo de las cepas para degradar diferentes fuentes carbonadas, así como excretar pigmentos y ácidos. Se puede apreciar que el 99% de ellas degradaron el papel de filtro y la celulosa cristalina con mayor o menor intensidad, y produjeron ácidos que excretaron al medio; el 80,8% de las cepas degradaron el almidón y la gelatina y solo el 615% de ellas excretaron pigmentos sobre la tira de papel de filtro (tonalidades amarillas a ámbar) o la colorearon de gris oscuro a negro con las hifas pigmentadas (hongos dematiáceos) una vez que formaron la biopelícula.
Actividades hidrolíticas cualitativas de las cepas fúngicas aisladas del aire de la Fototeca, la Mapoteca, de fotos y mapas
| Especie | Aislado de | Actividad celulolítica | Actividad amilolítica | Actividad proteolítica | Producción de ácidos (pH) | Excreción de pigmentosa | |
| Crecimiento en papel de filtro | Crecimiento en celulosa cristalina | Degradación de almidón | Degradación de gelatina | ||||
| Cladosporium cladosporioides | Aire de FARNAC y MARNAC | +++ | + | − | − | 3,9 | + |
| Cladosporium herbarum | Aire de FARNAC y MARNAC, F6, M4 | + | ± | + | + | 5,4 | − |
| Cladosporium oxysporum | Aire de FARNAC | ++ | ++ | − | − | 5,9 | + |
| Cladosporium sphaerospermum | Aire de FARNAC y MARNAC | +++ | +++ | + | − | 5,7 | + |
| Aspergillus niger | Aire de FARNAC y MARNAC | +++ | ++ | + | + | 4,5 | + |
| Aspergillus flavus | Aire de FARNAC y MARNAC | +++ | ++ | + | + | 5,9 | + |
| Aspergillus terreus | Aire de FARNAC, M4, M7 | +++ | +++ | + | + | 6,0 | + |
| Aspergillus oryzae | Aire de FARNAC y MARNAC | +++ | +++ | + | + | 4,9 | − |
| Aspergillus versicolor | Aire de MARNAC | +++ | ++ | + | + | 5,3 | + |
| Aspergillus clavatus | Aire de MARNAC | +++ | ++ | + | + | 6,2 | + |
| Penicillium frequentans | M5 | +++ | ++ | + | + | 4,4 | − |
| Penicillium chrysogenum | Aire de FARNAC y MARNAC, F4, M4 | +++ | ++ | + | + | 5,6 | + |
| Penicillium commune | Aire de FARNAC | ++ | + | + | + | 4,5 | + |
| Penicillium aurantiogriseum | Aire de MARNAC | ++ | + | − | + | 5,2 | + |
| Penicillium citrinum | F3 | +++ | ++ | + | + | 6,0 | + |
| Penicillium citroviride | M5, M6, M7 | +++ | ++ | + | + | 5,8 | − |
| Curvularia lunata | Aire de FARNAC y MARNAC | + | + | − | − | 5,5 | + |
| Curvularia sp. | Aire de FARNAC y MARNAC | + | ± | + | + | 4,5 | + |
| Alternaria alternata | Aire de FARNAC y MARNAC | ++ | + | + | − | 5,2 | + |
| Alternaria solani | Aire de FARNAC | +++ | ++ | + | + | 4,3 | + |
| Alternaria sp. | Aire de MARNAC | ++ | + | + | + | 4,8 | + |
| Fusarium oxysporum | Aire de FARNAC | +++ | ++ | + | + | 4,5 | − |
| Fusarium solani | Aire de FARNAC | +++ | +++ | + | + | 4,2 | − |
| Fusarium sp. | Aire de FARNAC y MARNAC | +++ | ++ | + | + | 4,5 | − |
| Emericella nidulans | M2 | − | − | + | + | 5,3 | − |
| Talaromyces flavus | F2 | +++ | +++ | + | + | 5,6 | − |
FARNAC: Fototeca; MARNAC: Mapoteca; +++: crecimiento abundante; ++: crecimiento moderado; +: crecimiento pobre sobre la fuente celulósica, también es indicativo de actividad amilolítica, proteolítica y de la excreción de pigmento; ±: crecimiento o producción de pigmento muy pobre; −: NO crecimiento y NO producción de pigmento.
Al observar las tablas 2 y 3 se puede apreciar que de un total de 26 especies de hongos filamentosos aislados, solamente 5 fueron detectadas tanto en el aire de los depósitos como sobre algún soporte documental analizado. Estas fueron A. flavus, A. niger, Aspergillus terreus, C. herbarum, Penicillium chrysogenum.
DiscusiónLa concentración de la micobiota en los depósitos estudiados no sobrepasó las 500UFC/m3, por lo que se considera que los ambientes son limpios y aceptables tanto para la conservación de los soportes patrimoniales como para la salud del personal, según los parámetros que estableció Omeliansky en su método1,5. Estudios precedentes de estos locales arrojaron resultados similares6,7,9,10. Aunque desde hace algunos años grupos multidisciplinarios de científicos han dedicado esfuerzos y tiempo a los estudios de calidad del aire interior de locales por el riesgo potencial que implica la presencia de altas concentraciones de hongos en ambientes interiores para la salud humana y la integridad del patrimonio, en la actualidad no existe un consenso internacional en cuanto a regulaciones que establezcan valores límites que permitan clasificar a un ambiente interior como contaminado o no. No obstante, en la literatura se encuentran disponibles algunos criterios para valores de contaminación fúngica en ambientes interiores desarrollados por varias instituciones. La Organización Mundial de la Salud plantea que un ambiente interior con una concentración mayor de 1.000UFC/m3 se considera contaminado32. Sin embargo, para Brasil, un ambiente interior con más de 700UFC/m3 de hongos se considera contaminado37. En Estados Unidos, la American Conference of Industrial Hygienists y US Public Health Service proponen que 200UFC/m3 resulta un valor preocupante para bioaerosoles fúngicos23, mientras que la Unión Europea estableció desde 1998 en las normas SBM45 que 500UFC/m3 es el valor límite a partir del cual se considera un ambiente interior altamente contaminado. Asimismo, el Ministerio de Cultura de Italia estableció que 150UFC/m3 debe ser el límite máximo de hongos y 750UFC/m3 el de bacterias para que el ambiente interior de locales en museos se considere de calidad11.
El comportamiento de la concentración fúngica ha sido estable durante años en los locales analizados6,7,9,10 y está dado por las condiciones higiénicas de los depósitos, así como por los valores de HR próximos al 60% que se han mantenido muy cercanos a los recomendados para conservar estos tipos de documentos40,51, a pesar de que la HR media de La Habana es superior al 70% todo el año33.
La densidad relativa de aparición en el aire de los depósitos indicó que Cladosporium fue el género más abundante (67,9% en fototeca y 45,5% en mapoteca), lo que representa concentraciones de 166,8 y 54,7CFU/m3, respectivamente, e inferiores a las permisibles para este género en ambientes interiores (300UFC/m3)31. Los géneros Aspergillus y Penicillium secundaron al género Cladosporium, coincidiendo con otros reportes que establecen a estos tres géneros como los principales contaminantes de ambientes interiores a nivel mundial16,32,47,49 y comúnmente aislados en casas, archivos, bibliotecas y museos de Cuba6-10,19,22,41,42,50. También, se detectaron pequeños porcentajes de cepas pertenecientes a los géneros Curvularia, Alternaria y Fusarium que, igualmente, están reportados en los ambientes antes mencionados.
Con relación a los hongos aislados de los soportes analizados, se pudieron detectar diferentes cantidades de hongos filamentosos en todos los soportes, en tanto que levaduras solo fueron encontradas en una técnica fotográfica que posee cristal como soporte primario (F3) y en un mapa cuyo soporte es de seda (M2). Es conveniente señalar que las concentraciones de hongos filamentosos no fueron superiores a 6,3×102 UFC/cm2 y que en el caso de la placa de vidrio la concentración de levaduras fue muy alta (3,6×103 UFC/cm2).
Las concentraciones de levaduras detectadas resultaron inferiores a las reportadas por Borrego et al.7 y coincidieron con los géneros Candida y Rhodotorula, reportados con anterioridad7. De estos géneros se conoce que ciertas especies de Candida son dañinas para la salud humana47.
En cuanto a la frecuencia relativa de las especies fúngicas aisladas en los materiales estudiados, se obtuvo un predominio de A. niger y A. flavus, que se consideran ecológicamente frecuentes y abundantes15. C. herbarum, única especie del género Cladosporium detectada, ocupó el tercer lugar de predominio, con un 33,3%, por lo que se considera una especie ocasional. Otras especies que se consideran como ocasionales fueron Penicillium frequentans y Penicillium citroviride. Un porcentaje considerable (16,6%) correspondió a un micelio blanco que no esporuló en ningún medio de cultivo ensayado (micelio no esporulado). En frecuencias de aparición más bajas se detectaron los teleomorfos de los géneros Penicillium (T. flavus) y Aspergillus (E. nidulans). Cuando se analiza la frecuencia relativa de aparición de los géneros Aspergillus, Penicillium y sus teleomorfos en su totalidad, se puede apreciar que fueron los que predominaron. Este resultado se corresponde con los valores de actividad de agua de estos géneros (aw<0,8) y los valores de HR de los depósitos estudiados52.
Hay que señalar que de las 26 especies de hongos filamentosos detectados, solamente 5 se encontraron tanto en el aire de los depósitos como sobre uno o más de los soportes documentales analizados (A. flavus, A. niger, Aspergillus terreus, C. herbarum, Penicillium chrysogenum). Esta coincidencia ecológica representa el 19,3%, que según Esquivel et al.15 se considera baja y es indicativa de que al parecer el aire ha incidido poco en la micobiota que se pudo detectar en los soportes analizados.
Según Florian16, los teleomorfos son difíciles de aislar de los soportes documentales, sin embargo otros autores anteriormente han logrado aislar e identificar estas formas fúngicas7,19,30, coincidiendo nuestros resultados con los antes mencionados. En trabajos previos, un teleomorfo de Penicillium spp. (Talaromyces helicus) se aisló de un mapa en seda7,19 y en esta ocasión ocurrió lo mismo, la diferencia estriba en que ahora es un teleomorfo de Aspergillus spp. (E. nidulans). Cabe destacar el hecho de que en este trabajo se detectó otro teleomorfo de Penicillium spp. (Talaromyces flavus) en una fotografía cuyo soporte también es seda. Todo parece indicar que la seda facilita la preservación de estas formas fúngicas en el tiempo.
La actividad hidrolítica cualitativa de las cepas fúngicas aisladas tanto del aire como de los soportes mostró que el 99% fueron capaces de crecer a expensas del papel de filtro (formado por celulosa amorfa y cristalina), utilizando la celulosa como única fuente de carbono, lo que demuestra que poseen actividad celulolítica. Asimismo, cerca del 81% de las cepas mostraron actividad amilolítica y proteolítica. La totalidad de las cepas analizadas produjeron ácidos, pues provocaron una disminución significativa del pH del medio de cultivo. Casi el 62% excretaron pigmentos sobre el papel, abarcando diferentes tonalidades, desde el amarillo hasta el carmelita intenso.
Se conoce desde hace años que los hongos provocan alteraciones cromáticas por manchas de diferentes colores, tonalidades y texturas producto del crecimiento micelial y por los pigmentos que excretan. En particular, los altamente celulolíticos llegan a atacar las fibras celulósicas y las debilitan. Es decir, que además de las afectaciones cromáticas, producen daños químicos y estructurales16,20,21,27,50.
Por todo ello, la manera de mantener estas colecciones en buen estado implicaría la realización de una limpieza profunda por aspiración para eliminar parte de la suciedad adherida y disminuir la carga microbiana en su superficie, así como mantener las condiciones climáticas correctas para su conservación (T≤25°C y HR≤65%)40,51.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo financiero concedido por el Programa de Ayuda para los Archivos de Iberoamérica (ADAI), proyecto 146/2008.