La descripción antiguamente más frecuente de la mucormicosis era la afectación nasosinusal en pacientes con cetoacidosis diabética. Sin embargo, en los últimos años han surgido nuevos grupos de pacientes con riesgo de mucormicosis.
Objetivos y métodosSe realizó un análisis retrospectivo de las características, tratamiento y evolución de los pacientes con mucormicosis en nuestro hospital (años 2012-2016).
ResultadosDe los 12 pacientes del estudio, siete padecían alguna enfermedad hematológica como factor predisponente, la mayoría (6 pacientes) por trasplante de progenitores hematopoyéticos. Solamente un paciente estaba en cetoacidosis diabética. Siete pacientes del total estaban recibiendo antifúngicos al inicio de los síntomas, y 9 pacientes los habían recibido los tres meses previos. La afectación fue rinosinusal (16,6%), pulmonar localizada (33,3%), musculoesquelética (25%) y diseminada (25%). En 8 pacientes se realizó desbridamiento quirúrgico. Seis pacientes recibieron tratamiento combinado con anfotericina B y posaconazol (mortalidad de grupo 16%), y 4 pacientes fueron tratados con anfotericina B en monoterapia (mortalidad 50%), con una mortalidad global del 41%. La mortalidad de los pacientes con afectación pulmonar fue del 71%, y en el caso de enfermedad diseminada del 100%. Ningún paciente con afectación únicamente musculoesquelética falleció.
ConclusionesLa mucormicosis sigue teniendo una elevada mortalidad, especialmente las formas pulmonares. Las formas musculoesqueléticas tuvieron mejor pronóstico. El grupo de riesgo principal fue el de los pacientes con trasplante de médula ósea. El tratamiento combinado obtuvo mejores resultados que la monoterapia, aunque se necesita más experiencia para definir el tratamiento más adecuado.
The most common presentation of mucormycosis in the past was the nasosinusal involvement in patients with diabetic ketoacidosis. However, in the last few years, new groups of patients with risk of mucormycosis have emerged.
Aims and methodsRetrospective analysis of the characteristics, treatment and evolution of patients with mucormycosis in a tertiary hospital in the years 2012-2016.
ResultsOf the 12 patients included in the study, 7 had a haematological disease as a predisposing factor, most of them (6 patients) related to transplantation of haematopoietic progenitors. Only one patient had diabetic ketoacidosis. Seven out of the twelve patients were receiving an antifungal treatment at the onset of symptoms, and 9 patients had received them three months before. The clinical presentation was rhinosinusal (16.6%), localised lung disease (33.3%), and musculoskeletal (25%) and disseminated disease (25%). Surgical debridement was performed on 8 patients. Combination therapy with amphotericin B and posaconazole was received by 6 patients (16% mortality), and 4 patients were treated with amphotericin B alone (50% mortality), with an overall mortality of 41%. The mortality of patients with pulmonary involvement was 71%, increasing to 100% in the case of disseminated disease. None of the patients with only musculoskeletal involvement died.
ConclusionsMucormycosis has a high mortality rate, especially the pulmonary forms. Musculoskeletal involvement had a better prognosis. The main group at risk was that of patients with haematopoietic stem cell transplantation. Combination therapy had better results than monotherapy, although more experience is needed to define the most appropriate treatment.
La mucormicosis, una infección grave por hongos del orden Mucorales, se considera actualmente la tercera enfermedad fúngica invasiva más frecuente, después de la candidiasis y la aspergilosis, y algunos autores sugieren que su incidencia está en aumento7. En los últimos años han surgido nuevos grupos de pacientes con riesgo de mucormicosis en los que la presentación de la enfermedad difiere de la forma antiguamente más frecuente de afectación nasosinual en la cetoacidosis diabética grave18 y sobre los que se dispone de menos información. En este estudio retrospectivo presentamos las características y evolución de los pacientes diagnosticados de mucormicosis en nuestro centro entre los años 2012 y 2016.
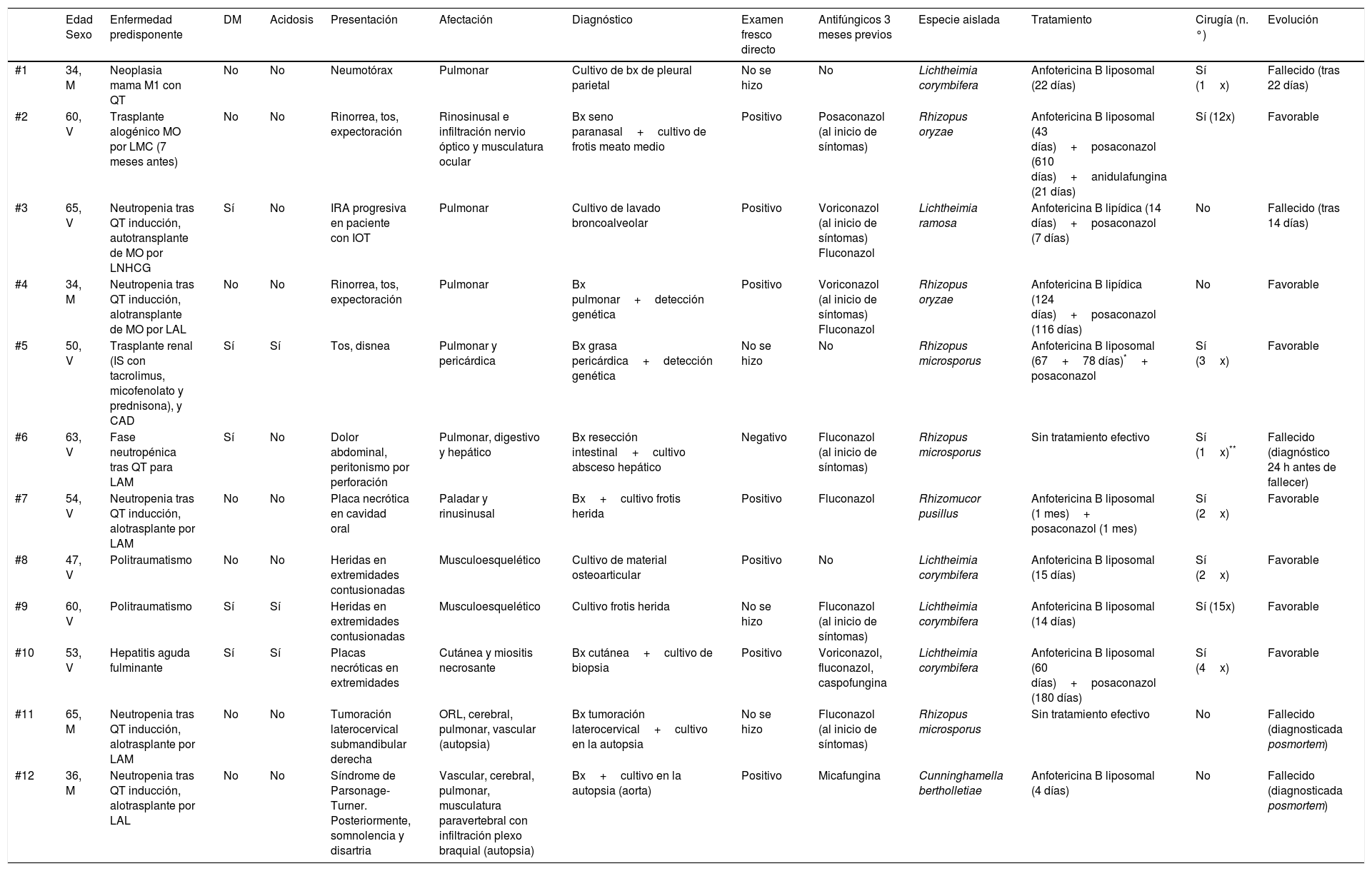
El número de pacientes afectados por esta enfermedad fue de 12, con una edad media de 51 años (desviación estándar=11) y predominantemente varones (4:1) (tabla 1). El principal factor predisponente fue la quimioterapia por enfermedad hematológica (7/12): cinco pacientes se encontraban en la fase de inducción y uno en la de mantenimiento para el trasplante de progenitores hematopoyéticos; el séptimo paciente estaba en la fase de inducción de tratamiento de leucemia aguda mieloide. El resto de pacientes (5/12) eran un paciente con un trasplante renal en cetoacidosis diabética, una receptora de quimioterapia por carcinoma de mama, dos pacientes politraumatizados y uno con hepatitis fulminante.
Características clínicas, tratamiento y evolución de los pacientes con mucormicosis diagnosticados en nuestro centro entre los años 2012 y 2016
| Edad Sexo | Enfermedad predisponente | DM | Acidosis | Presentación | Afectación | Diagnóstico | Examen fresco directo | Antifúngicos 3 meses previos | Especie aislada | Tratamiento | Cirugía (n.°) | Evolución | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| #1 | 34, M | Neoplasia mama M1 con QT | No | No | Neumotórax | Pulmonar | Cultivo de bx de pleural parietal | No se hizo | No | Lichtheimia corymbifera | Anfotericina B liposomal (22 días) | Sí (1x) | Fallecido (tras 22 días) |
| #2 | 60, V | Trasplante alogénico MO por LMC (7 meses antes) | No | No | Rinorrea, tos, expectoración | Rinosinusal e infiltración nervio óptico y musculatura ocular | Bx seno paranasal+cultivo de frotis meato medio | Positivo | Posaconazol (al inicio de síntomas) | Rhizopus oryzae | Anfotericina B liposomal (43 días)+posaconazol (610 días)+anidulafungina (21 días) | Sí (12x) | Favorable |
| #3 | 65, V | Neutropenia tras QT inducción, autotransplante de MO por LNHCG | Sí | No | IRA progresiva en paciente con IOT | Pulmonar | Cultivo de lavado broncoalveolar | Positivo | Voriconazol (al inicio de síntomas) Fluconazol | Lichtheimia ramosa | Anfotericina B lipídica (14 días)+posaconazol (7 días) | No | Fallecido (tras 14 días) |
| #4 | 34, M | Neutropenia tras QT inducción, alotransplante de MO por LAL | No | No | Rinorrea, tos, expectoración | Pulmonar | Bx pulmonar+detección genética | Positivo | Voriconazol (al inicio de síntomas) Fluconazol | Rhizopus oryzae | Anfotericina B lipídica (124 días)+posaconazol (116 días) | No | Favorable |
| #5 | 50, V | Trasplante renal (IS con tacrolimus, micofenolato y prednisona), y CAD | Sí | Sí | Tos, disnea | Pulmonar y pericárdica | Bx grasa pericárdica+detección genética | No se hizo | No | Rhizopus microsporus | Anfotericina B liposomal (67+78 días)*+ posaconazol | Sí (3x) | Favorable |
| #6 | 63, V | Fase neutropénica tras QT para LAM | Sí | No | Dolor abdominal, peritonismo por perforación | Pulmonar, digestivo y hepático | Bx resección intestinal+cultivo absceso hepático | Negativo | Fluconazol (al inicio de síntomas) | Rhizopus microsporus | Sin tratamiento efectivo | Sí (1x)** | Fallecido (diagnóstico 24 h antes de fallecer) |
| #7 | 54, V | Neutropenia tras QT inducción, alotrasplante por LAM | No | No | Placa necrótica en cavidad oral | Paladar y rinusinusal | Bx+cultivo frotis herida | Positivo | Fluconazol | Rhizomucor pusillus | Anfotericina B liposomal (1 mes)+ posaconazol (1 mes) | Sí (2x) | Favorable |
| #8 | 47, V | Politraumatismo | No | No | Heridas en extremidades contusionadas | Musculoesquelético | Cultivo de material osteoarticular | Positivo | No | Lichtheimia corymbifera | Anfotericina B liposomal (15 días) | Sí (2x) | Favorable |
| #9 | 60, V | Politraumatismo | Sí | Sí | Heridas en extremidades contusionadas | Musculoesquelético | Cultivo frotis herida | No se hizo | Fluconazol (al inicio de síntomas) | Lichtheimia corymbifera | Anfotericina B liposomal (14 días) | Sí (15x) | Favorable |
| #10 | 53, V | Hepatitis aguda fulminante | Sí | Sí | Placas necróticas en extremidades | Cutánea y miositis necrosante | Bx cutánea+cultivo de biopsia | Positivo | Voriconazol, fluconazol, caspofungina | Lichtheimia corymbifera | Anfotericina B liposomal (60 días)+posaconazol (180 días) | Sí (4x) | Favorable |
| #11 | 65, M | Neutropenia tras QT inducción, alotrasplante por LAM | No | No | Tumoración laterocervical submandibular derecha | ORL, cerebral, pulmonar, vascular (autopsia) | Bx tumoración laterocervical+cultivo en la autopsia | No se hizo | Fluconazol (al inicio de síntomas) | Rhizopus microsporus | Sin tratamiento efectivo | No | Fallecido (diagnosticada posmortem) |
| #12 | 36, M | Neutropenia tras QT inducción, alotrasplante por LAL | No | No | Síndrome de Parsonage-Turner. Posteriormente, somnolencia y disartria | Vascular, cerebral, pulmonar, musculatura paravertebral con infiltración plexo braquial (autopsia) | Bx+cultivo en la autopsia (aorta) | Positivo | Micafungina | Cunninghamella bertholletiae | Anfotericina B liposomal (4 días) | No | Fallecido (diagnosticada posmortem) |
Bx: biopsia; CAD: cetoacidosis diabética; DM: diabetes mellitus; Dx: diagnóstico; IOT: intubación orotraqueal; IRA: insuficiencia respiratoria aguda; LAL: leucemia aguda linfoide; LAM: leucemia aguda mieloide; LMC: leucemia mieloide crónica; LNHCG: linfoma no Hodgkin de células gigantes; M: mujer; MO: médula ósea; QT: quimioterapia; TC: tomografía computarizada; V: varón.
Tras lobectomía pulmonar y 67 días de tratamiento con anfotericina B y posaconazol, y ante la ausencia de hallazgos de infección activa en la TC y la buena evolución, se retiró la anfotericina B y se mantuvo solamente el posaconazol. Sin embargo, 3 meses después se observa en la TC de control progresión de la enfermedad (las concentraciones de posaconazol durante ese periodo habían sido de 0,84-1,33μg/ml), por lo que se retomó el tratamiento con anfotericina B (78 días más) y se realizaron dos nuevas cirugías de desbridamiento pulmonar. Se mantuvo el tratamiento con posaconazol de manera permanente.
Al inicio de la sintomatología, cuatro pacientes estaban en tratamiento con fluconazol, dos con voriconazol y uno con posaconazol. Dos pacientes (16,6%) presentaron enfermedad rinosinusal con invasión de tejidos circundantes; cuatro (33,3%) enfermedad pulmonar localizada (en un caso con afectación pericárdica por contigüidad); tres (25%) afectación musculoesquelética; y tres (25%) enfermedad diseminada. En ocho casos había una biopsia tisular confirmatoria. En las muestras de diez pacientes se aisló el hongo por cultivo. En los otros dos casos se consiguió la detección por amplificación de ácidos nucleicos directamente de la muestra clínica mediante la metodología previamente descrita por Voigt y por Turenne23,24. Se realizó la identificación molecular de las cepas aisladas por el mismo procedimiento. Los géneros Rhizopus y Lichtheimia fueron los más prevalentes. El tiempo de crecimiento en cultivo fue de 2 a 5 días. No se dispone de estudios de sensibilidad. Seis pacientes recibieron tratamiento combinado con anfotericina B (AmB) y posaconazol, cuatro con AmB en monoterapia, y dos no cumplieron el tratamiento por fallecimiento precoz. Asimismo, en ocho pacientes se realizó desbridamiento quirúrgico, y en cuatro de ellos se realizó tres o más veces.
La mortalidad a los 30 días fue del 41% (5 pacientes); en el grupo de pacientes con un tratamiento combinado fue del 16% (un paciente de seis), y la de los pacientes tratados con monoterapia fue del 50% (dos pacientes de cuatro). Ningún paciente con afectación únicamente musculoesquelética falleció. La mortalidad a los 30 días de los pacientes con afectación pulmonar fue del 71% (cinco pacientes de siete), y la de aquellos con enfermedad diseminada del 100% (tres pacientes).
En este estudio reportamos una elevada mortalidad por esta enfermedad, especialmente en aquellos pacientes con afectación distinta a la osteomuscular. Se observa un cambio epidemiológico respecto a la descripción clásica puesto que en ningún paciente la cetoacidosis diabética era el único factor de riesgo. El grupo epidemiológico más frecuente fue el de los pacientes inmunodeprimidos, principalmente por enfermedad hematológica. Este hecho podría estar relacionado con distintos factores, como la mayor supervivencia actual de estos pacientes, especialmente desde la introducción del trasplante de progenitores hematopoyéticos de intensidad reducida, que permite la realización de este trasplante en pacientes con más comorbilidad y edad, y su mayor exposición a tratamientos prolongados con azoles activos frente a los géneros más frecuentes (Candida y Aspergillus) pero poco activos frente a los mucorales6,10. En nuestra serie, nueve pacientes (75%) habían recibido antifúngicos los tres meses previos. Otro factor podría ser el mejor control glucémico en los pacientes diabéticos; incluso algún autor sugiere que el uso de estatinas podría tener un cierto papel al inhibir la síntesis de ergosterol en la membrana celular fúngica, teniendo así actividad in vivo e in vitro frente a los mucorales14.
La afectación rinosinusal y pulmonar fueron las manifestaciones clínicas más frecuentes en nuestra serie. Esta última plantea el diagnóstico diferencial con la aspergilosis, que puede tener un patrón radiológico y clínico similar13. En ambas entidades la rentabilidad de los cultivos puede ser baja. La presencia de galactomanano orientará al diagnóstico de aspergilosis, mientras que un patrón radiológico de derrame pleural o más de 10 nódulos pulmonares son más sugestivos de mucormicosis2. Dado que un retraso en el inicio del tratamiento se asocia a una mayor mortalidad11, una biopsia tisular está indicada si existe sospecha de infección fúngica de etiología no clara.
Los antifúngicos con una mayor evidencia de curación son la AmB liposomal (dosis>5mg/kg), el posaconazol y el isavuconazol4,16,20. Estos dos últimos son los únicos triazoles con buena actividad frente a los mucorales. El itraconazol también tiene cierta actividad frente a los mucorales, aunque limitada5. En nuestra serie destaca el paciente #2, que desarrolló la infección a pesar de recibir profilaxis con posaconazol. La explicación más plausible sería que tuviera una baja concentración plasmática de posaconazol (no disponemos de los valores de concentración de ese periodo), pues recibía la fórmula líquida enteral, con una biodisponibilidad muy baja, particularmente si no se administra con una dieta rica en grasas. Otra explicación podría ser que se tratara de una cepa de Rhizopus resistente al posaconazol (no se realizaron estudios de sensibilidad con esta cepa).
A pesar de que la mortalidad de esta entidad se sitúa alrededor del 40-50%15,21, su baja incidencia hace que la pauta de tratamiento más eficaz no esté todavía bien establecida3. Algunos datos sugieren que la combinación de dos antifúngicos podría ser una opción razonable. En nuestra serie la mortalidad fue menor con esta estrategia terapéutica que la monoterapia (16 vs. 50%). En modelos animales la asociación de fármacos con dianas de actuación diferentes, como la AmB y las equinocandinas, parece ofrecer mejores resultados8, si bien este hecho ha sido observado únicamente en la mucormicosis por Rhizopus arrhizus. Un estudio retrospectivo que analizó 41 pacientes con mucormicosis rinocerebral observó un aumento de la supervivencia con esta combinación19. En este estudio, sin embargo, no se especificaba si el éxito terapéutico de esta asociación se observaba frente a los aislamientos de R. arrhizus. Otros estudios, en cambio, no encuentran diferencias significativas entre la monoterapia y la asociación con las equinocandinas1. Todavía está por resolver si la asociación de un azol con AmB puede mejorar el pronóstico. Actualmente no hay estudios clínicos en el ser humano que demuestren su eficacia, y las recomendaciones se basan en modelos in vitro o animales, con resultados dispares: algunos autores recomiendan su uso17, mientras que otros no observan un mejor pronóstico9 o incluso refieren actividad antagónica12.
Un pilar del tratamiento es el desbridamiento quirúrgico, incluso repetidas veces, de los tejidos necróticos, donde no penetra correctamente el antifúngico3. Otras medidas son la reducción del tratamiento inmunosupresor, especialmente los corticoides, con soporte en caso necesario de factores estimuladores de colonias, o el uso de cámaras hiperbáricas para las lesiones musculoesqueléticas. Se ha sugerido que el uso de quelantes de hierro puede ser beneficioso. Sin embargo, un estudio randomizado mostró una mayor mortalidad a los 30 y 90 días en los pacientes tratados con AmB asociada a quelantes del hierro en comparación con el grupo placebo (45 vs. 11%, p=0,1; 82 vs. 22%, p=0,01, respectivamente)22.
En conclusión, la mucormicosis es una infección que sigue teniendo una elevada mortalidad, especialmente las formas pulmonares, donde el diagnóstico es un reto para los clínicos. El grupo de riesgo más importante de este estudio fue el paciente con enfermedad hematológica. Las formas musculoesqueléticas se asociaron a un mejor pronóstico, quizás por la mayor accesibilidad para la obtención de muestras histológicas que permitieron un diagnóstico precoz, la ausencia de inmunosupresión (en los casos de politraumatismo), y que el desbridamiento quirúrgico en estos casos pudo ser amplio y completo. Asimismo, el tratamiento combinado también dio mejores resultados. En esta serie se refleja el cambio epidemiológico de esta infección, si bien tiene las limitaciones de un estudio retrospectivo y la muestra es pequeña. Se necesita más experiencia para definir el tratamiento antifúngico más adecuado.