La aspergilosis invasora es la infección fúngica invasora más frecuente en pacientes con neoplasias hematológicas agudas o tratados con trasplante de progenitores hematopoyéticos debido a la marcada alteración de los mecanismos fisiológicos de inmunidad antifúngica que tiene lugar en estas situaciones. Por este motivo, la profilaxis antifúngica tiene un papel relevante en estos pacientes. La introducción de nuevos agentes antifúngicos ha motivado la actualización de las recomendaciones de profilaxis y tratamiento en distintas guías.
Los objetivos de este capítulo son una breve revisión de los mecanismos de la inmunidad frente a los hongos, de la definición de riesgo de desarrollo de infección fúngica invasora y una actualización de las recomendaciones de profilaxis y el tratamiento de la aspergilosis invasora en el conjunto de pacientes con enfermedades hematológicas.
Invasive aspergillosis is the most common invasive fungal infection in patients with acute hematological malignancies or treated with hematopoietic stem cell transplantation due to the marked alteration of the physiological mechanisms of antifungal immunity that takes place in these situations. For this reason, antifungal prophylaxis has a relevant role in these patients. The introduction of new antifungal agents has motivated the updating of recommendations for prophylaxis and treatment in different guidelines.
The objectives of this chapter are a brief review of the mechanisms of immunity against fungi, the definition of risk for developing an invasive fungal infection and an update of the prophylaxis recommendations and treatment of invasive aspergillosis in the group of patients with hematological diseases.
La aspergilosis invasora es una infección causada por hongos del género Aspergillus que afecta fundamentalmente a pacientes con leucemia aguda mieloide y a pacientes tratados con trasplante alogénico de progenitores hematopoyéticos (TPH-Alo), pero que también se presenta en otras neoplasias hematológicas39,40. A pesar de los avances en la profilaxis y el tratamiento de la aspergilosis invasora, su incidencia y su mortalidad siguen siendo elevadas, incluso en pacientes sin factores de riesgo reconocibles41.
Es importante entender la aspergilosis invasora como una entidad multifactorial con un riesgo diferente en el que influyen factores genéticos del paciente, la epidemiología local de cada centro, el momento de la enfermedad y el tratamiento administrado.
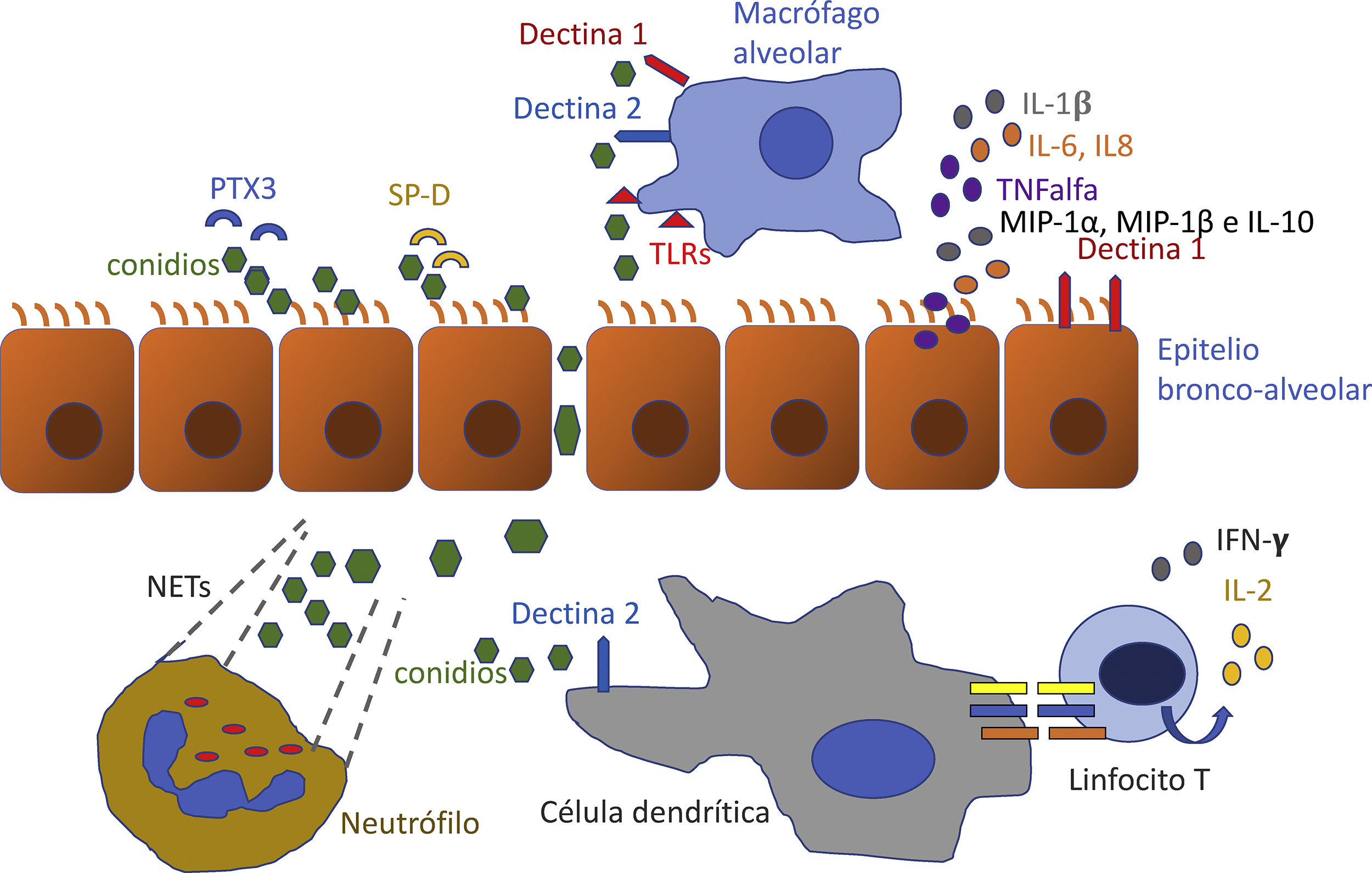
Inmunidad frente a Aspergillus fumigatus en los pacientes con enfermedades onco-hematológicasLa protección fisiológica frente a Aspergillus depende de una interacción altamente coordinada entre la inmunidad innata y la adaptativa. El reconocimiento de los hongos a través de receptores de patrones moleculares asociados a patógenos (PAMPs), tales como la pentraxina-3, la dectina-1 y los receptores de tipo Toll (TLRs), conduce a la activación del complemento, la fagocitosis y la destrucción de los hongos. Las células T-helper1 y17, específicas en la respuesta inmune contra los hongos, producen citoquinas tales como el interferón (IFN) y la interleucina 17 (IL-17) que incrementan la activación de los macrófagos y el reclutamiento de los neutrófilos, respectivamente. Los defectos genéticos o inducidos por fármacos en los componentes de la inmunidad antifúngica aumentan el riesgo de sufrir aspergilosis invasora después de una quimioterapia o de un trasplante de progenitores hematopoyéticos. Las infecciones por Aspergillus están causadas más frecuentemente por Aspergillus fumigatus que por Aspergillus flavus, Aspergillus niger, Aspergillus terreus u otras especies.
En el paciente oncohematológico suelen estar alterados varios de los mecanismos de inmunidad, lo que justifica el alto riesgo de infección fúngica observada en este tipo de pacientes. El mejor conocimiento de la respuesta inmune frente a A. fumigatus puede permitir desarrollar nuevas estrategias para reducir la mortalidad relacionada con esta infección y anticipar el aumento del riesgo asociado a nuevos tratamientos que interfieren en vías metabólicas críticas para la correcta activación inmune. La inmunidad frente a Aspergillus se puede dividir de forma esquemática en tres líneas (fig. 1).
Primera línea: inmunidad innata. Barrera mucosa y macrófagos alveolaresA. fumigatus es un hongo filamentoso ubicuo y saprófito que forma y libera conidios que son transportados por el aire y son inhalados a diario. Tras la inhalación de los conidios su germinación se evita mediante la barrera mucosa y los macrófagos alveolares. Si el hongo no se elimina de manera efectiva, los conidios germinan y forman hifas invasoras que pueden penetrar en el tejido pulmonar y diseminarse por invasión vascular. El epitelio de las vías respiratorias incluye neumocitos de tipo II y sus secreciones, células traqueales y neumocitos de tipo I, y representan el primer punto de contacto de los conidios de A. fumigatus inhalados y la primera barrera de defensa15. La mayoría de los conidios son atrapados por la mucosa y eliminados por la acción ciliar, aunque la eliminación de los conidios puede ser poco eficiente por la acción tóxica de moléculas producidas por Aspergillus (verruculogeno, gliotoxina, fumagilina). Estas células pueden internalizar los conidios al incluirlos en vesículas endo-lisosomales que los exponen a medio ácido, pero con una actividad fungicida débil. Además, segregan péptidos antimicrobianos, algunos con actividad frente a A.fumigatus como la lactoferrina (secuestro del hierro, necesario para el crecimiento del hongo), beta-defensinas y quitinasas (degradan la quitina de la pared fúngica)4.
El surfactante pulmonar contiene receptores solubles para A.fumigatus que actúan como opsoninas: mejoran el reconocimiento y la fagocitosis de conidios por los macrófagos alveolares y neutrófilos, y activan el complemento por la vía de las lectinas. Entre los receptores solubles se incluye la pentraxina-3 (PTX3), el complemento, las colectinas (mannan binding lectins [MBL], MBL asociadas a proteasas de serina [MASPs], proteína surfactante pulmonar A y D [SP-A y SP-D]) y las ficolinas. Se unen a conidios, facilitan la fagocitosis por los macrófagos alveolares y activan el complemento por la vía de las lectinas.
Además, los macrófagos y células epiteliales disponen de receptores de superficie de patrones moleculares específicos (PAMP) como la dectina-1, la dectina-2 y los TLRs. La dectina-1 es un receptor de lectinas tipoC61 que reconoce residuos de β-glucano en conidios hinchados y en germinación, activando vías como Syk cinasa, el inflamasoma CARD9 (caspase-associated domain-containing protein 9) y NF-κB (nuclear factor kappa B), que inducen la expresión de citocinas y quimiocinas como TNF-α (tumor necrosis factor alpha), IL-6, IL-1α, IL-1β, G-CSF (factor estimulante de colonia de granulocitos), GM-CSF (factor estimulante de colonia de granulocito/macrófago), MIP-1 y MIP-1 (proteínas inflamatorias del macrófago alfa y beta e IL-1052. La dectina-2 reconoce α-mananos, lo que induce la producción de IL-1β, TNF- α, IL-23 e IL-10 mediada por Syk cinasa y NFκB47.
Los TLR son receptores de membrana y endosomales caracterizados por un dominio extracelular que reconocen PAMPS; ello induce una respuesta en cascada que culmina con la activación de los factores de transcripción nuclear NF-κB y AP-1, dando lugar a una respuesta inmune específica26,54.
Los macrófagos alveolares fagocitan y destruyen conidios mediante mecanismos oxidativos como la generación de especies reactivas de oxígeno (ROS), los aniones superóxido y peróxido de hidrógeno, y por mecanismos no oxidativos, que incluyen la acidificación del fago-lisosoma19.
Segunda línea: inmunidad innata. Neutrófilos, células NK, células dendríticas, macrófagosLos neutrófilos son las primeras células reclutadas en el foco infeccioso. Tienen una potente capacidad fagocítica mediada por receptores del complemento y la fracción constante de las inmunoglobulinas. Los neutrófilos disponen de mecanismos oxidativos como la síntesis de radicales libres que provocan alteraciones en la estructura de proteínas, degradación de ácidos nucleicos y peroxidación lipídica20. Recientemente se ha descubierto que los neutrófilos pueden generar fibras o redes extracelulares llamadas trampas extracelulares de neutrófilos (neutrophil extracelular traps [NET]). Las NET son una barrera física que evita la diseminación del patógeno, facilita su muerte al favorecer la alta concentración de moléculas antimicrobianas y limita el daño del tejido. Es particularmente importante en la defensa frente a patógenos que son demasiado grandes para ser fagocitados, como es el caso de las hifas de A. fumigatus6.
En cuanto a los monocitos, fagocitan conidios de forma eficaz e inhiben la germinación de los conidios a hifas (población de monocitos clásicos o fagocitadores CD14+/CD16−) o secretan altas cantidades de TNFα tras la exposición al hongo (población CD14+/CD16+ o monocitos no clásicos o inflamatorios). Pueden diferenciarse a células dendríticas que transportan los conidios a los ganglios linfáticos que drenan el pulmón, iniciando así una respuesta específica de linfocitosT CD4+. Por tanto, desempeñan un papel crucial en la diseminación de la infección fúngica y también en el inicio de la respuesta adaptativa antifúngica16.
Tercera línea: inmunidad adaptativaLa expresión de antígenos fúngicos en moléculas coestimuladoras del complejo mayor de histocompatibilidad de clase II (MHC-II) de los fagocitos activa a los linfocitos T CD4+ colaboradores o helper, que pertenecen a la inmunidad adaptativa, proceso denominado presentación antigénica. Las citoquinas liberadas por los linfocitos helper tipo 1 -Th1- (IFN-γ) y las liberadas de los linfocitos helper tipo 2 - Th2- (IL-4 e IL-10) tienen efectos opuestos sobre las funciones efectoras de algunos tipos de macrófagos y de células dendríticas, inmunoprotectores o facilitadores de la infección por A. fumigatus por su acción anti-inflamatoria y cicatrizante del tejido, respectivamente24.
Variabilidad genética y polimorfismosExisten numerosas regiones de variabilidad genética dentro de los genes implicados, tanto en la respuesta inmunológica innata como en la adquirida. Las variaciones de un único nucleótido (single nucleotide polymorphism [SNP]) en regiones incluidas en genes de moléculas inmunológicas están asociadas con la susceptibilidad o la resistencia a padecer infecciones. Esto explica una cierta variabilidad en la incidencia de la infección fúngica invasiva (IFI) en pacientes oncohematológicos con similares factores de riesgo clínicos. Se han descrito alteraciones de la inmunidad frente a hongos en relación con polimorfismos genéticos en citoquinas, quimioquinas y sus receptores, incluyendo IL-1, TNF-α, IL-6, IL-10, CXCL10 e IL23R48, polimorfismos en receptores de PAMPs (TLR y dectina-1)14 y polimorfismos en receptores solubles (PTX3, MBL)13.
Definición de riesgo de IFIComo se ha señalado anteriormente, el riesgo de que un paciente hematológico desarrolle una IFI depende de factores como las características del paciente (condiciones biológicas, comorbilidades), la situación clínica de la enfermedad hematológica de base, el tipo de trasplante, uso o no de terapias biológicas, y complicaciones postrasplante. El riesgo puede variar en diferentes pacientes y también en el mismo paciente en distintos momentos a lo largo del curso del tratamiento y de su enfermedad; por eso actualmente ha de considerarse el riesgo como dinámico en cada momento evolutivo del paciente18,60.
Profilaxis en la aspergilosis invasoraLa dificultad para establecer un diagnóstico precoz, la alta mortalidad de la aspergilosis invasora una vez está establecida y el alto coste de la terapia justifican el uso de profilaxis primaria cuando la prevalencia de la aspergilosis invasora es superior al 8-10%28. Distintos meta-análisis en pacientes con neoplasias hematológicas que recibieron tratamiento citotóxico intensivo y/o trasplante de progenitores hematopoyéticos asociaron la profilaxis antifúngica con una disminución de la IFI y de la mortalidad relacionada con la infección17. Los azoles son el grupo de antifúngicos más adecuado para realizar profilaxis dada su formulación oral e intravenosa, su buena biodisponibilidad, su espectro antifúngico y un buen perfil de seguridad.
El fluconazol fue el primer azol utilizado para la quimioprofilaxis de las IFI debido a su actividad frente a hongos levaduriformes, su baja toxicidad y su escasa interacción farmacológica debido a su débil inhibición del CYP3A4. Sin embargo, es efectivo solo en dosis altas, que se asocian con más frecuencia con reacciones adversas33,58. Existe evidencia de su eficacia en la prevención de la IFI y es activo frente a la mayoría de especies de Candida22,33,43,50, si bien algunas son intrínsecamente resistentes (Candida krusei) o presentan baja sensibilidad (Candida glabrata)55,64. Los pacientes con leucemia aguda mieloide y los que reciben un trasplante alogénico de progenitores hematopoyéticos (especialmente en pacientes que reciben trasplante de sangre de cordón umbilical o TPH haploidéntico) tienen riesgo de infección por Aspergillus durante la fase de neutropenia, y en el caso de presentar la enfermedad injerto contra receptor (EICR)46, la profilaxis requiere una actividad específica frente a Aspergillus.
A diferencia del fluconazol, el itraconazol es activo frente a Aspergillus. Sin embargo, el estudio del Gruppo Italiano Malattie Ematologiche dell’Adulto (GIMEMA) comparó la solución oral de itraconazol frente a un placebo, sin observar ninguna ventaja en el uso del itraconazol en la incidencia de la aspergilosis invasora, aunque sí redujo de forma significativa la incidencia de candidemia36. Dos estudios han comparado la actividad profiláctica del fluconazol y el itraconazol en pacientes hematológicos tratados con TPH-Alo33,63. El primero de ellos63 describió una reducción de las IFI probadas/probables (9% vs. 25%; p=0,01), tanto de las causadas por Candida (3% vs. 12%) como de las causadas por Aspergillus (4% vs. 12%). La mortalidad global fue similar en ambos grupos (45% vs. 42%; p>0,2), pero el itraconazol se asoció con una reducción estadísticamente no significativa de la mortalidad relacionada con la IFI (9% vs. 18%; p=0,13). El segundo estudio33 no encontró diferencias en la incidencia de la IFI global, pero se describió una reducción en la incidencia de la IFI por hongos filamentosos, sin impacto, en cualquier caso, en la supervivencia global y en la mortalidad asociada a la IFI. El uso del itraconazol en este contexto está limitado por su baja absorción en la presentación de cápsulas y la toxicidad gastrointestinal cuando se utiliza la suspensión oral36.
El uso del voriconazol en la profilaxis primaria de la IFI ha sido evaluado fundamentalmente en el contexto del TPH-Alo32,62. En el estudio de Wingard et al., donde se compara este antifúngico con el fluconazol, y en el estudio de Marks et al., donde la comparación se establece con el itraconazol, no se describen diferencias significativas en la incidencia de la IFI, supervivencia independiente de la IFI, o uso de tratamiento antifúngico empírico o supervivencia global. En el estudio de Wingard et al. se observó una menor incidencia de infecciones por Aspergillus en el grupo tratado con voriconazol (9 vs. 17; p=0,05). El estudio de Marks et al. demostró una mayor eficacia con el uso del voriconazol para alcanzar el objetivo compuesto (48,7% vs. 33,2%; p<0,01); el grupo del itraconazol recibió con mayor frecuencia otros antifúngicos sistémicos (41,9% vs. 29,9%; p<0,01), y las diferencias se relacionaron con una mayor tolerancia al uso del voriconazol durante 100 días tras el trasplante (53,6% vs. 39,0%; p<0,01). No hubo diferencias en la incidencia de la IFI probada o probable (1,3% vs. 2,1%).
El posaconazol es un triazol con un espectro antifúngico que incluye especies de Candida, Aspergillus, zigomicetos y Fusarium51. Ha demostrado su eficacia en la profilaxis antifúngica primaria en pacientes con leucemia aguda mieloide o síndrome mielodisplásico en un estudio multicéntrico y aleatorizado frente al fluconazol o el itraconazol12. Los resultados mostraron una reducción de la IFI probada/probable en el grupo tratado con posaconazol (2% vs. 8%; p<0,001), con una supervivencia global significativamente superior durante el periodo de estudio (16% vs. 22%, p=0,048) y un menor uso de tratamiento antifúngico empírico los 100 días (p=0,02).
El isavuconazol (sin la indicación para estos pacientes aprobada en la ficha técnica) es un nuevo triazol aprobado en 2015 y con un espectro antifúngico amplio que ha demostrado no inferioridad frente al voriconazol en el tratamiento de primera línea de la IFI causada por Aspergillus y otros hongos filamentosos31. Sin embargo, la experiencia en profilaxis antifúngica es muy limitada9 como para recomendar su uso en profilaxis (CII).
En lo referente a las equinocandinas, no existe evidencia de la eficacia de su uso en la profilaxis antifúngica, excepto con la micafungina: un estudio aleatorizado demostró igual eficacia de esta equinocandina que el fluconazol en la fase precoz de TPH-Alo y una mejor tolerancia que con el itraconazol59, por lo que las guías le asignan generalmente una recomendación CI.
Por último, la utilización de anfotericina B liposomal aerosolizada en pacientes con neutropenia prolongada ha demostrado que reduce de forma marcada la incidencia de aspergilosis pulmonar, lo que motivó un grado de recomendación BII en 201444.
En las tablas 1 y 2 se resumen los criterios de recomendación y las recomendaciones de las guías de distintas sociedades científicas3,10,21,30,35,42,53,57.
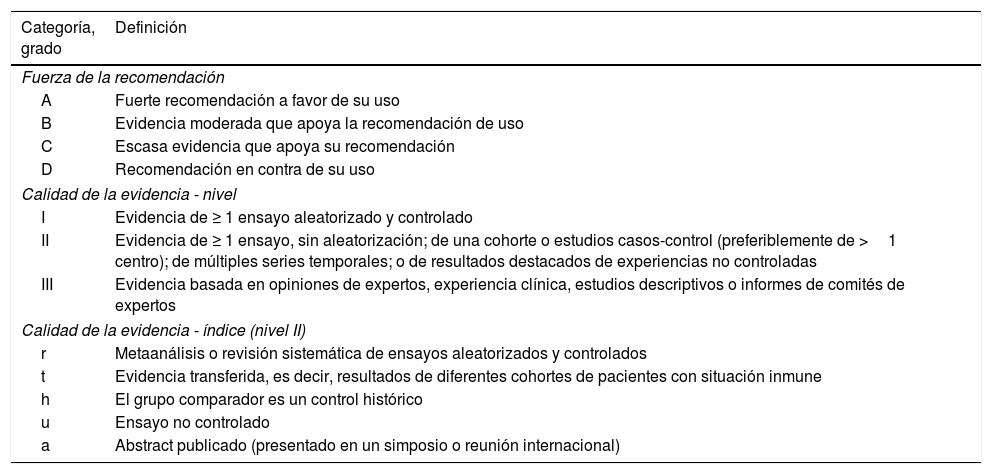
Gradación de recomendaciones de la ESCMID-ECMM 2017
| Categoría, grado | Definición |
|---|---|
| Fuerza de la recomendación | |
| A | Fuerte recomendación a favor de su uso |
| B | Evidencia moderada que apoya la recomendación de uso |
| C | Escasa evidencia que apoya su recomendación |
| D | Recomendación en contra de su uso |
| Calidad de la evidencia - nivel | |
| I | Evidencia de ≥ 1 ensayo aleatorizado y controlado |
| II | Evidencia de ≥ 1 ensayo, sin aleatorización; de una cohorte o estudios casos-control (preferiblemente de >1 centro); de múltiples series temporales; o de resultados destacados de experiencias no controladas |
| III | Evidencia basada en opiniones de expertos, experiencia clínica, estudios descriptivos o informes de comités de expertos |
| Calidad de la evidencia - índice (nivel II) | |
| r | Metaanálisis o revisión sistemática de ensayos aleatorizados y controlados |
| t | Evidencia transferida, es decir, resultados de diferentes cohortes de pacientes con situación inmune |
| h | El grupo comparador es un control histórico |
| u | Ensayo no controlado |
| a | Abstract publicado (presentado en un simposio o reunión internacional) |
ECMM: European Confederation of Medical Mycology; ESCMID: European Society for Clinical Microbiology and Infectious Diseases.
Fuente: Cornely et al.10.
Recomendaciones de profilaxis antifúngica primaria de distintas sociedades científicas
| Fluconazol | Itraconazol | Voriconazol | Posaconazol | Isavuconazol | Caspofungina | Micafungina | Anfotericina B liposomal | |
|---|---|---|---|---|---|---|---|---|
| ECIL-5-6 | C-I | BI | BII | AI | CIIu | CII | − | CII (BI inh) |
| QT | A-I | BI | BI | AI | − | − | CI | CIII |
| TPH-Alo | AI | BI | BI | BII | − | − | BI | CII (CIII inh) |
| Pre-injerto EICR | AIII en contra | BI | BI | AI | − | − | CII | CII |
| AGIHO- DGHO QT | CI | CI | CII | AI (so) | CIIu | CI | CIIh | BII (inh)/ BII (I.V.) |
| TPH-Alo (anti-Asp) | − | CI | CI | AII (comp) BII (no EICR) AI (EICR) | − | − | CI | − |
| IDSA (anti-Asp) | − | − | − | BI | − | − | − | − |
| ESCMID | AI | BI | AI | AII | − | CII | CI | BII |
| NCCN 2016 | 2B | 2B | 2B | 1 | 2B | 2B | 2B | 2B |
| QT TPH-Alo | 2B | 2B | 2B | 1 | 2B | 2B | 2B | 2B |
Asp: Aspergillus; comp: comprimidos; EICR: enfermedad injerto contra receptor; inh: inhalada; QT: quimioterapia intensiva tipo inducción leucemia aguda mieloide; so: suspensión oral. Fuente: Baden et al.3; Cornely et al.10; Freifeld et al.21; Maertens et al.30; Mellinghoff et al.35; Patterson et al.42; Tacke et al.53; Ullmann et al.57.
En muchas ocasiones es difícil distinguir el tratamiento anticipado/empírico del tratamiento dirigido; por ello revisaremos en este apartado las estrategias de tratamiento antifúngico dirigido. Merece la pena enfatizar que el inicio precoz del tratamiento antifúngico es una de las variables que más influye en el éxito de este, por lo que algunas de las afirmaciones propuestas en este artículo pueden hacerse extensivas al tratamiento anticipado o empírico2,29,42,45.
Son escasas las series publicadas que incluyen exclusivamente tanto pacientes trasplantados como neutropénicos, por lo que el nivel de evidencia en estos subgrupos de pacientes es menor y algunas recomendaciones se hacen extendiendo lo observado en otros grupos de pacientes.
Aspectos diagnósticos. Monitorización de la respuesta a la infecciónEs preciso tener en cuenta que existen especies de Aspergillus crípticas que se asocian con relativa frecuencia a valores elevados de concentración mínima inhibitoria (CMI) a los triazoles5,8 y se ven con frecuencia en pacientes trasplantados, por lo que es preciso identificarlas mediante métodos moleculares (secuenciación de regiones transcriptoras de β-tubulina, actina y calmodulina). Además, algunas especies, como A.terreus, presentan CMI elevadas a la anfotericinaB.
Existen dos marcadores biológicos, galactomanano y β(1,3)-D-glucano, que podrían utilizarse en la monitorización de la respuesta al tratamiento en el caso de estar elevados al comienzo del tratamiento de la infección. La reducción de los valores séricos de galactomanano, tanto en meta-análisis como en series individuales, se ha asociado con mejoras en la resolución de la infección y la supervivencia (incluyendo series autópsicas), e incluso la corrección de factores como la recuperación de la neutropenia.
Antifúngicos empleados en el tratamiento de la aspergilosis invasora. Características farmacocinéticas/farmacodinámicasLos triazoles son el grupo farmacológico de elección en el tratamiento de la aspergilosis invasora. En el tratamiento dirigido, el voriconazol es considerado el fármaco de primera elección según muchas de las guías y recomendaciones (IDSA, ESCMID, SEIMC, ECIL). Disuelto en ciclodextrina, la acumulación de este compuesto se puede producir cuando el fármaco se administra por vía intravenosa (por vía oral la absorción de ciclodextrina es mínima) y puede deteriorar la función renal, si bien este aserto está menos claro en el ser humano. El fármaco se metaboliza por vía hepática, siendo su concentración en orina insuficiente para el tratamiento de la infección de vías urinarias inferiores. Influenciado por los polimorfismos CYP2C19 y CYP3A4, presenta una farmacocinética no lineal con aumentos considerables de concentraciones máximas y área bajo la curva con pequeños aumentos de dosis. La coadministración del voriconazol con la rifampicina y la fenitoína puede disminuir su concentración, mientras que los inhibidores de la bomba de protones y antiácidos pueden aumentarla.
La determinación de la concentración sérica de voriconazol en el tratamiento de la infección documentada puede ser útil para alcanzar concentraciones óptimas que minimicen su toxicidad45. La toxicidad neurológica incluye fotopsias y alucinaciones visuales (no claramente relacionadas con la concentración del fármaco), así como signos de leucoencefalopatía y daño hepático (sí correlacionados). Puede prolongar el intervalo QT y originar arritmias crónicas. La exposición crónica puede producir fotosensibilidad y favorecer el desarrollo de carcinomas de piel y melanomas.
La nueva formulación del posaconazol en tabletas mejora la biodisponibilidad de la solución oral y disminuye el impacto del pH gástrico sobre el fármaco antifúngico y la necesidad de tomar la solución con comida grasa. El posaconazol se metaboliza mediante glucuronidación e inhibe la CYP3A4, pudiendo producir arritmias y alteraciones gastrointestinales. Las concentraciones conseguidas con la formulación en tabletas son superiores a las conseguidas en solución (pudiendo estar recomendada la monitorización de los niveles del fármaco si se administra la solución).
El isavuconazol se encuentra ahora mismo con el mismo nivel de evidencia que el voriconazol para el tratamiento de la aspergilosis invasora, y requiere dosis de carga pero no incluye ciclodextrina para su administración por vía intravenosa. Presenta una menor tasa de fotopsia, fotosensibilización y toxicidad hepatobiliar. A diferencia de otros azoles acorta, en vez de prolongar, el intervalo QT. Las interacciones farmacológicas son menores que en el caso del voriconazol y el posaconazol, pero es preciso recordar que la coadministración con metotrexato aumenta la exposición a metabolitos tóxicos de este último. A diferencia del voriconazol, los diferentes polimorfismos de CYP2C19 no alteran su farmacocinética.
Las equinocandinas inhiben la síntesis del β(1,3)-D-glucano, un polisacárido de la pared fúngica. Pueden utilizarse en el tratamiento de rescate, pero no se recomienda su uso en monoterapia en primera línea. Por su vida media, superior a 10h, se administran una vez al día. Su unión a proteínas plasmáticas es elevada y se distribuye bien a los tejidos, excepto al líquido cefalorraquídeo (salvo disrupción de la barrera hemato-encefálica), ojos y orina. La anidulafungina sufre una degradación química espontánea (por lo que no hay que reducir la dosis en caso de insuficiencia hepática), la caspofungina se metaboliza en el hígado (debiendo reducirse la dosis en casos de insuficiencia hepática severa) y la micafungina se metaboliza por la vía de la catecol-O-metiltransferasa. Las equinocandinas se toleran bien, tienen pocos efectos secundarios y pocas interacciones medicamentosas (algo mayores para la caspofungina).
En el tratamiento de la aspergilosis invasora debe utilizarse la anfotericina B lipídica y no la anfotericina B desoxicolato. La anfotericinaB parece formar canales iónicos en la membrana celular y también agregados extramembranosos que extraen el ergosterol de la membrana y que producen un daño oxidativo. Suelen distribuirse en el sistema reticuloendotelial. Existe un síndrome caracterizado por disnea, dolor torácico y lumbar e hipoxia con la infusión de anfotericinaB liposomal. Además, estos pacientes pueden desarrollar hipopotasemia, hipomagnesemia y elevaciones de la bilirrubina y la fosfatasa alcalina.
La monitorización de las concentraciones en suero de los triazoles permite identificar la exposición a niveles subterapéuticos de estos fármacos y minimizar su toxicidad. Las concentraciones séricas, en el caso del voriconazol, están influenciadas por los polimorfismos de CYP2C19. Los polimorfismos de CYP3A4 no son, en general, relevantes. Es importante monitorizar también las concentraciones de los inhibidores calcineurínicos, anticoagulantes, medicación neurotrópica, barbitúricos, corticoides, etc. La coadministración de los triazoles con alcaloides de vincapervinca debe evitarse por la neurotoxicidad. Es preciso recordar que la coadministración con sirolimus obliga a reducir considerablemente la dosis de este último, en el caso de que la coadministración sea totalmente necesaria. La monitorización puede estar particularmente indicada en el caso del itraconazol, el voriconazol y el posaconazol en pacientes con aspergilosis invasora y debe hacerse a los 4-7días de iniciar la terapia. La monitorización repetida de las concentraciones depende de la evolución clínica, de los fármacos coadministrados, de la toxicidad, etc. Las concentraciones del voriconazol, en el caso de la aspergilosis invasora, deben ser superiores a 1-1,5μg/ml para asegurar la eficacia, e inferiores a 5-6μg/ml para minimizar la toxicidad (fundamentalmente sobre el sistema nervioso central, ya que está menos probada la relación entre la concentración y la toxicidad hepática). Existe un estudio en el que las concentraciones apropiadas del antifúngico se asociaron con un mejor curso clínico y una menor toxicidad. En el caso de concentraciones bajas del fármaco se recomienda una elevación reducida, dado que la concentración del fármaco puede aumentar de modo notable por su farmacocinética no lineal. La coadministración con omeprazol puede también aumentar su concentración.
La monitorización sérica del posaconazol está indicada fundamentalmente en los pacientes que toman el fármaco en suspensión. No está claro si las concentraciones altas del fármaco se asocian con toxicidad. La necesidad de monitorizar a los pacientes tratados con posaconazol intravenoso o en comprimidos es dudosa.
Tampoco está claro que sea necesaria la monitorización sérica del isavuconazol, aunque un estudio reciente sugiere que es innecesaria65, salvo en situaciones muy concretas.
En los últimos años se ha comenzado a observar en Europa un aumento de la tasa de resistencia de Aspergillus a los azoles. Este desarrollo de resistencias está relacionado fundamentalmente con el empleo de antifúngicos en agricultura, y por ello es difícil encontrar factores de riesgo específicos en pacientes infectados con especies resistentes de Aspergillus. Se recomienda utilizar polienos en el tratamiento de estos pacientes o una combinación de equinocandinas y azoles. Debe tenerse en cuenta que existen especies resistentes a anfotericinaB, entre las que se incluyen A.terreus, Aspergillus nidulans y Aspergillus lentulus.
Otra situación especial es la infeccción de brecha en pacientes que reciben profilaxis antifúngica frente a hongos filamentosos, algo que ocurre raramente (en menos del 3% de los casos). Se recomienda una rápida aproximación diagnóstica para obtener una muestra que pueda ser cultivada, determinar los valores de galactomanano en el lavado broncoalveolar si la infección es pulmonar (a diferencia de los valores séricos, no parecen estar influidos por el uso de la profilaxis activa frente a Aspergillus) y descartar otras coinfecciones oportunistas. El tratamiento debe realizarse con fármacos de una familia diferente a la utilizada en la profilaxis: anfotericinaB liposomal en los casos de profilaxis con voriconazol, especialmente si la incidencia de Mucor en el centro es elevada; si la profilaxis se realizó con posaconazol puede considerarse la anfotericinaB liposomal y, en algunos casos, el voriconazol o el isavuconazol. Si se elige tratamiento combinado debe realizarse con fármacos de familias diferentes a las empleadas en la profilaxis.
Tratamiento de la aspergilosis invasora pulmonarEl tratamiento debe instaurarse tempranamente ante una fundada sospecha clínica, dados los peores resultados que conlleva la demora en iniciarlo. Sin embargo, es preciso enfatizar que no deben regatearse esfuerzos para realizar el diagnóstico diferencial con otros hongos filamentosos y otros patógenos.
Como hemos visto anteriormente, el voriconazol es el tratamiento de elección del paciente con aspergilosis pulmonar invasora. Durante los primeros días el fármaco debe administrarse por vía intravenosa, especialmente en pacientes graves, con la correspondiente dosis de carga. El paso a tratamiento oral puede realizarse una vez que el paciente está estable y es recomendable monitorizar las concentraciones séricas del fármaco para que estén en el rango terapéutico1. En un reciente estudio aleatorizado, la eficacia clínica del isavuconazol fue similar a la del voriconazol pero con una menor toxicidad, cumpliéndose así el objetivo de no inferioridad propuesto27.
El voriconazol y el isavuconazol son la primera opción terapéutica; además, el isavuconazol es un fármaco a considerar en pacientes con insuficiencia renal, independientemente de la gravedad, insuficiencia hepática, leve o moderada y en pacientes que reciben tratamiento concomitante con inmunosupresores, por el menor aumento de las concentraciones de estos respecto a otros azoles. La anfotericina B liposomal puede ser una alternativa. En el estudio clásico de Cornely et al. las dosis altas (10mg/kg/día vs. 3mg/kg/día) al inicio del tratamiento (dos primeras semanas) no aumentaron la eficacia, aunque sí la toxicidad11, por lo que podría tener un lugar en pacientes con insuficiencia hepática, interacciones medicamentosas difíciles de sortear e infecciones por Aspergillus resistentes a los azoles.
El tratamiento de combinación con una equinocandina y voriconazol o equinocandina y anfotericinaB liposomal puede considerarse en pacientes seleccionados. Diferentes estudios no aleatorizados sugieren una ventaja del tratamiento combinado. Entre los estudios aleatorizados, en el estudio Combistrat la combinación de la caspofungina y la anfotericina B liposomal a dosis estándar mejoró la respuesta al final del tratamiento pero la supervivencia no fue diferente7. En otro estudio aleatorizado en el que se comparó la combinación de la anidulafungina y el voriconazol frente al voriconazol, la mortalidad a las seis semanas del inicio del tratamiento fue superior para el grupo de pacientes que recibió el tratamiento en monoterapia (27,5% vs. 19,3%), si bien se quedó al límite de la significación estadística34. El subgrupo de pacientes con «infección probable» (basado en estudios radiológicos y positividad del galactomanano) fue el que presentó un mayor beneficio del tratamiento combinado en términos de mortalidad a las seis semanas, pero no en respuestas clínicas globales. En resumen, no hay una clara evidencia del beneficio del tratamiento combinado, aunque diversos estudios apuntan hacia su utilidad y podría considerarse su utilización en pacientes de alto riesgo con neutropenia prolongada23.
En base a dos estudios con un reducido número de pacientes, uno de ellos en receptores de TPH, no se recomienda el empleo de las equinocandinas como agentes únicos en el tratamiento de la aspergilosis invasora a la vista de los mejores resultados obtenidos con el voriconazol. El tratamiento debe durar entre 6 y 12semanas según la gravedad, la inmunosupresión y la evolución clínica. Suele cambiarse a tratamiento oral tras 2-3semanas de tratamiento intravenoso, en pacientes estables.
Las concentraciones de galactomanano pueden ser un marcador indirecto de la carga fúngica. Las concentraciones séricas basales elevadas, más discutidas en el lavado broncoalveolar, pueden correlacionarse con la mortalidad. La monitorización del galactomanano se correlaciona con la respuesta al tratamiento: mayores concentraciones de galactomanano durante el tratamiento se asocian, en general, a un peor pronóstico; su reducción en la primera semana, especialmente si es rápida y en pacientes tratados con voriconazol, mejoraría el pronóstico. Sin embargo, la normalización de la concentración de galactomanano no es un criterio suficiente para discontinuar el tratamiento.
El papel de la cirugía debe considerarse en lesiones cercanas a grandes vasos, órganos vitales, pleura y hueso, dada la capacidad angioinvasora de Aspergillus. También debe considerarse en pacientes con hemoptisis importante de foco único.
Para valorar la refractariedad/progresión de la IFI es preciso recordar que en los primeros días de tratamiento el patrón radiológico puede empeorar, sin que ello refleje progresión/resistencia. La recuperación de la cifra de neutrófilos y la reconstitución inmune con mejora de la respuesta inflamatoria puede explicar alguna de estas situaciones paradójicas clínico-radiológicas. Por ello, no se recomienda cambiar el tratamiento antifúngico si la TAC empeora en los primeros 10-12días de tratamiento y si el paciente no sufre deterioro clínico importante. En los casos de progresión debe considerarse el cambio de antifúngico, la reducción de la inmunosupresión (si ello es posible) y la resección quirúrgica en casos seleccionados. En cuanto al cambio de antifúngico, es difícil reseñar la mayor efectividad de uno sobre otro agente (voriconazol, si no recibió este fármaco como primera línea —experiencia más limitada con el isavuconazol—, anfotericinaB liposomal, micafungina, caspofungina, posaconazol o itraconazol), con tasas de rescate que varían entre el 30 y el 50%, dada la heterogeneidad de los estudios y la mortalidad intrínseca secundaria a la enfermedad de base. Otra dificultad para la valoración de los estudios de rescate son la farmacocinética de los antifúngicos, ya que el paciente que no responde adecuadamente al tratamiento con anfotericinaB recibirá, en realidad, con la administración del fármaco de rescate, un tratamiento combinado durante los primeros días debido a la prolongada vida media de la anfotericinaB.
Con todas estas consideraciones, puede concluirse de manera general que el cambio de un antifúngico de una familia terapéutica por otro de otra familia suele preferirse en caso de tener que sustituir el fármaco de primera línea por toxicidad; en los casos de mala evolución suele preferirse la terapia combinada, aun en ausencia de estudios comparativos apropiados. Además, hay que tener en cuenta la conveniencia de determinar las concentraciones séricas del fármaco, especialmente con los azoles, la diferente toxicidad entre fármacos de la misma familia (voriconazol e isavuconazol) y el hecho de que si se elige un azol como tratamiento de rescate en un paciente tratado con otro azol en primera línea, la posibilidad de multirresistencia o resistencia cruzada aumenta.
Tratamiento de la aspergilosis invasora extrapulmonarLa aspergilosis invasora extrapulmonar focal puede presentarse como una infección localizada en un órgano o como parte de una infección diseminada. Como se trata de infecciones infrecuentes que se observan en un amplio espectro de cuadros clínicos, no se han completado ensayos clínicos que evalúen los abordajes terapéuticos en pacientes con estas infecciones. En un estudio aleatorizado que compara el voriconazol con la anfotericinaB desoxicolato25 el grupo de expertos recomienda el voriconazol como tratamiento primario de estas manifestaciones infrecuentes de la aspergilosis invasora (B-III). El empleo del voriconazol en estos casos tiene el respaldo de una serie de casos y otros anecdóticos que documentan la eficacia del voriconazol en las infecciones extrapulmonares, algunas de las cuales han estado históricamente asociadas con respuestas pésimas, como la infección del sistema nervioso central49, la osteomielitis38 y la endocarditis37. Es posible abordar el empleo de fármacos alternativos y tratamientos de último recurso de una manera similar a la descrita para la aspergilosis pulmonar invasora. En el caso de infección de los senos paranasales se utiliza una aproximación combinada de cirugía (ostomía, ampliación del drenaje) y tratamiento con voriconazol/anfotericinaB liposomal. En los casos en que se extirpa una bola fúngica la cirugía puede ser suficiente en algunas ocasiones, sin precisar el paciente un tratamiento antifúngico56.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Carlos Solano ha participado como ponente en reuniones científicas patrocinadas por Pfizer, MSD, Astellas y Gilead. Ha recibido ayudas a la investigación preclínica o clínica de Pfizer y de Astellas.
Lourdes Vázquez ha participado como ponente en reuniones científicas patrocinadas por Pfizer, MSD, Astellas y Gilead. Ha recibido ayudas a la investigación preclínica o clínica de Pfizer, MSD y de Astellas.