Malassezia furfur es una levadura comensal de la piel del ser humano que ha sido asociada con la presencia de algunas entidades dermatológicas e infecciones sistémicas oportunistas. Por su condición dependiente de lípidos, los métodos de referencia establecidos para las levaduras por el Clinical and Laboratory Standards Institute (CLSI) para evaluar la sensibilidad antifúngica no son aplicables.
ObjetivosEvaluar la sensibilidad in vitro de aislamientos de M. furfur asociados a procesos patológicos en el ser humano frente a antifúngicos de uso clínico.
MétodosSe evaluó el perfil de sensibilidad a la anfotericina B, el itraconazol, el ketoconazol y el voriconazol de 20 aislamientos de M. furfur mediante el método de microdilución en caldo (CLSI M27-A3) y Etest®.
ResultadosEl itraconazol y el voriconazol presentaron la mayor actividad antifúngica frente a los aislamientos evaluados. El acuerdo esencial entre los dos métodos usados para evaluar la actividad antifúngica de los azoles estuvo en el 60-85%, y el acuerdo categórico en el 70-80%; para la anfotericina B tanto el acuerdo esencial como el categórico fueron del 10%.
ConclusionesDe acuerdo con los dos métodos evaluados los azoles fueron los compuestos que presentaron la mayor actividad antifúngica frente a M. furfur; sin embargo, es necesario realizar más estudios que permitan afirmar que Etest® es un método confiable para ser implementado en la rutina del laboratorio clínico.
Malassezia furfur is a human skin commensal yeast that can cause skin and opportunistic systemic infections. Given its lipid dependant status, the reference methods established by the Clinical and Laboratory Standards Institute (CLSI) to evaluate antifungal susceptibility in yeasts are not applicable.
AimsTo evaluate the in vitro susceptibility of M. furfur isolates from infections in humans to antifungals of clinical use.
MethodsThe susceptibility profile to amphotericin B, itraconazole, ketoconazole and voriconazole of 20 isolates of M. furfur, using the broth microdilution method (CLSI M27-A3) and Etest®, was evaluated.
ResultsItraconazole and voriconazole had the highest antifungal activity against the isolates tested. The essential agreement between the two methods for azoles antifungal activity was in the region of 60-85% and the categorical agreement was around 70-80%, while the essential and categorical agreement for amphotericin B was 10%.
ConclusionsThe azoles were the compounds that showed the highest antifungal activity against M. furfur, as determined by the two techniques used; however more studies need to be performed to support that Etest® is a reliable method before its implementation as a routine clinical laboratory test.
El género Malassezia comprende levaduras lipofílicas, en su mayoría lípido-dependientes, comensales de la piel del ser humano y los animales. Actualmente hay descritas 14 especies con Malassezia furfur, Malassezia globosa, Malassezia sympodialis, Malassezia restricta y Malassezia slooffiae como las más frecuentes en el ser humano9,11,16,17,26.
Estas levaduras son comensales de la piel, pero pueden convertirse en patógenos cuando hay factores predisponentes, como cambios en el microambiente cutáneo o alteración de los mecanismos de defensa del hospedero2,5,9. M. furfur ha sido aislada en pacientes inmunocompetentes como responsable de desórdenes dermatológicos como la pitiriasis versicolor, la foliculitis, la dermatitis seborreica y la dermatitis atópica. Además se ha reportado su capacidad para producir infecciones sistémicas en pacientes inmunodeprimidos que reciben nutrición parenteral total con suplementación lipídica, especialmente neonatos pretérmino en unidades de cuidados intensivos con catéteres venosos centrales, pacientes positivos para el VIH y pacientes con cáncer9,24,30,32.
Con respecto a la terapia antifúngica para el manejo de las enfermedades asociadas a M. furfur, se recomienda utilizar azoles tópicos u orales dependiendo de la gravedad y extensión del cuadro clínico; para las infecciones sistémicas se utilizan el ketoconazol, el itraconazol, el fluconazol o la anfotericina B1,30,32,33. Sin embargo, existen en la literatura reportes de sensibilidad disminuida in vitro a la anfotericina B y el fluconazol1,13,18,27,32.
Aunque la infección sistémica es la menos frecuente, se han documentado fungemias causadas por Malassezia, lo que implica realizar terapias inmediatas y adecuadas. Sin embargo, los métodos de referencia in vitro establecidos por el Clinical and Laboratory Standards Institute (CLSI), el método de microdilución en caldo (documento M27-A3) y el de difusión en agar (documento M44-A2), para determinar los perfiles de sensibilidad, no son aplicables para este género por su condición lipodependiente. Dado que aún no existe un consenso sobre las pruebas de sensibilidad en Malassezia, las mismas requieren ser estandarizadas3,4,12,15,18.
Por lo anterior, y teniendo en cuenta que en Colombia son escasos los estudios que evalúan el perfil de sensibilidad antifúngica25, así como los que buscan correlacionar estos datos por diferentes métodos, en este estudio se evaluó la sensibilidad in vitro de aislamientos de M. furfur asociados a diferentes cuadros clínicos por los métodos de microdilución en caldo (CLSI) y Etest® frente a antifúngicos comúnmente utilizados en terapia clínica.
Materiales y métodosAislamientosVeinte aislamientos clínicos de pacientes con pitiriasis versicolor, dermatitis atópica y dermatitis seborreica fueron recuperados de la colección de microorganismos del Laboratorio de Micología y Fitopatología (Universidad de Los Andes). Estos aislamientos fueron conservados en leche descremada al 10% a –70°C y recuperados en agar Dixon modificado por incubación a 32°C14. La identificación de la especie se llevó a cabo por secuenciación de las regiones 5.8S rDNA-ITS2 y 26S rDNA D1/D210,21.
Pruebas de sensibilidadMicrodilución en caldoEl método de microdilución en caldo fue realizado de acuerdo al documento M27-A3 (CLSI 2008) con modificaciones para cumplir los requerimientos nutricionales del género Malassezia. El medio de cultivo utilizado fue caldo Sabouraud con dextrosa suplementado con Tween 40 0,5% (v/v) y Tween 60 0,5% (v/v)29. La utilización de este medio de cultivo se determinó en un estudio previo en el que se compararon los caldos de cultivo Urea de Christensen y Saboureaud dextrosa, y diferentes suplementos lipídicos como glicerol y Tween 40, Tween 60 y Tween 80. En un estudio de Carfachia et al. no se obtuvo un buen crecimiento de esta levadura en el medio RPMI 1640 con suplementos lipídicos3, razón por la cual no se evaluó en nuestro estudio previo. Por otro lado, aunque el medio Dixon modificado es el más utilizado para el crecimiento de Malassezia, no puede ser empleado para evaluar la sensibilidad por el método de microdilución en caldo debido a la turbidez provocada por los suplementos lipídicos3. Las soluciones stock de anfotericina B, itraconazol, ketoconazol y voriconazol (Sigma-Aldrich) fueron preparadas en dimetil sulfóxido (16mg de antifúngico en 10ml de dimetil sulfóxido). A partir de las diluciones seriadas de cada antifúngico se depositaron 100μl en las microplacas de 96 pocillos, en un rango de 0,06-32μg/ml. Posteriormente se añadieron 100μl de cada inóculo, preparado a partir de cultivos de 5 días de incubación en agar Dixon modificado con Tween 80 al 1% (v/v), con un ajuste de la suspensión a 0,4-0,45UA (Abs 530nm), equivalente a 1-5×106 cél/ml, para una concentración final en el pocillo de 0,5×103 a 2,5×103 cél/ml.
Las microplacas fueron incubadas a 32°C y la lectura se realizó a las 72h. Para los azoles la concentración mínima inhibitoria (CMI) fue definida como la concentración más baja que produjo el 50% de inhibición del crecimiento en comparación con el pocillo control del crecimiento. Para la anfotericina B, la CMI se definió como la concentración más baja con la que no se produjo crecimiento. Se utilizaron como controles de calidad las cepas Candida parapsilosis ATCC 22019 y C. krusei ATCC 6258. Todas las pruebas se realizaron por triplicado4,7,23,31.
Etest®El medio de cultivo utilizado para la prueba de Etest® fue agar Sabouraud dextrosa suplementado con Tween 40 al 0,5% (v/v) y Tween 60 al 0,5% (v/v). La superficie del agar se sembró por inundación con una suspensión ajustada a 0,4-0,45UA (Abs 530nm), equivalente a 1-5×106 cél/ml (0,5 escala de McFarland). Una vez la suspensión en la superficie de la placa fue absorbida se colocaron las tiras de Etest® (bioMérieux, Marcy-l’Étoile). Los antifúngicos evaluados fueron la anfotericina B, el itraconazol, el ketoconazol y el voriconazol en una concentración de 0,002-32μg/ml. Las placas fueron incubadas a 32°C y la lectura realizada a las 72h. Los valores de CMI fueron determinados en el punto de intersección de la elipse de inhibición del crecimiento con la tira de Etest®. Se utilizaron los mismos controles de calidad descritos para el método de microdilución. Las pruebas fueron realizadas por triplicado4,8,23,31.
Análisis de resultadosSe determinaron los percentiles 50 (CMI50) y 90 (CMI90) para cada antifúngico. Las medias geométricas (MG) fueron calculadas a partir de los datos de los valores CMI obtenidos de todos los aislamientos. Además, los resultados fueron categorizados siguiendo los criterios establecidos por Cafarchia et al. en sensible (S)=CMI aislamiento≤CMI50, sensible-intermedio (I)=CMI50<CMI aislamiento≤CMI90, o resistente (R)=CMI aislamiento>CMI904.
Para comparar los métodos de microdilución en caldo y Etest® se estableció un acuerdo esencial cuando los valores de CMI obtenidos en cada método no diferían en más de dos diluciones. Se determinaron discrepancias entre los métodos de acuerdo a la propuesta de Cafarchia, y se clasificaron en menores, para los aislamientos S o R por uno de los dos métodos pero I por el otro; mayores, los aislamientos S por el método de microdilución en caldo y R por Etest®; y muy mayores los aislamientos R por el método de microdilución en caldo y S por Etest®. El acuerdo categórico fue asignado a la concordancia de S, I y R por ambos métodos4.
La correlación entre los valores CMI para cada antifúngico por microdilución y Etest® fue evaluada mediante el test de correlación lineal de Spearman y el software IBM SPSS Statistics (versión 20), con un valor p<0,01 como estadísticamente significativo.
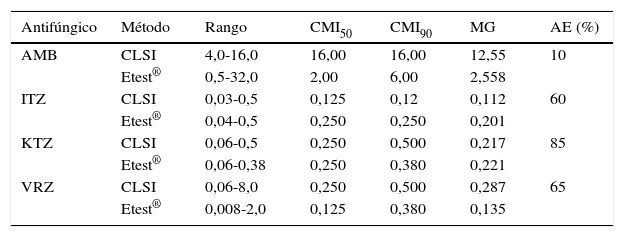
ResultadosLos resultados de las CMI de las cepas ATCC se correspondieron con los rangos esperados según el documento de referencia7,8. Los valores de CMI50, CMI90, media geométrica e intervalos de las CMI de los 20 aislamientos de M. furfur frente a los antifúngicos evaluados se muestran en la tabla 1. Se muestra también el acuerdo esencial en porcentaje entre ambos métodos.
Perfil de sensibilidad de aislamientos de M. furfur por microdilución en caldo (CLSI) y Etest®
| Antifúngico | Método | Rango | CMI50 | CMI90 | MG | AE (%) |
|---|---|---|---|---|---|---|
| AMB | CLSI | 4,0-16,0 | 16,00 | 16,00 | 12,55 | 10 |
| Etest® | 0,5-32,0 | 2,00 | 6,00 | 2,558 | ||
| ITZ | CLSI | 0,03-0,5 | 0,125 | 0,12 | 0,112 | 60 |
| Etest® | 0,04-0,5 | 0,250 | 0,250 | 0,201 | ||
| KTZ | CLSI | 0,06-0,5 | 0,250 | 0,500 | 0,217 | 85 |
| Etest® | 0,06-0,38 | 0,250 | 0,380 | 0,221 | ||
| VRZ | CLSI | 0,06-8,0 | 0,250 | 0,500 | 0,287 | 65 |
| Etest® | 0,008-2,0 | 0,125 | 0,380 | 0,135 |
CMI50 y CMI90 corresponden a las concentraciones de antifúngico en las que el crecimiento fue inhibido en un 50% y un 90%, respectivamente. Los valores corresponden a μg/ml.
AE: acuerdo esencial; AMB: anfotericina B; ITZ: itraconazol; KTZ: ketoconazol; MG: media geométrica; VRZ: voriconazol.
Los valores más bajos de CMI50, CMI90 y MG se presentaron con los antifúngicos del grupo de los azoles por el método de microdilución y Etest®. Por el contrario, la anfotericina B fue el compuesto que mostró menor actividad antifúngica frente a todos los aislamientos evaluados con ambos métodos, especialmente con el método de microdilución.
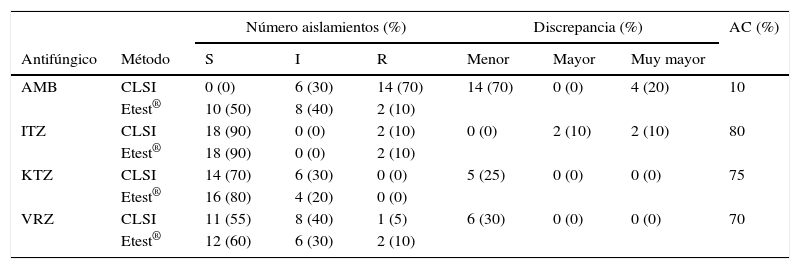
El acuerdo esencial fue de 60-85% para los compuestos azólicos, lo que sugiere una alta concordancia entre los dos métodos utilizados. Para la anfotericina B el valor del acuerdo esencial fue solo del 10%, lo que indica una baja concordancia entre los métodos. La interpretación de los perfiles de sensibilidad in vitro, de acuerdo con los criterios definidos por Cafarchia et al., se muestran en la tabla 24.
Perfil de sensibilidad antifúngica de M. furfur determinado por microdilución en caldo (CLSI) y Etest®
| Número aislamientos (%) | Discrepancia (%) | AC (%) | ||||||
|---|---|---|---|---|---|---|---|---|
| Antifúngico | Método | S | I | R | Menor | Mayor | Muy mayor | |
| AMB | CLSI | 0 (0) | 6 (30) | 14 (70) | 14 (70) | 0 (0) | 4 (20) | 10 |
| Etest® | 10 (50) | 8 (40) | 2 (10) | |||||
| ITZ | CLSI | 18 (90) | 0 (0) | 2 (10) | 0 (0) | 2 (10) | 2 (10) | 80 |
| Etest® | 18 (90) | 0 (0) | 2 (10) | |||||
| KTZ | CLSI | 14 (70) | 6 (30) | 0 (0) | 5 (25) | 0 (0) | 0 (0) | 75 |
| Etest® | 16 (80) | 4 (20) | 0 (0) | |||||
| VRZ | CLSI | 11 (55) | 8 (40) | 1 (5) | 6 (30) | 0 (0) | 0 (0) | 70 |
| Etest® | 12 (60) | 6 (30) | 2 (10) | |||||
AC: acuerdo categórico; AMB: anfotericina B; I: sensible-intermedio; ITZ: itraconazol; KTZ: ketoconazol; R: resistente; S: sensible; VRZ: voriconazol.
El 70% de los aislamientos fueron clasificados en resistentes a la anfotericina B por el método de microdilución; esta resistencia fue del 10% por el método Etest®, por lo que el acuerdo categórico entre los métodos fue bajo, lo que coincide con el acuerdo esencial para los dos métodos determinado por las diferencias en las CMI. Por el contrario, los azoles mostraron acuerdos categóricos y esenciales altos. Se observó una correlación lineal de los resultados entre la microdilución en caldo y el Etest® con la anfotericina B (r=0,621; p=0,003) y el voriconazol (r=0,707; p<0,001) con la prueba de Spearman.
DiscusiónLos valores de CMI y las MG mostraron una mayor actividad de los azoles frente a los aislamientos de M. furfur, lo que coincide con lo publicado en investigaciones similares12,15,26–28. El itraconazol presentó una mayor actividad inhibitoria por el método de microdilución en caldo, mientras que el voriconazol lo hizo con el Etest®, resultados igualmente similares a los de Nakamura et al. y Rincón et al.22,26. A diferencia de nuestros resultados, y de los reportados por los investigadores mencionados anteriormente, Velegraki et al. encontraron la misma actividad antifúngica para el itraconazol por ambos métodos, microdilución en caldo y Etest®31. La diferencia en los resultados podría atribuirse a que las pruebas fueron realizadas en diferentes medios de cultivo y suplementos lipídicos, pues la composición del medio no solo influye en el crecimiento de la especies de Malassezia, sino que también puede permitir una mayor o menor difusión de los antifúngicos en el caso del Etest®. Aunque el documento M27-A3 define el uso del medio de cultivo RPMI 1640, Cafarchia et al. describen un mejor crecimiento de M. pachydermatis, especie no lipodependiente, en caldos de cultivo como Urea de Christensen, Sabouraud dextrosa y Dixon3.
Los resultados de concordancia entre los métodos de microdilución y Etest® para los azoles difieren de lo publicado por Velegraki et al., quienes describieron una concordancia del 84-97% para los azoles y del 49% para la anfotericina B, lo que les permitió sugerir la posibilidad de determinar perfiles de sensibilidad frente a los azoles por cualquiera de los dos métodos31. Teniendo en cuenta el número de aislamientos evaluados en nuestro estudio, una muestra mayor permitiría tener una mayor certeza de los porcentajes de concordancia entre los dos métodos.
Dado que no existen puntos de corte definidos por el CLSI para determinar la sensibilidad o la resistencia en levaduras del género Malassezia, la clasificación se llevó a cabo según los criterios propuestos por Cafarchia et al. con aislamientos de M. pachydermatis3. Nuestros resultados mostraron diferencias entre los dos métodos para la anfotericina B, hallazgos difíciles de interpretar, dado que la mayoría de los estudios que comparan los dos métodos se centran en los azoles y no existe una regla universal para categorizar como sensibles o resistentes aislamientos de Malassezia.
Aunque no han sido estudiados los mecanismos de resistencia en Malassezia, la resistencia observada para la anfotericina B por el método de microdilución en caldo se podría explicar por los hallazgos en otras levaduras de importancia clínica, como Candida y Cryptococcus, donde se han descrito cepas con defectos en genes involucrados en la síntesis del ergosterol, como el gen ERG3, que implican una menor concentración de ergosterol en la membrana celular19,20; bombas de eflujo a múltiples fármacos pueden determinar también una resistencia cruzada a la anfotericina B y al fluconazol6.
Las mayores discrepancias observadas entre los métodos4 han sido con la anfotericina B. No obstante, para el ketoconazol y el voriconazol las discrepancias fueron menores, lo que podría indicar una mejor concordancia entre los dos métodos. Son pocos los estudios que determinan el grado de correlación entre los dos métodos evaluados; Velegraki et al. describieron un coeficiente de correlación lineal de Pearson (R2) de 0,89 entre ambos métodos para la anfotericina B y los azoles31. Por otro lado, Cafarchia et al. describieron una buena concordancia categórica entre los dos métodos, lo que confirmó la fiabilidad del Etest® como método de rutina en el laboratorio clínico4.
El voriconazol fue el antifúngico con mayor concordancia entre los dos métodos. A pesar de lo anterior, y de lo documentado por algunos autores que recomiendan el uso de Etest® como un método menos laborioso y más fácil de implementar en los laboratorios de microbiología4, nuestros resultados con los antifúngicos evaluados no permiten apoyar el uso rutinario de esta técnica.
Este estudio muestra que los azoles son los compuestos con mayor actividad antifúngica frente a M. furfur. No obstante, es necesario realizar más estudios que comparen los métodos de microdilución en caldo y Etest® para establecer su concordancia y poder implementar métodos más rápidos y fáciles en la rutina del laboratorio clínico, que permitan tomar decisiones terapéuticas para el manejo de estas infecciones.
FinanciaciónEste proyecto fue financiado por la Vicerrectoría de Investigación de la Pontificia Universidad Javeriana (convocatoria 2011, ID PPTA 4598).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Vicerrectoría de Investigación de la Pontificia Universidad Javeriana la financiación de este proyecto.